扩展功能
文章信息
- 黄小丹, 肖洒, 贺长皓, 李智杰, 张秀霞, 李亚军, 费小雯, 邓晓东
- HUANG Xiao-dan, XIAO Sa, HE Chang-hao, LI Zhi-jie, ZHANG Xiu-xia, LI Ya-jun, FEI Xiao-wen, DENG Xiao-dong
- CYP307A1 RNAi重组小球藻口服喂饲对白纹伊蚊的致死作用
- Lethal effects of recombinant CYP307A1 RNAi Chlorella by feeding on Aedes albopictus
- 中国媒介生物学及控制杂志, 2023, 34(3): 336-343
- Chin J Vector Biol & Control, 2023, 34(3): 336-343
- 10.11853/j.issn.1003.8280.2023.03.010
-
文章历史
- 收稿日期: 2022-10-23
2 中国热带农业科学院热带生物技术研究所/海南热带农业资源研究院, 海南 海口 570216
2 Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Science/Hainan Tropical Agricultural Resources Research Institute, Haikou, Hainan 570216, China
蚊媒传染病是全世界重视的公共卫生问题,每年高达72万人死于该类传染病[1]。其中最常见的几种蚊媒病毒源于黄病毒科黄病毒属,分别是登革病毒(Dengue virus,DENV)、寨卡病毒(Zika virus,ZIKV)和黄热病毒(Yellow fever,YFV),以及甲病毒属的基孔肯雅病毒(Chikungunya virus,CHIKV)[2]。登革热广泛流行于128个国家,每年约39.7亿人受此疾病的威胁[3-4]。2014和2019年在广东省暴发的登革热疫情中,统计的登革热感染病例分别为47 000和12 908例[5]。寨卡病毒于1947年从乌干达寨卡森林的恒河猴中分离出来[6],2016年世界卫生组织(WHO)宣布将寨卡病毒疫情定为国际卫生紧急事件[7]。黄热病是一种人兽共患疾病,每年大约造成30 000例死亡[8],2016年的安哥拉疫情期间,数十名在安哥拉的中国公民感染了黄热病,其中8例死亡,另有11例中国公民将黄热病携带入中国[9]。基孔肯雅热起源于肯尼亚海岸发生的传播性流行病[10],截至2017年,已在44个国家造成180多万例疑似病例[11],2008、2012和2017年,中国输入基孔肯雅热感染病例分别为2、1和1例[12]。迄今由于尚无有效的药物和安全的疫苗用于治疗这些蚊媒传染病。因此,全球针对蚊媒病毒的防疫重点均集中在对伊蚊的灭杀上。我国以白纹伊蚊(Aedes albopictus)和埃及伊蚊(Ae. aegypti)为主要的传播媒介。目前对于这2种蚊虫的防控,主要采用化学杀虫剂,然而杀虫剂在对环境造成不可逆污染的同时,蚊虫对化学药剂的耐受性也在不断增加[13]。因此,迫切需要一种环境友好的技术来达到对埃及伊蚊和白纹伊蚊的控制。
RNA干扰(RNA interference,RNAi)指双链RNA(double-stranded RNA,dsRNA)引起内源靶标mRNA降解,从而导致靶标基因表达量明显下调的现象[14]。最初研究是通过将致雄性化基因(fem-1)dsRNA和不协调蛋白基因(unc-22)dsRNA注射到蠕虫的性腺和体腔中,前者43%表现出无精子(雌性)表型并不育;后者产生特征性和一致的抽搐表型[15]。此后,Lisa和Andy将表达蠕虫dsRNA的细菌喂食蠕虫,能够特异性地沉默蠕虫体内目的基因的表达[16]。除此之外,Kumar等[17]将3-HKT基因转化入莱茵衣藻(Chlamydomonas reinharditii)CC425,喂食的按蚊幼虫出现相应基因表达量下降和死亡率升高的现象;在家蚕的研究中通过对CYP314A1的RNAi导致家蚕化蛹及雌蛾卵巢发育异常,并引起蜕皮激素信号通路基因下调表达[18]。到目前为止,RNAi技术已在小鼠、果蝇、线虫、真菌及植物中应用。因此,本研究利用RNAi技术沉默伊蚊蜕皮激素合成通路关键基因用于伊蚊的防控是可行的。
微藻是单细胞或多细胞的真核生物,生活在水生和陆地环境,且可进行光合自养、异养以及混合营养[19]。在自然界中,部分种类微藻[如小球藻(Chlorella vulgaris)]由于体积小且富含营养,被水生生物和昆虫的幼虫当做食物来源[20]。微藻由于大多是单细胞,不需要植物中繁琐的再生步骤,一旦获得转化体可在体内长久维持,因此也被用于基因组学研究[21]。
20-羟基蜕皮酮(20E)是蜕皮甾体的一种活性形式,调节昆虫体内的周期性蜕皮和变态蜕皮[22],20E的生物合成是由胆固醇通过Halloween基因编码的细胞色素P450羟化酶(Spook,Spo;Phantom,Phm;Disembodied,Dib;Shadow,Sad;Shade,Shd)催化的若干羟基化反应完成,其中Spook(CYP307A1)主要负责催化7-脱氢胆甾醇转化为二酮醇(Diketol),之后依次被细胞色素P450羟化酶Phantom(CYP306A1)、Disembodied(CYP302A1)和Shadow(CYP315A1)催化生成无生物活性的蜕皮酮。通过前胸腺细胞(PG)释放α-蜕皮甾酮到血淋巴,随着体液循环进入靶细胞,在细胞质内被细胞色素P450羟化酶Shade(CYP314A1)催化生成具有生物活性20-羟基蜕皮酮[23-24]。CYP307A1蛋白具有复杂的家族进化史,在不同物种中表达模式具有差异。1986年,Abdel-Aal和Hammock[25]发现果蝇体内的CYP307A1仅在胚胎和卵泡细胞中表达,而且降低CYP307A1的表达水平会导致Ⅰ龄幼虫发育停滞。1995年,Warren等[26]在灰背飞虱中鉴定出CYP307A1基因。2005年,Namiki等[27]发现家蚕中的CYP307A1仅在前胸腺中表达,其转录水平与20E滴度的变化呈正相关。2013年,Emilie等在冈比亚按蚊(Anopheles gambiae)的幼虫、蛹、成年雌性和雄性中检测到CYP307A1,但在胚胎中并未检测到,后续以CYP307A1为靶点的RNAi实验进一步证明CYP307A1是20E合成所必需的基因。除此之外,CYP307A1还参与黑腹果蝇(Drosophila melanogaster)、烟草天蛾(Manduca sexta)和赤拟谷盗(Tribolium castaneum)体内20E的生物合成[28-31]。
本研究将CYP307A1基因作为RNAi靶点构建表达载体,转化入小球藻,将经筛选得到的重组藻株喂食白纹伊蚊幼蚊,重组藻株在伊蚊体内释放CYP307A1基因的dsRNA,特异性沉默伊蚊幼蚊蜕皮激素通路基因,从而阻碍20E合成,阻断伊蚊的正常蜕皮和变态发育并导致死亡,这为蚊媒传染病的防控提供新的思路。
1 材料与方法 1.1 实验材料小球藻HOC5是从海南省红树林水域分离的本地藻株,在TAP培养基上培养,藻株培养条件为温度(23±1) ℃,光照周期(L∶D)=16 h∶8 h,光照强度为4 000 lx,摇床转速220 r/min。RNAi干涉载体pMaa7IR/XIR、中间载体pT282由本实验室保存。其他试剂盒转化菌株购置于生工生物工程(上海)股份有限公司、宝生物工程(大连)有限公司等。
1.2 CYP307A1 RNAi表达载体构建CYP307A1 RNAi表达载体是通过生工生物工程(上海)股份有限公司根据提供的白纹伊蚊CYP307A1基因的编码区序列合成RNAi片段,之后整合到pMD18-T。转化感受态细胞,挑取单菌落,以SanPrep柱式质粒DNA小量抽提试剂盒进行质粒提取。随后进行PCR分析,得到pMD18-CYP307A1载体。分别通过Hind Ⅲ、BamH Ⅰ酶以及Sal Ⅰ、Xba Ⅰ酶切割下正反2个方向的基因片段,2个片段通过与pT282连接得到含CYP307A1反向重复序列的中间载体,最后经过EcoRⅠ酶切整合到pMaa7IR/XIR表达载体上得到CYP307A1 RNAi表达载体,再进行EcoRⅠ酶切鉴定和测序分析。
1.3 重组载体转化小球藻及筛选取50 ml培养至对数生长期的小球藻藻液,离心半径为13.5 cm,3 500 r/min,离心2~3 min,弃上清,高渗缓冲液悬浮静置1 h。离心收集藻体后加入(3~5 ml)电击缓冲液悬浮,在500 μl藻液中添加3 μg CYP307A1 RNAi表达载体,冰上静置30 min。经电击后将藻液涂布于含10 μg/ml Paromomycin的TAP固体培养基,5~7 d后挑取藻株转化子置于含1.5 mmol/L L-Tryptophan、5 μmol/L 5-Fluoroindole的TAP固体培养基上进行第2次重组藻株筛选,保存并编号存活的CYP307A1 RNAi重组小球藻进行后续检测和伊蚊的喂食实验。
1.4 伊蚊饲养和生物学检测将CYP307A1 RNAi重组小球藻在50 ml TAP培养液中震荡培养到对数生长中期,每天取出1 ml/只喂食伊蚊幼蚊。记录幼蚊的长度、存活数量、化蛹数量、成蚊数量等。
1.5 饲喂幼蚊基因组学和形态学检测伊蚊L1幼蚊饲喂不同食物后第4天,各组分别随机取3只存活幼蚊在显微镜下进行体长测定和形态拍照,同时取部分存活幼蚊进行总RNA的提取(TaKaRa MiniBEST Universal RNA Extration Kit,Code No. 9767),反转录后通过Real-time PCR分析幼蚊体内CYP307A1的表达水平。
1.6 统计学分析采用WPS 2020软件汇总整理数据,SPSS 25软件进行各组平均值的单因素ANOVA检验,P < 0.05为差异有统计学意义。最后使用Origin 2019和WPS 2020软件进行图表的制作。
2 结果 2.1 CYP307A1基因聚类分析本研究涉及的白纹伊蚊CYP307A1基因全长3 154 bp(GenBank登录号:XP_019525703),基因开放阅读框为1 698 bp,编码氨基酸序列长度为564 aa。采用MEGA 11软件中邻接法(neighbor-joining method,NJ法)构建系统发育树,各分支重复检验次数均为1 000次。结果显示,白纹伊蚊(Aedes albopictus,XP_029709566.1)与埃及伊蚊(Ae. aegypti,XP_040173252.1)聚为一支,其亲缘关系最近,同源性为96.81%,其次是致倦库蚊(Culex pipiens quinquefasciatus,XP_038117770.1)、阿拉伯按蚊(Anopheles arabiensis,XP_040173252.1),同源性最低的是黎巴嫩假果蝇(Scaptodrosophila lebanonensis,XP_030379937.1)(55.02%)。见图 1。
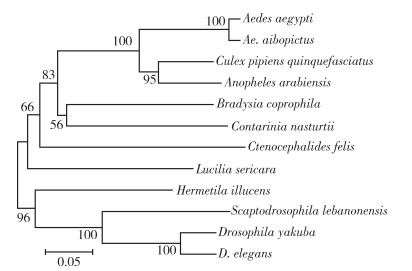
|
| 注:埃及伊蚊(Aedes aegypti,XP_021694486.1);白纹伊蚊(Ae. albopictus,XP_029709566.1);致倦库蚊(Culex pipiens quinquefasciatus,XP_038117770.1);阿拉伯按蚊(Anopheles arabiensis,XP_040173252.1);尖眼蕈蚊(Bradysia coprophila,XP_037026398.1);黑水虻(Hermetia illucens,XP_037921113.1);丝光绿蝇(Lucilia sericata,XP_037813198.1);甘蓝瘿蚊(Contarinia nasturtii,XP_031617972.1);果蝇(Drosophila yakuba,XP_002093808.1);黎巴嫩假果蝇(Scaptodrosophila lebanonensis,XP_030379937.1);牵牛花果蝇(D. elegans,XP_017129564.1);栉头蚤/猫栉首蚤(Ctenocephalides felis,XP_026465022.1)。 图 1 白纹伊蚊与近缘生物CYP307A1氨基酸序列聚类分析 Figure 1 Phylogenetic tree of CYP307A1 amino acid sequence from Aedes albopictus and related creatures |
| |
以重组载体为模板,分别进行EcoRⅠ酶切和序列分析,结果如图 2所示:酶切片段大小为900 bp左右,与预期片段大小相符合,即可初步判断该基因表达载体构建成功;另外使用正向与反向引物分别进行序列分析,CYP307A1插入片段测序峰图显示所测得结果与预期序列一致,重组质粒构建成功。见图 3。
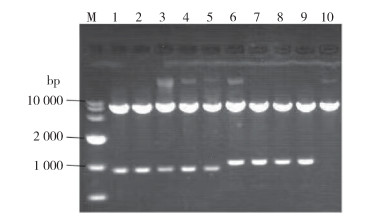
|
| 注:M DL10 000分子质量标准;1~8 CYP307A1 RNAi表达载体酶切产物;9阳性对照;10阴性对照。 图 2 RNA表达载体pMaa7 IR/CYP307A1 EcoRⅠ酶切结果 Figure 2 Results of EcoRⅠdigestion of RNA expression vector pMaa7 IR/CYP307A1 |
| |
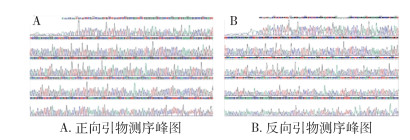
|
| 图 3 重组质粒CYP307A1基因测序峰图 Figure 3 CYP307A1 gene sequencing chromatogram of recombinant plasmid |
| |
CYP307A1 RNAi表达载体通过电击法转入小球藻藻株后,依次经过含10 μg/ml Paromomycin的TAP固体培养基和含1.5 mmol/L L-Tryptophan、5 μmol/L 5-Fluoroindole的TAP固体培养基的筛选,得到CYP307A1 RNAi重组小球藻藻株共25个。经提取藻基因组DNA后进行PCR鉴定,结果如图 4所示:PCR片段大小为430 bp左右,与预期片段大小相符合,该片段已成功转入小球藻受体。
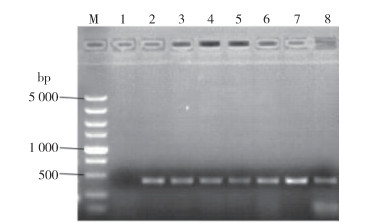
|
| 注:M DL5 000分子质量标准;1阴性对照;2~7 CYP307A1 RNAi重组小球藻PCR产物;8阳性对照。 图 4 转基因藻基因组的PCR结果 Figure 4 PCR results of genome of transgenic Chlorella |
| |
为了检测口服CYP307A1 RNAi重组小球藻对伊蚊幼蚊是否有致死作用,每组饲喂10只伊蚊幼蚊,同样的饲养环境下,与饲喂过滤水、饲料、野生小球藻和转pMaa7IR/XIR空载体小球藻的对照组相比,饲喂CYP307A1 RNAi重组小球藻藻株(307A1-1~307A1-5)在第14天全部死亡,死亡率分别为73.00%、60.00%、63.33%、70.00%和53.33%,而饲喂对照组(过滤水、饲料、野生小球藻和转pMaa7IR/XIR载体小球藻)的死亡率分别为3.33%、0、3.33%和16.17%(图 5)。从幼蚊的化蛹和羽化率上看,饲喂过滤水、饲料、野生小球藻和转pMaa7IR/XIR载体小球藻的化蛹率分别为0、90.00%、83.33%和73.33%,羽化率分别为0、86.67%、76.67%和70.00%,其中饲喂饲料的幼蚊在第5天开始化蛹,第7天开始羽化成蚊;而饲喂CYP307A1 RNAi重组小球藻(307A1-1~307A1-5)的化蛹率分别为0、6.67%、0、0和10.00%,羽化率分别为0、6.67%、0、0和6.67%,其中饲喂CYP307A1 RNAi重组小球藻(307A1-2)的幼蚊第11天开始化蛹,第13天开始羽化;以上结果显示,饲喂CYP307A1 RNAi重组小球藻比饲喂对照组小球藻在化蛹和羽化时间上要延迟,在数量上显著降低。见图 6、7。
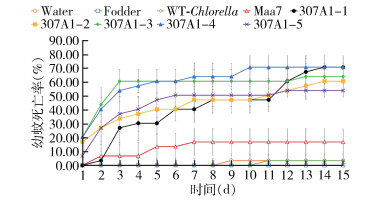
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1~307A1-5用CYP307A1 RNAi重组小球藻藻株(1~5)饲喂幼蚊。 图 5 喂食重组小球藻的白纹伊蚊幼蚊死亡率 Figure 5 Mortality of Aedes albopictus larvae fed with recombinant Chlorella |
| |
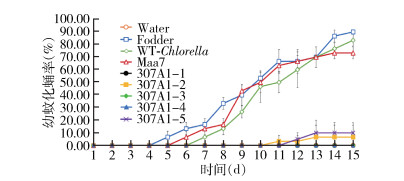
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1~307A1-5用CYP307A1 RNAi重组小球藻藻株(1~5)饲喂幼蚊。 图 6 喂食重组小球藻的白纹伊蚊幼蚊化蛹率 Figure 6 Pupation rate of Aedes albopictus larvae fed with recombinant Chlorella |
| |
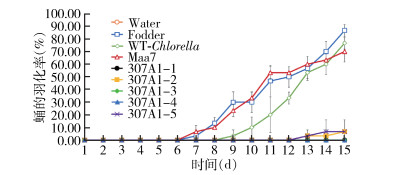
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1~307A1-5用CYP307A1 RNAi重组小球藻藻株(1~5)饲喂幼蚊。 图 7 喂食重组小球藻白纹伊蚊蛹的羽化率 Figure 7 Emergence rate of Aedes albopictus pupae fed with recombinant Chlorella |
| |
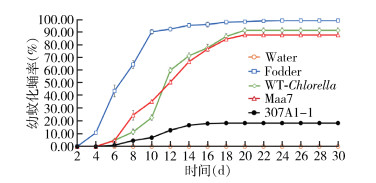
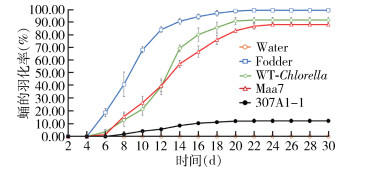
为了更加准确和科学地检测CYP307A1 RNAi重组小球藻是否具有杀伊蚊幼蚊作用,进行每组300只幼蚊为期30 d的放大实验。
幼蚊死亡率表明(图 8),饲喂过滤水、饲料、野生小球藻和转pMaa7/IR载体小球藻的死亡率分别为1.50%、0.17%、0.83%和8.00%,而饲喂CYP307A1 RNAi重组小球藻(307A1-1)在第24天全部死亡,死亡率为80.33%。幼蚊化蛹结果显示(图 9),饲喂饲料的伊蚊幼蚊在第4天开始化蛹,到第21天化蛹率为99.83%;饲喂野生小球藻的幼蚊第5天开始化蛹,第20天还剩8只未化蛹,化蛹率为92.00%;而饲喂CYP307A1 RNAi重组小球藻(307A1-1)幼蚊第6天开始化蛹,到第17天化蛹率为18.50%。从蛹的羽化结果显示(图 10),饲喂饲料的蛹在第5天开始羽化,到第21天羽化率为98.50%;饲喂野生小球藻和转pMaa7/IR载体小球藻的蛹羽化率分别为90.83%和87.33%;以上结果显示,饲喂CYP307A1 RNAi重组小球藻(307A1-1)有少量伊蚊幼蚊在化蛹阶段和蛹的羽化阶段会发生死亡现象。
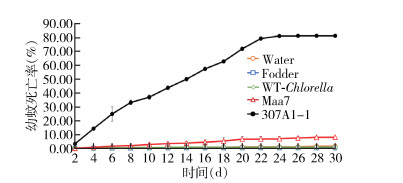
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1用CYP307A1 RNAi重组小球藻藻株(1)饲喂幼蚊。 图 8 大规模喂食重组小球藻的白纹伊蚊幼蚊死亡率 Figure 8 Mortality of Aedes albopictus larvae fed with recombinant Chlorella after expanding trials |
| |
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1用CYP307A1 RNAi重组小球藻藻株(1)饲喂幼蚊。 图 9 大规模喂食重组小球藻的白纹伊蚊幼蚊化蛹率 Figure 9 Pupation rate of Aedes albopictus larvae fed with recombinant Chlorella after expanding trials |
| |
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;307A1-1用CYP307A1 RNAi重组小球藻藻株(1)饲喂幼蚊。 图 10 大规模喂食重组小球藻白纹伊蚊蛹的羽化率 Figure 10 Emergence rate of Aedes albopictus pupae fed with recombinant Chlorella after expanding trials |
| |
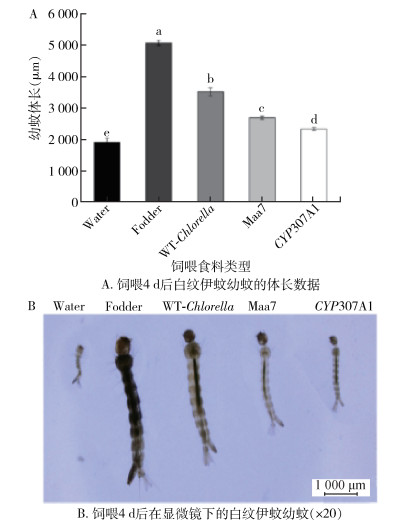
为了检测CYP307A1- RNAi重组小球藻对伊蚊幼蚊生长发育的影响,在饲喂后第4天存活的伊蚊幼蚊在显微镜下进行体长测定。结果显示(图 11),饲喂饲料的幼蚊体长为(5 069.06±82.73) μm,饲喂野生小球藻幼虫的体长为(3 509.36±131.23) μm;而饲喂CYP307A1-RNAi重组小球藻的幼蚊体长为(2 325.68±44.82) μm,与饲喂野生小球藻的幼蚊相比体长下降了33.73%。
|
| 注:Water用过滤水饲喂幼蚊;Fodder用饲料饲喂幼蚊;WT-Chlorella野生小球藻饲喂幼蚊;Maa7转空载质粒的小球藻饲喂幼蚊;CYP307A1用CYP307A1 RNAi重组小球藻藻株饲喂幼蚊;a表示该组平均数最大,与其他各组比较,P < 0.05;b与Fodder组比较,P < 0.05;c与WT-Chlorella组比较,P < 0.05;d与Maa7组比较,P < 0.05;e与CYP307A1组比较,P < 0.05。 图 11 喂食后白纹伊蚊幼蚊的体长测定结果 Figure 11 Body length of Aedes albopictus larvae after feeding for 4 days |
| |
为了检测CYP307A1-RNAi重组小球藻后是否影响靶基因的表达量,我们在饲喂后第4天测定伊蚊幼蚊体内CYP307A1基因的表达情况。以饲喂野生小球藻的表达量为1,实验重复3次。结果显示(图 12),与对照相比,喂食重组藻株伊蚊幼蚊体内CYP307A1基因表达量显著下降79.00%(P < 0.01)。饲喂CYP307A1-RNAi重组小球藻能有效地沉默伊蚊体内的CYP307A1基因。

|
| 注:WT-Chlorella野生小球藻饲喂幼蚊;CYP307A1 CYP307A1-RNAi重组小球藻饲喂幼蚊。a表示该组平均数最大,b表示CYP307A1组mRNA表达量平均值比WT-Chlorella组的小,WT-Chlorella和CYP307A1组用不同字母标识,表示饲喂转CYP307A1基因小球藻与饲喂野生小球藻的伊蚊幼蚊体内的mRNA表达量差异有统计学意义(P < 0.05)。 图 12 饲喂4 d后白纹伊蚊幼蚊体内CYP307A1 mRNA水平 Figure 12 CYP307A1 mRNA level in Aedes albopictus larvae after feeding for 4 days |
| |
蚊媒传染病是广泛流行的自然疫源性疾病,预计在2050年,此类疾病将对全球近一半的人口造成健康威胁[32]。目前应对蚊媒传染病的防疫重点都集中在消灭媒介蚊虫和疫苗研发上[33-34],鉴于世界范围内缺乏针对大多数蚊媒病毒的有效疫苗,WHO更加关注创新型控蚊工具的研发[35]。除了新兴的昆虫不育技术(SIT)和Wolbachia感染雄蚊技术,RNAi技术也日渐成熟,通过将RNAi基因片段传递入生物体方式的不同,分成非微生物介导和微生物介导两类。非微生物介导RNAi包括注射法、浸泡法和纳米颗粒介导法[36-38],而微生物介导包括细菌介导法、酵母介导法以及微藻介导法[39-41]。其中微藻介导RNAi法具有特异性强、成本低、绿色环保和不会增加蚊虫抗药性等特点,因此本研究选取催化20E合成的CYP307A1基因转化小球藻,通过对进食的伊蚊幼蚊进行死亡统计、基因组学分析和形态学观察,对重组藻株的控蚊效果作出评价。
在本实验中,喂食饲料和野生小球藻藻株的幼蚊最终羽化率分别为98.50%和90.83%,说明野生小球藻可以为伊蚊幼蚊的生长发育提供所需的营养。对撒哈拉南部富含藻类水域中存活的冈比亚按蚊和阿拉伯按蚊幼蚊进行的稳定同位素分析,发现2种幼蚊体内均残留着不同浓度的绿藻[20],说明部分绿藻在自然界中能够作为幼蚊的食物,使重组藻株的实际应用具有可行性。然而,喂食重组藻株的伊蚊幼蚊最终的羽化率要低于化蛹率,源于部分幼蚊在蛹期直接死亡或者一直维持蚊蛹的状态,说明饲喂CYP307A1 RNAi重组小球藻能够抑制伊蚊幼蚊的化蛹和羽化过程(图 6、7);除此之外,本实验喂食CYP307A1 RNAi重组小球藻的伊蚊幼蚊死亡率为80.33%,且体长要短于喂食饲料的对照组幼蚊,说明喂食重组小球藻阻碍伊蚊幼蚊的周期性蜕皮或形态蜕皮,最终致使伊蚊无法羽化,甚至是死亡。而在Kumar等[17]的实验中喂食3HKT RNAi转基因重组藻株的幼蚊死亡率在33.00%左右,由此说明喂食CYP307A1 RNAi重组小球藻比喂食3HKT RNAi重组藻株的致死效果更强,其因喂食RNAi沉默片段的不同而产生不同强度致死效果。最后,饲喂CYP307A1 RNAi重组小球藻幼蚊体内CYP307A1基因表达量下降了79.00%,说明重组小球藻可以有效降低伊蚊幼蚊体内CYP307A1基因的表达,而在贾爽[42]实验中饲喂CYP307A1-dsRNA的白背飞虱幼虫和Pondeville等[43]实验中注射CYP307A1-dsRNA的冈比亚按蚊体内,相对应基因表达量分别下降约77.00%和66.00%,此类结果表明针对昆虫CYP307A1基因的RNAi技术能切实和高效地降低其体内相应基因的表达,也是致使昆虫发育异常的主要原因。
综上所述,野生小球藻是伊蚊幼蚊的天然食物来源,且在户外拥有自主繁殖和净化水质的能力,转CYP307A1 RNAi表达载体的重组小球藻通过沉默白纹伊蚊幼蚊体内相应基因的表达,阻断白纹伊蚊的正常蜕皮和变态发育并导致死亡,可为蚊媒传染病的防控提供新的思路。
利益冲突 无
| [1] |
Gubler DJ. The global threat of emergent/re-emergent vector-borne diseases[M]//Atkinson PW. Vector biology, ecology and control. Dordrecht: Springer, 2010: 39-62. DOI: 10.1007/978-90-481-2458-9_4.
|
| [2] |
Yu X, Zhu YB, Xiao XP, et al. Progress towards understanding the mosquito-borne virus life cycle[J]. Trends Parasitol, 2019, 35(12): 1009-1017. DOI:10.1016/j.pt.2019.09.006 |
| [3] |
Bhatt S, Gething PW, Brady OJ, et al. The global distribution and burden of dengue[J]. Nature, 2013, 496(7446): 504-507. DOI:10.1038/nature12060 |
| [4] |
Brady OJ, Gething PW, Bhatt S, et al. Refining the global spatial limits of dengue virus transmission by evidence-based consensus[J]. PLoS Negl Trop Dis, 2012, 6(8): e1760. DOI:10.1371/journal.pntd.0001760 |
| [5] |
Yue YJ, Liu XB, Ren DS, et al. Spatial dynamics of dengue fever in mainland China, 2019[J]. Int J Environ Res Public Health, 2021, 18(6): 2855. DOI:10.3390/ijerph18062855 |
| [6] |
Simpson DIH. Zika virus infection in man[J]. Trans R Soc Trop Med Hyg, 1964, 58(4): 335-338. DOI:10.1016/0035-9203(64)90200-7 |
| [7] |
Fauci AS, Morens DM. Zika virus in the Americas: Yet another arbovirus threat[J]. N Engl J Med, 2016, 374(7): 601-604. DOI:10.1056/NEJMp1600297 |
| [8] |
Beard JR, Officer A, de Carvalho IA, et al. The world report on ageing and health: A policy framework for healthy ageing[J]. Lancet, 2016, 387(10033): 2145-2154. DOI:10.1016/S0140-6736(15)00516-4 |
| [9] |
国家卫生和计划生育委员会, 国家质检总局. 黄热病防控方案(2016年版)[J]. 国际流行病学传染病学杂志, 2016, 43(3): 150-152. National Health and Family Planning Commission, General Administration of Quality Supervision, Inspection and Quarantine. Protocol for prevention and control for yellow fever[J]. Inter J Epidemiol Infect Dis, 2016, 43(3): 150-152. DOI:10.3760/cma.j.issn.1673-4149.2016.03.002 |
| [10] |
Njenga MK, Nderitu L, Ledermann JP, et al. Tracking epidemic Chikungunya virus into the Indian Ocean from east Africa[J]. J Gen Virol, 2008, 89(Pt 11): 2754-2760. DOI:10.1099/vir.0.2008/005413-0 |
| [11] |
Shragai T, Tesla B, Murdock C, et al. Zika and chikungunya: Mosquito-borne viruses in a changing world[J]. Ann N Y Acad Sci, 2017, 1399(1): 61-77. DOI:10.1111/nyas.13306 |
| [12] |
杨天赐, 傅桂明. 浙江省登革热传播媒介白纹伊蚊调查研究[J]. 中华卫生杀虫药械, 2006, 12(3): 189-191. Yang TC, Fu GM. Investigation on the distribution of dengue vector Aedes albopictus in Zhejiang province[J]. Chin J Hyg Insect Equip, 2006, 12(3): 189-191. DOI:10.3969/j.issn.1671-2781.2006.03.012 |
| [13] |
Wilson AL, Courtenay O, Kelly-Hope LA, et al. The importance of vector control for the control and elimination of vector-borne diseases[J]. PLoS Negl Trop Dis, 2020, 14(1): e0007831. DOI:10.1371/journal.pntd.0007831 |
| [14] |
王伟伟, 刘妮, 陆沁, 等. RNAi技术的最新研究进展[J]. 生物技术通报, 2017, 33(11): 35-40. Wang WW, Liu N, Lu Q, et al. Latest research progress on RNA interference technology[J]. Biotechnol Bull, 2017, 33(11): 35-40. DOI:10.13560/j.cnki.biotech.bull.1985.2017-0455 |
| [15] |
Timmons L, Fire A. Specific interference by ingested dsRNA[J]. Nature, 1998, 395(6705): 854. DOI:10.1038/27579 |
| [16] |
Tabara H, Grishok A, Mello CC. RNAi in C. elegans: Soaking in the genome sequence[J]. Science, 1998, 282(5388): 430-431. DOI:10.1126/science.282.5388.430 |
| [17] |
Kumar A, Wang SJ, Ou RG, et al. Development of an RNAi based microalgal larvicide to control mosquitoes[J]. MalariaWorld J, 2013, 4(6): 1-7. |
| [18] |
张职显. 双链RNA介导的甜菜夜蛾CYP314A1基因沉默对甲氧虫酰肼与虱螨脲复配毒力的影响[D]. 北京: 中国农业科学院, 2021. DOI: 10.27630/d.cnki.gznky.2021.000463. Zhang ZX. Effects of double-stranded RNA mediated CYP314A1 gene silencing gene silencing on the toxicity of methoxyfenozide and lufenuron complex on Spodoptera exigua[D]. Beijing: Chinese Academy of Agricultural Sciences, 2021. DOI: 10.27630/d.cnki.gznky.2021.000463.(inChinese) |
| [19] |
Dorrell RG, Smith AG. Do red and green make brown?: Perspectives on plastid acquisitions within chromalveolates[J]. Eukaryot Cell, 2011, 10(7): 856-868. DOI:10.1128/EC.00326-10 |
| [20] |
Jeuken MJW, Zhang NW, McHale LK, et al. Rin4 causes hybrid necrosis and race-specific resistance in an interspecific lettuce hybrid[J]. Plant Cell, 2009, 21(10): 3368-3378. DOI:10.1105/tpc.109.070334 |
| [21] |
Altpeter F, Springer NM, Bartley LE, et al. Advancing crop transformation in the era of genome editing[J]. Plant Cell, 2016, 28(7): 1510-1520. DOI:10.1105/tpc.16.00196 |
| [22] |
Gilbert LI, Rybczynski R, Warren JT. Control and biochemical nature of the ecdysteroidogenic pathway[J]. Annu Rev Entomol, 2002, 47: 883-916. DOI:10.1146/annurev.ento.47.091201.145302 |
| [23] |
Zhou J, Zhang HL, Li J, et al. Molecular cloning and expression profile of a Halloween gene encoding CYP307A1 from the seabuckthorn carpenterworm, Holcocerus hippophaecolus[J]. J Insect Sci, 2013, 13(1): 56. DOI:10.1673/031.013.5601 |
| [24] |
Marchal E, Vandersmissen HP, Badisco L, et al. Control of ecdysteroidogenesis in prothoracic glands of insects: A review[J]. Peptides, 2010, 31(3): 506-519. DOI:10.1016/j.peptides.2009.08.020 |
| [25] |
Abdel-Aal YAI, Hammock BD. Transition state analogs as ligands for affinity purification of juvenile hormone esterase[J]. Science, 1986, 233(4768): 1073-1076. DOI:10.1126/science.3738525 |
| [26] |
Warren JT, Rybczynski R, Gilbert LI. Stereospecific, mechanism-based, suicide inhibition of a cytochrome P450 involved in ecdysteroid biosynthesis in the prothoracic glands of Manduca sexta[J]. Insect Biochem Mol Biol, 1995, 25(6): 679-695. DOI:10.1016/0965-1748(95)00007-I |
| [27] |
Namiki T, Niwa R, Sakudoh T, et al. Cytochrome P450 CYP307A1/Spook: A regulator for ecdysone synthesis in insects[J]. Biochem Biophys Res Commun, 2005, 337(1): 367-374. DOI:10.1016/j.bbrc.2005.09.043 |
| [28] |
Chavez VM, Marques G, Delbecque JP, et al. The Drosophila disembodied gene controls late embryonic morphogenesis and codes for a cytochrome P450 enzyme that regulates embryonic ecdysone levels[J]. Development, 2000, 127(19): 4115-4126. DOI:10.1242/dev.127.19.4115 |
| [29] |
Hentze JL, Moeller ME, Jørgensen AF, et al. Accessory gland as a site for prothoracicotropic hormone controlled ecdysone synthesis in adult male insects[J]. PLoS One, 2013, 8(2): e55131. DOI:10.1371/journal.pone.0055131 |
| [30] |
Ono H, Rewitz KF, Shinoda T, et al. Spook and Spookier code for stage-specific components of the ecdysone biosynthetic pathway in Diptera[J]. Dev Biol, 2006, 298(2): 555-570. DOI:10.1016/j.ydbio.2006.07.023 |
| [31] |
Rewitz KF, Rybczynski R, Warren JT, et al. Identification, characterization and developmental expression of Halloween genes encoding P450 enzymes mediating ecdysone biosynthesis in the tobacco hornworm, Manduca sexta[J]. Insect Biochem Mol Biol, 2006, 36(3): 188-199. DOI:10.1016/j.ibmb.2005.12.002 |
| [32] |
Kraemer MUG, Sinka ME, Duda KA, et al. The global distribution of the arbovirus vectors Aedes aegypti and Ae. albopictus[J]. Elife, 2015, 4: e08347. DOI:10.7554/eLife.08347 |
| [33] |
Silva JVJ, Lopes TRR, de Oliveira-Filho EF, et al. Current status, challenges and perspectives in the development of vaccines against yellow fever, dengue, Zika and Chikungunya viruses[J]. Acta Trop, 2018, 182: 257-263. DOI:10.1016/j.actatropica.2018.03.009 |
| [34] |
LaTourette II PC, Awasthi S, Desmond A, et al. Protection against herpes simplex virus type 2 infection in a neonatal murine model using a trivalent nucleoside-modified mRNA in lipid nanoparticle vaccine[J]. Vaccine, 2020, 38(47): 7409-7413. DOI:10.1016/j.vaccine.2020.09.079 |
| [35] |
World Health Organization. A WHO report on global strategy for dengue prevention and control, 2012-2020[R]. Geneva: WHO, 2012.
|
| [36] |
Zhou R, Mohr S, Hannon GJ, et al. Inducing RNAi in Drosophila cells by soaking with dsRNA[J]. Cold Spring Harb Protoc, 2014, 2014(5): pdb.prot080747. DOI:10.1101/pdb.prot080747 |
| [37] |
Magalhaes T, Brackney DE, Beier JC, et al. Silencing an Anopheles gambiae catalase and sulfhydryl oxidase increases mosquito mortality after a blood meal[J]. Arch Insect Biochem Physiol, 2008, 68(3): 134-143. DOI:10.1002/arch.20238 |
| [38] |
Sim C, Denlinger DL. Insulin signaling and FOXO regulate the overwintering diapause of the mosquito Culex pipiens[J]. Proc Natl Acad Sci USA, 2008, 105(18): 6777-6781. DOI:10.1073/pnas.0802067105 |
| [39] |
张萍, 李晨曦, 郝晓冉, 等. 新型隐球酵母非编码小RNAs的研究进展[J]. 菌物学报, 2018, 37(10): 1357-1363. Zhang P, Li CX, Hao XR, et al. Small non-coding RNAs in Cryptococcus neoformans[J]. Mycosystema, 2018, 37(10): 1357-1363. DOI:10.13346/j.mycosystema.180159 |
| [40] |
Duman-Scheel M. Saccharomyces cerevisiae (Baker's yeast) as an interfering RNA expression and delivery system[J]. Curr Drug Targets, 2019, 20(9): 942-952. DOI:10.2174/1389450120666181126123538 |
| [41] |
费小雯, 张阳, 李亚军, 等. 伊蚊3HKT基因RNAi载体构建及口服对伊蚊的致死作用[J]. 热带生物学报, 2021, 12(3): 356-362. Fei XW, Zhang Y, Li YJ, et al. Construction of RNAi vector of 3HKT gene and its lethal effect on Aedes aegypti[J]. J Trop Biol, 2021, 12(3): 356-362. DOI:10.15886/j.cnki.rdswxb.2021.03.012 |
| [42] |
贾爽. 白背飞虱和灰飞虱蜕皮激素合成相关Halloween基因的克隆与功能验证[D]. 南京: 南京农业大学, 2013. Jia S. Cloning and characterization of Halloween genes involving in ecdysteriodogenesis in Sogatella furcifera and Laodelphgax striatellus[D]. Nanjing: Nanjing Agricultural University, 2013. (in Chinese) |
| [43] |
Pondeville E, David JP, Guittard E, et al. Microarray and RNAi analysis of P450 s in Anopheles gambiae male and female steroidogenic tissues: CYP307A1 is required for ecdysteroid synthesis[J]. PLoS One, 2013, 8(12): e79861. DOI:10.1371/journal.pone.0079861 |
 2023, Vol. 34
2023, Vol. 34


