扩展功能
文章信息
- 柴能明, 谭启龙, 舒纪为, 叶凌, 张彤杰, 李世波, 张森
- CHAI Neng-ming, TAN Qi-long, SHU Ji-wei, YE Ling, ZHANG Tong-Jie, LI Shi-bo, ZHANG Sen
- 浙江省舟山群岛部分地区2021年汉坦病毒宿主调查与病原学分析
- Host animal investigation and etiological analysis of Hantavirus in some areas of Zhoushan Islands, Zhejiang province, China, 2021
- 中国媒介生物学及控制杂志, 2023, 34(3): 326-330
- Chin J Vector Biol & Control, 2023, 34(3): 326-330
- 10.11853/j.issn.1003.8280.2023.03.008
-
文章历史
- 收稿日期: 2023-01-12
2 岱山县疾病预防控制中心传染病预防与控制科,浙江 舟山 316200;
3 温州医科大学附属舟山医院感染科,浙江 舟山 316000;
4 舟山市定海区疾病预防控制中心,浙江 舟山 316000
2 Department of Infectious Disease Conirol and Prevention, Daishan Center for Disease Control and Prevention, Zhoushan, Zhejiang 316200, China;
3 Department of Infectious Disease, Zhoushan Hospital, Wenzhou Medical University, Zhoushan, Zhejiang 316000, China;
4 Dinghai Center for Disease Control and Prevention of Zhoushan, Zhoushan, Zhejiang 316000, China
肾综合征出血热(HFRS)是由汉坦病毒(Hantavirus)感染引起的一种自然疫源性急性传染病,属我国法定乙类传染病。HFRS患者感染早期血液和尿液中存在汉坦病毒,虽有少量接触后被感染的案例报告,但普遍认为HFRS传染源以啮齿类动物为主,而非患者[1]。汉坦病毒不会引起宿主动物患病,但感染汉坦病毒的宿主动物排泄物含有大量病毒,是人类感染汉坦病毒的主要来源[2]。该病发生主要取决于病毒、啮齿类宿主动物和人之间的相互作用,存在地理、季节差异,也存在一定的周期性和偶然性,受气候与气象、环境、经济社会发展、人类活动和个人行为等因素影响[3]。浙江省舟山市20世纪80、90年代HFRS病例报告较多,是HFRS的老疫区,自然疫源地存在广泛,传染源主要是褐家鼠(Rattus norvegicus),1986年为发病高峰,此后发病率逐渐下降,呈散发状[4]。目前舟山市可供参考的宿主动物相关资料较少,2021年岱山县疾病预防控制中心(疾控中心)与定海区疾控中心于舟山市的岱山县和定海区等地开展了HFRS宿主动物鼠密度、种群分布和鼠带病毒情况的调查以及病毒基因特点分析等工作。
1 材料与方法 1.1 主要试剂与仪器RNeasy Mini Kit(74104)(德国Qiagen);HFRS汉坦病毒Ⅰ、Ⅱ分型核酸测定试剂盒(荧光PCR法)购于上海之江科技有限公司;一步法RT-PCR试剂盒(RR055A)、PCR试剂盒(RR902A)均购自宝生物工程(大连)有限公司。荧光定量PCR仪采用Applied Biosystems QuantStudio 5;普通PCR仪使用梯度基因扩增仪T-one 96G(德国耶拿分析仪器股份公司);凝胶成像分析仪Essential V6;电泳仪EPS300。
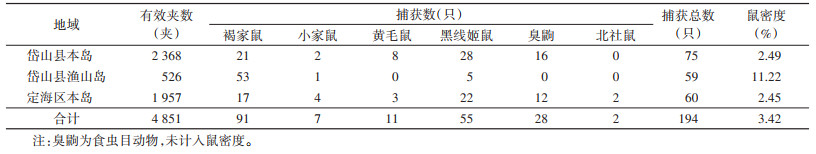
1.2 鼠密度和鼠种监测根据《全国肾综合征出血热监测方案》[5]要求,2021年在浙江省舟山市定海区、岱山县采用夹夜法,开展野外和居民区的鼠密度、鼠种监测,并进行鼠种鉴定统计。
1.3 样本处理与核酸提取无菌采集小兽肺标本置于2 ml无菌离心管中,标记编号后置于冰上,在离心管中加入无菌不锈钢珠和400 μl磷酸盐缓冲液(PBS),用组织研磨器研磨0.5~1 min制作组织匀浆;将匀浆液4 ℃ 8 000×g离心1 min,收集上清液分装至1.5 ml离心管中;采用RNeasy Mini Kiti试剂盒,按说明书操作提取病毒核酸。
1.4 引物的设计与合成根据汉坦病毒首尔型M基因(KY639618.1)自行设计M段全基因序列引物进行病毒基因扩增,序列见表 1。

|
采用HFRS汉坦病毒Ⅰ、Ⅱ分型核酸测定试剂盒(荧光PCR法)进行检测以确定基因型别,RT-qPCR反应体系及反应条件按试剂盒中使用说明书进行。
1.6 M段RT-qPCR扩增及测序采用巢式PCR进行2轮扩增,首轮外套扩增条件[用一步法RT-PCR试剂盒(RR055A)]:50 ℃ 30 min,95 ℃ 5 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min 45 s,30个循环。第2轮内套扩增条件[用PCR试剂盒(R902A)]:95 ℃ 2 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,36个循环。内套扩增产物经电泳50 min后在成像仪上确定特异性条带浓度达到测序要求后,递交上海派森诺基因科技有限公司进行测序。
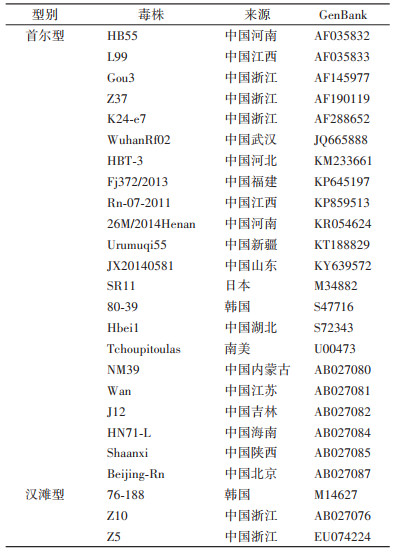
1.7 M段测序及生物信息学分析将测序中的引物序列去除后,应用DNAStar软件进行序列的拼接、比对和分析。从美国国立生物技术信息中心(NCBI)的GenBank中下载国内外人源和鼠源M基因序列作为参比序列(表 2)。采用MEGA 7软件(v7.0.26)进行序列间的同源性比较,绘制M基因的遗传进化树。选用贝叶斯信息量(BIC)值最小的Tamura 3-parameter模型来构建,绘制方法采用邻接(neighbor-joining,NJ)法。
用SPSS 18.0统计软件对数据进行分析,率的比较采用χ2检验。检验水准取α=0.05。
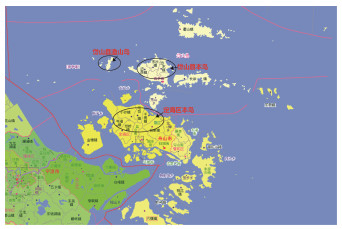
2 结果 2.1 鼠密度和鼠种分布2021年在舟山市岱山县本岛、岱山县渔山岛及定海区本岛共布放有效鼠夹4 851夹次,其中野外布放2 985夹次,居民区布放1 866夹次。共捕获小兽194只,小兽密度为4.00%,其中鼠166只,鼠密度为3.42%,臭鼩(Suncus murinus)28只,密度为0.58%。野外捕获鼠51只,野外鼠密度为1.71%,居民区捕获115只,居民区鼠密度为6.16%。居民区优势鼠种为褐家鼠,占捕获鼠类的54.82%,野外优势鼠种为黑线姬鼠,占捕获鼠类的33.13%。岱山县本岛、岱山县渔山岛和定海区本岛鼠密度(χ2=108.468,P < 0.001),居民区和野外鼠密度(χ2=68.935,P < 0.001),以及岱山县本岛、岱山县渔山岛和定海区本岛不同鼠种密度(χ2=37.749,P < 0.001)之间差异均有统计学意义。共鉴定出褐家鼠、小家鼠(Mus musculus)、黄毛鼠(R. losea)、黑线姬鼠(Apodemus agrarius)、臭鼩和北社鼠(Niviventer confucianus)6种(表 3)。宿主动物调查点位见图 1。
|
|
| 图 1 2021年浙江省舟山群岛宿主动物调查点位分布 Figure 1 Distribution of investigation sites for host animals in Zhoushan Islands, Zhejiang province, 2021 |
| |
对194份小兽肺标本进行RT-qPCR扩增检测,13份小兽肺标本检测到汉坦病毒RNA,阳性率为6.70%,其中11份来自岱山县渔山岛褐家鼠,岱山县本岛和定海区本岛褐家鼠阳性各1份,分型均为Ⅱ型(SEOV型)汉坦病毒核酸阳性。
2.3 M基因的测序及进化树构建13份标本汉坦病毒RNA提取物中3份(岱山县本岛、岱山县渔山岛和定海区本岛各1份)成功扩增并对汉坦病毒的M段基因测序。系统进化树表明,本研究中3个M段基因同源性在96.90%~97.10%,属于SEOV型汉坦病毒S3亚型。本研究的3段M基因DSE2、DS55、DSD3与浙江分离株Z37(AF190119.1)、河北分离株HBT-3(KM233661.1)、山东分离株JX20140581(KY639572.1)同源性最为接近,分别为97.39%、98.33%和98.22%。见图 2。

|
| 注:●为本次检测到的病毒序列;SEOV首尔型汉坦病毒;HTNV汉滩型汉坦病毒。 图 2 SEOV部分M基因核苷酸序列系统进化分析 Figure 2 Phylogenetic analysis of nucleotide sequence of M gene fragment of SEOV |
| |
舟山群岛位于浙江省东部海岛,20世纪80、90年代HFRS病例报告较多,疫情经历了快速上升期、快速下降期和低水平散发几个时期,流行情况与浙江省的整体情况类似[6]。作为一种自然疫源性疾病,HFRS的流行与其自然宿主动物密切相关。本研究共捕获鼠166只,鼠密度为3.42%,接近浙江省的平均鼠密度(4.21%)[7],岱山县本岛和定海区本岛鼠密度分别为2.49%、2.45%,与1985-2000年的平均鼠密度相近[4]。渔山岛鼠密度高达11.22%,可能主要与渔山岛整岛搬迁后挖山填海扩容,整体开发成工业园,导致宿主动物栖息环境发生改变,同时大量工作人员驻岛作业,人口密度剧增,居住环境杂乱给宿主动物提供了良好的隐匿繁殖环境有关[8-9]。野外鼠密度低于居民区,与姚萍萍等[10]在浙江省天台县监测结果不同,主要原因可能与HFRS宿主动物监测结果影响因素众多,与鼠夹类型、鼠夹布放人员技术和气候条件等因素有关[11],提示今后应建立稳定的监测队伍持续开展监测,以保证监测数据的代表性、真实性。定海区本岛和岱山县本岛小兽以褐家鼠、黑线姬鼠和臭鼩为主,而岱山县渔山岛主要鼠种为褐家鼠,这可能与前文所述渔山岛整体搬迁后挖山填海开发为工业园,岛上地理环境和宿主动物生境较为单一有关。居民区优势鼠种为褐家鼠,野外优势鼠种为黑线姬鼠,与浙江省2016-2020年监测结果以及全国2014年监测结果一致[6, 12],优势鼠种相对稳定。
宿主动物标本汉坦病毒总阳性率为6.70%,与张连根等[13]舟山群岛的调查结果(6.11%)相近,但高于2011年浙江省监测点结果(2.62%)[14],可能与岛内开发导致宿主动物栖息环境受扰,带病毒宿主动物的扩散和繁殖有关。经济发展、基础建设、人口流动等社会因素会使HFRS宿主动物习性改变,会加速汉坦病毒基因变异,以适应新环境或形成新的HFRS自然疫源地。同时,汉坦病毒也会逐渐增强在宿主和传播媒介体内的适应能力。应加强对自然疫源地,尤其是新发现疫源地宿主动物及其携带汉坦病毒监测,达到疾病防控关口前移,对降低疾病发病率、保障居民生命健康以及维护社会旅游经济的稳定发展具有重要作用。
汉坦病毒具有宿主动物特异性和地理簇聚性[15],本次所有汉坦病毒阳性标本均来自褐家鼠,均为SEOV型,表明褐家鼠是SEOV的主要宿主,并且提示当地暂未出现SEOV进化过程中病毒在宿主间的“溢出”现象。3份汉坦病毒阳性样本M基因核苷酸同源性较高,均为SEOV S3亚型,提示当地汉坦病毒可能为同一型别,而舟山地区HFRS的流行毒株是否以SEOV S3亚型为主,还需进一步研究。
综上所述,舟山存在以褐家鼠为传染源的HFRS疫源地,流行型别为SEOV S3亚型,是否存在其他流行型别需进一步调查;多种社会因素会改变宿主动物习性从而影响HFRS的流行,今后应加强HFRS疫源地的调查及病原学等监测,为当地HFRS的防控提供可靠依据。
志谢 本研究得到定海区疾控中心的大力配合,特此志谢利益冲突 无
| [1] |
张亚萍, 王文英, 李莉莉, 等. 我国肾综合征出血热流行病学特征及预防控制研究现状[J]. 中华卫生杀虫药械, 2020, 26(4): 387-393. Zhang YP, Wang WY, Li LL, et al. Research status of epidemiology and prevention and control of hemorrhagic fever with renal syndrome in China[J]. Chin J Hyg Insect Equip, 2020, 26(4): 387-393. DOI:10.19821/j.1671-2781.2020.04.026 |
| [2] |
Avšič-Županc T, Saksida A, Korva M. Hantavirus infections[J]. Clin Microbiol Infect, 2019, 21S: e6-16. DOI:10.1111/1469-0691.12291 |
| [3] |
尚翠, 张全福, 殷强玲, 等. 汉坦病毒病流行影响因素分析[J]. 中华流行病学杂志, 2020, 41(6): 968-974. Shang C, Zhang QF, Yin QL, et al. Influence factors related epidemics on Hantavirus disease[J]. Chin J Epidemiol, 2020, 41(6): 968-974. DOI:10.3760/cma.j.cn112338-20190916-00678 |
| [4] |
陈胜林, 王建跃. 舟山市1985-2000年肾综合征出血热监测资料分析[J]. 预防医学文献信息, 2002, 8(1): 102-103. Chen SL, Wang JY. Analysis of surveillance data of hemorrhagic fever with renal syndrome in Zhoushan from 1985 to 2000[J]. Lit Inf Prev Med, 2002, 8(1): 102-103. DOI:10.3969/j.issn.1672-9153.2002.01.101 |
| [5] |
中华人民共和国卫生部. 全国肾综合征出血热监测方案(试行)[S]. 北京: 中华人民共和国卫生部, 2005. Ministry of Health, PRC. National hemorrhagic fever with renal syndrome surveillance program (Trial)[S]. Beijing: Ministry of Health, PRC, 2005. (in Chinese) |
| [6] |
张蓉, 张宁, 凌锋, 等. 2016-2020年浙江省肾综合征出血热监测分析[J]. 疾病监测, 2021, 36(9): 915-919. Zhang R, Zhang N, Ling F, et al. Surveillance for hemorrhagic fever with renal syndrome in Zhejiang, 2016-2020[J]. Dis Surveill, 2021, 36(9): 915-919. DOI:10.3784/jbjc.202106220354 |
| [7] |
张蓉, 姚苹苹, 徐芳, 等. 2010-2014年浙江省肾综合征出血热流行特征分析[J]. 中华地方病学杂志, 2016, 35(7): 520-524. Zhang R, Yao PP, Xu F, et al. Analysis of epidemiological characteristics of hemorrhagic fever with renal syndrome in Zhejiang province, China, 2010-2014[J]. Chin J Endemiol, 2016, 35(7): 520-524. DOI:10.3760/cma.j.issn.2095-4255.2016.07.012 |
| [8] |
陈旭辉, 谭启龙, 舒纪为, 等. 浙江省岱山县一起肾综合征出血热疫情汉坦病毒分子流行病学分析[J]. 中国媒介生物学及控制杂志, 2022, 33(5): 706-709. Chen XH, Tan QL, Shu JW, et al. Molecular epidemiological analysis of Hantavirus in an outbreak of hemorrhagic fever with renal syndrome in Daishan county, Zhejiang province, China[J]. Chin J Vector Biol Control, 2022, 33(5): 706-709. DOI:10.11853/j.issn.1003.8280.2022.05.017 |
| [9] |
谭启龙, 叶凌, 徐虹, 等. 浙江省岱山县工业园肾综合征出血热疫情特征及基因分析[J]. 中华地方病学杂志, 2022, 41(3): 193-199. Tan QL, Ye L, Xu H, et al. Epidemic characteristics and genetic analysis of hemorrhagic fever with renal syndrome in an industrial park in Daishan county, Zhejiang province[J]. Chin J Endemiol, 2022, 41(3): 193-199. |
| [10] |
姚苹苹, 徐芳, 朱函坪, 等. 天台县汉坦病毒宿主动物调查及病毒分离结果[J]. 预防医学, 2019, 31(5): 433-436, 440. Yao PP, Xu F, Zhu HP, et al. The host investigation and virus isolation of Hantavirus in Tiantai county[J]. Prev Med, 2019, 31(5): 433-436, 440. DOI:10.19485/j.cnki.issn2096-5087.2019.05.001 |
| [11] |
刘天, 郝海波, 姚梦雷, 等. 2017-2020年湖北省荆州市肾综合征出血热宿主动物监测分析[J]. 中国人兽共患病学报, 2022, 38(2): 128-134. Liu T, Hao HB, Yao ML, et al. Analysis of hemorrhagic fever with renal syndrome host animal surveillance in Jingzhou city, Hubei province from 2017 to 2020[J]. Chin J Zoonoses, 2022, 38(2): 128-134. DOI:10.3969/j.issn.1002-2694.2022.00.029 |
| [12] |
王芹, 李建东, 张全福, 等. 2014年全国肾综合征出血热监测总结和疫情分析[J]. 疾病监测, 2016, 31(3): 192. Wang Q, Li JD, Zhang QF, et al. Surveillance for hemorrhagic fever with renal syndrome in China, 2014[J]. Dis Surveill, 2016, 31(3): 192-199. DOI:10.3784/j.issn.1003-9961.2016.03.005 |
| [13] |
张连根, 王忠发, 蒋文雅. 舟山港鼠类携带HFV与人群感染情况的调查[J]. 旅行医学科学, 1997, 3(1): 19. Zhang LG, Wang ZF, Jiang WY. The investigation of situation of rats carried HFV and infected population at Zhoushan port area[J]. Sci Travel Med, 1997, 3(1): 19. |
| [14] |
徐芳, 朱函坪, 姚苹苹, 等. 浙江省2008-2011年啮齿动物中汉坦病毒的分离及鉴定[J]. 中国媒介生物学及控制杂志, 2013, 24(4): 285-288. Xu F, Zhu HP, Yao PP, et al. Isolation and identification of Hantavirus carried by rodents in Zhejiang province, China from 2008 to 2011[J]. Chin J Vector Biol Control, 2013, 24(4): 285-288. DOI:10.11853/j.issn.1003.4692.2013.04.001 |
| [15] |
Sibold C, Meisel H, Krüger DH, et al. Recombination in Tula Hantavirus evolution: Analysis of genetic lineages from Slovakia[J]. J Virol, 1999, 73(1): 667-675. DOI:10.1128/JVI.73.1.667-675.1999 |
 2023, Vol. 34
2023, Vol. 34