扩展功能
文章信息
- 向昱龙, 周敬祝, 张燕, 胡勇, 梁文琴
- XIANG Yu-long, ZHOU Jing-zhu, ZHANG Yan, HU Yong, LIANG Wen-qin
- 贵州省少数民族自治州微小扇头蜱的宏基因组分析
- Metagenomic analysis of Rhipicephalus microplus from minority autonomous prefectures in Guizhou province, China
- 中国媒介生物学及控制杂志, 2023, 34(3): 319-325
- Chin J Vector Biol & Control, 2023, 34(3): 319-325
- 10.11853/j.issn.1003.8280.2023.03.007
-
文章历史
- 收稿日期: 2022-12-19
2 贵州省疾病预防控制中心病媒生物监测科,贵州 贵阳 550004
2 Vector Surveillance Section of Guizhou Center for Disease Control and Prevention, Guiyang, Guizhou 550004, China
蜱传疾病是全球性的公共卫生问题[1]。蜱体内的微生物种类繁多,其中一些对人类和其他哺乳动物都有致病作用。微小扇头蜱(Rhipicephalus microplus)是全球家畜农业生态系统中传播疾病的相关媒介,主要寄生于牛,偶尔也会感染人,也是在中国发现的优势蜱种之一[2-4]。作为一种单宿主物种,微小扇头蜱在其所有生长发育阶段都停留在宿主上,幼虫、若虫和成虫各吸血1次,每次持续几天或几周[5]。在觅血过程中可能导致疾病传播,如最常见于牛的蜱传无形体病[6]。
贵州省少数民族自治州具有独特的人文地理环境,畜牧业较为发达,微小扇头蜱广泛存在于这些地区,但其作为蜱传疾病的生物媒介作用尚不清楚。因此本研究旨在评估在这些地区采集的微小扇头蜱的微生物多样性,比较其不同生长阶段、不同性别的微生物组成差异。这项工作将有助于评估该地区牛和人感染蜱传疾病的风险,并作为制定防控策略的基础。
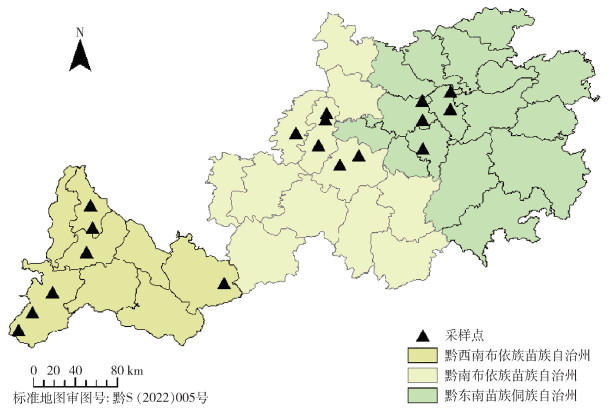
1 材料与方法 1.1 标本采集与鉴定根据前期调查基础和地理区划,在贵州省黔东南苗族侗族自治州(黔东南州)、黔南布依族苗族自治州(黔南州)、黔西南布依族苗族自治州(黔西南州)共选取18个采样点进行采样(图 1),本次采样于2019-2020年4和7月采用动物体表捕捉法采集黄牛和羊的体表寄生蜱。采集过程均已得到动物主人的同意。采集的蜱经液氮冷冻保存带回实验室,在体视显微镜下观察假头基、须肢、孔区、基突、盾板、足基节、距、生殖孔、肛门肛沟、气门板等形态学特征,按照分类检索表进行鉴定,鉴定后保存在-80 ℃超低温冰箱待检。
|
| 图 1 贵州省少数民族自治州蜱采样点空间分布 Figure 1 Spatial distribution of tick-sampling sites in minority autonomous prefectures of Guizhou province |
| |
采集的微小扇头蜱先按照自治州进行分组,再按照不同生长阶段、不同性别进行分组,最终得到27组样本。每个自治州分别有9组样本,其中若蜱(饱血)、雌蜱(饱血)和雄蜱(饱血)各3组。若蜱组和雄蜱组采用10只蜱混样,雌蜱组采用5只蜱混样。
1.3 实验方法 1.3.1 核酸提取将各样本用75%乙醇溶液清洗3次,然后用磷酸盐缓冲液(PBS)清洗1次以除去表面微生物和杂质。然后根据核酸提取试剂盒说明书,使用E.Z.N.ATM Mgg-Bind.Soil DNA Kit(Omega,M5635-02,美国)进行蜱及其携带微生物的总DNA提取,并使用Qubit 4.0(ThermoFisher,美国)测定DNA浓度,以确保提取到足够数量的高质量基因组DNA。
1.3.2 文库制备及测序每个样品中的DNA总量为500 ng,作为DNA样品制备的输入材料。使用Hieff NGSⓇ MaxUp Ⅱ DNA Library Prep Kit for IlluminaⓇ(12200ES96,YEASEN,中国)按照说明书生成测序文库,并加入索引代码以归属每个样品的序列。首先用超声波DNA破碎仪(S220,Covaris,美国)将DNA裂解成约500 bp的片段。然后用Hieff NGSTM DNA Selection Beads DNA(12601ES56,YEASEN,中国)纯化文库片段。纯化的DNA经过末端修复、适配器连接和片段选择。再用2×Super CanaceⓇⅡ高保真混合液、引物混合液(p5/p7)和适配器连接的DNA进行PCR。最后,对扩增产物进行纯化(Hieff NGSTM DNA Selection Beads),并在QubitⓇ4.0荧光定量仪上评估文库质量。然后对文库进行量化并富集。文库的双端测序在NovaSeq 6000测序仪(Illumina,美国)上进行。
1.3.3 数据评估及质控用Fastp(v. 0.36)软件对测序后的数据进行质量评价,对原始数据按以下几个步骤进行过滤:①去除接头序列;②去除读长(reads)的3'-5'方向的低质量碱基,用划窗法去除低于平均质量值Q20的碱基(划窗大小为4 bp);③找到每对读长的重叠部分,适当纠正区间内不一致的碱基;④剔除长度小于35 nt的双端读长。将剩余的干净数据用于进一步分析。
1.3.4 宏基因组拼接组装与分箱首先,使用megahit(v. 1.2.9)进行多样本混池剪接,获得初步的剪接重叠群(contig)序列。然后使用Bowite2(v. 2.1.0)清理读长,将其映射回剪接结果,提取未映射的读长,并使用SPAdes(v. 3.13)再次拼接以获得低丰度重叠群。使用MetaWRAP(v. 1.3.2)执行一系列的分箱,依次完成Bin分选、Bin提纯、Bin定量、Bin重组装和Bin鉴定等过程。最终经过滤后得到完整度较高且低污染度的单菌基因组草图。
1.3.5 基因预测和非冗余基因组构建采用Prodigal(v. 2.60)对拼接结果进行开放阅读框(ORF)预测,选择长度≥100 bp的基因,并将其翻译成氨基酸序列。对于各样本的基因预测结果,采用CD-HIT(v. 2.60)软件进行去冗余,以获得非冗余的基因集。使用Salmon(v. 1.5.0)构建非冗余基因集的特定指数,使用双向并行推理算法以及构建偏差模型的方法准确定量各个样本中基因的丰度,并根据基因长度信息计算基因丰度。
1.3.6 物种与功能注释使用DIAMOND(v. 0.8.20)将基因集与美国国立生物技术信息中心(NCBI)非冗余蛋白库(http://ncbi.nlm.nih.gov/)进行同源性比对,获得基因的功能注释和同源物种信息,并根据基因集丰度得到功能丰度和物种丰度。同时根据NCBI的微生物分类学信息数据库,获得基因的物种分类注释信息,并在界、门、纲、目、科、属和种各个分类学水平上统计物种的相对丰度,然后进行物种组成分析、物种差异分析、样本比较分析等多方位的统计分析。
1.3.7 统计学分析Beta多样性分析评估样本间微生物群的差异,通过与非度量多维尺度(non-metric multidimensional scaling,NMDS)分析相结合以获得可视化表示,组间相似性分析(analysis of similarities,ANOSIM)用于检验分组是否合理。这些分析使用软件R(v. 3.6.3)和GraPhIAn(v. 1.1.3)进行可视化,最后以分布图的形式显示样本间的距离。
2 结果18个采样点共采集微小扇头蜱1 227只,其中若蜱331只,雌蜱667只,雄蜱229只。黔东南州共采集174只,其中若蜱69只,雌蜱69只,雄蜱36只;黔南州共采集900只,其中若蜱216只,雌蜱528只,雄蜱156只;黔西南州共采集153只,其中若蜱46只,雌蜱70只,雄蜱37只。
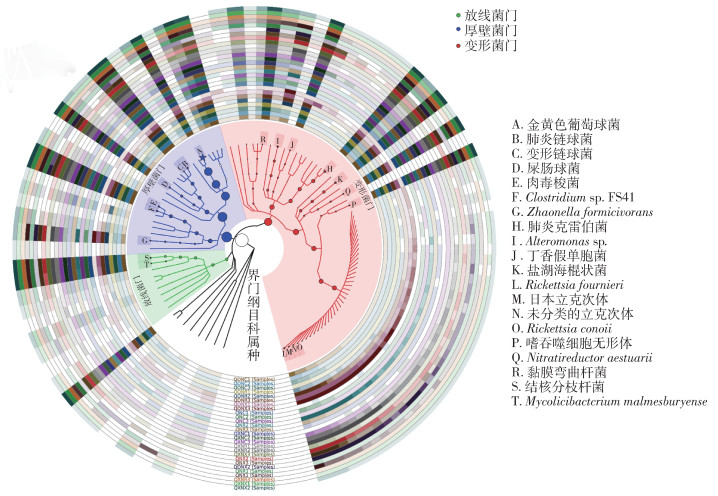
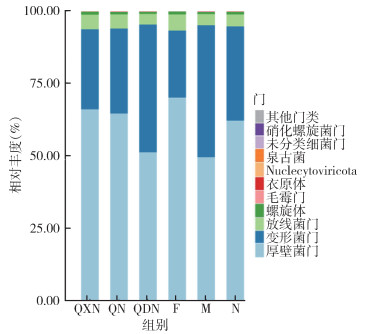
从宏基因组文库的原始读数中剔除低质量序列后,总共产生10 776 878个重叠群,N50为685 bp。原始数据的平均读长为53 287 607条,范围36 943 660~71 589 506条,平均碱基对为7 993 141 111对,范围5 541 549 000~10 738 425 900对;质控后的数据平均读长为52 942 762条,范围36 751 961~71 057 843条,平均碱基对为7 888 471 532对,范围5 476 042 189~10 587 618 607对。利用GraPhlAn进行层级注释可视化分析,根据样本的物种或功能丰度分析结果,选出优势物种,结合物种层级信息,将其可视化和注释(图 2)。从门水平来看,厚壁菌门(Firmicutes)是优势菌门,相对丰度为60.70%,其次是变形菌门(Proteobacteria)和放线菌门(Actinobacteria),相对丰度分别为33.76%和4.53%,其余门类占1.01%。除来自黔东南州的3个雄蜱样本以变形菌门为优势菌门外,其余样本均以厚壁菌门为优势菌门。将样本按地区分组,来自黔西南州的微小扇头蜱的厚壁菌门相对丰度最高,为66.15%;按照若蜱、雌蜱和雄蜱分组,雌蜱的厚壁菌门相对丰度最高,为70.22%。见图 3。
|
| 注:居中的是丰度前100个物种进化分类树,并将丰度前20个物种(以星号标出)所对应的门按不同的颜色标出,圈和星号的大小代表丰度大小,越大表示丰度越高。外围环为热力图,每一环为一个样本,每个样本对应一种颜色。颜色深浅随物种丰度变化,颜色越深表示丰度越高。 图 2 微小扇头蜱微生物群层级注释图 Figure 2 Hierarchical annotation diagram of microbiota of Rhipicephalus microplus |
| |
|
| 注:仅显示相对丰度排名前10的门类,其余用“其他门类”表示;QXN、QN和QDN分别表示黔西南州、黔南州和黔东南州的微小扇头蜱;F表示雌蜱,M表示雄蜱,N表示若蜱。 图 3 微小扇头蜱的门水平微生物群落相对丰度柱状图 Figure 3 Histogram of relative abundance of phylum-level microbial communities of Rhipicephalus microplus |
| |
从种水平来看,金黄色葡萄球菌(Staphylococcus aureus)是优势菌种,相对丰度为38.29%,其次是肺炎克雷伯菌(Klebsiella pneumoniae)和肺炎链球菌(Streptococcus pneumoniae),相对丰度分别为7.79%和5.26%。相对丰度排名前10的物种还有盐湖海棍状菌(Maritimibacter lacisalsi,4.58%)、屎肠球菌(Enterococcus faecium,3.87%)、肉毒梭菌(Clostridium botulinum,3.81%)、Alteromonas sp.(3.72%)、Clostridium sp. FS41(3.35%)、Rickettsia fournieri(2.91%)和结核分枝杆菌(Mycobacterium tuberculosis,2.82%)。除来自黔东南州的2个雄蜱样本外,其余样本均以金黄色葡萄球菌为优势菌种。将样本按地区分组,来自黔西南州的微小扇头蜱具有最高丰度的金黄色葡萄球菌,相对丰度为42.91%;按照生长阶段、性别分组,雌蜱的金黄色葡萄球菌相对丰度最高,为46.07%(图 4)。本次检测检出多种由蜱传播的立克次体基因型,如R. fournieri、日本立克次体(R. japonica,1.76%)、R. conorii(0.95%)、西伯利亚立克次体(R. sibirica,0.17%)、R. monacensis(0.04%)等。R. fournieri和日本立克次体主要由雄蜱携带,相对丰度分别为6.17%和3.70%。此外导致人粒细胞无形体病(human granulocytic anaplasmosis,HGA)的病原体嗜吞噬细胞无形体(Anaplasma phagocytophilum,1.38%)也被检出,在各样本间分布均匀。

|
| 注:仅显示相对丰度排名前10的物种,其余物种用“其他种类”表示;QXN、QN和QDN分别表示黔西南州、黔南州和黔东南州的微小扇头蜱;F表示雌蜱,M表示雄蜱,N表示若蜱。 图 4 微小扇头蜱种水平微生物群落相对丰度柱状图 Figure 4 Histogram of relative abundance of species-level microbial communities of Rhipicephalus microplus |
| |
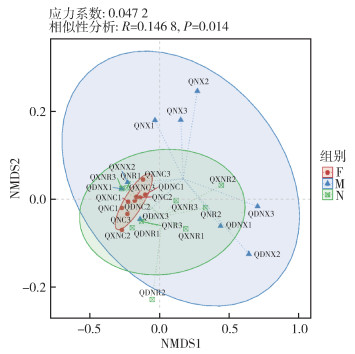
NMDS分析将样品中包含的物种信息以点的形式反映在多维空间上,通过点对点间的距离体现不同样品间的差异程度,并结合ANOSIM判断分组是否合理。结果表明,当按若蜱、雌蜱、雄蜱分组时,组间差异大于组内差异(R=0.147,P=0.014)。见图 5。
|
| 注:NMDS非度量多维尺度;F表示雌蜱,M表示雄蜱,N表示若蜱,用不同颜色和标识表示;QXN、QN和QDN分别表示黔西南州、黔南州和黔东南州的微小扇头蜱,X1~3、R1~3和C1~3表示不同的样本;样本在图中的位置代表样本受主成分影响下的相似性距离;椭圆表示95%置信区间;应力系数越小(< 0.1)表示模型效果越好。 图 5 微小扇头蜱微生物菌群物种水平的非度量多维尺度分析图 Figure 5 Non-metric multidimensional scaling diagram of microbiota of Rhipicephalus microplus at the species level |
| |
本研究选择蜱的活跃时期4和7月进行采集,将贵州省的优势寄生蜱种—微小扇头蜱作为研究对象[7],为了更好地了解蜱传病原体,本研究比较了不同地区、不同生长阶段、不同性别微小扇头蜱的微生物菌群,为预防蜱传疾病发生提供科学依据。
研究结果表明,微小扇头蜱在贵州省少数民族自治州分布较为广泛,携带较多种类的病原体,不同生长阶段、不同性别的微小扇头蜱携带的微生物菌群有差异,而地域差异不大。厚壁菌门、变形菌门和放线菌门是蜱的常见菌门,已从国内外多项研究证实[4, 8-10]。金黄色葡萄球菌相对丰度最高,此前曾在黔西南州兴义市的褐黄血蜱(Haemaphysalis flava)中分离出该菌株[11],推测可能与蜱的生命活动和生活环境有关。本研究首次从贵州省分布的微小扇头蜱中检出多种斑点热群立克次体(spotted fever group Rickettsia,SFGR)的基因型和嗜吞噬细胞无形体,且SFGR主要由雄蜱携带,表明该地区的微小扇头蜱具有一定的传病潜力,但雄蜱传播风险有待进一步评价。
SFGR是一种专性胞内细菌,由20多种与人类感染有关的病原体构成[12],能引起多种以急性发热为主要症状的自然疫源性疾病。本研究中多个斑点热群立克次体的基因型被检出,其中2种是中国常见的蜱传立克次体,提示贵州省少数民族自治州有潜在的斑点热传播风险。R. fournieri是2013年在澳大利亚的仙燕锐缘蜱(Argas lagenoplastis)中分离出的SFGR新种[13],于2018年命名,是本次研究的SFGR中丰度最高的基因型,在中国首次从蜱中发现,其致病性和流行病学特征尚未可知。R. fournieri与我国新发现的Candidatus R. xinyangensis亲缘关系最近,而Candidatus R. xinyangensis在我国河南省信阳市已有3例病例发现[14],表明R. fournieri值得更广泛和深入的调查以了解这种病原体的分布情况和致病性。
日本立克次体是目前中国已鉴定的对人体致病的8种SFGR之一[15],是日本斑点热的病原体,自1984年以来一直存在于日本,并在过去十几年陆续从亚洲其他国家分离出来,我国已从山东、安徽等省份的长角血蜱(H.longicornis)中分离出该病原体[16-17],本次在贵州省发现该病原体值得注意。
R. conorii是地中海斑点热的病原体,最初症状类似流感,通常与蜱叮咬部位的焦痂有关[18],目前在中国未发现病例。西伯利亚立克次体是西伯利亚斑疹伤寒的病原体,于20世纪30年代在靠近太平洋的俄罗斯远东地区首次被发现[19],其亚种西伯利亚立克次体BJ-90于1990年在中国的中华革蜱(Dermacentor sinicus)首次分离,并在中国黑龙江省哈尔滨市[20]和牡丹江市[21]有病例发现,感染者一般临床症状较轻,常见的包括发热、头痛、皮疹等。
R. monacensis也是我国可以感染人体的SFGR[15],其自然感染已在不同物种中证实。R. monacensis导致地中海斑点热样疾病在过去几十年更为常见,全身不适、头痛、无瘙痒、散发的斑丘疹或红斑性皮疹是典型症状[22]。此前曾在全沟硬蜱(Ixodes persulcatus)中发现R. monacensis[23],本研究表明微小扇头蜱也可携带R. monacensis,虽然在采样地区丰度极低,但提示我们其他地区的其他蜱种也可能携带该病原体,需引起重视。
嗜吞噬细胞无形体是一种革兰阴性专性胞内寄生菌,可以感染多种动物和人类,主要由蜱叮咬传播,以硬蜱为主。本次研究结果表明,微小扇头蜱可以携带嗜吞噬细胞无形体,与其他研究结果一致,微小扇头蜱是其传播媒介[24]。由嗜吞噬细胞无形体引起的HGA在我国分布较为广泛,主要集中在河南、湖北和浙江省等地,人群普遍易感,且感染数量逐年增加[25]。贵州省虽未有HGA报道,但HGA临床表现错综复杂,很容易漏诊误诊,因此不能排除HGA流行风险。
贵州省近十几年来无蜱传疾病病例报道,包括斑点热和HGA,但曾报道过莱姆病和Q热[26],这可能与2种疾病及其病原体的诊断鉴定困难有关,容易出现漏诊。因此,加强当地居民蜱及蜱传疾病防控的宣传教育以及培训强化临床医生蜱传疾病知识将有助于对符合相应临床体征并有蜱叮咬史的患者的诊断,有助于反映蜱传疾病的真实水平。同时,随着贵州省的高速发展、环境气候变化以及近年来在病媒生物传染病方面所做的努力,蜱的适生环境已经发生改变,有必要对全省蜱种进行摸底调查,评估蜱传疾病风险,为蜱传疾病防控提供科学依据。
综上所述,本研究调查了贵州省少数民族自治州微小扇头蜱携带的微生物群,发现微小扇头蜱的微生物菌群种类丰富,丰度靠前的微生物分别是金黄色葡萄球菌、肺炎链球菌和变形链球菌等常见细菌,它们在蜱体内的作用尚未可知。发现了微生物群明显的性别、不同生长阶段之间的差异,检测出2种常见的蜱传疾病病原体——斑点热群立克次体和嗜吞噬细胞无形体。SFGR中R. fournieri在中国首次从蜱中发现,其致病性尚不清楚,同时发现了2种中国常见的蜱传立克次体。本次研究结果不仅为蜱传疾病防控提供依据,也为今后贵州省媒介蜱的研究奠定基础。
志谢 本研究得到黔东南州、黔南州、黔西南州各级疾病预防控制机构的大力支持,特此志谢利益冲突 无
| [1] |
Wikel SK. Ticks and tick-borne infections: Complex ecology, agents, and host interactions[J]. Vet Sci, 2018, 5(2): 60. DOI:10.3390/vetsci5020060 |
| [2] |
Xiang LL, Poźniak B, Cheng TY. Bacteriological analysis of saliva from partially or fully engorged female adult Rhipicephalus microplus by next-generation sequencing[J]. Antonie Van Leeuwenhoek, 2017, 110(1): 105-113. DOI:10.1007/s10482-016-0780-8 |
| [3] |
Gómez GF, Isaza JP, Segura JA, et al. Metatranscriptomic virome assessment of Rhipicephalus microplus from Colombia[J]. Ticks Tick-borne Dis, 2020, 11(5): 101426. DOI:10.1016/j.ttbdis.2020.101426 |
| [4] |
Segura JA, Isaza JP, Botero LE, et al. Assessment of bacterial diversity of Rhipicephalus microplus ticks from two livestock agroecosystems in Antioquia, Colombia[J]. PLoS One, 2020, 15(7): e0234005. DOI:10.1371/journal.pone.0234005 |
| [5] |
Anderson JF, Magnarelli LA. Biology of ticks[J]. Infect Dis Clin North Am, 2008, 22(2): 195-215. DOI:10.1016/j.idc.2007.12.006 |
| [6] |
Galay RL, Llaneta CR, Monreal MKFB, et al. Molecular prevalence of Anaplasma marginale and Ehrlichia in domestic large ruminants and Rhipicephalus (Boophilus) microplus ticks from Southern Luzon, Philippines[J]. Front Vet Sci, 2021, 8. DOI:10.3389/fvets.2021.746705 |
| [7] |
杨茂生, 吴位珩, 杨莉, 等. 贵州微小牛蜱的检测与防制研究[J]. 贵州农业科学, 2009, 37(11): 157-159. Yang MS, Wu WH, Yang L, et al. Study on detection and control of Boophilus microplus in Guizhou[J]. Guizhou Agric Sci, 2009, 37(11): 157-159. DOI:10.3969/j.issn.1001-3601.2009.11.049 |
| [8] |
Maldonado-Ruiz LP, Neupane S, Park Y, et al. The bacterial community of the lone star tick (Amblyomma americanum)[J]. Parasit Vector, 2021, 14(1): 49. DOI:10.1186/s13071-020-04550-z |
| [9] |
杨小娜, 张琳, 侯学霞, 等. 16S rDNA全长高通量测序在蜱媒病原生物多样性研究中的应用[J]. 中国媒介生物学及控制杂志, 2021, 32(4): 404-411. Yang XN, Zhang L, Hou XX, et al. Application of 16S rDNA full-length high-throughput sequencing in the study of tick-borne pathogen biodiversity[J]. Chin J Vector Biol Control, 2021, 32(4): 404-411. DOI:10.11853/j.issn.1003.8280.2021.04.004 |
| [10] |
黄邵军, 张一, 罗学辉, 等. 基于高通量测序技术分析浙江省余姚市蜱中携带细菌菌群多样性[J]. 疾病监测, 2020, 35(7): 642-645. Huang SJ, Zhang Y, Luo XH, et al. High-throughput sequencing based analysis on diversity of pathogens carried by ticks in Yuyao, Zhejiang[J]. Dis Surveill, 2020, 35(7): 642-645. DOI:10.3784/j.issn.1003-9961.2020.07.019 |
| [11] |
向昱龙, 周敬祝, 刘英, 等. 贵州省部分地区蜱及其携带细菌调查[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 148-152. Xiang YL, Zhou JZ, Liu Y, et al. An investigation of ticks and tick-borne bacteria in some areas of Guizhou province, China[J]. Chin J Vector Biol Control, 2022, 33(1): 148-152. DOI:10.11853/j.issn.1003.8280.2022.01.027 |
| [12] |
Matei IA, Estrada-Peña A, Cutler SJ, et al. A review on the eco-epidemiology and clinical management of human granulocytic anaplasmosis and its agent in Europe[J]. Parasite Vector, 2019, 12(1): 599. DOI:10.1186/s13071-019-3852-6 |
| [13] |
Diop A, Barker SC, Eberhard M, et al. Rickettsia fournieri sp. nov., a novel spotted fever group rickettsia from Argas lagenoplastis ticks in Australia[J]. Int J Syst Evol Microbiol, 2018, 68(12): 3781-3784. DOI:10.1099/ijsem.0.003057 |
| [14] |
Li H, Li XM, Du J, et al. Candidatus Rickettsia xinyangensis as cause of spotted fever group rickettsiosis, Xinyang, China, 2015[J]. Emerg Infect Dis, 2020, 26(5): 985-988. DOI:10.3201/eid2605.170294 |
| [15] |
韩婧, 贺真, 邵中军. 常见蜱传立克次体的研究进展[J]. 中华卫生杀虫药械, 2022, 28(1): 86-89. Han J, He Z, Shao ZJ. The research progress of common tick-borne rickettsia[J]. Chin J Hyg Insect Equip, 2022, 28(1): 86-89. DOI:10.19821/j.1671-2781.2022.01.024 |
| [16] |
Li JB, Hu W, Wu T, et al. Japanese spotted fever in Eastern China, 2013[J]. Emerg Infect Dis, 2018, 24(11): 2107-2109. DOI:10.3201/eid2411.170264 |
| [17] |
Qin XR, Han HJ, Han FJ, et al. Rickettsia japonica and novel Rickettsia species in ticks, China[J]. Emerg Infect Dis, 2019, 25(5): 992-995. DOI:10.3201/eid2505.171745 |
| [18] |
Narra HP, Sahni A, Alsing J, et al. Comparative transcriptomic analysis of Rickettsia conorii during in vitro infection of human and tick host cells[J]. BMC Genomics, 2020, 21(1): 665. DOI:10.1186/s12864-020-07077-w |
| [19] |
Sentausa E, El Karkouri K, Robert C, et al. Sequence and annotation of Rickettsia sibirica sibirica Genome[J]. J Bacteriol, 2012, 194(9): 2377. DOI:10.1128/JB.00150-12 |
| [20] |
Li H, Fu XY, Jiang JF, et al. Severe illness caused by Rickettsia sibirica subspecies sibirica BJ-90 infection, China[J]. Emerg Microbes Infect, 2017, 6(1): 1-3. DOI:10.1038/emi.2017.95 |
| [21] |
Jia N, Jiang JF, Huo QB, et al. Rickettsia sibirica subspecies sibirica BJ-90 as a cause of human disease[J]. N Engl J Med, 2013, 369(12): 1176-1178. DOI:10.1056/NEJMc1303625 |
| [22] |
Ye XD, Sun Y, Ju WD, et al. Vector competence of the tick Ixodes sinensis (Acari: Ixodidae) for Rickettsia monacensis[J]. Parasite Vector, 2014, 7: 512. DOI:10.1186/s13071-014-0512-8 |
| [23] |
Li W, Liu L, Jiang X, et al. Molecular identification of spotted fever group rickettsiae in ticks collected in central China[J]. Clin Microbiol Infect, 2009, 15: 279-280. DOI:10.1111/j.1469-0691.2008.02235.x |
| [24] |
周琦, 贺真, 邵中军. 嗜吞噬细胞无形体的流行特征及临床诊断进展[J]. 中华卫生杀虫药械, 2022, 28(2): 184-187. Zhou Q, He Z, Shao ZJ. Epidemiological characteristics and progress in clinical diagnosis of Anaplasma phagocytophilum[J]. Chin J Hyg Insect Equip, 2022, 28(2): 184-187. DOI:10.19821/j.1671-2781.2022.02.022 |
| [25] |
刘增加, 郑龙, 张爱勤, 等. 人粒细胞无形体病临床流行病学与防治研究现状[J]. 中华卫生杀虫药械, 2018, 24(5): 417-422. Liu ZJ, Zheng L, Zhang AQ, et al. Research progress of clinical epidemiology, prevention and treatment on human granulocytic anaplasmosis[J]. Chin J Hyg Insect Equip, 2018, 24(5): 417-422. DOI:10.19821/j.1671-2781.2018.05.001 |
| [26] |
Wu XB, Na RH, Wei SS, et al. Distribution of tick-borne diseases in China[J]. Parasit Vectors, 2013, 6: 119. DOI:10.1186/1756-3305-6-119 |
 2023, Vol. 34
2023, Vol. 34


