扩展功能
文章信息
- 谭爱, 刘鹃, 王雅伟, 曾佳芮, 刘鹏
- TAN Ai, LIU Juan, WANG Ya-wei, ZENG Jia-rui, LIU Peng
- 四川省内江市白纹伊蚊野外群体电压门控钠离子通道基因突变检测分析
- Detection of mutations in the voltage-gated sodium channel genes of field Aedes albopictus populations in Neijiang, Sichuan province, China
- 中国媒介生物学及控制杂志, 2023, 34(3): 314-318
- Chin J Vector Biol & Control, 2023, 34(3): 314-318
- 10.11853/j.issn.1003.8280.2023.03.006
-
文章历史
- 收稿日期: 2022-12-19
2 中国科学院动物研究所,北京 100101
2 Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
白纹伊蚊(Aedes albopictus)可以传播登革热、基孔肯雅热和寨卡病毒病等疾病,目前对于登革热尚无特效的治疗手段和疫苗,使用化学杀虫剂控制蚊虫密度是应急控制的主要措施。菊酯类杀虫剂由于其低毒、高效等优点,在过去的30年来,成为了我国杀虫剂的首选[1]。随着杀虫剂的长期、大量使用,白纹伊蚊种群已经产生了不同程度的抗药性,根据王明强等[2]研究显示,内江市建成区白纹伊蚊幼蚊对溴氰菊酯呈现高抗状态,抗性倍数达63.37倍,对高效氯氰菊酯、氯菊酯同样呈现中抗。相关文献显示,随着分子生物学、基因组学的发展,蚊虫抗药性的分子机制得到普遍验证,主要包括代谢抗性、靶标抗性和行为抗性[3]。其中相关的靶标主要有电压门控钠离子通道(voltage-gated sodium channel,VGSC)、乙酰胆碱酯酶和γ-氨基丁酸受体[4]。拟除虫菊酯类杀虫剂的主要靶标位点是VGSC,该通道基因编码区突变导致蚊虫对杀虫剂的敏感性降低[5]。本次研究对2021年6-7月内江市各个县(市、区)采集的白纹伊蚊VGSC基因进行检测,以了解当地蚊虫对拟除虫菊酯类杀虫剂的抗性情况。
1 材料与方法 1.1 试虫来源2021年6-7月使用诱蚊灯法采集四川省内江市东兴区、威远县和隆昌市的白纹伊蚊野外成蚊,诱蚊灯主要放置在畜产品加工企业、小区、牛场和福利院等场所,晚放晨收,经分类鉴定为白纹伊蚊后将其浸于75%乙醇溶液。共采集到110只成蚊用于实验分析。
1.2 试剂 1.2.1 裂解液配制(容量500 ml)Tris-HCl 6.057 g(100 mmol/L,pH8.0)(C4H11NO3,北京中生万达生物科技有限责任公司,Sigma进口分装,规格500 g);EDTA 1.46 g(10 mmol/L)(C10H16 N2O8,乙二胺四乙酸,北京欣经科生物技术有限公司,规格250 g);NaCl 1.46 g(50 mmol/L)(北京酷来搏科技有限公司,货号:CS9971,规格500 g);SDS 5 g(1%)(C12H25NaO4S,北京中生万达生物科技有限责任公司,Sigma L5750进口分装),蒸馏水溶解,高温高压灭菌,冷却后使用。
1.2.2 8 mol/L醋酸钾(KAc)溶液配制(容量100 ml)KAc:78.51 g(CH3COOK,北京益利精细化学品有限公司),蒸馏水定容至100 ml,用玻璃棒搅拌,静置5 h,使小的固体颗粒充分溶解后使用。
1.2.3 其他试剂蛋白酶K[天根生化科技(北京)有限公司,货号RT403,规格1 ml(20 mg/ml)];无水乙醇(CH3CH2OH,天津市汇杭化工科技有限公司,规格500 ml)。
1.3 实验方法 1.3.1 DNA提取① 取单只白纹伊蚊,用蒸馏水冲洗数次,洗去表面残留的乙醇,去掉腹部(腹部组织放回原处保存),留头胸部置于1.5 ml EP管中,做好标记(名称、日期、编号);②加入400 μl裂解液,研碎;③加入5 μl的蛋白酶K,混匀;④56 ℃水浴,1 h;⑤取出后加入50 μl 8 mol/L KAc溶液,颠倒混匀,冰上静置10 min;⑥14 000×g离心30 min,移取上清350 μl(避免取到沉淀),放入新的离心管,编号对应;⑦向上述上清液中加入2倍体积(700 μl)冰无水乙醇,室温静置20 min;⑧14 000×g离心10 min,弃上清液,加入350 μl 70%乙醇溶液(现配现用);⑨8 000×g离心10 min,弃尽上清,置于超净工作台中风干;⑩加入25 μl ddH2O,置于4 ℃冰箱溶解(暂存于透明4 ℃冰箱冻存盒中)。
1.3.2 PCR扩增及检测① VGSC 1016位点:使用引物AA_V2F:GACAATGTGGATCGCTTCCC,AA_V2R:GCAATCTGGCTTGTTAACTTG对Domain Ⅱ的部分片段进行PCR扩增;VGSC 1532和1534位点:使用引物AA_V3F:GAGAACTCGCCGATGAACTT,AA_V3R:TAGCTTTCAGCGGCTTCTTC对Domain Ⅲ的部分片段进行PCR扩增;② PCR反应程序:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s, 35个循环;72 ℃ 5 min。③琼脂糖凝胶电泳检测:1.2%琼脂糖凝胶电泳,样品上样7 μl,Marker使用D2000,上样5 μl,电压140V电泳20 min。
引物合成及测序[使用反向引物直接测序(Sanger法测序)]均在北京擎科生物科技有限公司进行。
1.4 序列比对和统计学分析基因型频率进行Hardy-Weinberg遗传平衡检验,P > 0.05则认为该位点符合Hardy-Weinberg遗传平衡。用WPS 11.1.0软件统计和计算试虫VGSC基因的等位基因和基因型频率。
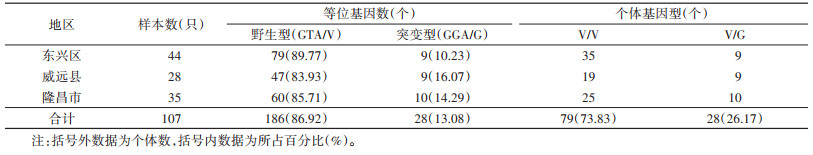
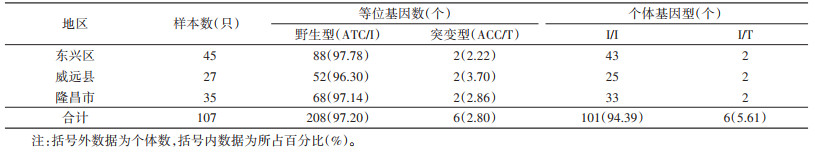
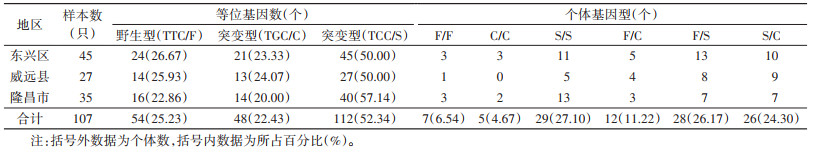
2 结果 2.1 VGSC基因突变位点的基因型本次现场共获得110只成蚊用于分析,其中每个位点均有3只测序失败。对各位点获得的107只白纹伊蚊VGSC基因部分片段比对发现,1016位点存在突变,1016位点有2种等位基因,即编码缬氨酸的野生型GTA/V(186,86.92%),编码甘氨酸的突变型GGA/G(28,13.08%);2种基因型,野生型纯合子V/V(79,73.83%),野生/突变型杂合子V/G(28,26.17%)(表 1),未发现突变型纯合基因型。1532位点共有2种等位基因,即编码异亮氨酸的野生型ATC/I(208,97.20%),编码苏氨酸的突变型ACC/T(6,2.80%);2种基因型,野生型纯合子I/I(101,94.39%),野生/突变型杂合子I/T(6,5.61%)(表 2),未发现突变型纯合基因型。1534位点共有3种等位基因,即编码苯丙氨酸的野生型TTC/F(54,25.23%),编码半胱氨酸的突变型TGC/C(48,22.43%)和编码丝氨酸的突变型TCC/S(112,52.34%);6种基因型,野生型纯合子F/F(7,6.54%),有100只发生突变(93.46%),其中突变型纯合子C/C(5,4.67%),突变型纯合子S/S(29,27.10%),野生/突变型杂合子F/C(12,11.21%),野生/突变型杂合子F/S(28,26.17%),突变/突变型杂合子S/C(26,24.30%)。见表 3。
|
|
|
遗传平衡检验结果显示,东兴区、威远县和隆昌市的1016、1532和1534共3个位点均符合遗传平衡定律(均P > 0.05)。
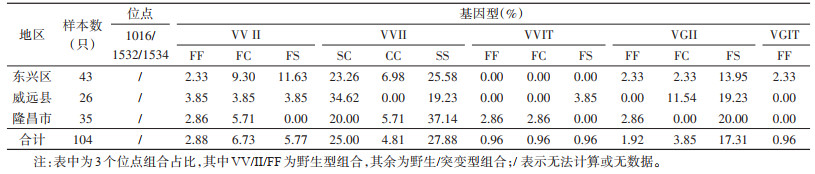
2.2 VGSC基因突变位点1016、1532和1534组合分析本次共检测3个位点组合个体104个,其中VGSC基因部分片段1016、1532、1534位点同时为野生型的共3个(2.88%);仅1个位点为突变型的个体共76个(73.08%),其中1016、1532位点为野生型、1534位点为突变型的个体共73个(70.19%),1532、1534位点为野生型、1016位点为突变型的共2个(1.92%),1016和1534位点为野生型,1532位点为突变型的共1个(0.96%)。2个位点为突变型的个体共25个(24.04%),其中1016位点为野生型、1532和1534位点同时突变的个体共2个(1.92%),1532位点为野生型、1016和1534位点同时突变的个体共22个(21.15%),1534位点为野生型、1532和1016位点同时突变的个体共1个(0.96%)。所有突变基因型中,VV+II+SS组合基因型频率最高(27.88%),其次为VV+II+SC型(25.00%),最低为VG+II+FS型(17.31%),本次现场未发现3个位点同时突变的个体。见表 4。
|
白纹伊蚊是包括登革热在内的多种蚊媒传染病的传播媒介。内江市交通区位优势明显,近年来不断有登革热输入病例报告,2019年邻近市(州)有本土病例报告[6],目前菊酯类杀虫剂空间喷洒仍是控制白纹伊蚊成蚊的重要手段,多个地区研究表明,随着菊酯类杀虫剂长期使用,白纹伊蚊对氯菊酯、溴氰菊酯、高效氯氰菊酯等产生了高、中抗药性[7-9],加之早期内江市开展的抗药性调查也提示白纹伊蚊幼虫对3种拟除虫菊酯类杀虫剂已经产生中高水平抗性[2],因此持续开展白纹伊蚊抗性研究,有助于制定更有效的蚊媒传染病控制策略。
目前报道的白纹伊蚊VGSC基因抗性突变位点有1016(V1016G)、1532(I1532T)和1534(F1534C、F1534L、F1534S)等[10-11],内江市此前无相关的系统性监测。本次调查结果显示,内江市3个白纹伊蚊野外种群VGSC基因在1016、1532和1534均发生突变,其中1016位点突变率为26.17%,高于北京市等研究结果[12],1532位点突变率为5.61%,与江苏、云南省等[5, 13]基本一致或低于部分地区[12],1534位点突变率为93.46%,抗性等位基因频率为74.77%,高于上海市杨浦区、江苏省南京市、山东省济宁市等多个群体研究结果[5, 13-14],低于浙江省杭州群体[13]。本次研究还对1016、1532、1534位点组合突变进行研究,共检测到12种突变基因型组合,野生型纯合子发生频率较低(2.88%),2个位点同时突变的个体发生频率为25.00%,未发现3个位点同时突变的个体。有文献表明,F1534S突变与白纹伊蚊对菊酯类杀虫剂的抗性表型相关[13, 15],内江市1534位点抗性基因频率较高,突变类型多,其中1534S是优势抗性等位基因,并且存在抗性纯合子;结合相关文献,F1534S突变可能在白纹伊蚊溴氰菊酯抗性的进化中起着初始和重要的作用[16],济宁市相关性分析也提示F1534S突变等位基因增强了白纹伊蚊对溴氰菊酯的抗药性[14],提示本次研究现场的白纹伊蚊检测种群中可能已存在相当程度的抗药性,但1534位点抗性基因频率高的原因仍需要进一步研究。另外本次调查现场中未发现F1534L突变,有待进一步扩大样本量,寻找新的突变个体。本次调查作为内江市现场群体的初步探索,未与白纹伊蚊群体的抗药性调查结合分析,因此接下来需要长期进行白纹伊蚊抗药性调查和VGSC基因的突变监测,以便于更好地了解现场群体抗性情况和检测抗药性分子标志的开发。
目前,拟除虫菊酯类杀虫剂仍是控制白纹伊蚊的常用杀虫剂,深入研究白纹伊蚊VGSC基因的突变,有助于开发快速检测抗药性的试剂盒,定期、连续、操作性强的抗药性监测,有助于提升蚊虫抗性监测工作的质量和效率。相关研究表明,等位基因特异性PCR(allele specifc PCR,AS-PCR)技术能够简单、有效区分VGSC基因1534位点突变的个体基因型,可用于大规模研究中白纹伊蚊的击倒抗性监测[17],内江本地以1534位点抗性基因频率较高,若本地发生规模疫情,可考虑用于识别和监测。本次现场种群VGSC基因多个位点均已发生突变,需要及时更换杀虫剂品种,避免长期且高频使用拟除虫菊酯类杀虫剂,可考虑应用苏云金杆菌、除虫脲和多杀菌素等生物杀虫剂延缓抗药性的产生[18],延长杀虫剂使用寿命。
志谢 中国科学院动物研究所邱星辉教授给予倾力支持,特此志谢利益冲突 无
| [1] |
赵春春. 我国白纹伊蚊抗药性及kdr基因分布研究[D]. 北京: 中国疾病预防控制中心, 2019. Zhao CC. Study on insectcides resistance and kdr gene distribution of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2019. (in Chinese) |
| [2] |
王明强, 徐勇, 刘鹃, 等. 内江市建成区白纹伊蚊幼虫对5种杀虫剂的抗药性调查[J]. 中华卫生杀虫药械, 2018, 24(1): 99-100. Wang MQ, Xu Y, Liu J, et al. Resistance of Aedes albopictus larvae to five insecticides in build-up area district of Neijiang city[J]. Chin J Hyg Insect Equip, 2018, 24(1): 99-100. DOI:10.19821/j.1671-2781.2018.01.032 |
| [3] |
姜陆, 邹玉梅, 高玉峰. 蚊虫抗药性研究主要进展[J]. 口岸卫生控制, 2019, 24(6): 59-62. Jiang L, Zou YM, Gao YF. Major advances in mosquito resistance research[J]. Port Health Control, 2019, 24(6): 59-62. DOI:10.3969/j.issn.1008-5777.2019.06.018 |
| [4] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. DOI:10.3969/j.issn.1005-0507.2019.03.009 |
| [5] |
王冠熙, 李雅姝, 李月月, 等. 江苏省白纹伊蚊对溴氰菊酯抗性及击倒抗性突变分析[J]. 中国寄生虫学与寄生虫病杂志, 2022, 40(4): 468-474. Wang GX, Li YS, Li YY, et al. Resistance to deltamethrin and knockdown resistance mutation in Aedes albopictus from Jiangsu province[J]. Chin J Parasitol Parasit Dis, 2022, 40(4): 468-474. DOI:10.12140/j.issn.1000-7423.2022.04.008 |
| [6] |
曹一鸥, 吕强, 张佳珂, 等. 2019年四川省首例登革热本地病例调查与疫区处置情况分析[J]. 预防医学情报杂志, 2020, 36(11): 1499-1503. Cao YO, Lyu Q, Zhang JK, et al. Investigation and disposal of the first local case of dengue fever in Sichuan province[J]. J Prev Med Inf, 2020, 36(11): 1499-1503. |
| [7] |
姬淑红, 张杰, 陆崇华, 等. 上海市杨浦区白纹伊蚊幼虫对5种常用杀虫剂的抗药性调查[J]. 中华卫生杀虫药械, 2017, 23(4): 335-336. Ji SH, Zhang J, Lu CH, et al. Resistance investigation of Aedes albopictus to five kinds of common used insecticides in Yangpu district of Shanghai[J]. Chin J Hyg Insect Equip, 2017, 23(4): 335-336. DOI:10.19821/j.1671-2781.2017.04.012 |
| [8] |
古灵满, 郭建宇, 杨雪琴, 等. 2020年中山市区白纹伊蚊抗药性调查[J]. 现代预防医学, 2021, 48(17): 3097-3100. Gu LM, Guo JY, Yang XQ, et al. Investigation on insecticide resistance of Aedes albopictus in Zhongshan city, 2020[J]. Mod Prev Med, 2021, 48(17): 3097-3100. |
| [9] |
张要锋, 梅树林, 齐振文. 2020年焦作市某县白纹伊蚊对常用卫生杀虫剂抗药性调查[J]. 河南预防医学杂志, 2022, 33(4): 291-293. Zhang YF, Mei SL, Qi ZW. Investigation of Aedes albopictus resistance to sanitary insecticides in Jiaozuo, 2020[J]. Henan J Prev Med, 2022, 33(4): 291-293. DOI:10.13515/j.cnki.hnjpm.1006-8414.2022.04.014 |
| [10] |
陈翰明. 我国白纹伊蚊群体遗传结构和击倒抗性突变检测研究[D]. 上海: 海军军医大学, 2019. Chen HM. Detection of genetic structure and knockdown resistance mutations in Aedes albopictus (Diptera: Culicidae) populations from China[D]. Shanghai: Naval Medical University, 2019. (in Chinese) |
| [11] |
朱彩英, 赵春春, 伦辛畅, 等. 云南省景洪市2018-2019年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 7-11. Zhu CY, Zhao CC, Lun XC, et al. Distribution of knockdown resistance genotypes in Aedes albopictus in Jinghong, Yunnan province, China, 2018-2019[J]. Chin J Vector Biol Control, 2020, 31(1): 7-11. DOI:10.11853/j.issn.1003.8280.2020.01.002 |
| [12] |
周小洁, 赵宇晗, 刘念, 等. 北京市两个白纹伊蚊种群kdr抗性突变检测分析[J]. 中华卫生杀虫药械, 2021, 27(4): 304-307. Zhou XJ, Zhao YH, Liu N, et al. Detection and analysis of kdr resistance mutations in two populations of Aedes albopictus in Beijing[J]. Chin J Hyg Insect Equip, 2021, 27(4): 304-307. DOI:10.19821/j.1671-2781.2021.04.003 |
| [13] |
陈翰明, 高景鹏, 姜进勇, 等. 我国白纹伊蚊现场群体击倒抗性基因I1532和F1534突变检测及I1532T突变等位基因报告[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 120-125. Chen HM, Gao JP, Jiang JY, et al. Detection of the I1532 and F1534 kdr mutations and a novel mutant allele I1532T in VGSC gene in the field populations of Aedes albopictus from China[J]. Chin J Vector Biol Control, 2018, 29(2): 120-125. DOI:10.11853/j.issn.1003.8280.2018.02.002 |
| [14] |
刘鲁宏. 济宁市白纹伊蚊kdr基因突变检测[J]. 中华卫生杀虫药械, 2022, 28(3): 267-269. Liu LH. Detection of knockdown resistance gene mutation in Aedes albopictus of Jining city[J]. Chin J Hyg Insect Equip, 2022, 28(3): 267-269. DOI:10.19821/j.1671-2781.2022.03.020 |
| [15] |
Chen HY, Li KL, Wang XH, et al. First identification of kdr allele F1534S in VGSC gene and its association with resistance to pyrethroid insecticides in Aedes albopictus populations from Haikou city, Hainan island, China[J]. Infect Dis Poverty, 2016, 5: 31. DOI:10.1186/s40249-016-0125-x |
| [16] |
Guo YJ, Zhou JN, Zhao YJ, et al. CRISPR/Cas9-mediated F1534S substitution in the voltage-gated sodium channel reveals its necessity and sufficiency for deltamethrin resistance in Aedes albopictus[J]. J Pest Sci, 2022(96): 1173-1186. DOI:10.1007/s10340-022-01557-6 |
| [17] |
Zhu CY, Zhao CC, Wang YG, et al. Establishment of an innovative and sustainable PCR technique for 1534 locus mutation of the knockdown resistance (kdr) gene in the dengue vector Aedes albopictus[J]. Parasit Vectors, 2019, 12(1): 603. DOI:10.1186/s13071-019-3829-5 |
| [18] |
师灿南. 景洪市登革热媒介伊蚊对常用杀虫剂的抗药性及机制初步研究[D]. 北京: 中国疾病预防控制中心, 2017. Shi CN. Insecticides resistance and its underlying mechanisms for dengue vectors Aedes albopictus and Ae. aegypti in Jinghong city, Yunnan province[D]. Beijing: Chinese Center for Disease Control and Prevention, 2017. (in Chinese) |
 2023, Vol. 34
2023, Vol. 34

