扩展功能
文章信息
- 赵奇, 樊金星, 张叶, 岳思宁, 刘吉起
- ZHAO Qi, FAN Jin-xing, ZHANG Ye, YUE Si-ning, LIU Ji-qi
- 河南省家蝇种群对拟除虫菊酯类杀虫剂敏感性测定和击倒抗性基因突变研究
- Susceptibility of Musca domestica to pyrethroid insecticides and knockdown resistance gene mutations in Henan, China
- 中国媒介生物学及控制杂志, 2023, 34(3): 308-313
- Chin J Vector Biol & Control, 2023, 34(3): 308-313
- 10.11853/j.issn.1003.8280.2023.03.005
-
文章历史
- 收稿日期: 2022-06-10
病媒生物的敏感品系指“由于未曾接触过杀虫药剂而保持对杀虫剂敏感的遗传上较均一的病媒生物种群”[1]。通过对敏感品系的抗药性诊断,可以建立其对目标杀虫剂的敏感基线,为更规范、准确地开展病媒生物抗药性监测工作提供依据。
河南省使用最广泛[2]、家蝇(Musca domestica)抗药性水平最高[3]的杀虫剂是拟除虫菊酯类杀虫剂,而家蝇对其抗性机制主要表现为编码钠离子通道的相关基因突变导致的杀虫剂作用靶点敏感度下降[4-5],即编码电压门控钠离子通道(voltage-sensitive sodium channel,VSSC)的VSSC基因产生了L1014F突变或L1014H突变,导致亮氨酸(Leu/L)变为苯丙氨酸(Phe/F)或组氨酸(His/H),该突变造成的抗性被称为击倒抗性(knock down resistance,kdr)或kdr-his[6]。这种击倒抗性的单一位点突变,本质上属于等位基因的单核苷酸多态性(single nucleotide polymorphisms,SNP)。等位基因特异性PCR技术(allele-specific PCR,AS-PCR)[7]通过设计针对突变位点的不同引物,通过PCR和凝胶电泳即可在平行扩增中将有点突变的模板与正常模板区分开来,达到检测DNA中点突变的目的,是SNP的常用检测方法之一。
本研究建立了河南省家蝇对拟除虫菊酯类杀虫剂的敏感基线和L1014F/L1014H突变的AS-PCR检测方法,并利用新的基线和方法检测了河南省部分地市野生家蝇种群的抗药性和抗性基因多态性。
1 材料与方法 1.1 试虫供试家蝇敏感品系为实验室饲养多年的家蝇种群,未接触过杀虫剂[8]。野生种群为2019-2021年间采集自河南省开封、安阳、南阳、驻马店和鹤壁市等地的野外家蝇。在实验室饲养至子1代后供试。实验室饲养条件为温度(26±1)℃,相对湿度(65±5)%,光周期(L∶D)=14 h∶10 h。
1.2 供试药剂99.00%氯菊酯、95.95%溴氰菊酯、92.00%高效氯氰菊酯原药由中国疾病预防控制中心传染病预防控制所媒介生物控制室提供。
1.3 抗药性生物测定按照GB/T 26350-2010《蝇类抗药性检测方法家蝇生物测定法》[9]中的成虫敏感基线微量点滴法操作。通过预实验确定3种拟除虫菊酯类杀虫剂对各地家蝇种群的测试浓度范围,然后将配制成母液的待测杀虫剂稀释成7个不同的浓度梯度,每个浓度梯度重复3次,每个重复的试虫量为20只,并以稀释溶剂丙酮作为阴性对照。将家蝇用乙醚轻度麻醉后,分别在前胸背板上点滴不同浓度的杀虫剂,24 h后观察并记录死亡情况。
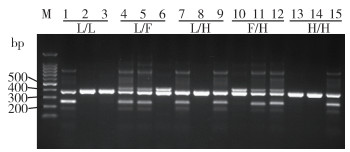
1.4 击倒抗性基因检测家蝇VSSC基因的cDNA序列已知[10],参考文献[11-13]的研究设计外引物P1(5'-GAATTTCACCGACTTCATGCAC-3')和P2(5'-AGCAATACGATTGAAGGCCTC-3'),敏感型内引物L(5'-CGGTCGTGATCGGCAATCT-3')与抗性内引物F(5'-ACGGTCGTGATCGGCAATT-3')和H(5'-CGGTCGTGATCGGCAATCA-3')。外引物扩增产物长度为381 bp,内引物扩增产物长度为257 bp。选择各地生物测定法中同笼的家蝇各64只,提取其基因组DNA后分别进行扩增(扩增条件:94 ℃预变性5 min;94 ℃变性30 s,65 ℃退火60 s,72 ℃延伸90 s,共35个循环;72 ℃延伸3 min)和凝胶电泳,通过不同的电泳条带判断基因型,计算突变率。
1.5 统计学分析利用DPS 7.05软件处理生物测定实验数据,计算半数致死剂量(LD50)及其95%置信区间。利用SPSS 25.0软件,采用Spearman相关性分析检验突变率与LD50的相关性。
1.6 DNA测序验证对AS-PCR方法检测出的所有抗性样本及部分敏感样本进行了DNA测序检测,以检验AS-PCR方法的准确性。引物同上述外引物P1和P2。
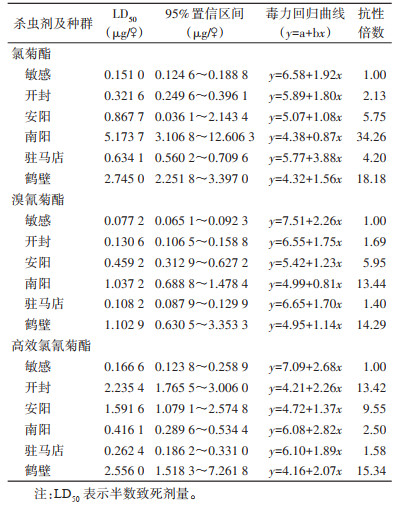
2 结果 2.1 家蝇种群的抗药性生物测定氯菊酯、溴氰菊酯、高效氯氰菊酯对家蝇敏感品系的敏感基线LD50分别为0.151 0、0.077 2和0.166 6 μg/♀。上述杀虫剂对开封种群的LD50分别为0.321 6、0.130 6和2.235 4 μg/♀;对安阳种群的LD50分别为0.867 7、0.459 2和1.591 6 μg/♀;对南阳种群的LD50分别为5.173 7、1.037 2和0.416 1 μg/♀;对驻马店种群的LD50分别为0.634 1、0.108 2和0.262 4 μg/♀;对鹤壁种群的LD50分别为2.745 0、1.102 9和2.556 0 μg/♀。见表 1。
|
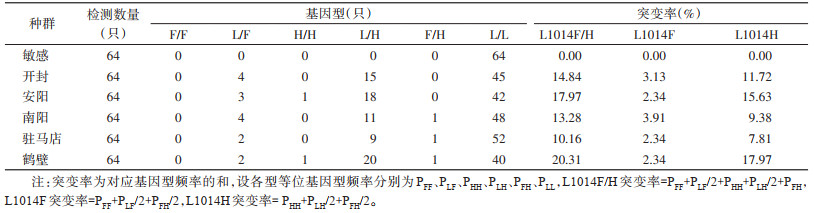
家蝇敏感品系仅检测到1种基因型,即敏感纯合子L/L。开封、安阳、南阳、驻马店、鹤壁等野生种群共检测到5种基因型,分别为敏感纯合子(L/L)、敏感/1014F杂合子(L/F)、敏感/1014H杂合子(L/H)、1014F/1014H杂合子(F/H)和1014H纯合子(H/H),不同基因型的电泳结果见图 1。按基因型频率分析,开封种群的基因型频率依次为L/L(70.31%)、L/H(23.44%)、L/F(6.25%),安阳种群的基因型频率依次为L/L(65.63%)、L/H(28.13%)、L/F(4.69%)、H/H(1.56),南阳种群的基因型频率依次为L/L(75.00%)、L/H(17.19%)、L/F(6.25%)、F/H(1.56%),驻马店种群的基因型频率依次为L/L(81.25%)、L/H(14.06%)、L/F(3.13%)、F/H(1.56%),鹤壁种群的基因型频率依次为L/L(62.50%)、L/H(31.25%)、L/F(3.13%)、F/H(1.56%)和H/H(1.56%)。按突变率分析,开封种群的总突变率为14.84%,L1014F突变率为3.13%,L1014H突变率为11.72%;安阳种群的总突变率为17.97%,L1014F突变率为2.34%,L1014H突变率为15.63%;南阳种群的总突变率为13.28%,L1014F突变率为3.91%,L1014H突变率为9.38%;驻马店种群的总突变率为10.16%,L1014F突变率为2.34%,L1014H突变率为7.81%;鹤壁种群的总突变率为20.31%,L1014F突变率为2.34%,L1014H突变率为17.97%。见表 2。
|
| 注:M表示100 bp DNA分子质量标准;泳道1、4、7、10和13为敏感型内引物L的扩增产物;泳道2、5、8、11和14为抗性内引物F的扩增产物;泳道3、6、9、12和15为抗性内引物H的扩增产物;泳道1~15均能使用P1/P2引物扩增出1条381 bp的片段,不同的基因型分别扩增出257 bp的片段。 图 1 等位基因特异性PCR方法从家蝇敏感品系和野外种群中检测出的L/L、L/F、L/H、F/H和H/H基因型 Figure 1 Genotypes of L/L, L/F, L/H, F/H, and H/H detected from the susceptible strain and wild populations of Musca domestica by allele-specific PCR method |
| |
|
计算突变率后,通过Spearman相关性分析分别检验各地种群总突变率、L1014F突变率、L1014H突变率与氯菊酯、溴氰菊酯、高效氯氰菊酯LD50的相关性。结果显示,总突变率和L1014H突变率与溴氰菊酯的LD50存在相关性(r=0.829,P=0.042),也与高效氯氰菊酯的LD50存在相关性(r=0.943,P=0.005)。总突变率、L1014F突变率、L1014H突变率与氯菊酯的LD50无相关性,L1014F突变率与溴氰菊酯的LD50、高效氯氰菊酯的LD50无相关性(均P > 0.05)。
2.4 DNA测序验证结果选取全部93个AS-PCR检测阳性的样本,并在剩余阴性样本中每个种群随机选择约10%的标本进行SNP测序检测。测序检测结果与AS-PCR检测结果不一致的有27个,AS-PCR检测的准确率为79.23%。27个结果不一致样本中,AS-PCR检测假阴性14个,假阴性率为10.77%,灵敏度为89.23%,其中9个AS-PCR检测为L/F、SNP测序检测为F/F,5个AS-PCR检测为L/H、SNP测序检测为H/H,都归因于在AS-PCR中多出L条带。AS-PCR检测假阳性13个,假阳性率为10.00%,特异度为90.00%,其中11个是AS-PCR检测为L/H、SNP测序检测为L/L,1个是AS-PCR检测为F/H、SNP测序检测为F/F,都归因于在AS-PCR中多出H条带;还有1个样本AS-PCR检测为F/H、SNP测序检测为L/F,归因于在AS-PCR中少出了L条带同时多出了H条带。
3 讨论抗药性监测是家蝇控制的重要组成部分,本研究首次使用河南省本地的家蝇种群进行敏感基线的测定,并检测了河南省部分地市野生家蝇种群的抗药性和抗性基因多态性。
各地家蝇种群对受试的拟除虫菊酯类杀虫剂的LD50均大于实验室敏感品系,其中抗性倍数 > 10,判定为中抗水平的有:南阳种群、鹤壁种群对氯菊酯,南阳种群、鹤壁种群对溴氰菊酯,开封种群、鹤壁种群对高效氯氰菊酯;抗性倍数在3~10之间,判定为低抗水平的有:安阳种群、驻马店种群对氯菊酯,安阳种群对溴氰菊酯和高效氯氰菊酯;其余抗性倍数均 < 3,判定为敏感;无抗性倍数 > 40的高抗种群。本实验室饲养的敏感品系已经能够在日常监测中作为敏感基线使用。
毒力回归方程y=a+bx中,y为试虫死亡率的概率值,x为药物剂量(浓度)的对数值,a为截距,表示死亡率的基底值,b为斜率,表示剂量(浓度)对死亡率影响的显著程度,进而表征了受试种群对杀虫剂敏感性的均一程度,即异质性。b值越大,剂量(浓度)对死亡率影响越大,说明该种群对杀虫剂的敏感性均一程度越高,异质性越低。本研究发现实验室敏感品系、驻马店种群的b值较高,种群异质性较低;安阳、南阳种群的异质性较高。对比分析各种群的突变率,驻马店种群的整体突变率较低,因而种群较均一;安阳、南阳种群整体突变率较高,且F突变占比较大,故种群异质性较高。
与SNP测序检测结果的比较,AS-PCR检测的灵敏度为89.23%,特异度为90.00%,能够满足病媒生物抗性基因的检测需要。相关性分析结果显示,通过AS-PCR方法检测得出的突变率,能够有效地解释家蝇种群对溴氰菊酯和高效氯氰菊酯的抗药性,说明家蝇对溴氰菊酯和高效氯氰菊酯的抗药性与L1014H突变存在正相关。
家蝇的抗性基因监测尚在起步阶段,仅有部分科研院校和经济发达地区的疾病预防控制机构对当地家蝇种群进行过相关研究[12, 14-18],随着生物测定法在全国家蝇抗药性监测工作中的全面展开和基因检测技术门槛的降低,家蝇抗药性的基因监测将成为今后抗性监测工作的新方向。击倒抗性基因的检测通常采用“扩增+测序”的方法[19-23],但考虑到大多数市、县级疾控机构的人员、设备配置[24]、自购测序仪的成本较高,委托检测服务公司又耗时较长,不适用于开展日常监测。AS-PCR方法仅使用了常规PCR和凝胶电泳技术,成本较测序低,且提取、扩增、电泳在1~3 d即可完成,更适合基层疾控机构开展抗性基因监测工作。
本研究得到的敏感基线数据,与其他省市[25-27]相比偏高,说明本研究所用的敏感品系仍有进一步降低其LD50的可能性。下一步研究将在持续的实验室传代基础上,通过反选育等手段筛选敏感性更高的家蝇种群,进一步降低敏感品系的种群异质性。本研究结果显示家蝇种群对溴氰菊酯、高效氯氰菊酯的抗性与L1014H突变相关,尚不能认为其他拟除虫菊酯类杀虫剂的抗性与L1014H突变相关。昆虫抗药性的形成机制,除钠离子通道敏感性下降外,还受乙酰胆碱酯酶敏感度下降、代谢酶系增强、表皮穿透性下降等因素影响,本研究仅考查了河南省部分家蝇种群对典型拟除虫菊酯类杀虫剂的抗药性和VSSC基因突变,发现家蝇对溴氰菊酯和高效氯氰菊酯的抗药性与L1014H突变呈正相关。本研究验证了AS-PCR方法能够便捷有效地检测家蝇击倒抗性突变,适合市、县级疾控机构开展相关监测工作。随着抗药性基因监测工作在河南省的逐步展开,在更大样本量的基础上用AS-PCR方法检验抗性与突变的相关性,将得到更客观的结果。
利益冲突 无
| [1] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 31721-2015病媒生物控制术语与分类[S]. 北京: 中国标准出版社, 2015. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 31721-2015 Vector control terms and classification[S]. Beijing: Standards Press of China, 2015. (in Chinese) |
| [2] |
赵奇, 高丽君, 钱丹, 等. 河南省卫生杀虫剂使用现状调查[J]. 中华卫生杀虫药械, 2015, 21(1): 26-28. Zhao Q, Gao LJ, Qian D, et al. Investigation on the application of public health insecticides in Henan[J]. Chin J Hyg Insect Equip, 2015, 21(1): 26-28. DOI:10.19821/j.1671-2781.2015.01.009 |
| [3] |
赵奇, 高丽君, 张玉勤, 等. 河南省开封和安阳市2012-2016年家蝇对常用化学杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2018, 29(5): 518-520. Zhao Q, Gao LJ, Zhang YQ, et al. Resistance trend of Musca domestica to common insecticides in Henan province during 2012-2016[J]. Chin J Vector Biol Control, 2018, 29(5): 518-520. DOI:10.11853/j.issn.1003.8280.2018.05.026 |
| [4] |
Salgado VL, Irving SN, Miller TA. The importance of nerve terminal depolarization in pyrethroid poisoning of insects[J]. Pestic Biochem Physiol, 1983, 20(2): 169-182. DOI:10.1016/0048-3575(83)90021-4 |
| [5] |
Soderlund DM, Bloomquist JR. Neurotoxic actions of pyrethroid insecticides[J]. Annu Rev Entomol, 1989, 34: 77-96. DOI:10.1146/annurev.en.34.010189.000453 |
| [6] |
Farnham AW. Genetics of resistance of houseflies(Musca domestica L.)to pyrethroids.Ⅰ. Knock-down resistance[J]. Pestic Sci, 1977, 8(6): 631-636. DOI:10.1002/ps.2780080607 |
| [7] |
Clark JM, Lee SH, Kim HJ, et al. DNA-based genotyping techniques for the detection of point mutations associated with insecticide resistance in Colorado potato beetle Leptinotarsa decemlineata[J]. Pest Manag Sci, 2001, 57(10): 968-974. DOI:10.1002/ps.369 |
| [8] |
刘吉起, 崔建新, 张玉勤, 等. 不同性别家蝇吊飞行为研究[J]. 中国媒介生物学及控制杂志, 2011, 22(3): 212-214, 222. Liu JQ, Cui JX, Zhang YQ, et al. Comparison of sex-specific tethered flight of Musca domestica[J]. Chin J Vector Biol Control, 2011, 22(3): 212-214, 222. |
| [9] |
中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 26350-2010蝇类抗药性检测方法家蝇生物测定法[S]. 北京: 中国标准出版社, 2011. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China, Standardization Administration of the People's Republic of China. GB/T 26350-2010 Test methods of fly resistance to insecticides: Bioassay methods for Musca domestica[S]. Beijing: Standards Press of China, 2011. (in Chinese) |
| [10] |
Williamson MS, Martinez-Torres D, Hick CA, et al. Identification of mutations in the housefly para-type sodium channel gene associated with knockdown resistance (kdr) to pyrethroid insecticides[J]. Mol Gen Genet, 1996, 252(1/2): 51-60. DOI:10.1007/bf02173204 |
| [11] |
曹晓梅, 宋锋林, 赵彤言, 等. Kdr等位基因频率与家蝇对溴氰菊酯抗性的关系[J]. 寄生虫与医学昆虫学报, 2004, 11(4): 223-229. Cao XM, Song FL, Zhao TY, et al. Relationship between kdr allele and deltamethrin resistance in house fly (Musca domestica)[J]. Acta Parasitol Med Entomol Sin, 2004, 11(4): 223-229. DOI:10.3969/j.issn.1005-0507.2004.04.007 |
| [12] |
李春晓, 张晓龙, 曹晓梅, 等. 特异性等位基因PCR扩增技术检测家蝇击倒抗性相关钠通道的基因突变[J]. 中国媒介生物学及控制杂志, 2007, 18(3): 255-256. Li CX, Zhang XL, Cao XM, et al. Detection of knockdown resistance-associated sodium channels gene mutations in house fly (Musca domestica) by specific-allelic PCR[J]. Chin J Vector Biol Control, 2007, 18(3): 255-256. DOI:10.3969/j.issn.1003-4692.2007.03.026 |
| [13] |
杨茜. 贵州省部分城市家蝇抗药性现状及Vssc、Ace基因突变频率分析[D]. 贵阳: 贵州医科大学, 2018. Yang X. Analysis of Musca domestica resistance and genetic mutation frequency of Vssc and Ace in partial cities of Guizhou province[D]. Guiyang: Guizhou Medical University, 2018. (in Chinese) |
| [14] |
单超. 家蝇对残杀威的抗性机制与遗传方式研究[D]. 北京: 中国农业大学, 2016. Shan C. Mechanisms and inheritance of propoxur resistance in housefly, Musca domestica (Diptera: Muscidae)[D]. Beijing: China Agricultural University, 2016. (in Chinese) |
| [15] |
李今越. 天津市家蝇种群的抗药性现状与抗性等位基因分布频率的研究[D]. 北京: 中国疾病预防控制中心, 2014. Li JY. Study on resistance status and frequency of allele distribution for resistance in Musca domestica population in Tianjin[D]. Beijing: Chinese Center for Disease Control and Prevention, 2014. (in Chinese) |
| [16] |
王英红, 孔庆鑫, 邱丽华, 等. 高分辨率熔解曲线分析检测家蝇cyp6d1基因突变[J]. 中国媒介生物学及控制杂志, 2012, 23(6): 499-502. Wang YH, Kong QX, Qiu LH, et al. Determination of cyp6d1 gene mutation in Musca domestica by high-resolution melting analysis[J]. Chin J Vector Biol Control, 2012, 23(6): 499-502. |
| [17] |
王英红, 孔庆鑫, 邱丽华, 等. 高分辨率熔解曲线分析检测家蝇kdr基因突变[J]. 中国预防医学杂志, 2012, 13(10): 733-735. Wang YH, Kong QX, Qiu LH, et al. Detection of the kdr gene mutation in house fly by QPCR and high resolution melting analysis[J]. Chin Prev Med, 2012, 13(10): 733-735. DOI:10.16506/j.1009-6639.2012.10.003 |
| [18] |
冷培恩, 张晓龙, 李春晓, 等. 不同杀虫剂选育对家蝇抗药性水平及kdr基因频率的影响[J]. 昆虫学报, 2009, 52(1): 59-64. Leng PE, Zhang XL, Li CX, et al. Effects of selection by several insecticides on resistance levels and kdr allele frequency of housefly, Musca domestica (Diptera: Muscidae)[J]. Acta Entomol Sin, 2009, 52(1): 59-64. DOI:10.3321/j.issn:0454-6296.2009.01.009 |
| [19] |
李文玉, 周欣欣, 伦辛畅, 等. 淡色库蚊成蚊对拟除虫菊酯类杀虫剂敏感性的影响因素研究[J]. 中国媒介生物学及控制杂志, 2022, 33(2): 171-176. Li WY, Zhou XX, Lun XC, et al. A study of factors affecting the susceptibility of adult Culex pipiens pallens to pyrethroid insecticides[J]. Chin J Vector Biol Control, 2022, 33(2): 171-176. DOI:10.11853/j.issn.1003.8280.2022.02.002 |
| [20] |
吴治明, 阴琪, 田野, 等. 我国东南沿海地区三带喙库蚊对拟除虫菊酯类杀虫剂抗药性调查分析[J]. 寄生虫与医学昆虫学报, 2021, 28(4): 218-223. Wu ZM, Yin Q, Tian Y, et al. Resistance of Culex tritaeniorhynchus to pyrethroid in southeast coastal areas of China[J]. Acta Parasitol Med Entomol Sin, 2021, 28(4): 218-223. DOI:10.3969/j.issn.1005-0507.2021.04.003 |
| [21] |
潘婧, 邱星辉. 不同家蝇种群拟除虫菊酯杀虫剂抗性基因频率的比较研究[J]. 中国媒介生物学及控制杂志, 2015, 26(5): 443-446. Pan J, Qiu XH. Population-specific frequency change of pyrethroid resistance alleles in different Musca domestica populations in China[J]. Chin J Vector Biol Control, 2015, 26(5): 443-446. DOI:10.11853/j.issn.1003.4692.2015.05.003 |
| [22] |
张石昊, 徐宏, 夏斯伟, 等. 上海市普陀区白纹伊蚊抗性监测与机制探索[J]. 寄生虫与医学昆虫学报, 2021, 28(4): 224-230. Zhang SH, Xu H, Xia SW, et al. Resistance monitoring of Aedes albopictus to emergency insecticides in Putuo district, Shanghai[J]. Acta Parasitol Med Entomol Sin, 2021, 28(4): 224-230. DOI:10.3969/j.issn.1005-0507.2021.04.004 |
| [23] |
李秋红, 刘美德, 周小洁, 等. 德国小蠊对高效氯氰菊酯抗性选育与抗性机制研究[J]. 寄生虫与医学昆虫学报, 2020, 27(3): 168-173. Li QH, Liu MD, Zhou XJ, et al. Resistance selection and mechanism of Blattella germanica to bete-cypermethrin[J]. Acta Parasitol Med Entomol Sin, 2020, 27(3): 168-173. DOI:10.3969/j.issn.1005-0507.2020.03.006 |
| [24] |
刘吉起, 周瑞敏, 张玉勤, 等. 河南省市级疾病预防控制中心消毒与媒介生物控制人力资源现状调查[J]. 现代预防医学, 2013, 40(13): 2451-2454. Liu JQ, Zhou RM, Zhang YQ, et al. Investigation and analysis on current status of human resources for disinfection and vector control in city level centers for disease control and prevention, Henan province[J]. Mod Prev Med, 2013, 40(13): 2451-2454. |
| [25] |
邓泽静, 倪朝荣, 李万仓, 等. 浙江省温州市家蝇对5种常用杀虫剂的抗药性调查[J]. 中国媒介生物学及控制杂志, 2019, 30(3): 334-336. Deng ZJ, Ni CR, Li WC, et al. An investigation of resistance of Musca domestica to five common insecticides in Wenzhou, Zhejiang[J]. Chin J Vector Biol Control, 2019, 30(3): 334-336. DOI:10.11853/j.issn.1003.8280.2019.03.025 |
| [26] |
黄志光, 鲜军, 胡俊, 等. 我国家蝇对常用杀虫剂的抗性现状分析[J]. 中华卫生杀虫药械, 2015, 21(3): 306-308, 313. Huang ZG, Xian J, Hu J, et al. Resistance of Musca domestica to commonly used insecticides in China[J]. Chin J Hyg Insect Equip, 2015, 21(3): 306-308, 313. DOI:10.19821/j.1671-2781.2015.03.031 |
| [27] |
吴彤宇, 张咏梅, 张静, 等. 天津市2010年蚊蝇抗药性监测[J]. 中国媒介生物学及控制杂志, 2012, 23(2): 122-124. Wu TY, Zhang YM, Zhang J, et al. Surveillance of the resistance of Culex pipiens pallens and Musca domestica to insecticides in Tianjin in 2010[J]. Chin J Vector Biol Control, 2012, 23(2): 122-124. |
 2023, Vol. 34
2023, Vol. 34


