扩展功能
文章信息
- 母群征, 华栋栋, 李文玉, 周欣欣, 伦辛畅, 李贵昌, 王君, 宋秀平, 刘起勇, 孟凤霞
- MU Qun-zheng, HUA Dong-dong, LI Wen-yu, ZHOU Xin-xin, LUN Xin-chang, LI Gui-chang, WANG Jun, SONG Xiu-ping, LIU Qi-yong, MENG Feng-xia
- 河南省禹州地区白纹伊蚊击倒抗性基因突变检测
- Detection of knockdown resistance gene mutations in Aedes albopictus in Yuzhou, Henan province, China
- 中国媒介生物学及控制杂志, 2023, 34(3): 303-307, 335
- Chin J Vector Biol & Control, 2023, 34(3): 303-307, 335
- 10.11853/j.issn.1003.8280.2023.03.004
-
文章历史
- 收稿日期: 2023-02-13
2 山东大学公共卫生学院,山东 济南 250000;
3 宁夏回族自治区疾病预防控制中心,宁夏 银川 750000;
4 北京市大兴区疾病预防控制中心,北京 102600
2 School of Public Health, Shandong University, Ji'nan, Shandong 250000, China;
3 Ningxia Center for Disease Prevention and Control, Yinchuan, Ningxia 750000, China;
4 Daxing District Center for Disease Control and Prevention of Beijing, Beijing 102600, China
近年来国内外登革热发病呈上升趋势[1-3],白纹伊蚊(Aedes albopictus)是我国登革热主要传播媒介[4],当前对于登革热防控主要依靠杀虫剂来控制蚊虫数量[5-6],拟除虫菊酯类杀虫剂因其广谱、高效及对哺乳动物低毒而被广泛用于蚊虫防控[4, 7-8]。电压门控钠离子通道(voltage-gated sodium channel,VGSC)是拟除虫菊酯类杀虫剂的主要作用靶标,由VGSC基因编码,VGSC基因突变可以降低其对杀虫剂的亲和性,从而产生击倒抗性(knockdown resistance,kdr)[9],VGSC基因又叫击倒抗性基因。自2009年首次在新加坡地区白纹伊蚊kdr基因中检测到基因突变导致氨基酸替换[10],当前在白纹伊蚊kdr基因中发现1016、1532、1534共计3个突变位点[11-13]。
2013年河南省许昌市禹州地区出现登革热暴发疫情,近年来研究人员对该地区白纹伊蚊进行了大量研究[1, 14-20],其中涉及白纹伊蚊密度监测、病毒分型和抗药性监测,但抗药性监测仅为生物学测定[21-22],缺少对于该地区白纹伊蚊击倒抗性基因调查,因此有必要对该地区传播登革热的白纹伊蚊kdr基因进行调查。2020和2022年我们在许昌市禹州地区采集了白纹伊蚊,并检测其kdr基因突变情况。现将结果报告如下。
1 材料与方法 1.1 标本采集于2020和2022年9月中旬,选择禹州地区荒地,采用《登革热媒介伊蚊监测指南》要求的成蚊监测标准方法双层叠帐法捕获白纹伊蚊[23],选择白纹伊蚊活动高峰时段(08:30-9:30和16:00-18:00),每次监测30 min,捕获的白纹伊蚊放入冻存管内带回实验室。
1.2 种类鉴定将捕获的蚊虫冷冻处死,观察捕获蚊虫形态特征,依据检索表鉴定蚊虫种类[24],将鉴定为白纹伊蚊的样本放入75%乙醇溶液中-20 ℃保存。
1.3 分子生物学鉴定白纹伊蚊kdr基因位点基因型采用磁珠法微量组织基因组DNA提取试剂盒Ⅱ说明书提取单只白纹伊蚊基因组DNA,参考Kasai等[7, 10]建立的方法,对白纹伊蚊VGSC基因的1016、1532和1534位点进行基因分型。利用Seqman、MEGA 7.0软件对测序结果进行序列比对和峰图分析,观察各个位点突变情况,确定基因型与等位基因类型。
1.4 统计学分析使用Excel 2021、SPSS 20.0软件进行数据整理和统计分析。计数资料因列联表20%以上单元格期望频数1 < T < 5,采用Fisher精确概率法计算P值,P < 0.05为差异有统计学意义。
2 结果 2.1 白纹伊蚊kdr基因突变分别提取禹州地区2020和2022年各40只白纹伊蚊基因组DNA,共计80只白纹伊蚊野外种群DNA样本。对测序结果用Excel 2021软件分别统计和计算各地理种群白纹伊蚊VGSC基因各突变位点的等位基因、基因型及频率。结果表明,1016、1532和1534位点均存在一定程度的突变,碱基改变导致相应的氨基酸替换。1016位点存在氨基酸V到G的突变,即由密码子GTA编码的缬氨酸(Val,V)突变为GGA编码的甘氨酸(Gly,G)。1532位点存在氨基酸I到T的突变,即由密码子ATC编码的异亮氨酸(Ile,I)突变为ACC编码的苏氨酸(Thr,T)。1534位点突变等位基因型最多,包括由氨基酸F突变为S和L,即由密码子TTC(Phe,F)编码的苯丙氨酸突变为TCC编码的丝氨酸(Ser,S)或TTA/CTC编码的亮氨酸(Leu,L)。3个突变位点共包括10种基因型,各位点的基因型密码子峰图见图 1。
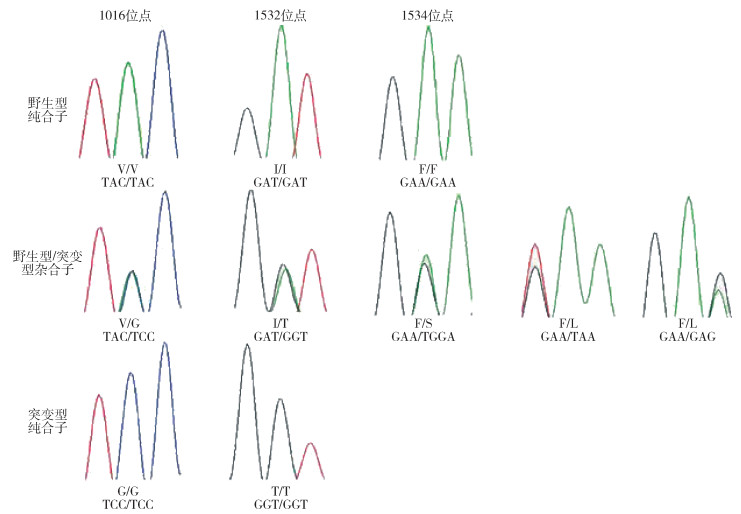
|
| 注:红色峰形代表T碱基,绿色峰形代表A碱基,蓝色峰形代表C碱基,黑色峰形代表G碱基;双峰代表单核苷酸多态性(SNP)位点,会导致碱基多态性、氨基酸突变。 图 1 白纹伊蚊击倒抗性基因突变位点基因型密码子峰图 Figure 1 Codon peaks of genotypes at knockdown resistance gene mutation sites in Aedes albopictus |
| |
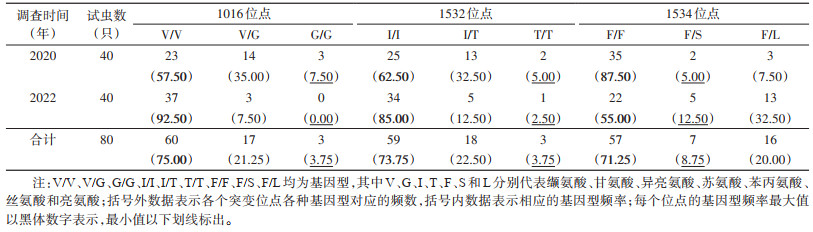
不同年份基因突变构成比(野生型纯合子、野生/突变型杂合子和突变型纯合子)经χ2检验,差异无统计学意义(χ2=3.677,P=0.157)。
总的来看,3个突变位点均是以野生型纯合子为主,野生/突变型杂合子次之,突变型纯合子所占比例最低。1016位点存在3种基因型,分别是野生型纯合子V/V(60/75.00%),野生/突变型杂合子V/G(17/21.25%),突变型纯合子G/G(3/3.75%);在1532位点也发现3种基因型,分别是野生型纯合子I/I(59/73.75%)、突变型杂合子I/T(18/22.50%)和突变型纯合子T/T(3/3.75%);1534位点较1016和1532位点,突变类型更加复杂,包括1种野生型纯合子F/F(57/71.25%)、2种野生/突变型杂合子F/L(16/20.00%)和F/S(7/8.75%),未检测到突变纯合子。见表 1。
|
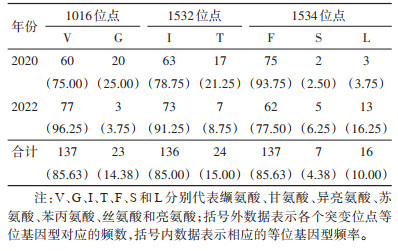
由表 2可见,1016位点有2种等位基因型,分别是编码缬氨酸的野生型GTA/V和编码甘氨酸的突变型GGA/G。1532位点存在2种等位基因,即编码异亮氨酸的野生型ATC/I和编码苏氨酸的突变型ACC/T。1534位点存在3种等位基因,即编码苯丙氨酸的野生型TTC/F、编码丝氨酸TCC/S和编码亮氨酸的突变型TTA/L与CTC/L。其中,突变型等位基因GGA/G、ACC/T、TCC/S及CTC/L在2020和2022年中均有发现。1532位点突变等位基因型频率最高,为15.00%,1016位点和1534位点突变等位基因型频率均为14.38%。
|
共得到11种组合基因型,分别编号为T1~T11型,其中T2、T3、T6和T9型是单个位点野生/突变杂合型组合,基因型频率合计为55.00%;T1型是3个位点的野生纯合型组合,基因型频率为28.75%;T4、T7、T10和T11型为双位点野生/突变杂合型,基因型频率合计为8.75%;T5和T8型是单个位点突变纯合型,基因型频率合计为7.50%。见表 3。

|
2013年禹州地区出现登革热暴发疫情,这是温带地区登革热引起本地流行的首次报道,提示登革热在我国的流行区域正在扩大[15]。许昌市是位于河南省中部的地级市,处于豫西山地与黄淮海冲积平原之间,地貌形态上,整体以平原为主,兼有山地、丘陵、洼地,许昌市所在的华北平原属大陆性暖温带季风气候,为白纹伊蚊提供了良好的生存环境,满足登革热传播的自然条件与媒介条件[16]。本次疫情由归国劳务人员引起,当地属于钧瓷产地,长期和我国东南沿海及东南亚国家存在着贸易往来,且每年有大批劳务人员前往东南亚等热带或亚热带登革热疫区务工,均给该传染病输入提供了社会传染源因素[12, 25]。以上因素均可导致登革热疫情的暴发流行。为预防该地区登革热再次暴发,控制媒介白纹伊蚊数量最为经济、合理。
本研究地区白纹伊蚊kdr基因突变率较高。随着拟除虫菊酯类杀虫剂的广泛使用,导致该地区白纹伊蚊kdr基因出现了突变,对于当前白纹伊蚊出现的3个kdr基因突变位点,本次调查均有发现,3个位点均未发生突变的个体占28.75%(23/80),其余71.25%(57/80)均发生不同程度的突变,相关研究利用成蚊接触筒法测定白纹伊蚊对常用拟除虫菊酯类杀虫剂的抗药性,结果均表现为抗性[21-22],这与本研究结果一致,但生物测定过程比较耗时且实验难度高,采用分子生物学方法进行白纹伊蚊kdr基因突变进行检测,以此判断该地区蚊虫对于拟除虫菊酯类杀虫剂的抗药性情况,该方法较成蚊接触筒法更为省时、方便。本研究提示该地区白纹伊蚊对拟除虫菊酯类杀虫剂已产生较大程度的抗性,应定期对该地区白纹伊蚊的各个击倒抗性基因位点进行监测,及时了解其动态变化趋势,从而科学指导杀虫剂的轮换使用。
本研究地区白纹伊蚊kdr基因突变型较复杂。3个kdr基因突变位点(1016、1532和1534)突变型所占频率差别不大,分别为25.00%、26.25%和28.75%,其中1534位点突变基因型最复杂,包括F1534L的2种基因型(TTA/CTC)和F1534S的1种基因型(TCC),当前报道1016和1532位点突变情况在本次调查中均有发现,1534位点发现S/L/C/R/W共5种有义突变[11, 26],本次研究未发现C/R/W突变型,但应加强对该位点的检测,以便及时了解该位点突变情况。通过对白纹伊蚊样本3个kdr基因位点组合基因型进行统计后,共得到11种组合基因型,其中发生单位点突变频率最高(62.50%),其次3位点均未发生突变的野生型纯合子(28.75%)和双位点突变(8.75%),可见该地区白纹伊蚊kdr基因突变复杂多样。1016位点突变是2019年白纹伊蚊中新发现的突变位点,并有研究表明1016G突变与1534位点突变相比会引起更强的拟除虫菊酯类杀虫剂抗性[7],单位点突变中1016位点V/G突变最多,说明V1016G突变在该地区白纹伊蚊野外种群已普遍存在,今后应加强对该位点的监测。双位点突变中1532位点I/T和1534位点F/L的联合突变最多,在埃及伊蚊(Ae. aegypti)中,研究证实VGSC基因多位点突变会对拟除虫菊酯类杀虫剂的抗药性产生协同作用[27-28],但关于白纹伊蚊多位点的联合突变效应还待进一步研究[29-31]。
自2013年禹州地区出现登革热暴发疫情,近年来研究人员对该地区进行了大量研究[1, 14-20],但均未涉及该地区白纹伊蚊kdr基因调查,本研究是首次在该地区进行白纹伊蚊kdr基因调查,但选择的调查点和样本数量较少,今后还需对此开展更多相关研究。
志谢 本研究得到河南省疾病预防控制机构的大力支持,特此志谢利益冲突 无
| [1] |
Wu TT, Wu ZD, Li YP. Dengue fever and dengue virus in the People's Republic of China[J]. Rev Med Virol, 2022, 32(1): e2245. DOI:10.1002/rmv.2245 |
| [2] |
Lun XC, Wang YG, Zhao CC, et al. Epidemiological characteristics and temporal-spatial analysis of overseas imported dengue fever cases in outbreak provinces of China, 2005-2019[J]. Infect Dis Poverty, 2022, 11(1): 12. DOI:10.1186/s40249-022-00937-5 |
| [3] |
Yue YJ, Liu QY, Liu XB, et al. Dengue fever in Mainland China, 2005-2020:A descriptive analysis of dengue cases and Aedes data[J]. Int J Environ Res Public Health, 2022, 19(7): 3910. DOI:10.3390/ijerph19073910 |
| [4] |
赵春春. 我国白纹伊蚊抗药性及kdr基因分布研究[D]. 北京: 中国疾病预防控制中心, 2019. Zhao CC. Study on insectcides resistance and kdr gene distribution of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2019. (in Chinese) |
| [5] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [6] |
Dalpadado R, Gunathilaka N, Amarasinghe D, et al. A challenge for a unique dengue vector control programme: Assessment of the spatial variation of insecticide resistance status amongst Aedes aegypti and Ae. albopictus populations in Gampaha district, Sri Lanka[J]. Biomed Res Int, 2021, 2021: 6619175. DOI:10.1155/2021/6619175 |
| [7] |
Kasai S, Caputo B, Tsunoda T, et al. First detection of a Vssc allele V1016G conferring a high level of insecticide resistance in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016:A new emerging threat to controlling arboviral diseases[J]. Euro Surveill, 2019, 24(5): 1700847. DOI:10.2807/1560-7917.ES.2019.24.5.1700847 |
| [8] |
Auteri M, La Russa F, Blanda V, et al. Insecticide resistance associated with kdr mutations in Aedes albopictus: An update on worldwide evidences[J]. Biomed Res Int, 2018, 2018: 3098575. DOI:10.1155/2018/3098575 |
| [9] |
周欣欣, 李芬, 段文波, 等. 白纹伊蚊电压门控钠离子通道基因克隆及其生物信息学分析[J]. 中国媒介生物学及控制杂志, 2021, 32(6): 672-679. Zhou XX, Li F, Duan WB, et al. Cloning and bioinformatics analysis of voltage-gated sodium channel gene of Aedes albopictus[J]. Chin J Vector Biol Control, 2021, 32(6): 672-679. DOI:10.11853/j.issn.1003.8280.2021.06.004 |
| [10] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [11] |
朱彩英. 中国白纹伊蚊击倒抗性基因突变及检测技术研究[D]. 北京: 中国疾病预防控制中心, 2020. DOI: 10.27511/d.cnki.gzyyy.2020.000116. Zhu CY. Study on knockdown resistance gene mutation and detection technique of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2020. DOI: 10.27511/d.cnki.gzyyy.2020.000116.(in Chinese) |
| [12] |
Wu YY, Liu QM, Qi YP, et al. Knockdown resistance (kdr) mutations I1532T and F1534S were identified in Aedes albopictus field populations in Zhejiang province, central China[J]. Front Cell Infect Microbiol, 2021, 11: 702081. DOI:10.3389/fcimb.2021.702081 |
| [13] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing China: First report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
| [14] |
马红霞, 杜燕华, 黄学勇, 等. 河南省2013年登革热暴发的登革热病毒基因组序列测定及分析[J]. 中华流行病学杂志, 2015, 36(10): 1185-1186. Ma HX, Du YH, Huang XY, et al. Analysis of the genome sequences of dengue virus caused an outbreak of dengue fever in Henan province, 2013[J]. Chin J Epidemiol, 2015, 36(10): 1185-1186. DOI:10.3760/cma.j.issn.0254-6450.2015.10.032 |
| [15] |
杜燕华, 王若琳, 李东晓, 等. 河南省2018年输入性登革热的病原监测分析[J]. 中华流行病学杂志, 2020, 41(4): 542-546. Du YH, Wang RL, Li DX, et al. Surveillance on the pathogen of imported dengue fever in Henan province, 2018[J]. Chin J Epidemiol, 2020, 41(4): 542-546. DOI:10.3760/cma.j.cn112338-20190614-00437 |
| [16] |
王福春. 我国登革热流行概况与预防控制措施研究进展[J]. 职业与健康, 2018, 34(12): 1717-1721. Wang FC. Epidemic situation and prevention and control measures of dengue fever in China[J]. Occup Health, 2018, 34(12): 1717-1721. DOI:10.13329/j.cnki.zyyjk.2018.0392 |
| [17] |
王永亮, 张勤, 苗丽, 等. 河南口岸81例输入性登革热流行病学分析及防控对策[J]. 口岸卫生控制, 2017, 22(5): 49-52. Wang YL, Zhang Q, Miao L, et al. Epidemiological analysis and prevention measures of 81 imported dengue cases at Henan port[J]. Port Health Control, 2017, 22(5): 49-52. DOI:10.3969/j.issn.1008-5777.2017.05.017 |
| [18] |
王永亮, 李帅, 高志华. 河南口岸3例输入性登革热实验室鉴定及回顾调查[J]. 口岸卫生控制, 2018, 23(3): 53-55, 58. Wang YL, Li S, Gao ZH. Laboratory identification of 3 imported dengue fever cases together with their retrospective investigation in Henan port[J]. Port Health Control, 2018, 23(3): 53-55, 58. DOI:10.3969/j.issn.1008-5777.2018.03.015 |
| [19] |
赵宁, 郭玉红, 吴海霞, 等. 2019年全国媒介蚊虫监测报告[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 395-400, 406. Zhao N, Guo YH, Wu HX, et al. National vector surveillance report on mosquitoes in China, 2019[J]. Chin J Vector Biol Control, 2020, 31(4): 395-400, 406. DOI:10.11853/j.issn.1003.8280.2020.04.003 |
| [20] |
汪峰, 李洁, 赵奇, 等. 2014-2020年河南省禹州市登革热媒介伊蚊监测结果[J]. 河南预防医学杂志, 2022, 33(7): 529-531. Wang F, Li J, Zhao Q, et al. Surveillance results of dengue vector Aedes larvae density in Yuzhou of Henan in 2014-2020[J]. Henan J Prev Med, 2022, 33(7): 529-531. DOI:10.13515/j.cnki.hnjpm.1006-8414.2022.07.013 |
| [21] |
赵春春, 周欣欣, 李文玉, 等. 2020年中国13省份登革热媒介白纹伊蚊抗药性监测及分析研究[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 30-37. Zhao CC, Zhou XX, Li WY, et al. Insecticide resistance surveillance and characteristic analysis of dengue vector Aedes albopictus in 13 provinces of China in 2020[J]. Chin J Vector Biol Control, 2022, 33(1): 30-37. DOI:10.11853/j.issn.1003.8280.2022.01.006 |
| [22] |
唐振强, 岳思宁, 赵奇. 2021年河南省白纹伊蚊对杀虫剂抗药性监测[J]. 河南预防医学杂志, 2022, 33(2): 116-118. Tang ZQ, Yue SN, Zhao Q. Monitoring of insecticide resistance of Aedes albopictus in Henan province in 2021[J]. Henan J Prev Med, 2022, 33(2): 116-118. DOI:10.13515/j.cnki.hnjpm.1006-8414.2022.02.009 |
| [23] |
韦凌娅, 孔庆鑫, 王慧敏. 双层叠帐法与BG-trap诱捕器法在登革热应急蚊媒监测中的捕蚊效果比较[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 65-68. Wei LY, Kong QX, Wang HM. Effectiveness of double mosquito net and BG-trap for emergency vector surveillance during dengue fever epidemics: A comparative study[J]. Chin J Vector Biol Control, 2019, 30(1): 65-68. DOI:10.11853/j.issn.1003.8280.2019.01.014 |
| [24] |
陆宝麟, 苏龙. 中国伊蚊鉴定手册[M]. 北京: 科学出版社, 1987: 55-56. Lu BL, Su L. Aedes identification manual in China[M]. Beijing: Science Press, 1987: 55-56. |
| [25] |
王永亮, 李新民, 郝宗宇, 等. 河南首次输入性登革热暴发流行控制的思考[J]. 河南预防医学杂志, 2016, 27(5): 321-324. Wang YL, Li XM, Hao ZY, et al. A outbreak of the first imported dengue fever epidemical control in Henan[J]. Henan J Prev Med, 2016, 27(5): 321-324. DOI:10.13515/j.cnki.hnjpm.1006-8414.2016.05.001 |
| [26] |
Chen HM, Zhou QM, Dong HW, et al. The pattern of kdr mutations correlated with the temperature in field populations of Aedes albopictus in China[J]. Parasit Vectors, 2021, 14(1): 406. DOI:10.1186/s13071-021-04906-z |
| [27] |
Plernsub S, Saingamsook J, Yanola J, et al. Additive effect of knockdown resistance mutations, S989P, V1016G and F1534C, in a heterozygous genotype conferring pyrethroid resistance in Aedes aegypti in Thailand[J]. Parasit Vectors, 2016, 9(1): 417. DOI:10.1186/s13071-016-1713-0 |
| [28] |
Smith LB, Kasai S, Scott JG. Pyrethroid resistance in Aedes aegypti and Ae. albopictus: Important mosquito vectors of human diseases[J]. Pestic Biochem Physiol, 2016, 133: 1-12. DOI:10.1016/j.pestbp.2016.03.005 |
| [29] |
Gao JP, Chen HM, Shi H, et al. Correlation between adult pyrethroid resistance and knockdown resistance (kdr) mutations in Aedes albopictus (Diptera: Culicidae) field populations in China[J]. Infect Dis Poverty, 2018, 7(1): 86. DOI:10.1186/s40249-018-0471-y |
| [30] |
Wei Y, Zheng XL, He S, et al. Insecticide susceptibility status and knockdown resistance (kdr) mutation in Aedes albopictus in China[J]. Parasit Vectors, 2021, 14(1): 609. DOI:10.1186/s13071-021-05095-5 |
| [31] |
Zulfa R, Lo WC, Cheng PC, et al. Updating the insecticide resistance status of Aedes aegypti and Ae. albopictus in Asia: A systematic review and meta-analysis[J]. Trop Med Infect Dis, 2022, 7(10): 306. DOI:10.3390/tropicalmed7100306 |
 2023, Vol. 34
2023, Vol. 34


