扩展功能
文章信息
- 张俊锋, 张雅丽, 王瑞晨, 禄阳, 张天姿, 付士红, 殷启凯, 李樊, 何英, 聂凯, 马超锋, 梁国栋, 扈瑞平, 许松涛, 王环宇
- ZHANG Jun-feng, ZHANG Ya-li, WANG Rui-chen, LU Yang, ZHANG Tian-zi, FU Shi-hong, YIN Qi-kai, LI Fan, HE Ying, NIE Kai, MA Chao-feng, LIANG Guo-dong, HU Rui-ping, XU Song-tao, WANG Huan-yu
- 流行性乙型脑炎和西尼罗病毒双重微滴数字PCR检测方法的建立
- Establishment of a duplex droplet digital PCR assay for Japanese encephalitis and West Nile viruses
- 中国媒介生物学及控制杂志, 2023, 34(3): 285-290
- Chin J Vector Biol & Control, 2023, 34(3): 285-290
- 10.11853/j.issn.1003.8280.2023.03.001
-
文章历史
- 收稿日期: 2023-01-18
2 中国疾病预防控制中心病毒病预防控制所虫媒病毒室,北京 102206;
3 陕西中医药大学公共卫生学院,陕西 咸阳 712360;
4 西安市疾病预防控制中心,陕西 西安 710000
2 Department of Arbovirus, Institute of Viral Disease Prevention and Control, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 School of Public Health, Shaanxi University of Traditional Chinese Medicine, Xianyang, Shaanxi 712360, China;
4 Xi'an Center for Disease Control and Prevention, Xi'an, Shaanxi 710000, China
流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)是一种单股正链RNA病毒,属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),三带喙库蚊(Culex tritaeniorhynchus)是其主要传播媒介,感染中枢神经系统后可导致流行性乙型脑炎(乙脑)[1-3]。乙脑是一种人兽共患急性传染病,是最常见的病毒性脑炎之一[4]。该病主要在亚洲及其周边地区流行(包括中国、日本、菲律宾、巴基斯坦、亚托雷斯海峡群岛等)[3]。JEV可以感染所有年龄段的人群,但主要引起儿童脑炎,严重威胁国民健康安全[5]。据估计,每年因乙脑就诊的病例达5万例,病死率约为20.00%,30%~50%的治愈者有明显的神经系统后遗症[5]。
西尼罗病毒(West Nile virus,WNV)也是一种单股正链RNA病毒,与JEV同属黄病毒科黄病毒属,尖音库蚊(Cx. pipiens pipiens)是其主要传播媒介,是目前全球范围内流行区域最广的虫媒病毒之一,主要分布在非洲、欧洲、中东、西亚、澳洲和北美[6]。WNV入侵人体后,约20.00%的被感染者会出现西尼罗热症状,若病毒感染中枢神经系统,则会引起脑炎、脑膜炎、脊髓炎等[6-7]。2011年,我国新疆维吾尔自治区(新疆)喀什地区伽师县首次报道了WNV人间感染病例,并且成功分离出WNV毒株,提示WNV此前可能已经在该区域有流行传播[8]。2017年,美国报道了2 000多例WNV感染病例,其中2/3的病例表现出神经侵袭性症状,对患者预后造成极大影响[9]。尽管目前WNV未在我国大规模暴发,但其潜在威胁不可忽视。
JEV和WNV在分子特征、传播媒介、感染症状等方面有较大相似;二者的流行地区存在重叠,具有共同传播、混合感染的可能性,在实际诊断或进行流行病学监测时有鉴别诊断的需求,且JEV和WNV都有较为严重的疾病负担,给我国的卫生体系带来潜在风险等。数字PCR(digital polymerase chain reaction,dPCR)属于第3代核酸检测技术,是一种全新的核酸绝对定量检测方法,可直接获得靶序列的起始浓度,实现真正意义的绝对定量。本研究基于双重微滴式数字PCR(droplet digital PCR,ddPCR)技术,建立了JEV和WNV的双重核酸检测方法,敏感性和特异性实验显示其性能满足真实检测情况,可以用于不同检测场景。
1 材料与方法 1.1 试剂与仪器QIAamp Viral RNA Mini Kit核酸提取试剂盒(德国,Qiagen);QIAamp DNA Blood Mini Kit核酸提取试剂盒(德国,Qiagen);qScriptTM XLT One-Step RT-qPCR ToughMixⓇ(2 ×)(美国,Quantabio);Fluorescein sodium salt(10 μmol/L)(美国,APExBIO);BIO-RAD CFX96实时荧光定量PCR仪(型号:C1000TM Thermal Cycler,美国);数字PCR液滴生成与核酸扩增仪为Naica crystal全自动微滴数字PCR仪系统,包括Sapphire芯片、Naica Geode系统、Naica Prism3和Crystal MinerTM(型号:NaicaTM,法国)。
1.2 样品准备 1.2.1 核酸样品JEV阳性样品为中国疾病预防控制中心(疾控中心)病毒病预防控制所(病毒病所)虫媒病毒室(以下简称本实验室)保存的JEV病毒株(P3株),该毒株在白纹伊蚊卵细胞(C6/36)上培养分离,在金黄地鼠肾细胞(BHK-21)上通过噬斑法进行病毒滴定测定,最终滴度为1×106.97 PFU/ml。滴定后的病毒保存在-80 ℃直至使用。将已知滴度的病毒按照核酸提取试剂盒说明书的使用方法进行核酸提取,提取后的核酸保存在-80 ℃备用。
WNV阳性样品为本实验室保存的WNV病毒株(XJ11129株),该毒株在BHK-21细胞上培养分离,在BHK-21细胞上通过噬斑法进行病毒滴定测定,最终滴度为1×106.81 PFU/ml。滴定后的病毒保存在-80 ℃,提取核酸后保存在-80 ℃备用。
登革病毒(Dengue virus,DENV)、基孔肯雅病毒(Chikungunya virus,CHIKV)、寨卡病毒(Zika virus,ZIKV)和蜱传脑炎病毒(Tick-borne encephalitis virus,TBEV)均为本实验室保存的毒株,人293细胞为中国疾控中心病毒病所麻疹室赠与。
1.2.2 质粒样品JEV质粒:用检测JEV的引物探针序列与载体pUC57合成质粒pUC57-JEV,由生工生物工程(上海)股份有限公司合成。
WNV质粒:用检测WNV的引物探针序列与载体pUC57合成质粒pUC57-WNV,由北京擎科生物科技有限公司合成。
1.3 引物探针的设计合成本研究所使用的引物探针均为本科室设计(表 1),由生工生物工程(上海)股份有限公司合成。
采用25 μl的反应体系:其中qScriptTM XLT One-Step RT-qPCR ToughMixⓇ(2×)12.5 μl,引物(20 μmol/L)各0.50~1.25 μl,探针(10 μmol/L)各0.625 μl,模板各2 μl,TE buffer补齐至25 μl。模板:滴度为1×104.97 PFU/ml的JEV RNA和滴度为1×104.81PFU/ml的WNV RNA。RT-qPCR程序:50 ℃ 20 min,95 ℃ 2 min,40个循环;95 ℃ 10 s、60 ℃ 30 s(采集荧光信号),荧光通道选择羧基荧光素(FAM,吸收波长492 nm,发射波长518 nm)和亚磷酰胺(VIC,吸收波长526 nm,发射波长543 nm)。
1.5 JEV和WNV反转录ddPCR(RT-ddPCR)检测反应体系及程序根据Crystal数字PCR技术应用指南(第2版),采用25 μl的反应体系,其中qScriptTM XLT One-Step RT-qPCR ToughMixⓇ(2×)12.5 μl,Fluorescein sodium salt(10 μmol/L)0.25 μl,引物(20 μmol/L)各1.25 μl,探针(10 μmol/L)各0.625 μl,阳性模板各2 μl,TE buffer补齐至25 μl,阳性模板同上。将配置好的25 μl PCR反应液上样至Sapphire芯片上,利用专用PCR盖封闭孔井后将芯片转移至Naica Geode微滴生成和扩增系统中。反应条件:40 ℃ 12 min,50 ℃ 20 min,95 ℃ 2 min,45个循环;95 ℃ 10 s、60 ℃ 30 s。反应结束后打开Naica Prism3微滴阅读分析系统对Sapphire芯片进行扫描分析,设置FAM和VIC的荧光通道时间分别为50和120 ms,防止过曝影响微滴读数。
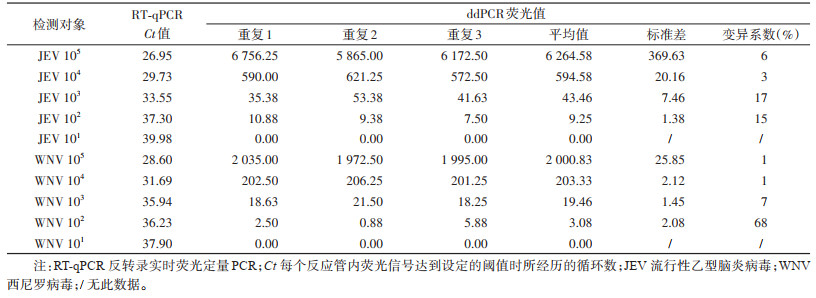
1.6 灵敏度、特异性测定 1.6.1 灵敏度实验及标准曲线计算为验证RT-ddPCR检测JEV和WNV的灵敏度,将pUC57-JEV和pUC57-WNV进行10倍的倍比稀释,获得101~105拷贝/μl模板,每个浓度各取2 μl作为模板,加入到建立好的双重RT-ddPCR反应体系中,且每个浓度进行3次重复,ddH2O作为阴性对照,检测后计算变异系数(CV),CV=标准差/平均数×100%,同时使用GraphPad Prism 9计算并绘制标准曲线。
1.6.2 特异性实验分别提取DENV、CHIKV、ZIKV、TBEV和人类基因(293细胞源)核酸,用经过优化的双重RT-ddPCR分别进行检测,用ddH2O作为阴性对照,评估该双重RT-ddPCR方法检测JEV和WNV的特异性。
2 结果 2.1 灵敏度实验及标准曲线计算使用101~105拷贝/μl的质粒模板进行灵敏度探索。结果显示,对于JEV检测,ddPCR方法可达到的最低检测极限为102拷贝/μl,经过计算可得标准曲线为Y=0.063X-11.910,相关系数(R2)=0.995;对于WNV检测,ddPCR方法可达到的最低检测极限也为102拷贝/μl,经过计算可得标准曲线为Y=0.020X+0.855,R2=0.999。见图 1、表 2。
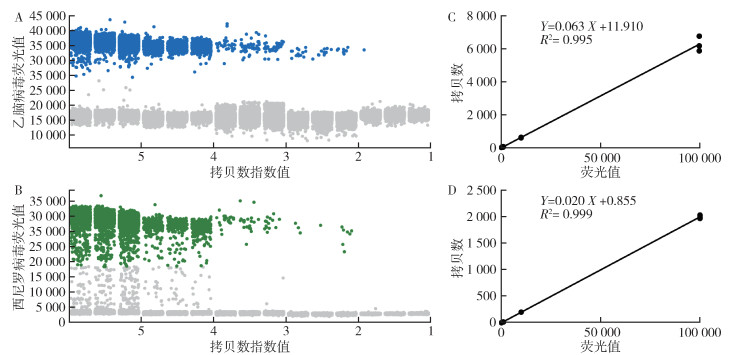
|
| 注:乙脑病毒流行性乙型脑炎病毒;A乙脑病毒数字PCR检测绝对定量散点图;B西尼罗病毒数字PCR检测绝对定量散点图;C乙脑病毒数字PCR检测标准曲线;D西尼罗病毒数字PCR检测标准曲线;1~5表示101~105拷贝/μl的质粒样本。 图 1 双重微滴式数字PCR(ddPCR)检测流行性乙型脑炎病毒和西尼罗病毒灵敏度液滴生成图和标准曲线 Figure 1 Droplet generation graph and standard curve for sensitivity of duplex droplet digital PCR detection for Japanese encephalitis virus and West Nile virus |
| |
|
使用上述ddPCR方法,对JEV、WNV、DENV、CHIKV、ZIKV、TBEV和人类基因核酸进行检测。结果显示,JEV和WNV检测通道出现特异性阳性微滴,而其他种类核酸未出现阳性微滴,JEV与WNV之间也未出现交叉。见图 2。
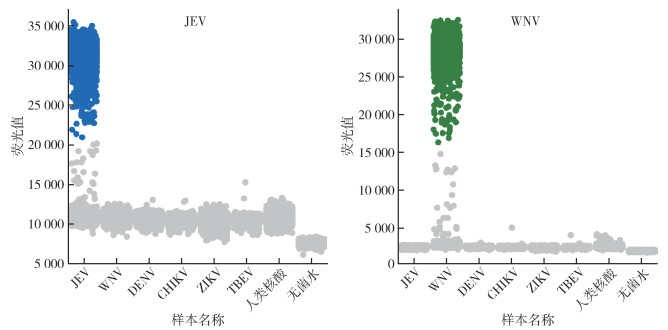
|
| 注:JEV流行性乙型脑炎病毒;WNV西尼罗病毒;DENV登革病毒;CHIKV基孔肯雅病毒;ZIKV寨卡病毒;TBEV蜱传脑炎病毒。 图 2 双重微滴式数字PCR(ddPCR)检测JEV和WNV的特异性实验 Figure 2 Specificity of duplex droplet digital PCR detection for Japanese encephalitis virus and West Nile virus |
| |
JEV和WNV是全球范围内流行范围最为广泛的2种可致病毒性脑炎的虫媒病毒,致死致残率高,临床症状相似,不易鉴别,建立快速、敏感、特异的多重核酸检测方法对于识别鉴定该2种病原体尤为重要。检测JEV和WNV的金标准是中和试验,其他常规检测方法还包括病毒分离、酶联免疫吸附试验(ELISA)和荧光定量PCR(qPCR)等[11-12]。中和试验和病毒分离至少需要3 d,不适合临床急症患者的诊断;血清学检测通常受限于黄病毒属病毒之间存在的交叉反应,而无法实现鉴别区分[12]。
相较于其他传统检测方法,qPCR与ddPCR在这些方面具有较大优势。qPCR在过去的20年间已经得到普及,在产前诊断、疫情防控等病原筛查场景下表现出快速、准确的性能。尽管qPCR较为简便,但是,qPCR的定量检测并不是直接反映待测样品中的目的核酸数量,而是通过先前计算Ct值与拷贝数或核酸浓度的回归方程进行推断,并不能称为真实的绝对定量,且在核酸浓度低时存在误诊、漏诊的情况[13]。近年来兴起的ddPCR恰好可以弥补qPCR的不足,ddPCR是将样品制备为微反应单元,使得每个微反应单元中只包含单个核酸,随后进行PCR并检测微反应单元的荧光,由此可判断原始样品中含有多少目的核酸,从而实现真正的绝对定量检测[14-15]。与中和试验和病毒分离相比,ddPCR方法更加方便快捷;与血清学检测相比,该方法没有受限于黄病毒属病毒存在的交叉反应问题;与qPCR相比,要求的样品量少,更加适合临床检测[14, 16-17]。已有研究者用ddPCR建立了多种病毒的检测方法,如新型冠状病毒[18]、ZIKV[19]、流感病毒[20]和肠道病毒[21]等。先前的研究已经建立了JEV和WNV的qPCR检测方法,因此,本研究进一步建立了JEV和WNV的双重ddPCR检测方法。
本研究为建立JEV和WNV的双重ddPCR检测方法,评估该方法的灵敏性、可重复性和特异性。ddPCR对浓度 > 106拷贝/μl的模板检测时会受限于芯片的微滴数目,因而无法根据泊松分布计算模板含量[22]。但是对低浓度模板检测时可以获得良好的结果。在灵敏度测试中,本研究发现对JEV和WNV检测而言,ddPCR均实现了102拷贝/μl的检测,该浓度已经可以满足实际情况下的检测需求。薛晓宁等[23]基于JEV的NS3基因建立了ddPCR检测方法,灵敏度可达16.1拷贝/μl,尽管灵敏度优于本研究,但该检测方法只是单独检测JEV,并不能实现双重检测,本方法在实际应用中更加便捷。3次重复实验的结果显示,本研究所建立的ddPCR检测方法在高浓度和低浓度模板下变异系数均较小,说明本方法的可靠性高。
本研究所使用的检测引物、探针分别针对JEV的NS1基因区域,WNV的NS4B基因区域。这2个基因遗传稳定,非常保守,在病毒复制和免疫反应中起重要作用,因此被选为检测标靶[24]。特异性测试中,2种方法均表现出极佳的检测特异性,未发现对其他几种常见的虫媒病毒产生非特异性扩增,同时也不与人类基因核酸产生交叉,说明本方法适用于疑似感染或携带虫媒病毒的样本检测。
ddPCR检测方法仍有不足。在检测通量上,qPCR的1个检测板可以同时检测96个样品,完整检测流程在2 h内,比较适合大规模筛查,以及急症患者的初步诊断。ddPCR的完整检测过程需要约3.5 h,且每个芯片只能检测12个样品,对于大规模检测略显不足。该方法更适合对常规方法无法检出的病例进行深入检测,也是对珍贵样品检测时的首选[25]。本研究建立了JEV和WNV的双重ddPCR检测方法,该方法具有较高的灵敏度、可重复性和特异性,适合于不同检测环境下的实际检测,为JEV和WNV流行的防控,以及对相关病例的临床诊断提供了可靠工具。
志谢 中国疾病预防控制中心病毒病预防控制所麻疹室提供人293细胞,特此志谢利益冲突 无
| [1] |
Sumiyoshi H, Mori C, Fuke I, et al. Complete nucleotide sequence of the Japanese encephalitis virus genome RNA[J]. Virology, 1987, 161(2): 497-510. DOI:10.1016/0042-6822(87)90144-9 |
| [2] |
Solomon T, Ni HL, Beasley DWC, et al. Origin and evolution of Japanese encephalitis virus in southeast Asia[J]. J Virol, 2003, 77(5): 3091-3098. DOI:10.1128/jvi.77.5.3091-3098.2003 |
| [3] |
Turtle L, Solomon T. Japanese encephalitis: The prospects for new treatments[J]. Nat Rev Neurol, 2018, 14(5): 298-313. DOI:10.1038/nrneurol.2018.30 |
| [4] |
Han N, Adams J, Chen P, et al. Comparison of genotypes Ⅰ and Ⅲ in Japanese encephalitis virus reveals distinct differences in their genetic and host diversity[J]. J Virol, 2014, 88(19): 11469-11479. DOI:10.1128/jvi.02050-14 |
| [5] |
Fischer M, Casey C, Chen RT. Promise of new Japanese encephalitis vaccines[J]. Lancet, 2007, 370(9602): 1806-1808. DOI:10.1016/S0140-6736(07)61753-X |
| [6] |
Caldwell M, Boruah AP, Thakur KT. Acute neurologic emerging flaviviruses[J]. Ther Adv Infect Dis, 2022, 9: 1-19. DOI:10.1177/20499361221102664 |
| [7] |
Ronca SE, Ruff JC, Murray KO. A 20-year historical review of West Nile virus since its initial emergence in North America: Has West Nile virus become a neglected tropical disease?[J]. PLoS Negl Trop Dis, 2021, 15(5): e0009190. DOI:10.1371/journal.pntd.0009190 |
| [8] |
Lu Z, Fu SH, Cao L, et al. Human infection with West Nile virus, Xinjiang, China, 2011[J]. Emerg Infect Dis, 2014, 20(8): 1421-1423. DOI:10.3201/eid2008.131433 |
| [9] |
Ahlers LRH, Goodman AG. The immune responses of the animal hosts of West Nile virus: A comparison of insects, birds, and mammals[J]. Front Cell Infect Microbiol, 2018, 8: 96. DOI:10.3389/fcimb.2018.00096 |
| [10] |
Shao N, Li F, Nie K, et al. TaqMan real-time RT-PCR assay for detecting and differentiating Japanese encephalitis virus[J]. Biomed Environ Sci, 2018, 31(3): 208-214. DOI:10.3967/bes2018.026 |
| [11] |
Lustig Y, Sofer D, Bucris ED, et al. Surveillance and diagnosis of West Nile virus in the face of Flavivirus cross-reactivity[J]. Front Microbiol, 2018, 9: 2421. DOI:10.3389/fmicb.2018.02421 |
| [12] |
Roberts A, Gandhi S. Japanese encephalitis virus: A review on emerging diagnostic techniques[J]. Front Biosci (Landmark Ed), 2020, 25(10): 1875-1893. DOI:10.2741/4882 |
| [13] |
Lei SW, Chen S, Zhong QP. Digital PCR for accurate quantification of pathogens: Principles, applications, challenges and future prospects[J]. Int J Biol Macromol, 2021, 184: 750-759. DOI:10.1016/j.ijbiomac.2021.06.132 |
| [14] |
Brandolini M, Taddei F, Marino MM, et al. Correlating qRT-PCR, dPCR and viral titration for the identification and quantification of SARS-CoV-2:A new approach for infection management[J]. Viruses, 2021, 13(6): 1022. DOI:10.3390/v13061022 |
| [15] |
Berden P, Wiederkehr RS, Lagae L, et al. Amplification efficiency and template accessibility as distinct causes of rain in digital PCR: Monte Carlo modeling and experimental validation[J]. Anal Chem, 2022, 94(45): 15781-15789. DOI:10.1021/acs.analchem.2c03534 |
| [16] |
Pomari E, Piubelli C, Perandin F, et al. Digital PCR: A new technology for diagnosis of parasitic infections[J]. Clin Microbiol Infect, 2019, 25(12): 1510-1516. DOI:10.1016/j.cmi.2019.06.009 |
| [17] |
Gaňová M, Zhang HQ, Zhu HL, et al. Multiplexed digital polymerase chain reaction as a powerful diagnostic tool[J]. Biosens Bioelectron, 2021, 181: 113155. DOI:10.1016/j.bios.2021.113155 |
| [18] |
de Almeida PR, Demoliner M, Eisen AKA, et al. SARS-CoV2 quantification using RT-dPCR: A faster and safer alternative to assist viral genomic copies assessment using RT-qPCR[J]. bioRxiv, 2020. DOI:10.1101/2020.05.01.072728 |
| [19] |
de Almeida PR, Eisen AKA, Demoliner M, et al. RT-dPCR in mosquito samples for ZIKV detection: Effects of RNA extraction and reverse transcription in target concentration[J]. Viruses, 2020, 12(8): 827. DOI:10.3390/v12080827 |
| [20] |
Ahrberg CD, Lee JM, Chung BG. Microwell array-based digital PCR for influenza virus detection[J]. BioChip J, 2019, 13(3): 269-276. DOI:10.1007/s13206-019-3302-8 |
| [21] |
Farkas K, Mannion F, Hillary LS, et al. Emerging technologies for the rapid detection of enteric viruses in the aquatic environment[J]. Curr Opin Environ Sci Health, 2020, 16: 1-6. DOI:10.1016/j.coesh.2020.01.007 |
| [22] |
徐蕾蕊, 李丹, 汪琦, 等. 基于RT-ddPCR技术的食品中诺如病毒定量检测[J]. 食品科学, 2022, 43(20): 313-320. Xu LR, Li D, Wang Q, et al. Quantitative detection of norovirus in foods using reverse transcriptase droplet digital polymerase chain reaction[J]. Food Sci, 2022, 43(20): 313-320. |
| [23] |
薛晓宁, 徐翮飞, 张娟, 等. 乙型脑炎病毒微滴式数字PCR检测方法的建立[J]. 口岸卫生控制, 2021, 26(5): 60-63. Xue XN, Xu HF, Zhang J, et al. Development of a reverse transcriptase droplet digital PCR assay for the detection of Japanese encephalitis virus[J]. Port Health Control, 2021, 26(5): 60-63. |
| [24] |
Rastogi M, Sharma N, Singh SK. Flavivirus NS1:A multifaceted enigmatic viral protein[J]. Virol J, 2016, 13: 131. DOI:10.1186/s12985-016-0590-7 |
| [25] |
Zhang LX, Parvin R, Fan QH, et al. Emerging digital PCR technology in precision medicine[J]. Biosens Bioelectron, 2022, 211: 114344. DOI:10.1016/j.bios.2022.114344 |
 2023, Vol. 34
2023, Vol. 34



