扩展功能
文章信息
- 吴胜春, 孟娇, 黄健胜, 余福勋, 吴家红, 杨光红, 江佳富, 孙毅, 曹务春, 詹琳
- WU Sheng-chun, MENG Jiao, HUANG Jian-sheng, YU Fu-xun, WU Jia-hong, YANG Guang-hong, JIANG Jia-fu, SUN Yi, CAO Wu-chun, ZHAN Lin
- 贵州省施秉县媒介蜱携带双芽巴贝斯虫的调查研究
- Investigation of Babesia bigemina carried by ticks in Shibing county, Guizhou province, China
- 中国媒介生物学及控制杂志, 2023, 34(2): 254-261
- Chin J Vector Biol & Control, 2023, 34(2): 254-261
- 10.11853/j.issn.1003.8280.2023.02.019
-
文章历史
- 收稿日期: 2022-10-26
2 贵州大学医学院, 贵州 贵阳 550025;
3 贵州省人民医院中心实验室, 贵州 贵阳 550002;
4 贵州省疾病预防控制中心, 贵州 贵阳 550001;
5 军事科学院军事医学研究院, 北京 100001
2 Medical School of Guizhou University, Guiyang, Guizhou 550025, China;
3 Central Laboratory, Guizhou Provincial People's Hospital, Guiyang, Guizhou 550002, China;
4 Guizhou Center for Disease Control and Prevention, Guiyang, Guizhou 550001, China;
5 Academy of Military Medicine, Academy of Military Sciences, Beijing 100001, China
蜱是一种专性吸血的体表寄生虫,主要寄生于家畜、野生动物、甚至人等脊椎动物的体表[1]。蜱可携带和传播病原体,主要包括病毒、细菌、立克次体、原虫等几大类[2],其传播能力仅次于蚊虫[3]。蜱传原虫病中的巴贝斯虫病(babesiosis)是越来越受关注的蜱媒传染病之一。至今报道的巴贝斯虫有100多种,其中双芽巴贝斯虫(Babesia bigemina)是我国引起牛巴贝斯虫病的主要病原体[4]。双芽巴贝斯虫属顶器复合门(Apicomplexa)、无类锥体纲(Aconoidasida)、梨形虫目(Piroplasmorida)、巴贝斯虫科(Babesiidae)、巴贝斯虫属(Babesia),是寄生于红细胞内的一种血液原虫病,宿主牛感染可表现为发热、消瘦、贫血、黄疸、血红蛋白尿等,甚至死亡,给我国畜牧养殖业造成了严重的经济损失[5]。双芽巴贝斯虫在我国分布广泛,主要分布于南方地区如云南、广西、四川等省份[6]。
近年来,黔西南布依族苗族自治州(黔西南州)义龙新区等多地陆续出现双芽巴贝斯虫病的报道[7]。但未见施秉县蜱分布及双芽巴贝斯虫流行情况的文献记载,该地本底情况未知。施秉县作为贵州省的白云岩喀斯特地貌的代表[8],位于长江流域沅江水系舞阳河中游地区,气候湿润,生境多样[9]。得天独厚的生态环境为蜱的孳生与寄生宿主的多样性提供了一定的可能。县境内以农耕为主、牛群散养居多,人与蜱的接触机会加大,增加了患病的风险。为了解贵州省施秉县部分地区蜱种类及双芽巴贝斯虫的感染情况,本研究对该县部分村庄的蜱传双芽巴贝斯虫进行调查研究,为当地蜱传双芽巴贝斯虫病防控提供一定的参考依据。
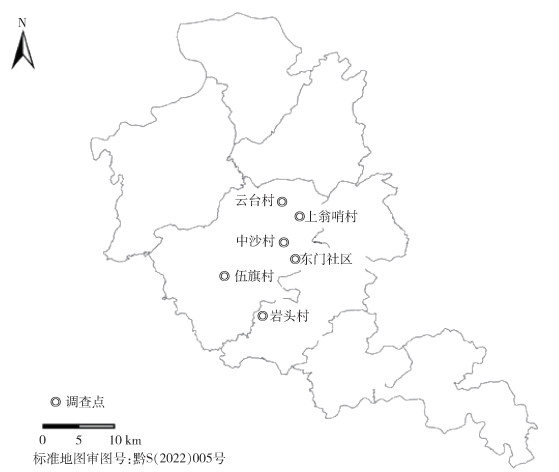
1 材料与方法 1.1 蜱采集地点及方法2021年7月-2022年5月,对施秉县的中沙村(27°02′50.28″N,108°08′38.89″E,海拔740 m)、上翁哨村(27°05′4.90″N,108°09′43.89″E,海拔894 m)、东门社区(27°01′48.50″N,108°09′14.34″E,海拔763 m)、云台村(27°05′45.95″N,108°08′14.98″E,海拔1 054 m)、岩头村(26°58′58.48″N,108°07′41.53″E,海拔694 m)和伍旗村(27°01′11.50″N,108°06′28.96″E,海拔742 m)的散养牛体表寄生蜱进行采集。采用体表检蜱法:采集宿主动物寄生蜱时重点检查动物的耳朵、脖子、大腿根、尾根等皮肤薄弱部位。将采集到的蜱放入装有润湿滤纸的收集管内,做好相关信息登记。
1.2 主要试剂与仪器Taq DNA polymerase、10×PCR buffer、dNTP购自宝日医生物技术(北京)有限公司;引物由生工生物工程(上海)股份有限公司合成;qEx-DNA/RNA核酸提取试剂盒、Generotex96全自动核酸提取仪购自西安天隆科技有限公司;BX53F光学显微镜购自日本Olympus公司;G50电动组织研磨器及RDY-SP6浸没式水平电泳槽购自生工生物工程(上海)股份有限公司;梯度基因扩增仪和凝胶成像仪购自美国Bio-Rad公司。
1.3 形态学分类将采集的蜱单只置于1.5 ml的EP管中,白纸铺满显微镜载物台面,限制蜱活动,虫体置于洁净载玻片上,镜下观察,重点观察假头基、口器、背部、生殖孔和尾突等,依据蜱形态学特征对蜱种进行初步鉴定。
1.4 DNA提取向装有蜱的1.5 ml EP管中加入210 μl的磷酸盐缓冲液(PBS),再用电动组织研磨器捣碎虫体使DNA充分暴露制成悬液,取200 μl悬液用核酸提取试剂盒抽提核酸,提取方法参考其说明书。
1.5 PCR扩增与测序 1.5.1 蜱种类分子生物学鉴定参考蜱线粒体16S rDNA基因通用引物[10],对蜱种类进行鉴定,不能准确判别蜱种时,辅以细胞色素C氧化酶亚基Ⅰ(COX1)基因加以验证[11]。PCR反应体系均为:Taq DNA polymerase 0.125 μl;10×PCR buffer 2.5 μl;dNTP(10 mmol/L)2.0 μl;正、反向引物各0.5 μl(10 μmol/L);蜱DNA模板1 μl;双蒸水补足体系;终体积为25 μl。16S rDNA基因扩增条件:95 ℃ 5 min预变性;95 ℃ 30 s,51 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min延伸。COX1基因扩增条件:95 ℃ 5 min预变性;95 ℃ 30 s变性,44 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 5 min延伸。后取5 μl的PCR扩增产物经1.5%琼脂糖凝胶电泳,凝胶成像仪观察结果。最后将已按形态学分类的蜱随机抽取部分阳性扩增产物送生工生物工程(上海)股份有限公司测序。每次反应均在样本间随机设立阴性对照(双蒸水)和阳性对照(本实验室已鉴定的微小扇头蜱DNA)。
1.5.2 梨形虫基因扩增参考我国巴贝斯虫诊断行业标准[12]巢氏PCR引物(梨形虫核酸PCR扩增通用引物),对蜱样本进行初筛检测,其中巢氏PCR反应的第2轮模板取自第1轮PCR扩增产物1 μl。初筛阳性样本,选取双芽巴贝斯虫种特异引物[13]进行验证(表 1)。每次反应均设置阴性和阳性对照(本实验室已鉴定的双芽巴贝斯虫DNA)。将扩增的部分阳性产物送生工生物工程(上海)股份有限公司测序。
登陆美国国立生物技术信息中心(NCBI)网站,将测序成功的结果同GenBank中注册的基因序列进行BLAST同源性比对。其次再利用DNAMAN 6.0软件将测序成功的样本DNA序列进行一致性比较,选取代表性DNA序列。同时从GenBank数据库中下载参考序列,用MEGA 7.0软件构建系统发育进化树,采用邻接法,自展检验1 000次,进一步确定蜱及其携带双芽巴贝斯虫的种类和进化关系。
2 结果 2.1 蜱的采集情况在施秉县的6个村(图 1)散养的黄牛体表共采得615只蜱,其中吸血蜱57只,未吸血蜱558只。中沙村和上翁哨村共采集445只、东门社区61只、云台村15只、岩头村39只和伍旗村50只。
|
| 图 1 2021-2022年贵州省施秉县蜱及其感染双芽巴贝斯虫调查点 Figure 1 Investigation sites of ticks and their infection with Babesia bigemina in Shibing county, Guizhou province, 2021-2022 |
| |
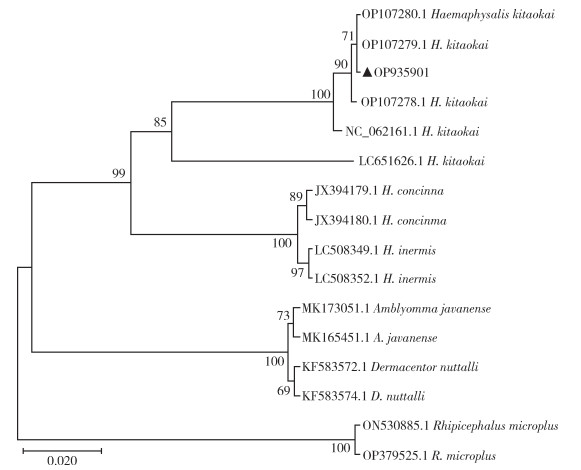
对采集的615只蜱依据形态特征初步分类后,再经过蜱线粒体16S rDNA基因进行PCR扩增,产物电泳得到450 bp左右的核酸片段。测序成功的序列经NCBI网站的BLAST进行序列比对及构建进化树,发现有2属4个种,均为硬蜱,分别为扇头蜱属的微小扇头蜱(Rhipicephalus microplus,605只)和镰形扇头蜱(R. haemaphysaloides,5只)、血蜱属的长角血蜱(Haemaphysalis longicornis,3只)和北岗血蜱(H. kitaokai,2只)。微小扇头蜱16S rDNA序列,所测序列与GenBank数据库中微小扇头蜱(基因号:MT555307.1)序列最接近,覆盖率(Query Cover)和一致性(Per.Identities)分别为96%、99.28%,注册基因号为OP923865;镰形扇头蜱16S rDNA序列与GenBank数据库中最接近的蜱种序列覆盖率和一致性分别为98%和98.54%,注册基因号为OP923867;长角血蜱与GenBank数据库中的长角血蜱(基因号:MT555302.1)最接近,基因注册号为OP923866,两者覆盖率和一致性分别为97%、99.52%;北岗血蜱的16S rDNA基因序列(基因号:OP933703、OP933705)与GenBank数据库中的H. kitaokai(NC_062161.1)全基因组序列一致性最为接近(覆盖率为96%;一致性为98.76%),其次为H. colasbelcouri(NC_062164.1)全基因组序列(覆盖率为95%;一致性为92.98%)。对2只北岗血蜱进行COX1基因扩增及序列测定,扩增的两条基因序列NCBI注册基因号分别为OP935901和OP935902,两序列一致性为100%,与GenBank数据库中H. kitaokai(NC_062161.1)最接近,序列覆盖率、一致性分别为100%和99.13%。COX1基因构建的进化发育树中,本研究蜱序列(基因号:OP935901)与中国疾病预防控制中心传染病预防控制所发布的北岗血蜱(基因号:OP107278.1、OP107279.1、OP107280.1)最为接近,序列一致性高达100%;与浙江省温州市从山羊检出的北岗血蜱(基因号:NC_062161.1)、日本的北岗血蜱(基因号:LC651626.1)聚为一分支;而与微小扇头蜱(基因号:OP379525.1)、草原革蜱(Dermacentor nuttalli)(基因号:KF583574.1)、爪哇花蜱(Amblyomma javanense)(基因号:MK165451.1)遗传距离较远,存在较大的差异,最终确定该蜱为北岗血蜱(H. kitaokai)(图 2)。本研究6个采样点中,东门社区发现的蜱种类最多,有2属4个种,其余的村庄目前仅发现微小扇头蜱。
|
| 注:▲本研究检测序列。 图 2 贵州省施秉县采集的北岗血蜱的细胞色素C氧化酶亚基Ⅰ(COX1)基因系统发育分析 Figure 2 Phylogenetic analysis of the cytochrome c oxidase subunit Ⅰ(COX1) gene of Haemaphysalis kitaokai collected from Shibing county, Guizhou province |
| |
巢式PCR扩增梨形虫18S rDNA基因片段,经琼脂糖凝胶电泳检测,在615份样本中共101份扩增出目的基因条带,测序比对后将双芽巴贝斯虫18S rDNA基因序列上传至NCBI数据库,基因注册号分别为OP941795、OP941793、OP941788和OP941796。从初筛阳性的标本中,扩增出59份双芽巴贝斯虫顶端膜抗原1(AMA-1)基因阳性条带,均为微小扇头蜱样本,且吸血和未吸血蜱样本均扩增出阳性条带。测序成功的双芽巴贝斯虫AMA-1基因序列已上传基因库(基因注册号:OQ127650)。
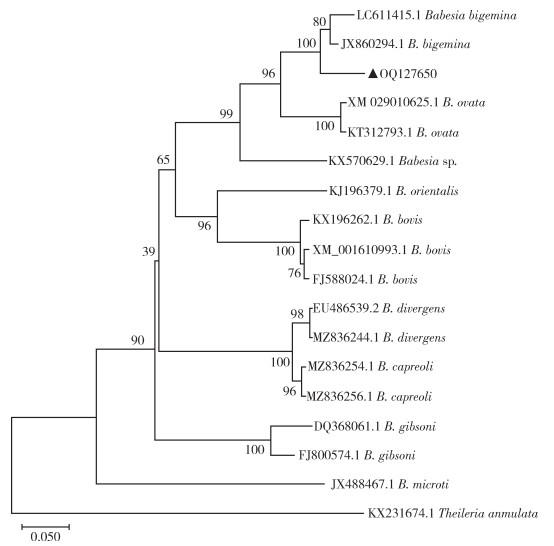
2.3.2 双芽巴贝斯虫的系统发育分析测序成功的双芽巴贝斯虫AMA-1样本的基因序列与2013年GenBank数据库发布的从南非的宿主牛体内检测到的B. bigemina序列(基因号:KF626606.1)最为接近,覆盖率和一致性分别为100%、99.04%。从NCBI上下载AMA-1基因参考序列,以环形泰勒虫(Theileria annulata)(基因号:KX231674.1)作为外群构建巴贝斯虫属的AMA-1基因进化树。本研究序列与从菲律宾的牛血中检出的双芽巴贝斯虫(基因号:JX860294.1)及从苏丹的小亚璃眼蜱(Hyalomma anatolicum)检出的双芽巴贝斯虫(基因号:LC611415.1)聚为同一个分支,有着较近的遗传进化关系;与日本(基因号:XM 029010625.1)、中国河南省(基因号:KT312793.1)从牛血检出的卵形巴贝斯虫(B. ovata)聚为大分支;与亦对人致病的B. microti(基因号:JX488467.1)、B. divergens(基因号:EU486539.2、MZ836244.1)距离较远。见图 3。
|
| 注:▲本研究的检测序列;B. divergens、B. microti已知对人致病。 图 3 贵州省施秉县从微小扇头蜱中检测到的双芽巴贝斯虫顶端膜抗原1(AMA-1)基因系统发育分析 Figure 3 Phylogenetic analysis of the apical membrane antigen-1(AMA-1) gene of Babesia bigemina detected in Rhipicephalus microplus in Shibing county, Guizhou province |
| |
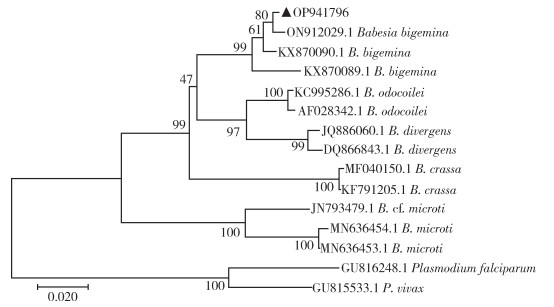
测序成功的18S rDNA双芽巴贝斯虫基因序列一致性为100%(基因号:OP941796),与已知对人致病的巴贝斯虫参考序列进行系统进化树的构建,以恶性疟原虫(Plasmodium falciparum)(基因号:GU816248.1)和间日疟原虫(Plasmodium vivax)(基因号:GU815533.1)作为外群,研究序列与GenBank数据库中印度的双芽巴贝斯虫参考序列(基因号:ON912029.1)亲缘关系最近,同源性为99.94%;与甘肃省天祝县牦牛身上检测到的双芽巴贝斯虫序列(基因号:KX870090.1、KX870089.1)聚集为一个分支,亲缘关系较近;与亦对人致病的B. microti(基因号:MN636453.1、MN636454.1)、B. crassa(基因号:KF791205.1)、B. divergens(基因号:JQ886060.1)等基因序列遗传关系较远。见图 4。
|
| 注:▲本研究的检测序列;B. divergens、B. crassa、B. microti、B. odocoilei已知对人致病。 图 4 贵州省施秉县从微小扇头蜱中检测到的双芽巴贝斯虫18S rDNA基因系统发育分析 Figure 4 Phylogenetic analysis of 18S rDNA gene of Babesia bigemina detected in Rhipicephalus microplus in Shibing county, Guizhou province |
| |
施秉县位于贵州省中东部,黔东南苗族侗族自治州西北部,处于云贵高原第二梯级向东部丘陵平原第一梯级过度的地带。县境内喀斯特地貌类型丰富,植被种类多样,自然条件优越,适宜蜱的生长繁殖。本次调查所采集到的蜱均为来自黄牛身上的寄生蜱,共采集到微小扇头蜱、长角血蜱、镰形扇头蜱、北岗血蜱4种。施秉县的调查点中,除了东门社区发现以上4种蜱,其他调查点发现的均为微小扇头蜱。现场流调时,各区域采样时的放牧植被类型场地有所区别,东门社区的黄牛被放牧于深山里,多为茂密的松树林,植被类型丰富,其他地区的黄牛则多喜放牧于丘陵和田埂间。黔东南岑巩县报道也发现了微小扇头蜱、北岗血蜱等[14]。黔东南生境多样,有报道指出具角血蜱(H. cornigera)、波斯锐缘蜱(Argas persicus)、嗜鸟血蜱(H. ornithophila)和雉鸡血蜱(H. phasiana)在贵州省仅见于黔东南[15],施秉县邻近的镇远县已发现具角血蜱,提示施秉县也可能存在更多蜱种有待发现。现场流调时,劳作归家的村民身上常能发现蜱,而蜱叮咬可以传播多种蜱媒传染病,对人民健康构成潜在威胁。本次流行病现场调查工作中仅局限于散养黄牛体表,还应继续扩大采样生境、宿主和范围,以更全面掌握施秉县蜱的种类和分布。
3.2 蜱传双芽巴贝斯虫双芽巴贝斯虫在我国广泛分布,贵州省黔西南州义龙新区[7]、关岭布依族苗族自治县[16]、贵定县[17]和独山县[18]等地均报道过双芽巴贝斯虫。本次研究从施秉县寄生蜱中检测到了双芽巴贝斯虫核酸片段,检出双芽巴贝斯虫的宿主为微小扇头蜱。微小扇头蜱已被证实是双芽巴贝斯虫的传播媒介,除卵期外,其余生长阶段均可传播病原体。He等[6]报道双芽巴贝斯虫的分布多依赖于微小扇头蜱的分布。贵州省是我国众多省份中微小扇头蜱分布较广的省份之一[19],牛双芽巴贝斯虫病的流行有近60年的历史[20],多地均报道过双芽巴贝斯虫感染宿主动物的案例,尤其是新引进牛和本地牛混合饲养放牧时,牛有较高的感染率,病死率也较高[21]。如贵州省黔西南州义龙新区某养牛场有13头牛发病,10头牛死亡,诊断时检测出双芽巴贝斯虫感染[7]。徐雨等[16]研究贵州省关岭县某散养户牛消瘦的原因,从牛血液中扩增出双芽巴贝斯虫核酸片段。微小扇头蜱是一宿主蜱,最适宜宿主为牛,Ma等[22]报道从南方采集的微小扇头蜱对牛、羊和兔宿主的吸血特性,其中对牛饱血率最高(11.0%)。本次研究发现,微小扇头蜱在6个村庄均有分布,数量在采获蜱中占比高达98.37%(605/615)。微小扇头蜱作为双芽巴贝斯虫的重要传播媒介,通过叮咬可使人和动物局部皮肤充血水肿,可将病原体传播给宿主动物而导致双芽巴贝斯虫病的发生。在进行现场采样时,通过触摸黄牛体表,可察部分黄牛体表有被蜱叮咬而起的结节,或伴随焦痂样伤口。同时,不同吸血状态的蜱体内均扩增到双芽巴贝斯虫核酸片段,吸血蜱体内被检出的巴贝斯虫是来自于蜱本身还是来自于宿主动物血液,尚需进一步研究。我国报道北岗血蜱多见于南方地区[23],关于北岗血蜱是否能传播巴贝斯虫还待进一步研究,其在蜱媒病传播的公共卫生学意义待进一步探索。镰形扇头蜱和长角血蜱也是双芽巴贝斯虫的携带媒介,在本次研究中未检出,可能与本次所采获样本量较少有关,未来需要继续扩大样本采集量和采集范围,以更准确地掌握施秉县蜱感染巴贝斯虫状况。
AMA-1基因在顶复门寄生虫中高度保守[24],双芽巴贝斯虫检测时通常选取AMA-1基因。在分析本研究中微小扇头蜱检测到的双芽巴贝斯虫基因特征时,为了解其与已知对人致病株(基因号:EU486539.2、MZ836244.1、JX488467.1和MN636453.1等)的进化关系,故选取了AMA-1和18S rDNA基因进行鉴定。本研究表明,AMA-1基因序列与从菲律宾的牛血及苏丹的小亚璃眼蜱中检出的双芽巴贝斯虫有着较近的亲缘关系,18S rDNA基因序列与印度的双芽巴贝斯虫亲缘关系最近。目前报道可以感染人的巴贝斯虫主要是田鼠巴贝斯虫(B. microti)、猎户巴贝斯虫(B. venatorum)、邓肯巴贝斯虫(B. duncani)和分歧巴贝斯虫(B. divergens)等。人群对巴贝斯虫普遍易感,轻则出现发热、肌痛、贫血等症状,重则导致死亡[25]。近年来,国内外相继有人体中检出巴贝斯虫的报道,我国云南、广西和浙江等地均有报道[26],其对人类致病的风险不容忽视。
本研究DNA模板提取、体系配置、PCR扩增和扩增产物电泳均在不同房间进行,每次PCR反应均在样本间随机设立多个阴性和阳性对照,尽可能地排除实验室污染和假阳性结果。通用梨形虫引物扩增同一份标本是为了使梨形虫基因扩增更加全面,提高对可能巴贝斯虫阳性样本的注意度,进一步提高巴贝斯虫扩增的准确性。但存在不足之处,引物扩增出的双芽巴贝斯虫基因,大部分电泳条带亮度较弱,可能和双芽巴贝斯虫DNA含量过低有关。选取电泳条带较好的样本送测序,结果仍旧存在套峰或测序失败。经过反复条件摸索,优化、切胶纯化,均不能排除干扰峰,提示本研究所用梨形虫18S rDNA PCR体系和AMA-1基因PCR扩增体系不能直接用于蜱体内巴贝斯虫鉴定,需通过进一步测序来证实。
本研究发现施秉县的微小扇头蜱体内携带双芽巴贝斯虫的核酸片段,提示人们进入野外应做好防蜱叮咬措施以避免感染;及时对家畜做驱虫处理,减少蜱对人和家畜的健康威胁,降低经济损失。施秉县至今未见双芽巴贝斯虫病流行分布情况的报道,对该地区进行该病的流行调查可为今后的蜱媒疾病防治提供一定的参考。
志谢 贵州省人民医院中心实验室老师、师兄师姐们对课题给予支持,施秉县村民们配合和协助样本采集,一并志谢利益冲突 无
| [1] |
邓国藩, 姜在阶. 中国经济昆虫志. 第三十九册. 蜱螨亚纲. 硬蜱科[M]. 北京: 科学出版社, 1991: 34-43. Deng GF, Jiang ZJ. Economic insect fauna of China. Fasc. 39 (Acari: Ixodidae)[M]. Beijing: Science Press, 1991: 34-43. |
| [2] |
刘玮. 中国新发蜱媒病原体概况[J]. 传染病信息, 2017, 30(1): 11-14. Liu W. Emerging tick borne agents in China[J]. Infect Dis Inf, 2017, 30(1): 11-14. DOI:10.3969/j.issn.1007-8134.2017.01.005 |
| [3] |
陈泽. 中国蜱类的系统分类及两种硬蜱的生物学特性分析[D]. 石家庄: 河北师范大学, 2010. Chen Z. Taxonomic and systematic research of Chinese ticks and biological characteristic analysis of two hard tick species[D]. Shijiazhuang: Hebei Normal University, 2010. (in Chinese) |
| [4] |
Niu QL, Liu ZJ, Yu PF, et al. Genetic characterization and molecular survey of Babesia bovis, B. bigemina and B. ovata in cattle, dairy cattle and yaks in China[J]. Parasit Vectors, 2015, 8: 518. DOI:10.1186/s13071-015-1110-0 |
| [5] |
刘启生. 牛巴贝斯虫病实时荧光PCR诊断方法的建立及其初步应用研究[D]. 乌鲁木齐: 新疆农业大学, 2013. Liu QS. Establishment of real-time fluorescence PCR methods for diagnosing bovine Babesiosis and its applications[D]. Urumqi: Xinjiang Agricultural University, 2013. (in Chinese) |
| [6] |
He L, Bastos RG, Sun YL, et al. Babesiosis as a potential threat for bovine production in China[J]. Parasit Vectors, 2021, 14(1): 460. DOI:10.1186/s13071-021-04948-3 |
| [7] |
周贵, 田琴, 梅世慧. 一例牛双芽巴贝斯虫、大肠杆菌混合感染的实验室诊断[J]. 黑龙江畜牧兽医, 2022(20): 100-103, 145. Zhou G, Tian Q, Mei SH. Laboratory diagnosis of a case of co-infection of bovine Babesia bigemina and Escherichia coli[J]. Heilongjiang Anim Sci Vet Med, 2022(20): 100-103, 145. DOI:10.13881/j.cnki.hljxmsy.2021.10.0255 |
| [8] |
汤晓辛, 王英, 杨庆伟, 等. 施秉云台山白云岩喀斯特地区豆科植物资源调查[J]. 湖北农业科学, 2016, 55(5): 1183-1185. Tang XX, Wang Y, Yang QW, et al. The resources survey of leguminosae plant in dolomite Karst area, Yuntai Mountain in Shibing[J]. Hubei Agric Sci, 2016, 55(5): 1183-1185. DOI:10.14088/j.cnki.issn0439-8114.2016.05.024 |
| [9] |
周玮. 贵州省施秉县旅游资源分析与发展策略[J]. 旅游纵览, 2015(16): 119-121. Zhou W. Analysis and development strategy of tourism resources in Shibing county of Guizhou province[J]. Tourism Surv, 2015(16): 119-121. |
| [10] |
Chen Z, Li YQ, Ren QY, et al. Dermacentor everestianus Hirst, 1926 (Acari: Ixodidae): Phylogenetic status inferred from molecular characteristics[J]. Parasitol Res, 2014, 113(10): 3773-3779. DOI:10.1007/s00436-014-4043-1 |
| [11] |
Chitimia L, Lin RQ, Cosoroaba I, et al. Genetic characterization of ticks from southwestern Romania by sequences of mitochondrial cox1 and nad5 genes[J]. Exp Appl Acarol, 2010, 52(3): 305-311. DOI:10.1007/s10493-010-9365-9 |
| [12] |
中华人民共和国国家卫生和计划生育委员会. WS/T 564-2017巴贝虫病诊断[S/OL]. (2017-08-01)[2022-09-16]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2017/08/20170811160825135.pdf. National Health and Family Planning Commission of the People's Republic of China. WS/T 564-2017 Diagnosis of babesiosis[S/OL]. (2017-08-01)[2022-09-16]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2017/08/20170811160825135.pdf. (in Chinese) |
| [13] |
Sivakumar T, Altangerel K, Battsetseg B, et al. Genetic detection of Babesia bigemina from Mongolian cattle using apical membrane antigen-1 gene-based PCR assay[J]. Vet Parasitol, 2012, 187(1/2): 17-22. DOI:10.1016/j.vetpar.2012.01.008 |
| [14] |
Lu M, Meng C, Zhang B, et al. Prevalence of spotted fever group Rickettsia and Candidatus Lariskella in multiple tick species from Guizhou province, China[J]. Biomolecules, 2022, 12(11): 1701. DOI:10.3390/biom12111701 |
| [15] |
刘联坤, 郭建军. 贵州禽畜寄生蜱种类及优势种[J]. 西南师范大学学报(自然科学版), 2011, 36(1): 98-101. Liu LK, Guo JJ. Species of poultry ticks and its dominant species in Guizhou province[J]. J Southwest China Norm Univ(Natl Sci Ed), 2011, 36(1): 98-101. DOI:10.13718/j.cnki.xsxb.2011.01.040 |
| [16] |
徐雨, 冯明祥, 韦登雄, 等. 关岭牛多种寄生虫混合感染病例的实验室诊断与治疗[J]. 贵州畜牧兽医, 2020, 44(5): 54-56. Xu Y, Feng MX, Wei DX, et al. Laboratory diagnosis and treatment of mixed infections of multiple parasites in Guanling cattle[J]. Guizhou J Anim Husb Vet Med, 2020, 44(5): 54-56. |
| [17] |
陈彦希, 张胜沾, 张海, 等. 牛双芽巴贝斯虫、附红细胞体和支原体混合感染的诊治[J]. 黑龙江畜牧兽医, 2018(2): 118, 120, 245. Chen YX, Zhang SZ, Zhang H, et al. Diagnosis and treatment of the coinfection of Babesia bigemina, Eperythrozoon and Mycoplasma in cattle[J]. Heilongjiang Anim Sci Vet Med, 2018(2): 118, 120, 245. DOI:10.13881/j.cnki.hljxmsy.2017.02.0088 |
| [18] |
周启泽, 张毅. 奶牛双芽巴贝斯虫病的诊治[J]. 中国兽医杂志, 2015, 51(2): 96-97. Zhou QZ, Zhang Y. Diagnosis and treatment of Babesia bigemina in dairy cows[J]. Chin J Vet Med, 2015, 51(2): 96-97. DOI:10.3969/j.issn.0529-6005.2015.02.038 |
| [19] |
肖鹏. 微小扇头蜱空间分布及感染病原体流行情况分析[D]. 北京: 北京化工大学, 2022. DOI: 10.26939/d.cnki.gbhgu.2022.001560. Xiao P. Prediction of spatial distribution and epidemic analysis of pathogens of Rhipicephalus microplus[J]. Beijing: Beijing University of Chemical Technology, 2022. DOI: 10.26939/d.cnki.gbhgu.2022.001560.(inChinese) |
| [20] |
吴位珩, 杨茂生, 廖明, 等. 牛双芽巴贝斯虫PCR检测方法的建立及初步应用[J]. 畜牧与兽医, 2009, 41(9): 78-80. Wu WH, Yang MS, Liao M, et al. Establishment and preliminary application of PCR method for detection of Babesia bigemina in cattle[J]. Anim Husb Vet Med, 2009, 41(9): 78-80. |
| [21] |
李白. 肉牛焦虫病的流行病学、临床症状和防治措施[J]. 现代畜牧科技, 2021(2): 103-104. Li B. Epidemiology, clinical symptoms and control measures of pyrococcosis in beef cattle[J]. Mod Anim Husb Sci Technol, 2021(2): 103-104. DOI:10.19369/j.cnki.2095-9737.2021.02.055 |
| [22] |
Ma ML, Chen Z, Liu AH, et al. Biological parameters of Rhipicephalus (Boophilus) microplus (Acari: Ixodidae) fed on rabbits, sheep, and cattle[J]. Korean J Parasitol, 2016, 54(3): 301-305. DOI:10.3347/kjp.2016.54.3.301 |
| [23] |
赵国平. 中国蜱类空间分布及其危害预测[D]. 北京: 军事科学院, 2018. Zhao GP. Spatial distribution of ticks and their hazard prediction in China[D]. Beijing: Academy of Military Sciences, 2018. (in Chinese) |
| [24] |
Torina A, Agnone A, Sireci G, et al. Characterization of the apical membrane antigen-1 in Italian strains of Babesia bigemina[J]. Transbound Emerg Dis, 2010, 57(1/2): 52-56. DOI:10.1111/j.1865-1682.2010.01118.x |
| [25] |
Ord RL, Lobo CA. Human babesiosis: Pathogens, prevalence, diagnosis, and treatment[J]. Curr Clin Microbiol Rep, 2015, 2(4): 173-181. DOI:10.1007/s40588-015-0025-z |
| [26] |
Zhao GP, Wang YX, Fan ZW, et al. Mapping ticks and tick-borne pathogens in China[J]. Nat Commun, 2021, 12(1): 1075. DOI:10.1038/s41467-021-21375-1 |
 2023, Vol. 34
2023, Vol. 34



