扩展功能
文章信息
- 吴丽群, 周欣欣, 周良才, 包继永, 郭慧, 刘求, 陈晓敏
- WU Li-qun, ZHOU Xin-xin, ZHOU Liang-cai, BAO Ji-yong, GUO Hui, LIU Qiu, CHEN Xiao-min
- 湖北省武汉市居民区白纹伊蚊电压门控钠离子通道基因突变分析
- Analysis of voltage-gated sodium channel gene mutations in Aedes albopictus in the residential area of Wuhan, Hubei province, China
- 中国媒介生物学及控制杂志, 2023, 34(2): 212-217
- Chin J Vector Biol & Control, 2023, 34(2): 212-217
- 10.11853/j.issn.1003.8280.2023.02.011
-
文章历史
- 收稿日期: 2022-05-09
2 中国疾病预防控制中心传染病预防 控制所, 传染病预防控制国家重点实验室, 北京 102206;
3 北京市大兴区疾病预防控制中心, 北京 102600;
4 武汉市东西湖区疾病预防控制中心, 湖北 武汉 430040
2 Key Laboratory of Infectious Disease Prevention and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 Daxing District Center for Disease Prevention and Control, Beijing 102600, China;
4 Dong Xi-hu District Center for Disease Control and Prevention, Wuhan, Hubei 430040, China
白纹伊蚊(Aedes albopictus)是全球最具侵袭性的蚊种之一[1],在武汉地区广泛分布。白纹伊蚊具有白昼叮人习性,能够传播登革热、黄热病、基孔肯雅热等多种疾病,白纹伊蚊防制对以其为媒介的病毒性传染病防控具有重要意义。化学防治仍是当前蚊媒防制的重要手段,但随着卫生杀虫剂长期、大量使用,蚊虫抗药性不断产生和发展并成为蚊虫防制的巨大障碍。武汉市以往抗药性研究仅限于生物测定方法,缺乏对蚊虫抗药性分子作用机制方面的研究和监测。靶标抗性是指昆虫对杀虫剂的各种靶标敏感性降低而导致抗药性,是蚊虫对杀虫剂产生抗药性的主要分子机制之一[2]。神经膜细胞电压门控钠离子通道(voltage-gated sodium channel,VGSC)是拟除虫菊酯类杀虫剂的作用靶标,VGSC基因突变可导致钠离子通道结构变化,降低与该类杀虫剂的亲和性,导致抗药性的产生[3-4],突出表现为击倒效应减弱或消失,因此VGSC基因突变产生的抗性又称为击倒抗性(knockdown resistance,kdr)。本研究以白纹伊蚊VGSC基因突变情况调查为切入点,初步探索武汉市白纹伊蚊对拟除虫菊酯类杀虫剂产生抗药性的作用机制,为白纹伊蚊科学、有效防制提供依据。
1 材料与方法 1.1 材料 1.1.1 供试蚊虫2021年8-10月,在武汉市江汉区常青街常宏里社区与常三社区共2个居民区采集白纹伊蚊幼虫和蛹,于实验室饲养至成蚊,经形态学鉴定并区分雌雄成蚊,选取羽化后3~5 d的成蚊用于抗性检测,获取238只白纹伊蚊成蚊样本(其中126只雌蚊,112只雄蚊)。选择的2个居民区相距3.8 km,社区外环境小型容器多,且成蚊密度高,并均属于武汉市政府购买服务进行除“四害”的承包社区范围,定期由第三方除害服务公司有害生物防治人员开展灭蚊、蝇服务。实验室饲养条件为温度(25±1)℃,相对湿度为(70±5)%。
1.1.2 主要仪器NP968-C核酸提取仪(西安天隆科技有限公司),MM 400组织研磨仪(德国Retsch公司),ProFlex PCR仪(美国ABI公司),电泳仪与水平电泳槽(美国Bio-Rad公司),凝胶成像仪(德国Analytikjena公司),生物安全柜(美国Thermo公司)。
1.1.3 主要试剂动物组织基因组DNA提取试剂盒(型号:ZTLKD)购自西安天隆科技有限公司,Taq PCR预混液、DNA marker和琼脂糖均购自宝生物工程(大连)有限公司,TBE和Hank’s液购自北京兰杰柯科技有限公司,引物由生工生物工程(上海)股份有限公司合成。
1.2 方法 1.2.1 成蚊基因组DNA提取将单只蚊虫样本装入含Hank’s液的EP管中进行研磨,按照DNA提取试剂盒使用说明书提取单只成蚊的组织DNA。
1.2.2 VGSC基因扩增与测序以提取的单只蚊虫DNA样本为模板,扩增白纹伊蚊VGSC基因结构域(domain)Ⅱ、Ⅲ和Ⅳ基因部分序列,3对引物序列[5]见表 1。PCR扩增体系:2×Taq PCR预混液12.5 μl,10 μmol/L正、反向引物各1.0 μl,DNA模板2.0 μl,ddH2O补足25 μl。反应条件:94 ℃ 2 min;94 ℃ 30 s,55 ℃(domain Ⅲ、Ⅳ)或58 ℃(domain Ⅱ)30 s,72 ℃ 30 s,共35个循环;72 ℃ 8 min。PCR产物经1%琼脂糖凝胶电泳检测,domain Ⅱ、Ⅲ和Ⅳ区部分基因扩增产物分别用于检测V1016位点、I1532与F1534位点、D1763位点的基因突变情况。将出现目的条带且条带清晰无拖尾的样本送至生工生物工程(上海)股份有限公司进行测序。
|
测序结果应用软件MEGA 11.0和Chromas 2.3进行序列比对和峰图分析,观察各位点的突变情况,确定等位基因类型和基因型,分别计算和统计VGSC基因各位点等位基因和基因型频率。同时,运用SPSS 20.0软件进行统计学分析,采用χ2检验,比较分析雌雄蚊个体在VGSC基因各位点基因型频率上的差异性。P < 0.05为差异有统计学意义。
2 结果 2.1 VGSC基因的等位基因和基因型238份白纹伊蚊野生种群DNA样本扩增后,共获取雌性成蚊VGSC基因片段378条,雄性成蚊VGSC基因片段336条,合计714条白纹伊蚊VGSC基因片段,其中,domain Ⅱ~Ⅳ区序列均为378条。在GenBank上进行BLAST比对,与白纹伊蚊VGSC基因(No. AY663384)的domain Ⅱ、Ⅲ和Ⅳ编码区的部分序列一致性达98.00%,证实所得序列为白纹伊蚊VGSC基因片段,其长度分别为480、740和280 bp。
对获得的238只白纹伊蚊VGSC基因片段序列进行比对分析,发现domain Ⅱ的V1016位点与domain Ⅲ的I1532及F1534位点均存在突变,但domain Ⅳ的D1763位点未发现基因突变情况。发现V1016与I1532位点同时存在突变的样本2份,V1016与F1534位点同时存在突变的样本109份,I1532与F1534位点同时存在突变的样本2份,未发现3个位点同时存在突变的样本。
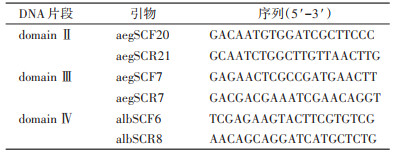
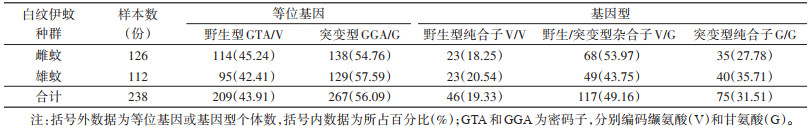
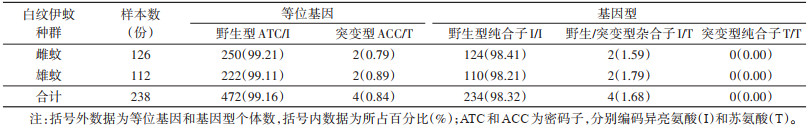
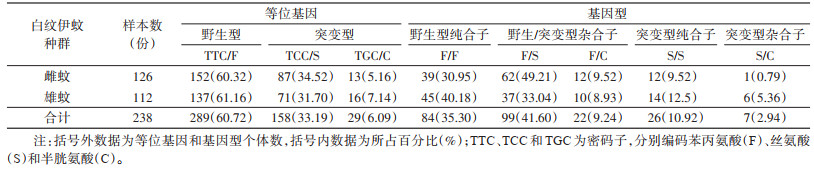
进一步分析发现,D1763位点仅存在1种基因型,即野生型GAC/D(100%)。V1016位点共有2种等位基因,即编码缬氨酸的野生型GTA/V(43.91%)和编码甘氨酸的突变型GGA/G(56.09%);3种基因型分别为野生型纯合子V/V(19.33%)、野生/突变型杂合子V/G(49.16%)和突变型纯合子G/G(31.51%)。I1532位点共有2种等位基因,即编码异亮氨酸的野生型ATC/I(99.16%)和编码苏氨酸的突变型ACC/T(0.84%);2种基因型分别为野生型纯合子I/I(98.32%)和野生/突变型杂合子I/T(1.68%),未发现突变型纯合子T/T。F1534位点共有3种等位基因,即编码苯丙氨酸的野生型TTC/F(60.72%)、编码丝氨酸的突变型TCC/S(33.19%)和编码半胱氨酸的突变型TGC/C(6.09%);5种基因型分别为野生型纯合子F/F(35.30%)、野生/突变型杂合子F/S(41.60%)和F/C(9.24%)、突变型纯合子S/S(10.92%)与突变型杂合子S/C(2.94%),未发现突变型纯合子C/C。本研究分别分析了雌性成蚊与雄性成蚊在V1016、I1532和F1534位点等位基因和基因型频率分布情况。见图 1及表 2~4。

|
| 注:VGSC基因结构域(domain)Ⅱ片段扩增后进行反向测序,测得3′端向5′端V1016位点密码子为野生型TAC和突变型TCC,对应5′端向3′端密码子分别为GTA和GGA,分别编码缬氨酸(V)和甘氨酸(G);domain Ⅲ片段扩增后进行反向测序,测得3′端向5′端I1532位点密码子分别为野生型GAT和突变型GGT,对应5′端向3′端密码子分别为ATC和ACC,分别编码异亮氨酸(I)和苏氨酸(T);测得3′端向5′端I1534位点密码子分别为野生型GAA、突变型GGA与GCA,对应5′端向3′端密码子分别为TTC、TCC与TGC,分别编码苯丙氨酸(F)、丝氨酸(S)和半胱氨酸(C);domain Ⅳ片段扩增后进行正向测序,测得5′端向3′端D1763位点密码子为GAC,编码天冬氨酸(D)。 图 1 湖北省武汉市居民区白纹伊蚊电压门控钠离子通道(VGSC)基因突变测序峰图 Figure 1 A sequencing chromatogram of the voltage-gated sodium channel (VGSC) gene of Aedes albopictus in residential area of Wuhan, Hubei province, China |
| |
|
|
|
共检测雌蚊126只,雄蚊112只。采用χ2检验对雌蚊样本与雄蚊样本VGSC基因V1016、I1532和F1534位点突变型(含野生/突变型杂合子、突变型杂合子和突变型纯合子)和野生型(野生型纯合子)进行比较分析。结果显示,雌、雄蚊个体间在V1016、I1532和F1534位点的基因型差异均无统计学意义(χ2=0.198,P=0.656;χ2=0.014,P=0.905;χ2=2.210,P=0.137)。见表 5。

|
居民区是容易孳生白纹伊蚊且与人群接触最广泛的生境之一。同时,拟除虫菊酯类杀虫剂在居民区外环境被广泛用于夏秋季城镇灭杀成蚊。本研究所选择的居民区属于武汉市政府购买社区外环境除“四害”服务的承包范围,定期有专业除害服务人员开展灭蚊工作,因此选择其作为白纹伊蚊样本采集点具有一定的代表性。
国内多个城市或地区已开展关于白纹伊蚊现场种群VGSC基因突变的研究,但突变位点及等位基因和基因型频率均有所不同。本研究对VGSC基因3个编码区基因片段的4个位点进行了研究,结果表明,武汉市白纹伊蚊种群在V1016、I1532与F1534位点均存在突变。V1016位点检测到野生/突变杂合子(V/G)和突变纯合子(G/G),北京市[6]和云南省景洪市[7]白纹伊蚊种群的研究也得出相同的结果,但是武汉市种群突变型等位基因频率达56.09%,且未发生突变的野生型纯合子仅占19.33%,突变率总体上高于北京市和景洪市种群。值得注意的是,国内其他地区白纹伊蚊种群的研究如广东省中山市、云南省瑞丽市、福建省福州市与莆田市等地区均未发现白纹伊蚊VGSC基因的V1016G突变[8-10]。本研究在I1532位点检测到点突变,由ATC/I突变为ACC/T,但突变型等位基因频率较低,仅为0.84%,且只存在野生/突变杂合子(I/T),未发现突变型纯合子,该结果与景洪、瑞丽和南京市种群的研究结果基本一致,但是等位基因频率低于该2个地区[7, 9, 11]。VGSC基因F1534位点突变在对拟除虫菊酯类杀虫剂的白纹伊蚊种群中普遍存在,且突变类型复杂,是当前白纹伊蚊VGSC基因研究的热点位点之一。综述多个城市或地区的研究结果,景洪、瑞丽、中山市等地区白纹伊蚊种群发现了TCC/S、TCG/S、TGC/C、TTG/L等4种突变型等位基因,其中,除中山市种群以TTG/L为频率最高外,其他地区突变型等位基因均以TCC/S为主[7, 9, 10];上海市青浦区和海口市种群各发现了3种突变型等位基因,且基因型不完全相同,但均是TCC/S的频率最高[11-12];广州和深圳市种群均发现TCC/S、TTG/L两种等位基因,其中广州市以TTG/L为主,深圳市以TCC/S为主[13];南京市与杭州市种群只发现TCC/S[11]。相比而言,武汉市白纹伊蚊种群仅发现TCC/S、TGC/C两种突变型等位基因,暂未发现TCG/S和TTG/L突变,与其他地区白纹伊蚊种群不尽相同,但突变等位基因以TCG/S为主,这点与大多数地区研究一致[1, 7, 9-13]。突变基因型中以F/C为主,且存在突变型纯合子S/S,未发现突变型纯合子C/C,这与其他地区研究中突变型纯合子C/C极为罕见基本一致[7, 9, 11]。D1763位点共有两种等位基因,即野生型GAC/D和突变型TAC/Y,此突变在埃及伊蚊(Ae. aegypti)种群更常见[14],白纹伊蚊目前国内仅瑞丽市种群曾检测到[9]。本研究在武汉市居民区生境采集的238只白纹伊蚊中检测该基因位点,但未发现该位点发生突变。武汉市白纹伊蚊种群VGSC基因突变位点与国内大部分地区研究结果基本一致,但在突变等位基因和基因型种类和频率上有差异,可能与各地区使用的卫生杀虫剂种类、使用浓度及使用频次等因素有关,从而造成基因突变的多态性[10]。总体上,武汉市白纹伊蚊种群VGSC基因V1016与F1534位点突变频率相对较高[7, 11]。此外,本研究结果表明近50.00%的蚊虫同时发生2个位点的突变,进一步提示武汉市白纹伊蚊VGSC基因突变的多态性,这与武汉市白纹伊蚊种群对拟除虫菊酯类杀虫剂产生高水平抗药性的生测结果相吻合。
本研究对白纹伊蚊雌、雄蚊种群的VGSC基因突变情况进行比较,结果显示,不同性别白纹伊蚊的VGSC基因V1016、I1532和F1534位点突变率差异均无统计学意义,与中山市种群研究结果一致[10],提示不同性别白纹伊蚊在靶标抗性分子机制上可能相同或相似。同时,胡梦雪等[15]研究发现淡色库蚊(Culex pipiens pallens)雌雄蚊之间部分抗性基因存在差异表达,李士根[16-17]研究表明不同性别淡色库蚊乙酰胆碱酯酶及非特异性酯酶也存在差异性表达,又提示雌雄性蚊虫在其他抗药性分子机制上或存在差别。雌雄蚊生理结构、生存环境及摄食条件不同,可能致使其抗药性分子机制部分发生变异,但具体分子机制尚不完全清楚,仍有待于进一步研究。
本研究是对武汉市白纹伊蚊种群抗药性分子机制的初步探讨,蚊虫采集生境相对单一,研究组下一步将对全市不同生境白纹伊蚊种群对杀虫剂的靶标抗性及代谢抗性机制等进行深入研究与监测,以更全面深入地了解武汉市白纹伊蚊抗性产生及发展的分子作用机制及其变化发展趋势。
利益冲突 无
| [1] |
Global Invasive Species Database. 100 of the world's worst invasive alien species [EB/OL]. (2020-07-02) [2022-05-09]. http://www.iucngisd.org/gisd/100_worst.php.
|
| [2] |
Dang K, Doggett SL, Veera Singham G, et al. Insecticide resistance and resistance mechanisms in bed bugs, Cimex spp. (Hemiptera: Cimicidae)[J]. Parasit Vectors, 2017, 10(1): 318. DOI:10.1186/s13071-017-2232-3 |
| [3] |
Ismail BA, Kafy HT, Sulieman JE, et al. Temporal and spatial trends in insecticide resistance in Anopheles arabiensis in Sudan: Outcomes from an evaluation of implications of insecticide resistance for malaria vector control[J]. Parasit Vectors, 2018, 11(1): 122. DOI:10.1186/s13071-018-2732-9 |
| [4] |
Zoh DD, Ahoua Alou LP, Toure M, et al. The current insecticide resistance status of Anopheles gambiae (s. l.) (Culicidae) in rural and urban areas of Bouaké, Côte d'Ivoire[J]. Parasit Vectors, 2018, 11(1): 118. DOI:10.1186/s13071-018-2702-2 |
| [5] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. DOI:10.7883/yoken.64.217 |
| [6] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing China: First report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
| [7] |
朱彩英, 赵春春, 伦辛畅, 等. 云南省景洪市2018-2019年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 7-11. Zhu CY, Zhao CC, Lun XC, et al. Distribution of knockdown resistance genotypes in Aedes albopictus in Jinghong, Yunnan province, China, 2018-2019[J]. Chin J Vector Biol Control, 2020, 31(1): 7-11. DOI:10.11853/j.issn.1003.8280.2020.01.002 |
| [8] |
李玉伟, 黄婧雯, 章灿明, 等. 福建省福州市和莆田市2020年白纹伊蚊击倒抗性基因突变分析[J]. 中国热带医学, 2021, 21(10): 952-955, 969. Li YW, Huang JW, Zhang CM, et al. Knockdown resistance gene mutations of Aedes albopictus from Fuzhou and Putian, Fujian, 2020[J]. China Trop Med, 2021, 21(10): 952-955, 969. DOI:10.13604/j.cnki.46-1064/r.2021.10.08 |
| [9] |
兰学梅, 徐家宝, 姜进勇. 云南省瑞丽市白纹伊蚊对拟除虫菊酯类杀虫剂抗性种群的电压门控钠离子通道基因突变分析[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 158-162. Lan XM, Xu JB, Jiang JY. An analysis of voltage-gated sodium channel gene mutation in Aedes albopictus resistant populations against pyrethroid insecticides in Ruili, Yunnan province, China[J]. Chin J Vector Biol Control, 2019, 30(2): 158-162. DOI:10.11853/j.issn.1003.8280.2019.02.010 |
| [10] |
杨罗菊, 刘德星, 陈健, 等. 中山市白纹伊蚊现场种群击倒抗性基因检测分析[J]. 中国人兽共患病学报, 2021, 37(2): 171-175. Yang LJ, Liu DX, Chen J, et al. Detection and analysis of the knockdown resistance gene in the field populations of Aedes albopictus in Zhongshan[J]. Chin J Zoonoses, 2021, 37(2): 171-175. DOI:10.3969/j.issn.1002-2694.2021.00.005 |
| [11] |
陈翰明, 高景鹏, 姜进勇, 等. 我国白纹伊蚊现场群体击倒抗性基因I1532和F1534突变检测及I1532T突变等位基因报告[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 120-125. Chen HM, Gao JP, Jiang JY, et al. Detection of the I1532 and F1534 kdr mutations and a novel mutant allele I1532T in VGSC gene in the field populations of Aedes albopictus from China[J]. Chin J Vector Biol Control, 2018, 29(2): 120-125. DOI:10.11853/j.issn.1003.8280.2018.02.002 |
| [12] |
赵春春, 朱彩英, 开文龙, 等. 海口市2018年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 7-11. Zhao CC, Zhu CY, Kai WL, et al. Genotypes of knockdown resistance gene and their distribution in Aedes albopictus in Haikou, China, in 2018[J]. Chin J Vector Biol Control, 2019, 30(1): 7-11. DOI:10.11853/j.issn.1003.8280.2019.01.002 |
| [13] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel (VGSC) gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
| [14] |
Du YZ, Nomura Y, Satar G, et al. Molecular evidence for dual pyrethroid-receptor sites on a mosquito sodium channel[J]. Proc Natl Acad Sci USA, 2013, 110(29): 11785-11790. DOI:10.1073/pnas.1305118110 |
| [15] |
胡梦雪, 孙雪丽, 孙小红, 等. 淡色库蚊溴氰菊酯抗性与性别相关性分析[J]. 中国病原生物学杂志, 2016, 11(10): 913-916, 923. Hu MX, Sun XL, Sun XH, et al. The correlation between deltamethrin resistance and gender in Culex pipiens pallens[J]. J Pathog Biol, 2016, 11(10): 913-916, 923. DOI:10.13350/j.cjpb.161011 |
| [16] |
李士根. 不同品系及不同性别淡色库蚊非特异性酯酶活性比较[J]. 中国血吸虫病防治杂志, 2009, 21(4): 332-333. Li SG. Comparison of non-specific esterase activity in different strains and gender of Culex pipiens pallens[J]. Chin J Schisto Control, 2009, 21(4): 332-333. DOI:10.16250/j.32.1374.2009.04.008 |
| [17] |
李士根. 乙酰胆碱酯酶在不同品系和不同性别淡色库蚊的变化[J]. 中国媒介生物学及控制杂志, 2009, 20(4): 288-289. Li SG. The changes of acetylcholinesterase in different strains and gender of Culex pipiens pallens[J]. Chin J Vector Biol Control, 2009, 20(4): 288-289. |
 2023, Vol. 34
2023, Vol. 34


