扩展功能
文章信息
- 肖秋秋, 李威仪, 何珊, 程金芝, 彭哲慧, 吴家红
- XIAO Qiu-qiu, LI Wei-yi, HE Shan, CHENG Jin-zhi, PENG Zhe-hui, WU Jia-hong
- 白纹伊蚊胰岛素样肽基因的鉴定和时空表达分析
- Identification and spatiotemporal expression of the insulin-like peptide genes in Aedes albopictus
- 中国媒介生物学及控制杂志, 2023, 34(2): 204-211
- Chin J Vector Biol & Control, 2023, 34(2): 204-211
- 10.11853/j.issn.1003.8280.2023.02.010
-
文章历史
- 收稿日期: 2022-12-02
2 贵州医科大学公共卫生学院, 贵州 贵阳 550025
2 School of Public Health, Guizhou Medical University, Guiyang, Guizhou 550025, China
胰岛素样肽(insulin-like peptide,ILP)广泛存在于后生动物中,是一类可以调节包括发育、增殖、代谢和寿命等多种生理过程的激素超家族[1-4],是目前研究最多的肽类激素[5]。昆虫的ILPs前肽由信号肽和连续的B链、C链和A链组成,通过二硫键将A链和B链连接,对C链进行蛋白水解切割,从而加工成活性肽[5-7]。这些因子来源于大脑中的胰岛素产生细胞(insulin produce cell,IPC)[8-10],在营养物质的刺激下分泌到血淋巴,与胰岛素受体(insulin receptor,IR)结合激活胰岛素/胰岛素生长因子信号通路(insulin/insulin growth factor signaling,IIS),对昆虫的生长发育、繁殖和免疫等发挥重要作用[11-13]。当前,已在埃及伊蚊(Aedes aegypti)基因组中发现8个ILP序列(insulin-like peptides of Aedes aegypti,AaegILPs)[14-15],冈比亚按蚊(Anopheles gambiae)中有7个ILP序列(insulin-like peptides of Anopheles gambiae,AgILPs),编码5个蛋白[16],斯蒂芬按蚊(An. stephensi)中发现5个ILP序列(insulin-like peptides of An. stephensi,AsILPs)[17],尖音库蚊(Culex pipiens)中目前存在3个ILP序列[18],以上研究表明每种蚊虫均具有其特异的一套ILPs序列。研究显示ILPs具有时空表达差异且具有不同功能。例如,AaegILP2、5和6在各种组织均有表达,AaegILP1、3和8仅在头部特异性表达,AaegILP4和7仅在头部和卵巢富集[14]。AaegILP3调控新陈代谢和脂肪的储备[9],AaegILP4刺激卵巢产生卵黄沉积[19],AaegILP7和8在脂质稳态和卵巢发育中起关键作用[20]。
白纹伊蚊(Ae. albopictus)在我国分布范围广,是登革热的重要传播媒介。2016年,白纹伊蚊全基因组测序工作的完成[21],使得其基因功能研究成为可能。鉴于前述ILPs在昆虫体内具有重要作用,而白纹伊蚊在这个领域的研究尚属空白,故本研究利用埃及伊蚊ILPs序列信息,从白纹伊蚊全基因组数据库中获取ILPs同源基因序列,进行生物信息学分析,获得分子结构特征;设计特异引物,观察ILPs在白纹伊蚊不同发育时期和不同组织中的表达情况,最后探讨吸血对AalbILPs表达的影响。研究结果为进一步探讨白纹伊蚊ILPs的功能奠定基础。
1 材料与方法 1.1 蚊虫来源与饲养白纹伊蚊为2017年于贵州省安顺市野外采集于实验室饲养的蚊种,实验室饲养条件为:温度(25±1)℃,湿度(75±5)%,光周期(L∶D)为14 h∶10 h。幼虫喂食专用蚊幼虫饲料,购于广州佰昆生物科技有限公司。成蚊饲以10%白糖水,以ICR小鼠给予血餐。
1.2 主要试剂与仪器qPCR SYBR Green Master Mix和反转录试剂盒(Ⅲ 1 st Strand cDNA Synthesis SuperMix for qPCR)购于翌圣生物科技(上海)股份有限公司,Premix Ex Taq酶、胶回收试剂盒和pMDTM18-TVector Cloning Kit载体购于宝生物工程(大连)有限公司,ICR小鼠[斯贝福(北京)生物技术有限公司],微量高速冷冻离心机(广州吉迪仪器有限公司),NanoDrop Lite(美国Thermo Fisher Scientific),TRIzolTM LS试剂(InvitrogenTM),荧光定量PCR仪(美国ABI 7300),体视显微镜(重庆光电仪器有限公司),研磨仪(上海净信实业发展有限公司)。
1.3 白纹伊蚊ILPs(AalbILPs)序列识别和生物信息学分析运用埃及伊蚊ILPs基因(GenBank登录号:DQ845750.1、DQ845752.2、DQ845751.2、DQ845753.1、DQ845758.1、DQ845755.1、DQ845757.1、DQ845754.1)的核苷酸序列在Vectorbase网站(www.vectorbase.org)的白纹伊蚊全基因组数据库中利用BLAST做同源搜索。对获得的可能为AalbILPs序列使用SignalP 6.0(https://services.healthtech.dtu.dk/service.php?SignalP)进行信号肽预测。用MEGA 11.0软件包对2种伊蚊的ILPs基因同源序列进行同源性比对及ILPs酶活性位点的保守性分析。运用最大似然法(maximum likelihood,ML)构建ILPs系统发育树,Bootstrap值为1 000次。
1.4 总RNA提取和cDNA的合成取白纹伊蚊卵、4龄幼虫(以下简称幼虫)、蛹和5日龄雌雄成蚊(卵20粒/管,幼虫1条/管,雌雄蚊成蚊各1只/管);将雌蚊解剖为头部、脂肪体、中肠、胸部和卵巢等组织置于200 μl的Trizol试剂中,保存于-80 ℃备用(脂肪体3个/管、头部6个/管、胸部2个/管、中肠6个/管、卵巢6对/管),用Trizol法提取总RNA,按照反转录试剂盒说明书获取cDNA,-20 ℃保存。
1.5 引物设计与合成从Vectorbase数据库中下载白纹伊蚊ILPs基因和核糖体S6蛋白(ribosomal protein S6,RPS6)序列,采用Premier-BLAST(https://www.ncbi.nlm.nih.gov/tools/Primer-blast/index.cgi)分别设计大小在20 bp的引物,由生工生物工程(上海)股份有限公司合成,PCR引物序列见表 1。

|
以白纹伊蚊cDNA为模板,采用AalbILPs基因的引物进行PCR扩增,反应体系:Ex Taq酶10 μl,cDNA 2 μl,正、反向引物各1 μl,加ddH2O至总体积20 μl。反应条件:95 ℃ 3 min;95 ℃ 30 s、55 ℃ 30 s、72 ℃ 1 min,30个循环;75 ℃ 5 min。PCR产物经切胶回收后,与pMDTM18-TVector Cloning Kit载体连接,对阳性克隆进行测序,AalbILP7未检测到阳性克隆无法测序。对测序为阳性的克隆提取质粒为标准品,使用NanoDrop Lite测定浓度,按照公式:y(copies/μl)=[浓度(g/ml)/碱基数×660(g/mol)]×6.02×1023(copies/mol)计算拷贝数,并将质粒的拷贝数按照102~109进行稀释:进行实时荧光定量PCR(qRT-PCR),以y为循环阈值(cycle threshold,Ct),x为起始模板浓度的lg值,绘制AalbILPs基因扩增的标准曲线;AalbILPs的定量采用RPS6和AalbILPs基因双标准曲线法计算,以AalbILPs/RPS6的值定量AalbILPs的表达量。
1.7 白纹伊蚊AalbILPs基因时空表达以不同发育时期和不同组织的cDNA为模板,以RPS6为对照,对AalbILPs进行qRT-PCR。反应体系:预混液10 μl,正、反向引物各0.8 μl,cDNA模板2 μl,用ddH2O补足至20 μl。反应条件:95 ℃ 3 min;95 ℃ 10 s,55 ℃ 30 s,共40个循环,生物学重复为6个。结果采用双标准曲线法分析。
1.8 吸血对AalbILPs转录表达的影响第17代白纹伊蚊雌蚊羽化后第5天,给予ICR小鼠血餐2 h后,挑选饱腹蚊,继续喂食白糖水24 h。收集蚊虫,-20 ℃麻醉,先后在75%乙醇溶液和生理盐水中浸泡10 s,然后在体视显微镜下解剖卵巢、脂肪体、胸部、头部以及中肠,将各组织置于含有200 μl Trizol试剂的1.5 ml离心管中(脂肪体5个/管、头部6个/管、胸部3个/管、中肠2个/管、卵巢1对/管),-80 ℃保存备用,RNA提取、cDNA的合成和qRT-PCR同上。
1.9 统计学分析采用SPSS 20.0软件做数据统计分析,对白纹伊蚊不同时空AalbILPs表达进行单因素方差分析,并用Tukey’s HSD检验法进行多重比较;对同一日龄的吸血雌蚊不同组织AalbILPs表达数据做t检验。P < 0.05为差异有统计学意义。
1.10 伦理批准和患者知情同意书本研究通过贵州医科大学实验动物中心伦理委员会审查批准(批准号:1702198)。
2 结果 2.1 白纹伊蚊ILPs基因家族序列确认和氨基酸序列比分析运用埃及伊蚊8个ILPs基因的核苷酸序列在白纹伊蚊全基因组数据库搜索并识别出7条ILPs序列,分别命名为AalbILP1~7,对基因结构的分析见表 2和图 1。AalbILPs基因长度在670~1 501 bp,编码蛋白的氨基酸139~178个。除AalbILP6有2个内含子外,其余AalbILPs仅有1个内含子。7条基因序列均具有完整的开放阅读框(open reading frame,ORF)以及由具有胰岛素超家族特征的信号肽和连续的B、C和A链组成的前肽。7条ILPs序列存在6个保守的半胱氨酸残基,且在B链和A链之间形成二硫键。信号肽序列为21~34个氨基酸。B、C和A链通过C链侧翼的假定蛋白水解切割位点[单个或成对的碱性氨基酸:精氨酸(Arg)和赖氨酸(Lys)]来识别。AalbILP5在A链的第2和第3个半胱氨酸残基之间有1个额外氨基酸,AalbILP4和7在A链的第3和第4个半胱氨酸残基之间也有1个额外的氨基酸;AalbILP1、2和5的B链具有21~32个氨基酸的N端延伸。预测的C链长度为8~90个残基,其中AalbILP6的短C链具有胰岛素生长因子(insulin like growth factor,IGF)的特征。此外,在Vectorbase的RNA-seq转录数据库中,除AalbILP7未检测到外,其余基因均检测到14条记录。

|

|
| 注:白纹伊蚊胰岛素样肽的氨基酸比对,其前肽依次按信号肽、B链、C链和A链排列;相同的氨基酸以深蓝色突出显示,相似的氨基酸以淡蓝色突出显示。 图 1 白纹伊蚊胰岛素样肽氨基酸序列比对 Figure 1 Amino acid sequence alignment of insulin-like peptide in Aedes albopictus |
| |
系统发育分析表明AalbILP1~7均与AaegIPL1~7分别聚在同一分支中(图 2)。AalbILP1、2、3和5与埃及伊蚊、冈比亚按蚊和致倦库蚊(Cx. pipiens quinquefasciatus)的ILP1、2、3和5各自在一个置信度较高的分支中,为直系同源;AalbILP6仅与AaegILP6和致倦库蚊胰岛素样肽6(insulin-like peptides of Cx. pipiens quinquefasciatus,CqILP6)在同一分支中,为直系同源;AalbILP4和7与AaegILP4和7分别聚后再聚合在一个分支上,相似性高达73%,伊蚊属的ILP4和7为旁系同源。
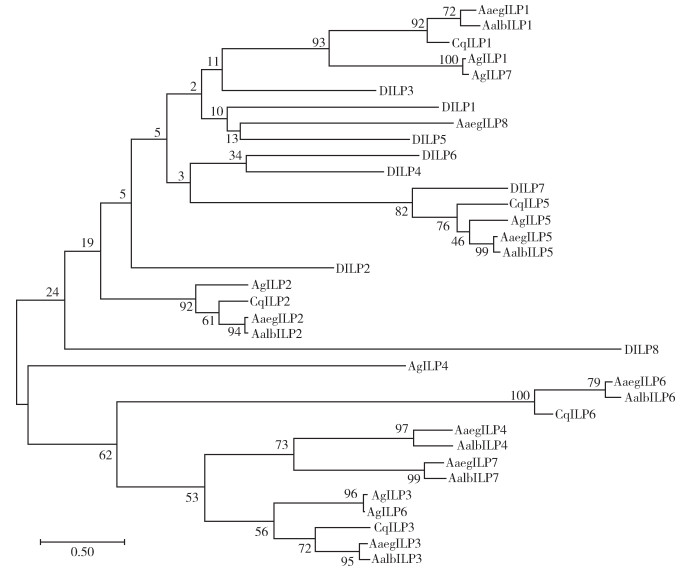
|
| 注:使用ClustalW比对生成的已知蚊虫胰岛素样肽的系统发育树和具有引导分析的进化树;Aaeg表示埃及伊蚊;Ag表示冈比亚按蚊;Aalb表示白纹伊蚊;D表示黑腹果蝇;Cq表示致倦库蚊。 图 2 白纹伊蚊胰岛素样肽的系统发育比较 Figure 2 Phylogenetic comparison of insulin-like peptides in Aedes albopictus |
| |
为了解AalbILPs基因的表达,利用qRT-PCR技术,对AalbILPs在各发育时期的表达情况进行分析(图 3)。其中AalbILP5的表达量是最高的,其次是AalbILP3和4,AalbILP6的表达最低。AalbILP1在卵、幼虫、蛹、雌蚊和雄蚊的相对表达量分别为0.004 1±0.001 6、0.003 2±0.002 0、0.013 3±0.001 7、0.013 2±0.002 5和0.042 7±0.017 2,多重比较发现雄蚊表达量最高(q卵=7.717,q幼虫=7.883,q蛹=5.862,q雌蚊=5.900,均P < 0.05),其次为雌蚊与蛹,卵与幼虫表达最低(图 3A);AalbILP2在卵、幼虫、蛹、雌蚊、雄蚊均有表达,相对表达量分别为0.009 0±0.003 8、0.011 3±0.003 5、0.032 5±0.009 3、0.025 7±0.001 0和0.049 5±0.018 9,多重比较发现雄蚊表达最高(q卵=5.994,q幼虫=5.640,q雌蚊=3.527,均P < 0.05;q蛹=2.516,P=0.119 图 3B);AalbILP3在卵、幼虫、蛹、雌蚊和雄蚊的相对表达量依次为0.003 9±0.001 7、0.017 7±0.006 2、0.016 7±0.011 4、0.091 8±0.045 6和0.111 0±0.045 1,多重比较发现雄蚊的表达最高(q卵=5.796,q幼虫=5.052,q蛹=5.106,均P < 0.01;q雌蚊=1.052,P=0.993,图 3C);AalbILP4在卵、幼虫、蛹、雌蚊和雄蚊的相对表达量依次为0.000 3±0.000 2、0.006 5±0.002 9、0.009 4±0.009 4、0.068 0±0.034 3和0.007 5±0.003 5,其中AalbILP4在雌蚊的转录明显高于雄蚊(q=5.957,P=0.009,图 3D);AalbILP5在卵、幼虫、蛹、雌蚊和雄蚊的相对表达量依次为0.048 5±0.010 0、0.208 0±0.048 5、0.280 0±0.107 0、0.737 0±0.387 0和1.358 3±0.576 9,在雄蚊的转录最高(q卵=6.572,q幼虫=5.771,q蛹=5.409,q雌蚊=3.115,均P < 0.05),其次为雌蚊(q卵=3.457,P=0.034;q幼虫=2.656,P=0.090;q蛹=2.294,P=0.180,图 3E);AalbILP6在卵、幼虫、蛹、雌蚊和雄蚊的相对表达量分别为0.000 1±0.000 1、0.000 5±0.000 1、0.000 6±0.000 4、0.001 2±0.001 3和0.002 3±0.000 8,在雌雄成蚊的表达差异无统计学意义(q=0.721,P=0.990,图 3F)。

|
| 注:柱上字母不同(a、b、c)表示经Tukey's HSD法多重比较后差异有统计学意义(P < 0.05);字母相同表示经Tukey's HSD法多重比较后差异无统计学意义(P > 0.05);A-F依次为AalbILP1~6。 图 3 白纹伊蚊胰岛素样肽在不同发育时期的表达 Figure 3 Expression of insulin-like peptide at different developmental stages of Aedes albopictus |
| |
收集白纹伊蚊5日龄雌蚊未吸血和吸血24 h时后的不同组织。与未吸血雌蚊相比,吸血24 h时,AalbILP1在头部、脂肪体以及中肠的表达分别上调10.33、6.07和3.79倍(t头部=4.255,P头部=0.001;t脂肪体=4.305,P脂肪体=0.001;t中肠=10.480,P中肠 < 0.001),胸部和卵巢的表达下降4.24和2.17倍(t胸部=7.922,P胸部 < 0.001;t卵巢=3.752,P卵巢=0.003,图 4A);AalbILP2在脂肪体的表达上调3.46倍(t脂肪体=3.211,P脂肪体=0.009,图 4B);AalbILP 3和4在头部特异性表达,吸血24 h时,AalbILP3和4在头部的表达上调2.60和1.68倍(tAalbILP3-头部=9.596,PAalbILP3-头部 < 0.001;tAalbILP4-头部=4.524,PAalbILP4-头部=0.001,图 4C、D);AalbILP5的表达在不同组织间差异无统计学意义;AalbILP6主要在卵巢表达,吸血24 h时,AalbILP6在中肠和卵巢的表达上调11.91和2.16倍(t中肠=5.799,P中肠 < 0.001;t卵巢=9.074,P卵巢 < 0.001,图 4F)。
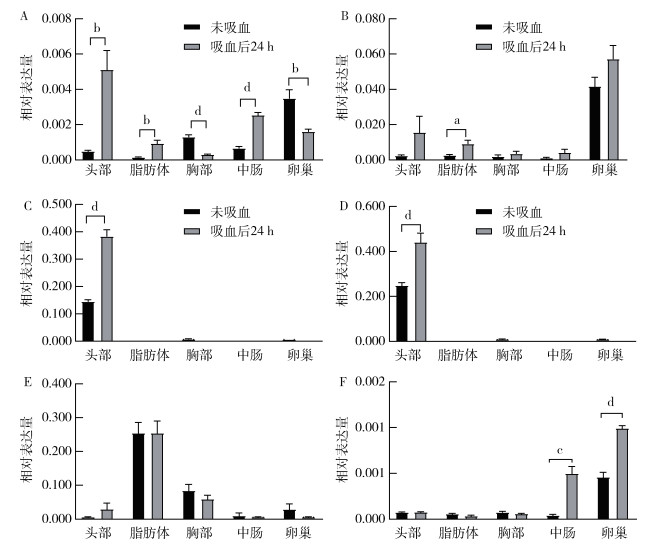
|
| 注:白纹伊蚊5日龄成蚊未吸血和吸血24 h后,AalbILPs在头部、脂肪体、中肠、卵巢和胸部的表达水平,数据有6个生物学重复;a P < 0.05;b P < 0.01;c P < 0.001;d P < 0.000 1;A-F依次为AalbILP1~6。 图 4 血餐对雌性白纹伊蚊不同组织中胰岛素样肽表达的影响 Figure 4 Effect of blood meal on insulin-like peptides expression of different tissues in female Aedes albopictus |
| |
本研究利用埃及伊蚊ILPs基因从白纹伊蚊全基因组数据库中共识别出7条含胰岛素超家族结构域的基因。生物信息学分析显示7条序列ORF框完整,表明这7条ILPs序列独立存在。通过搜寻RNA-seq转录数据库发现,除AalbILP7未检测到外,其余基因均检测到14条记录。同时,设计特异引物在白纹伊蚊卵、幼虫、蛹和雌雄成蚊进行qRT-PCR检测,均未检测到AalbILP7的转录本,故推测该基因为假基因。
系统进化树显示伊蚊属、按蚊属、库蚊属蚊虫的ILP1、2、3和5高度同源,表明这4个基因起源于同一个祖先,在蚊虫中高度保守。进一步分析显示,AalbILP3在雌蚊头部特异高表达。对AaegILP3的研究表明,其最类似哺乳动物的胰岛素,不仅调控蚊虫体内糖和脂的代谢[19-22],还刺激卵巢分泌蜕皮激素参与蚊虫卵巢的发育[23-24]。AgILP3与AsILP3参与蚊虫卵巢发育的功能也已被证实[12]。本研究发现血液可显著上调AalbILP3,间接说明AalbILP3可能参与蚊虫生殖。
AalbILP6与AaegILP6和CqILP6高度同源,均有1个短的C链和1个延长的A链,与脊椎动物的IGF结构相似[5]。AalbILP6与AaegILP6的C链上均有多个二元碱性蛋白水解位点(RRSHRRSKR),这与脊椎动物的IGF C链上仅有1个二元碱性蛋白水解位点是有差异的[14]。不同发育阶段中AalbILP6表达量较低,但在雌雄成蚊的表达显著高于其他阶段。雌蚊组织特异性表达显示AalbILP6在卵巢显著高表达,吸血可显著上调其在中肠和卵巢的表达。在高碳水化合物饮食条件下,雌蚊AaegILP6表达显著上调[21]。以上研究均表明ILP6可能参与调控蚊虫营养代谢。然而迄今尚未见任何关于蚊虫胰岛素样生长因子活性的报道,因此进一步研究其功能非常有必要。
AalbILP4仅与AaegILP4直系同源,且在A链的第3、4半胱氨酸残基之间均有1个额外的氨基酸,表明这2个基因是伊蚊属蚊虫特有的基因。本研究显示AalbILP4在不同发育阶段均有表达,但以雌蚊头部表达明显,吸血后明显上调表达,故推测AalbILP4可能与AaegILP4一样,通过胰岛素信号通路参与雌蚊卵巢的发育。然而对埃及伊蚊的研究发现尽管AaegILP4也在雌蚊高表达,但给以雄蚊高糖饮食,可调控其AaegILP4显著高表达[19],表明AaegILP4参与雄蚊的营养代谢。因此,AalbILP4的生物学功能还需进一步研究。
ILPs是一类功能多样的激素肽,其结构与功能一直是该研究领域的热点。已知哺乳动物胰岛素主要参与将血糖转化为多糖和脂类物质[25],因此目前昆虫胰岛素样肽的研究主要集中于对宿主营养代谢影响的研究。然而由于ILPs合成与纯化困难[20-26],严重制约了这一领域的发展。迄今蚊虫仅有少数ILPs的功能得到解析。本研究的发现将为白纹伊蚊ILPs在蚊虫营养代谢中的作用奠定基础。
利益冲突 无
| [1] |
Gao Y, Zhang XJ, Yuan JB, et al. CRISPR/Cas9-mediated mutation on an insulin-like peptide encoding gene affects the growth of the ridgetail white prawn Exopalaemon carinicauda[J]. Front Endocrinol (Lausanne), 2022, 13: 986491. DOI:10.3389/fendo.2022.986491 |
| [2] |
Defferrari MS, Da Silva SR, Orchard I, et al. A Rhodnius prolixus insulin receptor and its conserved intracellular signaling pathway and regulation of metabolism[J]. Front Endocrinol (Lausanne), 2018, 9: 745. DOI:10.3389/fendo.2018.00745 |
| [3] |
Chen ZN, Hendricks M, Cornils A, et al. Two insulin-like peptides antagonistically regulate aversive olfactory learning in C. elegans[J]. Neuron, 2013, 77(3): 572-585. DOI:10.1016/j.neuron.2012.11.025 |
| [4] |
Riehle MA, Brown MR. Insulin receptor expression during development and a reproductive cycle in the ovary of the mosquito Aedes aegypti[J]. Cell Tissue Res, 2002, 308(3): 409-420. DOI:10.1007/s00441-002-0561-8 |
| [5] |
Sharma A, Nuss AB, Gulia-Nuss M. Insulin-like peptide signaling in mosquitoes: The road behind and the road ahead[J]. Front Endocrinol (Lausanne), 2019, 10: 166. DOI:10.3389/fendo.2019.00166 |
| [6] |
Smit AB, Van Kesteren RE, Li KW, et al. Towards understanding the role of insulin in the brain: Lessons from insulin-related signaling systems in the invertebrate brain[J]. Prog Neurobiol, 1998, 54(1): 35-54. DOI:10.1016/s0301-0082(97)00063-4 |
| [7] |
Lu CX, Lam HN, Menon RK. New members of the insulin family: Regulators of metabolism, growth and now… reproduction[J]. Pediatr Res, 2005, 57(5 Pt 2): 70R-73R. DOI: 10.1203/01.PDR.0000159573.55187.CA.
|
| [8] |
Ohhara Y, Yamanaka N. Internal sensory neurons regulate stage-specific growth in Drosophila[J]. Development, 2022, 149(21): dev200440. DOI:10.1242/dev.200440 |
| [9] |
Gulia-Nuss M, Eum JH, Strand MR, et al. Ovary ecdysteroidogenic hormone activates egg maturation in the mosquito Georgecraigius atropalpus after adult eclosion or a blood meal[J]. J Exp Biol, 2012, 215(Pt 21): 3758-3767. DOI:10.1242/jeb.074617 |
| [10] |
Ling L, Raikhel AS. Serotonin signaling regulates insulin-like peptides for growth, reproduction, and metabolism in the disease vector Aedes aegypti[J]. Proc Natl Acad Sci USA, 2018, 115(42): E9822-E9831. DOI:10.1073/Pnas.1808243115 |
| [11] |
Li YJ, Fu HR, Zhang FQ, et al. Insulin-like peptide receptor-mediated signaling pathways orchestrate regulation of growth in the pacific oyster (Crassostrea gigas), as revealed by gene expression profiles[J]. Int J Mol Sci, 2021, 22(10): 5259. DOI:10.3390/ijms22105259 |
| [12] |
Nuss AB, Brown MR. Isolation of an insulin-like peptide from the Asian malaria mosquito, Anopheles stephensi, that acts as a steroidogenic gonadotropin across diverse mosquito taxa[J]. Gen Comp Endocrinol, 2018, 258: 140-148. DOI:10.1016/j.ygcen.2017.05.007 |
| [13] |
Nakai J, Chikamoto N, Fujimoto K, et al. Insulin and memory in invertebrates[J]. Front Behav Neurosci, 2022, 16: 882932. DOI:10.3389/fnbeh.2022.882932 |
| [14] |
Riehle MA, Fan YL, Cao C, et al. Molecular characterization of insulin-like peptides in the yellow fever mosquito, Aedes aegypti: Expression, cellular localization, and phylogeny[J]. Peptides, 2006, 27(11): 2547-2560. DOI:10.1016/j.peptides.2006.07.016 |
| [15] |
Ling L, Raikhel AS. Cross-talk of insulin-like peptides, juvenile hormone, and 20-hydroxyecdysone in regulation of metabolism in the mosquito Aedes aegypti[J]. Proc Natl Acad Sci USA, 2021, 118(6): e2023470118. DOI:10.1073/Pnas.2023470118 |
| [16] |
Pietri JE, Pietri EJ, Potts R, et al. Plasmodium falciparum suppresses the host immune response by inducing the synthesis of insulin-like peptides (ILPs) in the mosquito Anopheles stephensi[J]. Dev Comp Immunol, 2015, 53(1): 134-144. DOI:10.1016/j.dci.2015.06.012 |
| [17] |
Marquez AG, Pietri JE, Smithers HM, et al. Insulin-like peptides in the mosquito Anopheles stephensi: Identification and expression in response to diet and infection with Plasmodium falciparum[J]. Gen Comp Endocrinol, 2011, 173(2): 303-312. DOI:10.1016/j.ygcen.2011.06.005 |
| [18] |
Sim C, Denlinger DL. A shut-down in expression of an insulin-like peptide, ILP-1, halts ovarian maturation during the overwintering diapause of the mosquito Culex pipiens[J]. Insect Mol Biol, 2009, 18(3): 325-332. DOI:10.1111/j.1365-2583.2009.00872.x |
| [19] |
Pooraiiouby R, Sharma A, Beard J, et al. Nutritional quality during development alters insulin-like peptides' expression and physiology of the adult yellow fever mosquito, Aedes aegypti[J]. Insects, 2018, 9(3): 110. DOI:10.3390/insects9030110 |
| [20] |
Wen ZM, Gulia M, Clark KD, et al. Two insulin-like peptide family members from the mosquito Aedes aegypti exhibit differential biological and receptor binding activities[J]. Mol Cell Endocrinol, 2010, 328(1/2): 47-55. DOI:10.1016/j.mce.2010.07.003 |
| [21] |
Zhang HD, Xing D, Wang G, et al. Sequencing and analysis of the complete mitochondrial genome of Aedes albopictus (Diptera: Culicidae) in China[J]. Mitochondrial DNA A DNA Mapp Seq Anal, 2016, 27(4): 2787-2788. DOI:10.3109/19401736.2015.1053067 |
| [22] |
Dou XY, Chen KK, Brown MR, et al. Multiple endocrine factors regulate nutrient mobilization and storage in Aedes aegypti during a gonadotrophic cycle[J]. Insect Sci, 2022, 0: 1-18. DOI:10.1111/1744-7917.13110 |
| [23] |
Martinson EO, Chen KK, Valzania L, et al. Insulin-like peptide 3 stimulates hemocytes to proliferate in anautogenous and facultatively autogenous mosquitoes[J]. J Exp Biol, 2022, 225(5): jeb243460. DOI:10.1242/jeb.243460 |
| [24] |
Valzania L, Mattee MT, Strand MR, et al. Blood feeding activates the vitellogenic stage of oogenesis in the mosquito Aedes aegypti through inhibition of glycogen synthase kinase 3 by the insulin and TOR pathways[J]. Dev Biol, 2019, 454(1): 85-95. DOI:10.1016/j.ydbio.2019.05.011 |
| [25] |
Okawa ER, Gupta MK, Kahraman S, et al. Essential roles of insulin and IGF-1 receptors during embryonic lineage development[J]. Mol Metab, 2021, 47: 101164. DOI:10.1016/j.molmet.2021.101164 |
| [26] |
Riehle MA, Brown MR. Molecular analysis of the serine/threonine kinase Akt and its expression in the mosquito Aedes aegypti[J]. Insect Mol Biol, 2003, 12(3): 225-232. DOI:10.1046/j.1365-2583.2003.00405.x |
 2023, Vol. 34
2023, Vol. 34


