扩展功能
文章信息
- 华栋栋, 王磊, 肖迪, 李文玉, 周欣欣, 伦辛畅, 母群征, 刘起勇, 马伟, 孟凤霞
- HUA Dong-dong, WANG Lei, XIAO Di, LI Wen-yu, ZHOU Xin-xin, LUN Xin-chang, MU Qun-zheng, LIU Qi-yong, MA Wei, MENG Feng-xia
- 白纹伊蚊昌平种群高效氯氰菊酯抗性的比较蛋白质组学研究
- A comparative proteomics analysis of beta-cypermethrin resistance in Aedes albopictus population in Changping, Beijing, China
- 中国媒介生物学及控制杂志, 2023, 34(2): 196-203
- Chin J Vector Biol & Control, 2023, 34(2): 196-203
- 10.11853/j.issn.1003.8280.2023.02.009
-
文章历史
- 收稿日期: 2022-11-28
2 中国疾病预防控制中心传染病预防控制所 媒介生物控制室, 传染病预防控制国家重点实验室, 北京 102206
2 State Key Laboratory of Infectious Disease Prevention and Control, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
白纹伊蚊(Aedes albopictus)广泛分布在全球热带、亚热带和温带地区,在我国26个省份均有分布,能够传播登革热、基孔肯雅热和寨卡病毒病等多种疾病[1],是我国广东、云南等东南沿海地区本地登革热暴发的主要传播媒介[2],在我国乃至全球造成了重大公共卫生问题。登革热的预防主要通过控制白纹伊蚊的数量及密度。因拟除虫菊酯类杀虫剂高效低毒的特点,被广泛应用于我国白纹伊蚊的防制工作[3],导致白纹伊蚊对拟除虫菊酯类杀虫剂产生了抗药性。中国农药信息网登记在册的公共环境用产品中有效成分共有46种,其中高效氯氰菊酯登记数量最多[4-5]。据赵春春等[6]2020年对中国13个省份白纹伊蚊抗药性监测数据分析研究显示,白纹伊蚊成蚊对拟除虫菊酯类杀虫剂均已产生较为严重的抗药性,63个白纹伊蚊成蚊高效氯氰菊酯抗性监测点中有87.30%的监测点产生了抗药性。
白纹伊蚊抗药性机制主要分为行为抗性、靶标抗性和代谢抗性[7-9]。行为抗性是指蚊虫对杀虫剂产生逃避或拒食等行为,能够更容易地适应环境而存活的反应;靶标抗性又称击倒抗性,与杀虫剂作用的靶标位点敏感度下降有关,主要靶标位点有神经轴突钠离子通道(sodium channel,SC)、乙酰胆碱酯酶(Acetylcholinesterase,AChE)和γ-氨基丁酸受体氯离子通道(γ-aminobutyric,GABA);代谢抗性是蚊虫在接触杀虫剂时,在药剂作用下体内代谢酶的含量迅速增加,或者其活性迅速强化,对外来化合物的解毒作用增强、代谢速度加快,从而抑制或抵抗外源物质伤害的机制。
本研究对北京市昌平区白纹伊蚊高效氯氰菊酯敏感个体与抗性个体的蛋白液进行提取,采用Label-free质谱技术进行分析,通过比较蛋白质组学研究,在代谢抗性层面揭示白纹伊蚊的抗药性机制,并寻找潜在标志蛋白,在蛋白质水平上为今后白纹伊蚊抗药性监测提供线索,并为白纹伊蚊防制工作提供用药指导及提出合理化的建议。
1 材料与方法 1.1 试虫于2021年8月,在北京市昌平区某单位办公区室外的小型净水容器中(人工容器和排水沟)采集白纹伊蚊幼虫,在温度(26±1)℃、湿度(75±5)%、光周期(L∶D)14 h∶10 h的条件下,饲养1~2代,采用成蚊接触筒法,筛选出敏感个体和抗性个体,冻存于-70 ℃冰箱备用。
敏感个体:白纹伊蚊雌性成蚊在实验室JS-SUS敏感品系半数致死浓度(LC50)值(0.03%高效氯氰菊酯药膜)[10]下,接触杀虫剂药膜1 h内死亡的个体。
抗性个体:将接触诊断剂量[6]高效氯氰菊酯(0.08%)药膜1 h,转移至恢复筒内,24 h后仍存活的白纹伊蚊雌性成蚊作为抗性个体。
1.2 试剂 1.2.1 杀虫剂95.8%高效氯氰菊酯(江苏扬农化工股份有限公司生产),参考《蚊类抗药性及其测定》方法制作药膜。
1.2.2 主要试剂Solarbio BCA试剂盒,肽段定量试剂盒(Thermo Fisher Scientific,USA),RNeasy总RNA纯化mini试剂盒[购自凯杰企业管理(上海)有限公司],SYBR qPCR Master Mix试剂盒(购自南京诺维赞试剂公司)等。
1.3 敏感个体与抗性个体筛选 1.3.1 生物学测定采用世界卫生组织(WHO)推荐的成蚊接触筒法[6]。分别用0.03%高效氯氰菊酯药膜和0.08%高效氯氰菊酯药膜筛选敏感和抗性个体,每只恢复筒内放置20只左右的Ⅲ~Ⅴ日龄雌性成蚊。针对0.03%高效氯氰菊酯处理组,记录接触1 h后的死亡试虫数,并将死亡试虫按5只/管冻存于-70 ℃的冰箱备用。针对0.08%的高效氯氰菊酯处理组,在接触1 h后,将试虫吹回恢复筒,相同环境条件下供给10%葡萄糖溶液,24 h后记录存活试虫数,并将存活个体转移至1.5 ml离心管中,于-70 ℃冰箱冻存备用。处理组重复6次,对照组重复3次。
1.3.2 死亡判定标准试虫完全不动或仅足、翅、躯体等轻微震颤,无法爬行或起飞,判定死亡。
1.4 质谱样品前处理 1.4.1 蛋白提取和定量分别取敏感个体与抗性个体各10只,放入1.5 ml的离心管,1只/管,每管加入10颗左右的磁珠、100 μl的磷酸盐缓冲液(PBS),用电动组织研磨器研磨匀浆6 min后,于4 ℃、12 470×g高速离心15 min。取上清液于新的离心管中,使用浓缩旋转仪(美国LABCONCO)旋干。旋干后加入50 μl 8 mol/L尿素溶液复溶并进行蛋白定量。
1.4.2 溶液酶解向样品中加入终浓度10 mmol/L三膦(2-羟乙基,TCEP)室温还原1 h后,加入18.75 mmol/L碘乙酰胺(IAA)避光烷基化反应30 min。向100 μl 50 mmol/L NH4HCO3中加入20 μg胰酶溶解,每个样品中加入5 μl胰酶溶液,37 ℃酶解过夜。
1.4.3 肽段除盐和定量向样品中加入10%的三氟乙酸(TFA)至终浓度为0.4%,终止酶解反应,使用C18除盐柱纯化肽段,并用肽段定量试剂盒进行定量。
1.5 高效液相色谱串联质谱分析(LC-MS/MS)取1 μg样品肽段,使用EASY-nLC1000液相色谱仪(美国赛默飞公司)进行色谱分离。流动相为A相(1%甲酸溶液)和B相(0.1%甲酸、80%乙腈溶液)。色谱柱:预柱PepMap 100,nanoViper C18,100 Å,5 μm,100 μm×2 cm;分析柱PepMap 100,nanoViper C18,100 Å,3 μm,75 μm×25 cm。液相梯度为0~2 min,2%~8%B;2~112 min,8%~32%B;112~114 min,32%~95%B;114~120 min,95%B。使用Q ExactiveTMPlus质谱仪(美国赛默飞公司)采集质谱。参数设置:一级分辨率70 000,离子目标值3×106,最大离子注入时间50 ms,扫描范围300~1 800 m/z,二级分辨率17 500,离子目标值5×104,最大离子注入时间为45 ms,动态排除时间45 s。使用Xcalibur version 4.1软件进行谱图采集、记录。每个样本采集3次。
1.6 数据分析 1.6.1 白纹伊蚊质谱数据库搜索应用Proteome Discoverer 2.4软件进行数据库搜索,所用数据库为美国国立生物技术信息中心(NCBI)白纹伊蚊数据库(https://www.ncbi.nlm.nih.gov/protein/),包括41 203条蛋白序列。参数设置:半胱氨酸烷基化修饰为固定修饰,蛋氨酸氧化为可变修饰,漏切位点为2个,子离子偏差0.02 Da。
1.6.2 蛋白质生物信息学分析将白纹伊蚊10只抗性个体和10只敏感个体的蛋白质数据各作为一组,使用R 4.0.5软件进行生物信息学分析,其中缺失值处理采用K近邻(KNN)法,缺失值所占比例≥50%的数据不纳入分析。差异表达蛋白筛选标准为:差异表达倍数(FC) > 2.0。对差异蛋白用hcluster法进行聚类分析。将定量到的差异蛋白利用基因本体论(gene ontology,GO)数据库(http://geneontology.org/)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)数据库(https://www.genome.jp/kegg/)进行GO功能注释和KEGG通路分析,采用BH方法进行多重检验,校正P值(FDR) < 0.05为差异表达有统计学意义的KEGG通路。
1.7 差异蛋白的验证 1.7.1 RNA提取取白纹伊蚊昌平种群抗性个体与敏感个体各20只,分装于4只1.5 ml离心管内提取RNA,使用RNeasy总RNA纯化mini试剂盒进行反转录。
1.7.2 实时荧光定量PCR(qRT-PCR)选择在抗性个体中上调表达的8种蛋白质进行验证。在NCBI网站上查找表达目的蛋白的mRNA序列,并在生工生物工程平台上(https://www.sangon.com/)设计表达目的基因的引物,选择β-actin作为内参基因[11-13],内参基因的引物设计参考一项关于淡色库蚊(Culex pipiens pallens)的比较蛋白质组学研究[14],引物由生工生物工程(上海)股份有限公司合成,引物设计见表 1。采用SYBR-Green RT-qPCR法,对筛选到的差异蛋白进行验证。
0.03%高效氯氰菊酯组的白纹伊蚊接触药膜纸1 h,对照组死亡率为0,实验组死亡率为(34.45±7.75)%。0.08%高效氯氰菊酯组的白纹伊蚊接触药膜纸1 h后,转移至培养箱内饲养24 h,实验组存活率为(64.61±8.92)%。见表 2。
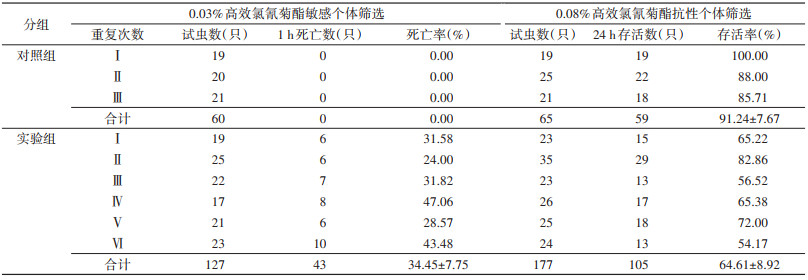
|
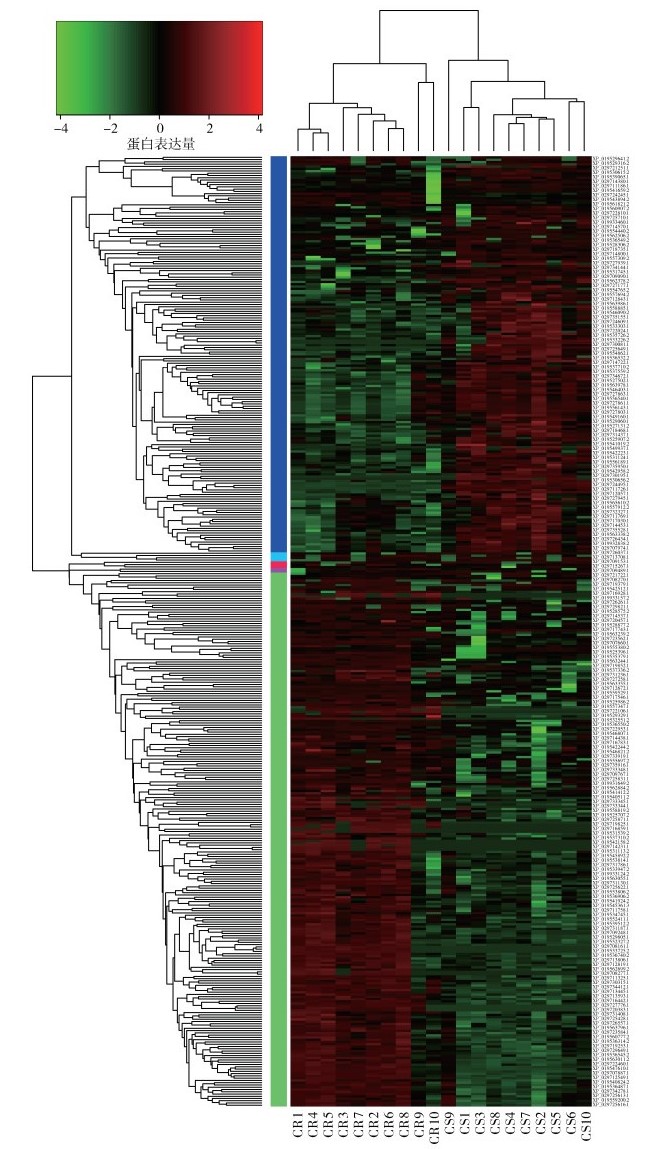
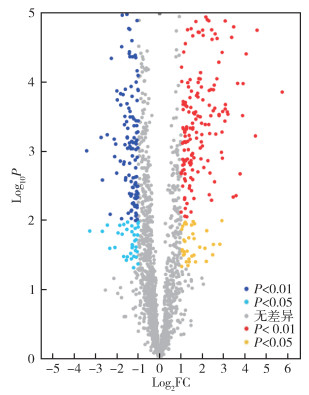
通过Label-free法对白纹伊蚊昌平种群高效氯氰菊酯抗性个体鉴定到1 861个蛋白,层聚类分析见图 1。其中抗性个体与敏感个体差异表达蛋白有383个,在抗性个体上调表达的有213个,在总蛋白数中占比为11.61%;下调表达的有170个,占比9.13%。见图 2。
|
| 注:横坐标为样本中不同个体,纵坐标为鉴定到的差异表达蛋白号。 图 1 白纹伊蚊敏感个体与抗性个体差异蛋白表达模式聚类图 Figure 1 Heatmap of differentially expressed proteins between sensitive and resistant individuals of Aedes albopictus |
| |
|
| 注:FC差异表达倍数。 图 2 白纹伊蚊高效氯氰菊酯抗性个体和敏感个体差异表达蛋白火山图 Figure 2 Volcano plot of differentially expressed proteins between sensitive and resistant individuals of Aedes albopictus |
| |
对白纹伊蚊抗性个体和敏感个体的上调和下调表达蛋白,进行GO富集分析,分别从生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecular function,MF)3个层面进行功能注释,17组属于生物过程功能,其中上调表达蛋白为547个,下调表达蛋白为193个;2组属于细胞组分,其中上调表达蛋白为206个,下调表达蛋白为141个;11组属于分子功能,其中上调表达蛋白314个,下调表达蛋白167个。参与生物过程功能的差异表达蛋白中,上调表达蛋白数量最多的是代谢过程,下调表达蛋白数量最多的是细胞过程(cellullar process,CP);在分子功能中上调表达蛋白数量最多的是催化功能(catalytic),下调表达数量最多的是结合(binding)活性;在细胞组分功能中,差异表达蛋白数量最多的是细胞解剖体(cellular anatomical entity)。见表 3。

|
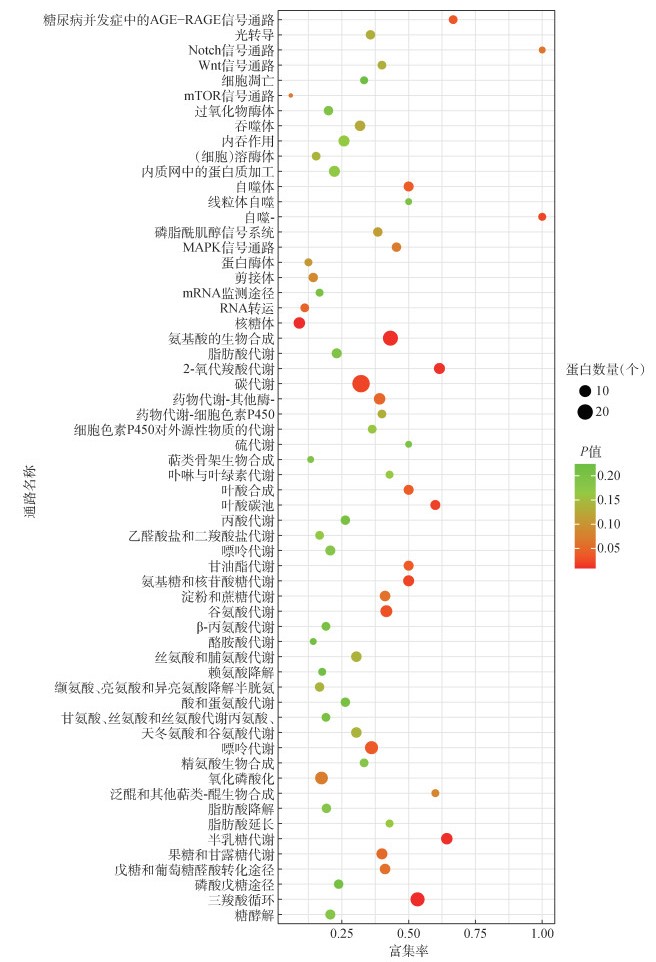
如图 3所示,对所有差异表达的蛋白进行通路富集,差异表达蛋白的KEGG通路分为细胞过程、环境信息处理(environmental information processing,EIP)、遗传信息处理(genetic information processing,GIP)、人类疾病(human diseases,HD)、代谢(metabolism)、有机系统(organismal systems,OS)等分类功能,其中富集显著的有核糖体通路、柠檬酸循环通路、半乳糖代谢通路、氨基酸的生物合成通路和2-氧羧酸代谢通路等。
|
| 图 3 白纹伊蚊抗性个体与敏感个体差异表达蛋白京都基因与基因组百科全书(KEGG)富集气泡图 Figure 3 Bubble plot of KEGG pathway enrichment of differentially expressed proteins between sensitive and resistant individuals of Aedes albopictus |
| |
选择差异富集显著性P < 0.05的功能通路中与药物代谢相关的8个上调表达蛋白:丙氨酸氨基转移酶(XP_029711752.1)、谷胱甘肽S-转移酶(GST)(XP_029709248.1)、尿苷酸-胞苷酸(UMP-CMP)激酶(XP_019543894.2)、GST X3亚型(XP_029717362.1)、GMP激酶(XP_029716679.1)、肌苷-5′-单磷酸脱氢样酶(XP_029732999.1)、谷胱甘肽S-转移酶1-1类(XP_019532551.2)和谷胱甘肽S-转移酶1类(XP_029709491.1)。在mRNA水平上进行验证,其中相对表达量最高的蛋白是丙氨酸氨基转移酶(XP_029711752.1),其次是谷胱甘肽S-转移酶1类(XP_029709491.1)、谷胱甘肽S-转移酶1-1类(XP_019532551.2)和UMP-CMP激酶(XP_019543894.2)。见表 4。
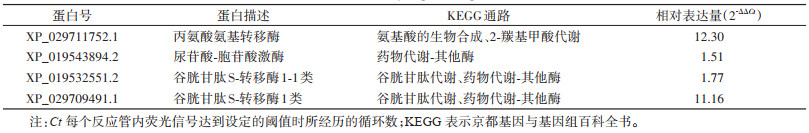
|
在白纹伊蚊抗药性机制中,参与代谢抗性的酶系主要有GST、多功能氧化酶(mixed-function oxidase,MFO)和非特异性酯酶(non-specific esterase,NSE)等。
GST是催化还原性谷胱甘肽与具有亲电子基团的化合物进行共轭反应的一类酶,在昆虫对杀虫剂的解毒中起着重要的作用[15]。对蚊虫研究发现,蚊虫体内有30多个GST基因,通过选择性剪接产生能作用于不同底物的特异性GST[16]。在埃及伊蚊(Ae. aegypti)中,GSTE5和GSTE7基因与敏感个体相比在抗性个体上调表达[17]。GST在其他昆虫体内也发挥抗药性作用:qRT-PCR结果显示在朱砂叶螨(Tetranychus cinnabarinus)抗性个体内GST表达水平增加[18];一项对褐飞虱[Nilaparvata lugens(Stal)]的研究表明,褐飞虱体内的几个关键GST基因参与对化学物质的解毒机制[19];吡虫啉处理过的蚜虫体内,验证到5个GST目的基因中有3个上调表达[20]。本研究发现谷胱甘肽S-转移酶1类(XP_029709491.1)、谷胱甘肽S-转移酶1-1类(XP_019532551.2)在白纹伊蚊抗性个体有上调表达,提示该酶可能与白纹伊蚊的抗药性有关。
本研究还发现,丙氨酸氨基转移酶在白纹伊蚊抗性个体有上调表达。丙氨酸氨基转移酶在生物体组织损伤时,催化L-丙氨酸的氨基转移到α-酮戊二酸,疟原虫侵入按蚊体内时,其体内的丙氨酸氨基转移酶浓度升高[21],提示丙氨酸氨基转移酶参与按蚊体内对外来微生物的免疫防御机制。丙氨酸氨基转移酶在蚊虫吸血后的营养繁殖周环中发挥作用,针对埃及伊蚊的研究发现,丙氨酸氨基转移酶能加快蚊虫的血食代谢以及尿酸和氮废物的排泄[22],抗性个体在杀虫剂作用下对食物的消化能力增强,能降低对生长发育的影响,使抗性个体的适合度提升。
有研究表明,UMP-CMP激酶在黑腹果蝇(Drosophila melanogaster)的整个发育过程中持续性表达,在RNA合成过程中能够将嘌呤和嘧啶进行磷酸化[23]。在感染日本脑炎病毒和西尼罗病毒的淡色库蚊体内UMP-CMP激酶上调表达[24],本研究发现在白纹伊蚊昌平种群抗性个体中UMP-CMP激酶上调表达。
有关白纹伊蚊抗药性分子机制研究进展表明[25],参与白纹伊蚊代谢抗性机制的酶类还有P450酶系和各类酯酶(ESTs),一项对马来西亚埃及伊蚊的调查结果表明,在抗性种群中与解毒作用有关的基因CYP9J27、CYP6CB1、CYP9J26和CYP9M4上调表达;P450酶系中参与代谢抗性的主要是CYP9、CYP6和CYP4家族[26-28]。羧酸酯酶(CCEs)可以通过螯合作用产生抗药性,羧酸酯酶活性的增加与伊蚊对拟除虫菊酯药物的抗性有关[29]。这提示可以通过进一步的实验继续挖掘、验证白纹伊蚊体内其他参与代谢抗性机制的酶类。
现在针对蚊虫抗药性的判断主要通过生物学测定、核酸测序等手段,代谢抗性评判从蛋白水平上为抗药性监测提供了新的方向,本研究选择了昌平种群白纹伊蚊,今后可以适当扩大样本量、增加样本采集地点,充分利用LC-MS/MS方法的高分辨率、高灵敏度等特点,重复实验,发现新的可能与代谢抗性相关的酶、对筛选到的抗性相关蛋白进行验证,为抗药性监测工作提供理论与技术支持。
利益冲突 无
| [1] |
Paupy C, Ollomo B, Kamgang B, et al. Comparative role of Aedes albopictus and Ae. aegypti in the emergence of dengue and Chikungunya in central Africa[J]. Vector Borne Zoonotic Dis, 2010, 10(3): 259-266. DOI:10.1089/vbz.2009.0005 |
| [2] |
Su XH, Guo YJ, Deng JL, et al. Fast emerging insecticide resistance in Aedes albopictus in Guangzhou, China: Alarm to the dengue epidemic[J]. PLoS Negl Trop Dis, 2019, 16, 13(9): e0007665. DOI:10.1371/journal.pntd.0007665 |
| [3] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [4] |
陈澄宇, 史雪岩, 髙希武. 昆虫对拟除虫菊酯类杀虫剂的代谢抗性机制研究进展[J]. 农药学学报, 2016, 18(5): 545-555. Chen CY, Shi XY, Gao XW. Mechanism of insect metabolic resistance to pyrethroid insecticides[J]. Chin J Pestic Sci, 2016, 18(5): 545-555. DOI:10.16801/j.issn.1008-7303.2016.0078 |
| [5] |
王以燕, 姜志宽. 我国公共卫生用农药的发展及应用概况[J]. 中国媒介生物学及控制杂志, 2016, 27(5): 421-425. Wang YY, Jiang ZK. Development and application of public health pesticides in China, 2013-2016[J]. Chin J Vector Biol Control, 2016, 27(5): 421-425. DOI:10.11853/j.issn.1003.8280.2016.05.001 |
| [6] |
赵春春, 周欣欣, 李文玉, 等. 2020年中国13省份登革热媒介白纹伊蚊抗药性监测及分析研究[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 30-37. Zhao CC, Zhou XX, Li WY, et al. Insecticide resistance surveillance and characteristic analysis of dengue vector Aedes albopictus in 13 provinces of China in 2020[J]. Chin J Vector Biol Control, 2022, 33(1): 30-37. DOI:10.11853/j.issn.1003.8280.2022.01.006 |
| [7] |
朱江, 邱星辉. 昆虫抗药性相关细胞色素P450基因的表达调控机制[J]. 昆虫学报, 2021, 64(1): 109-120. Zhu J, Qiu XH. Molecular mechanisms of expression regulation of insect cytochrome P450 genes involved in insecticide resistance[J]. Acta Entomol Sin, 2021, 64(1): 109-120. DOI:10.16380/j.kcxb.2021.01.012 |
| [8] |
Ibrahim SS, Riveron JM, Bibby J, et al. Allelic variation of cytochrome P450s drives resistance to bednet insecticides in a major malaria vector[J]. PLoS Genet, 2015, 11(10): e1005618. DOI:10.1371/journal.pgen.1005618 |
| [9] |
Coetzee M, Koekemoer LL. Molecular systematics and insecticide resistance in the major African malaria vector Anopheles funestus[J]. Annu Rev Entomol, 2013, 58: 393-412. DOI:10.1146/annurev-ento-120811-153628 |
| [10] |
王义冠. 我国登革热媒介伊蚊抗药性监测及抗性数据分析[D]. 北京: 中国疾病预防控制中心, 2016. Wang YG. Insecticides resistance surveillance for dengue vector Aedes in China and data analyses[D]. Beijing: Chinese Center for Disease Control and Prevention, 2016. (in Chinese) |
| [11] |
焦健华, 马磊, 张东辉. 白纹伊蚊β-肌动蛋白基因片段的克隆及其作为基因表达内参照的应用[J]. 中国病原生物学杂志, 2007, 2(6): 454-456. Jiao JH, Ma L, Zhang DH. Cloning and sequences of Aedes albopictus β-actin gene fragment and its application as an internal control[J]. J Pathogen Biol, 2007, 2(6): 454-456. DOI:10.13350/j.cjpb.2007.06.018 |
| [12] |
Vannini L, Reed TW, Willis JH. Temporal and spatial expression of cuticular proteins of Anopheles gambiae implicated in insecticide resistance or differentiation of M/S incipient species[J]. Parasit Vectors, 2014, 7: 24. DOI:10.1186/1756-3305-7-24 |
| [13] |
Hemingway J, Hawkes NJ, Mccarroll L, et al. The molecular basis of insecticide resistance in mosquitoes[J]. Insect Biochem Mol Biol, 2004, 34(7): 653-665. DOI:10.1016/j.ibmb.2004.03.018 |
| [14] |
王卫杰. 淡色库蚊抗药性比较蛋白质组学研究[D]. 南京: 南京医科大学, 2014. Wang WJ. A comparative proteomic study on insecticide resistance in the mosquito of Culex pipiens pallens[D]. Nanjing: Nanjing Medical University, 2014. (in Chinese) |
| [15] |
陈凤菊, 高希武, 雷明庆, 等. 单宁酸对棉铃虫谷胱甘肽S-转移酶的影响[J]. 昆虫学报, 2003, 46(6): 684-690. Chen FJ, Gao XW, Lei MQ, et al. Effects of tannic acid on glutathione S-transferases in Helicoverpa armigera (Hübner)[J]. Acta Entomol Sin, 2003, 46(6): 684-690. DOI:10.16380/j.kcxb.2003.06.004 |
| [16] |
Ranson H, Hemingway J. Mosquito glutathione transferases[J]. Methods Enzymol, 2005, 401: 226-241. DOI:10.1016/S0076-6879(05)01014-1 |
| [17] |
Lumjuan N, Rajatileka S, Changsom D, et al. The role of the Aedes aegypti epsilon glutathione transferases in conferring resistance to DDT and pyrethroid insecticides[J]. Insect Biochem Mol Biol, 2011, 41(3): 203-209. DOI:10.1016/j.ibmb.2010.12.005 |
| [18] |
Luo YJ, Yang ZG, Xie DY, et al. Molecular cloning and expression of glutathione S-transferases involved in propargite resistance of the carmine spider mite, Tetranychus cinnabarinus (Boisduval)[J]. Pestic Biochem Physiol, 2014, 114: 44-51. DOI:10.1016/j.pestbp.2014.07.004 |
| [19] |
Yang J, Kong XD, Zhu-Salzman K, et al. The key glutathione S-transferase family genes involved in the detoxification of rice gramine in Brown Planthopper Nilaparvata lugens[J]. Insects, 2021, 12(12): 1055. DOI:10.3390/insects12121055 |
| [20] |
Yang YX, Lin RH, Li Z, et al. Function analysis of P450 and GST genes to imidacloprid in Aphis craccivora (Koch)[J]. Front Physiol, 2021, 11: 624287. DOI:10.3389/fphys.2020.624287 |
| [21] |
Alvarado-Delgado A, Perales Ortiz G, Tello-López AT, et al. Infection with Plasmodium berghei ookinetes alters protein expression in the brain of Anopheles albimanus mosquitoes[J]. Parasit Vectors, 2016, 9(1): 542. DOI:10.1186/s13071-016-1830-9 |
| [22] |
Mazzalupo S, Isoe J, Belloni V, et al. Effective disposal of nitrogen waste in blood-fed Aedes aegypti mosquitoes requires alanine aminotransferase[J]. FASEB J, 2016, 30(1): 111-120. DOI:10.1096/fj.15-277087 |
| [23] |
Curbo S, Amiri M, Foroogh F, et al. The Drosophila melanogaster UMP-CMP kinase cDNA encodes an N-terminal mitochondrial import signal[J]. Biochem Biophys Res Commun, 2003, 311(2): 440-445. DOI:10.1016/j.bbrc.2003.10.018 |
| [24] |
Besson B, Basset J, Gatellier S, et al. Comparison of a human neuronal model proteome upon Japanese encephalitis or West Nile virus infection and potential role of mosquito saliva in neuropathogenesis[J]. PLoS One, 2020, 15(5): e0232585. DOI:10.1371/journal.pone.0232585 |
| [25] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. DOI:10.3969/j.issn.1005-0507.2019.03.009 |
| [26] |
Pan J, Yang C, Liu Y, et al. Novel cytochrome P450 (CYP6D1) and voltage sensitive sodium channel (Vssc) alleles of the house fly (Musca domestica) and their roles in pyrethroid resistance[J]. Pest Manag Sci, 2018, 74(4): 978-986. DOI:10.1002/ps.4798 |
| [27] |
Scott JG. Evolution of resistance to pyrethroid insecticides in Musca domestica[J]. Pest Manag Sci, 2017, 73(4): 716-722. DOI:10.1002/ps.4328 |
| [28] |
Ishak IH, Kamgang B, Ibrahim SS, et al. Pyrethroid resistance in Malaysian populations of dengue vector Aedes aegypti is mediated by CYP9 family of cytochrome P450 genes[J]. PLoS Negl Trop Dis, 2017, 11(1): e0005302. DOI:10.1371/journal.pntd.0005302 |
| [29] |
Marcombe S, Fustec B, Cattel J, et al. Distribution of insecticide resistance and mechanisms involved in the arbovirus vector Aedes aegypti in Laos and implication for vector control[J]. PLoS Negl Trop Dis, 2019, 13(12): e0007852. DOI:10.1371/journal.pntd.0007852 |
 2023, Vol. 34
2023, Vol. 34



