扩展功能
文章信息
- 吕文祥, 程鹏, 类晶晶, 郭秀霞, 王海防, 公茂庆, 刘丽娟
- LYU Wen-xiang, CHENG Peng, LEI Jing-jing, GUO Xiu-xia, WANG Hai-fang, GONG Mao-qing, LIU Li-juan
- 嗜水气单胞菌对淡色库蚊转录组和代谢组的影响
- Effect of Aeromonas hydrophila on the transcriptome and metabolome of Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2023, 34(2): 189-195
- Chin J Vector Biol & Control, 2023, 34(2): 189-195
- 10.11853/j.issn.1003.8280.2023.02.008
-
文章历史
- 收稿日期: 2022-11-04
淡色库蚊(Culex pipiens pallens)是一种重要的医学媒介昆虫,在中国分布于北纬33°以北地区[1],主要孳生于人类居住地附近污染的积水中,成蚊具有越冬的习性[2]。淡色库蚊可传播流行性乙型脑炎、丝虫病等多种疾病[3-4],给人类健康造成很大危害。目前防控蚊虫应用最广泛的方法是化学防治,长期广泛使用化学杀虫剂虽然在短期内可对蚊虫种群进行有效的控制,但也不可避免地导致媒介蚊虫对化学杀虫剂产生抗药性,污染生态环境,给蚊媒传染病的防治带来新的困难[5]。近年来,随着对昆虫肠道菌群的深入研究发现,肠道共生菌在宿主的消化吸收、免疫防御以及提升宿主抗药性等方面均发挥了重要的作用[6-8],利用共生菌防控害虫以及阻断蚊媒传染病的传播具有良好的应用前景[9]。
嗜水气单胞菌(Aeromonas hydrophila)属于弧菌科气单胞菌属,广泛分布于自然界各种水体和水生动物体内,是一种典型的人-水生动物-畜共患病细菌[10]。淡色库蚊幼虫、蛹、成蚊肠道中嗜水气单胞菌均占有较高的丰度[11]。据报道媒介蚊虫肠道中嗜水气单胞菌与蚊虫抗性有一定关系,淡色库蚊抗性品系中肠的嗜水气单胞菌的丰度显著高于敏感品系[12],邢一帆等[13]进一步研究发现中肠共生菌嗜水气单胞菌可增强淡色库蚊对溴氰菊酯的抗性。嗜水气单胞菌在媒介蚊虫肠道中的其他功能报道较少,为了探索嗜水气单胞菌在淡色库蚊生殖、营养等方面的作用,本文通过转录组学和代谢组学,从“因”和“果”两个方向,探究嗜水气单胞菌对淡色库蚊基因表达和代谢循环的影响,为进一步研究嗜水气单胞菌的更多功能提供实验依据。
1 材料与方法 1.1 蚊虫来源及处理实验所用淡色库蚊由山东省寄生虫病防治研究所提供,该品系已在山东省寄生虫病研究所蚊虫饲养室内饲养20多年。饲养条件:温度(26±2)℃,相对湿度为(75±5)%,光周期L∶D=14 h∶10 h,幼虫用猪肝粉和酵母粉(1∶3)混合饲养,成蚊饲喂5%的葡萄糖溶液。处理组为随机选取羽化1 d淡色库蚊连续饲喂嗜水气单胞菌葡萄糖溶液混合物3 d,嗜水气单胞菌来源于淡色库蚊的中肠,分离鉴定主要参考邢一帆等[13]的方法,将分离的嗜水气单胞菌于LB液体培养基中30 ℃,160 r/min(离心半经为0.95 cm)振荡培养24 h,培养结束后12 396×g离心10 min,弃上清,取菌体沉淀与5%无菌葡萄糖溶液混合并调节吸光度(A),使A600至0.8~1.0,得到细菌葡萄糖溶液混合物。对照组为羽化1 d的淡色库蚊连续饲喂5%无菌葡萄糖溶液3 d。
1.2 主要试剂和仪器营养琼脂(NA)培养基、LB液体培养基(青岛海博生物),基因组RNA提取试剂盒(德国Qiagen),甲醇、甲酸、乙腈(美国Thermo),Nanodrop 2000分光光度计、二氧化碳培养箱、MaxQ 6000型恒温摇床、高分辨质谱仪(美国Thermo),Illumina HiSeq X Ten测序仪(美国Illumina),高效液相色谱仪、色谱柱(美国Waters)。。
1.3 RNA提取和转录组测序淡色库蚊对照组(C)与处理组(T)的转录组测序各采用3个生物学重复,每个生物学重复以15只淡色库蚊为样本。使用QIAGEN RNeasy Mini Kit试剂盒从淡色库蚊中提取总RNA。使用NanoDrop 2000分光光度计测定RNA的产率,并使用溴化乙锭染色琼脂糖凝胶电泳评估其完整性。然后使用TruSeq Stranded mRNA LT Sample Prep Kit构建文库。转录组测序及分析由上海欧易生物技术有限公司进行。
在Illumina HiSeq X Ten平台上对文库进行测序,得到150 bp的配对末端序列。首先使用Trimmomatic对FASTQ格式的原始数据(raw reads)进行处理,去除低质量的数据(reads),得到质控数据(clean reads)。然后利用HISAT2将clean reads与指定的参考基因组[致倦库蚊(Cx. pipiens quinquefasciatus)基因组]进行序列比对,获取在参考基因组或基因上的位置信息,以及测序样本特有的序列特征信息。
1.4 差异表达分析和GO/KEGG富集分析使用Cufflinks计算每个基因的FPKM,使用HTSeqcount计算每个基因的读取计数。利用DESeq 2软件进行差异表达基因分析,其中符合q < 0.05且差异倍数 > 2或差异倍数 < 0.5阈值的基因被定义为差异表达基因(differentially expressed genes,DEGs)。采用R 3.2.0对DEGs进行层次聚类分析,以展示基因在不同组和样本中的表达模式。采用基于超几何分布的R分别对DEGs进行基因本体论(gene ontology,GO)富集和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路富集分析。
1.5 代谢组学样品提取及检测淡色库蚊对照组与处理组的代谢组测序各采用6个生物学重复,每个生物学重复15只淡色库蚊。精确称取30 mg组织样本到1.5 ml EP管中,加入内标(L-2-氯苯丙氨酸,0.06 mg/ml;甲醇配置)20 μl,加入400 μl甲醇-水(V甲醇∶V水=4∶1);加入2个小钢珠,在-20 ℃冰箱中预冷2 min后,放入研磨机中研磨(60 Hz,2 min);冰水浴超声提取10 min,-20 ℃静置30 min;4 ℃ 20 144×g离心10 min,取300 μl上清液装入LC-MS进样小瓶中挥干;用300 μl甲醇-水(V甲醇∶V水=1∶4)复溶(涡旋30 s,超声3 min);-20 ℃下静置2 h;4 ℃ 20 144×g离心10 min,用注射器吸取150 μl的上清液,使用0.22 μm的有机相针孔过滤器过滤后,转移到LC进样小瓶,-80 ℃下保存,直到进行LC-MS分析。质控样本由所有样本的提取液等体积混合制备而成。
本次实验的分析仪器为ACQUITY UPLC I-Class plus超高效液相串联QE HF高分辨质谱仪组成的液质联用系统。液相(色谱)条件包括:ACQUITY UPLC HSS T3(1.8 μm,100 mm×2.1 mm)色谱柱;流动相A(超纯水加0.1%甲酸);流动相B(乙腈加0.1%甲酸);线性梯度:0.01 min,A/B(体积比)为95%∶5%;2 min,95%∶5%;4 min,70%∶30%;8 min,50%∶50%;10 min,20%∶80%;14 min,0∶100%;15 min,0∶100%;15.1 min,95%∶5%;16 min,95%∶5%。流速0.35 ml/min,柱温45 ℃。分析过程中所有样品保存在4 ℃。进样量为5 μl。
质谱条件为:质量范围为质荷比70~1 000 kg/C,全扫描的分辨率设置为60 000;高能量碰撞解离质谱扫描的分辨率设置为15 000。碰撞能量设置为10、20和40 eV。质谱仪的工作电压为:喷雾电压为3 800 V(+)和3 000 V(-);鞘气流量,35个任意单位;辅助气流量,8个任意单位;毛细管温320 ℃;辅助燃气加热器温度350 ℃;射频透镜电压,50 V。
1.6 代谢组学数据分析数据预处理在进行模式识别之前,原始数据经代谢组学处理软件Progenesis QI v2.3进行基线过滤、峰识别、积分、保留时间校正、峰对齐和归一化。使用The human metabolome database(HMDB)、Lipidmaps(v2.3)和METLIN数据库以及自建库等对差异代谢物进行定性定量分析。采用主成分分析(principal component analysis,PCA)来观察各样本之间的总体分布和整个分析过程的稳定性,然后用偏最小二乘法分析(partial least-squares discrimination analysis,PLS-DA)及正交偏最小二乘法分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)来区分各组间代谢轮廓的总体差异,找到组间的差异代谢物。筛选的标准为OPLS-DA模型第一主成分的变量权重(variable important in projection,VIP)值> 1,经t检验,P < 0.05。
1.7 差异基因与差异代谢物联合分析根据转录组和代谢组的相对含量数据,分别选取前20的差异基因和差异代谢物(按P值从小到大排序),基于皮尔森相关系数计算差异基因的表达量与差异代谢物数据之间的关联性。相关系数 > 0为正相关,< 0为负相关。对差异基因和差异代谢物显著富集的KEGG通路进行分析,明确差异基因与差异代谢物共同富集到的通路,并将这些通路绘制成条形图。
2 结果 2.1 淡色库蚊转录组数据的组装所有RNA-seq数据已存入美国国立生物技术信息中心(national center for biotechnology information,NCBI)的序列阅读档案(sequence read archive,SRA)数据库,登录号为PRJNA905215。采用Illumina测序平台对淡色库蚊转录组进行测序,共获得43.60 Gb的有效序列数据(clean data),各样本的有效数据量分布在6.88~7.54 Gb,测序错误率 < 0.10%(Q30)的碱基分布在93.17%~93.65%(表 1),平均GC含量为53.75%。通过将reads比对到参考基因组上,得到各个样本的基因组比对情况,比对率为71.59%~73.33%。
|
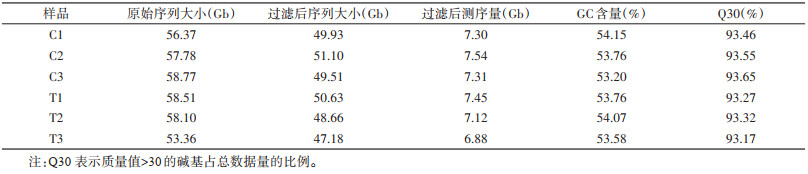
通过筛选条件q < 0.05且|log2FoldChange| > 1,确定了淡色库蚊处理组与对照组的差异表达基因(differentially expressed genes,DEGs)个数为305个,其中180个上调表达,125个下调表达(图 1A)。利用基因的定量结果进行PCA分析,第一轴解释了总差异的13.65%,第二轴解释了总差异的62.72%,2轴共解释了总差异的76.37%。其中C1、C2、C3归为一组,T1、T2、T3归为一组,同组的样本在空间分布比较集中(图 1B)。基因的GO功能注释包括21个生物学过程,16个细胞组分和10个分子功能,富集到细胞组分的基因最多(91.03%),其次为分子功能(85.20%)、生物学过程(76.23%)。在生物学过程分类中,以细胞过程(68.24%)和代谢过程(64.70%)最为显著,其次为对刺激的反应(49.40%)和生物调节(41.18%);在细胞组分分类中,细胞(60.59%)和细胞组分(60.59%)的富集程度最高,其次为胞外区(45.32%)、细胞器(44.33%)、细胞膜(35.96%)等;而在分子功能分类中,以结合(77.37%)和催化活性(54.21%)最为显著,其次为转运活性、分子传感器活性和结构分子活性,占13.68%(图 1C)。最富集的20条KEGG通路如图 1D所示,差异基因在叉头转录因子(FoxO)信号通路的富集程度最高,基因数目为6个;其次是脂肪细胞因子信号通路、蛋白质消化吸收通路、糖酵解/糖异生通路、胰腺分泌通路等富集较多,基因数目均为4个。
|
| 注:灰色圆点为表达差异不显著基因,红色圆点和蓝色圆点为差异表达显著基因;C1~C3为对照组,T1~T3为处理组;绿色、蓝色和红色条带分别表示在生物学过程、细胞组分、分子功能3种分类中对应差异基因数目的GO条目;图D中气泡越大的条目包含的差异蛋白编码基因数目越多,气泡颜色由蓝-白-黄-红变化,其富集P值越小,显著程度越大;GO基因本体论;KEGG京都基因与基因组百科全书。 图 1 淡色库蚊转录组差异基因表达分析 Figure 1 Differential gene expression analysis in Culex pipiens pallens transcriptome |
| |
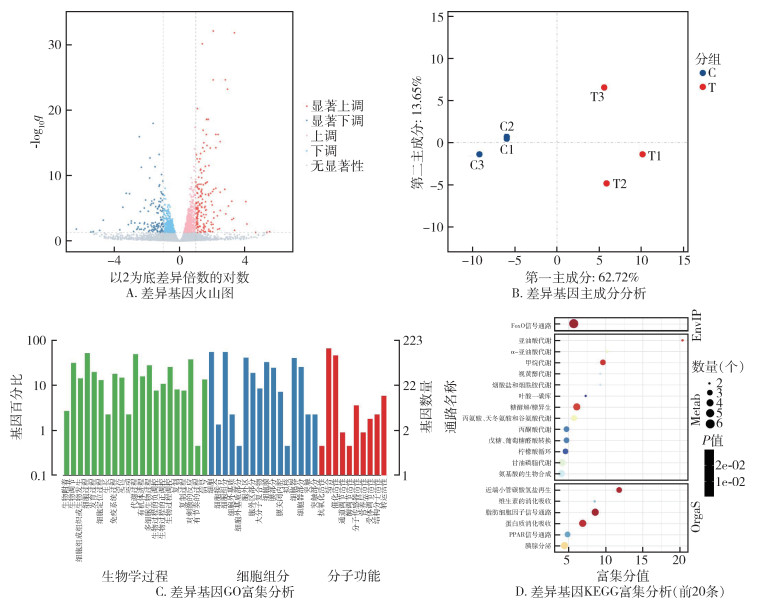
所有代谢组数据已存入MetaboLights数据库,登录号为MTBLS6589。将对照组样本、处理组样本以及QC样本进行PCA分析,其中6个对照组样本聚在一起,6个处理组样本聚在一起,说明样本之间差异性较小,分组较为合理。3个QC样本紧密聚集在一起,表明本次试验的仪器分析系统稳定性较好,试验数据稳定可靠,在试验中获得的代谢谱差异能反映样本间自身的生物学差异(图 2A)。通过检测共获得差异代谢物575个,其中264个上调,311个下调(图 2B)。KEGG功能富集分析结果显示,柠檬酸循环代谢通路的富集程度最大,其次是D-谷氨酰胺和D-谷氨酸代谢通路和丙氨酸、天冬氨酸和谷氨酸代谢通路(图 2C)。

|
| 注:A. 绿色圆点表示质控样本(QC),蓝色正方形表示对照组样本(C),红色三角形表示处理组样本(T);B. 红色圆点表示显著上调的代谢产物,蓝色圆点表示显著下调的代谢产物,灰色圆点表示不显著的代谢产物;C. 富集分值指该代谢通路中的总代谢物个数,富集分值越大,则说明富集程度越大;颜色由绿到红表示P值依次降低;点越大,说明富集到该通路上的代谢物数目越多,P值表示该通路富集的显著性;KEGG京都基因与基因组百科全书。 图 2 淡色库蚊代谢组差异代谢物分析 Figure 2 Analysis of differential metabolites in Culex pipiens pallens metabolome |
| |
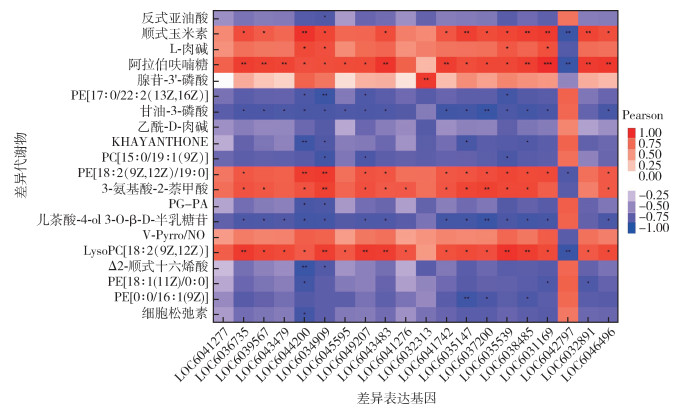
对前20的差异基因和差异代谢物进行皮尔森相关性分析发现,注释为双功能亚甲基四氢叶酸脱氢酶、嘌呤核苷磷酸化酶、丝氨酸-丙酮酸氨基转移酶等17个差异基因和注释为3-氨基-2-萘甲酸、阿拉伯呋喃糖、L-肉碱等18个差异代谢物呈正相关;注释为双功能亚甲基四氢叶酸脱氢酶、嘌呤核苷磷酸化酶、丝氨酸-丙酮酸氨基转移酶等17个差异基因和注释为甘油-3-磷酸、阿拉伯呋喃糖、反式亚油酸等15个差异代谢物呈负相关。见图 3。
|
| 注:色块中*代表相关性P < 0.05,**代表相关性P < 0.01,***代表相关性P < 0.001,每行为不同的基因,每列为对应的代谢物,图中橙红色为正相关,蓝色为负相关,颜色越深相关性越大,白色表示相关性为0;LOC6041277多功能蛋白ADE2;LOC6036735双功能亚甲基四氢叶酸脱氢酶;LOC6039567嘌呤核苷磷酸化酶;LOC6043479磷酸烯醇丙酮酸羧基酶;LOC6044200杀菌肽A;LOC6034909暂无注释;LOC6045595丝氨酸-丙酮酸氨基转移酶;LOC6049207支链氨基酸氨基转移酶;LOC6043483磷酸烯醇丙酮酸羧基酶;LOC6041276氨基磷酸核糖转移酶;LOC6032313防御素C;LOC6041742暂无注释;LOC6035147尿囊素酶;LOC6037200磷酸丝氨酸磷酸酶;LOC6035539暂无注释;LOC6038485丙氨酸-乙醛酸转氨酶;LOC6031169 CD109抗原;LOC6042797暂无注释;LOC6032891暂无注释;LOC6046496千里光碱氮氧化物。 图 3 淡色库蚊代谢组差异基因与差异代谢物表达相关性分析热图 Figure 3 Heat map for correlation analysis of differential gene and differential metabolite expression in Culex pipiens pallens metabolome |
| |
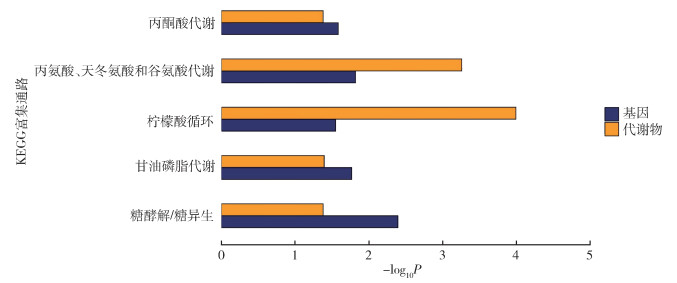
差异基因显著富集的通路有27个,差异代谢物显著富集的通路有15个,两者共同富集到5个通路。共同富集到的通路分别为糖酵解/糖异生,甘油磷脂代谢,柠檬酸循环,丙氨酸、天冬氨酸和谷氨酸代谢和丙酮酸代谢。其中柠檬酸循环富集的显著性最高。见图 4。
|
| 注:KEGG京都基因与基因组百科全书。 图 4 淡色库蚊差异基因与差异代谢物的KEGG关联分析 Figure 4 KEGG correlation analysis of differential genes and differential metabolites of Culex pipiens pallens |
| |
本研究通过转录组与代谢组联合分析揭示了喂饲嗜水气单胞菌对淡色库蚊基因表达和代谢差异的影响。共筛选出180个上调表达基因和125个下调表达基因,264个上调差异代谢物和311个下调差异代谢物,说明喂饲嗜水气单胞菌使淡色库蚊体内的基因表达和代谢产物发生了较为强烈的变化。
在对差异表达基因的GO功能分析中,差异表达基因主要富集到细胞过程、代谢过程、细胞、细胞组分、结合和催化活性等类群,这与阿尔泰蝠蛾(Hepialus altaicola)和小胸鳖甲(Microdera punctipennis)等昆虫在低温胁迫下的GO功能分类十分相似[14-15]。差异表达基因的KEGG富集分析显示,差异基因主要富集到FoxO信号通路,FoxO信号通路参与许多细胞生理事件,例如细胞代谢、生长、分化、凋亡,葡萄糖代谢,抗氧化应激和寿命改变[16-17],而其余差异基因主要富集到糖、蛋白质、脂质的代谢通路中,这表明喂饲嗜水气单胞菌可加强淡色库蚊的能量代谢。本研究还发现差异表达基因中有1个热休克蛋白(heat shock protein,HSP)基因和9个细胞色素P450(cytochrome P450)基因。热休克蛋白是生物在应对环境压力时产生的一种分子伴侣蛋白,它具有帮助氨基酸链的正确折叠以及参与蛋白质的跨膜运输等作用[18]。细胞色素P450是一种广泛存在于动植物体内的一种代谢酶,在昆虫的生长发育和抗药性等方面均发挥着重要作用。邢一帆等[13]发现,嗜水气单胞菌可诱导淡色库蚊体内P450酶活性升高,以此来增强对溴氰菊酯类杀虫剂的抗性。此外,还有研究报道细胞色素P450参与多种昆虫的低温响应过程[19-20]。淡色库蚊本身具有较强的抵抗低温的能力,而嗜水气单胞菌分离自淡色库蚊的中肠,因此,嗜水气单胞菌是否在淡色库蚊应对低温胁迫中发挥作用,还需进一步研究。差异代谢物KEGG功能富集到的通路为柠檬酸循环、丙氨酸、天冬氨酸、谷氨酸的代谢等,这些通路均与糖代谢或氨基酸代谢有关,这与转录组的KEGG富集结果基本一致。
转录组代谢组联合分析共同富集到5条通路,其中糖酵解/糖异生主要与葡萄糖的分解和糖原的合成有关,为生物体提供能量;丙氨酸、天冬氨酸和谷氨酸代谢为生物体内氨基酸代谢的重要组成部分;丙酮酸是糖代谢中具有关键作用的中间产物;丙酮酸可通过乙酰CoA和三羧酸循环实现体内糖、脂肪和氨基酸间的互相转化,因此,丙酮酸代谢在三大营养物质的代谢联系中起着重要的枢纽作用;柠檬酸循环是糖、脂肪、氨基酸代谢的联系通路和最终代谢通路;甘油磷脂代谢为脂质代谢的一部分,甘油磷脂不仅是生物膜结构和血浆脂蛋白的重要组成成分,还在细胞识别和信号转导方面起着重要作用[21]。以上结果说明喂饲嗜水气单胞菌可以激活淡色库蚊的的糖代谢、氨基酸代谢与脂代谢途径,促进新陈代谢,为淡色库蚊提供能量和所需的蛋白质和脂质。
利益冲突 无
| [1] |
冯兰洲, 刘维德. 中国尖音库蚊淡色变种与乏倦库蚊成虫在形态上的区别的研究[J]. 昆虫学报, 1954, 4(2): 103-114. Feng LZ, Liu WD. Studies on the morphological differences of the adults of Chinese Culex pipiens var. pallens and Cx. fatigans[J]. Acta Entomol Sin, 1954, 4(2): 103-114. DOI:10.16380/j.kcxb.1954.02.001 |
| [2] |
程鹏, 王怀位, 张本光, 等. 山东省潍坊市淡色库蚊越冬情况调查[J]. 中华卫生杀虫药械, 2019, 25(2): 132-134. Cheng P, Wang HW, Zhang BG, et al. Overwintering of Culex pipiens pallens in Weifang city of Shandong province[J]. Chin J Hyg Insect Equip, 2019, 25(2): 132-134. DOI:10.19821/j.1671-2781.2019.02.012 |
| [3] |
刘起勇. 新时代媒介生物传染病形势及防控对策[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 1-6, 11. Liu QY. Epidemic profile of vector-borne diseases and vector control strategies in the new era[J]. Chin J Vector Biol Control, 2019, 30(1): 1-6, 11. DOI:10.11853/j.issn.1003.8280.2019.01.001 |
| [4] |
郭小连, 杨中华. 我国流行性乙型脑炎传播媒介的研究进展[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 106-110. Guo XL, Yang ZH. Research progress in Japanese encephalitis vectors in China[J]. Chin J Vector Biol Control, 2019, 30(1): 106-110. DOI:10.11853/j.issn.1003.8280.2019.01.026 |
| [5] |
吕文祥, 程鹏, 彭荟, 等. 山东省东平湖地区2021年淡色库蚊抗药性调查[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 104-107. Lyu WX, Cheng P, Peng H, et al. Insecticide resistance of Culex pipiens pallens in Dongping Lake area, Shandong province, China, in 2021[J]. Chin J Vector Biol Control, 2022, 33(1): 104-107. DOI:10.11853/j.issn.1003.8280.2022.01.019 |
| [6] |
Kucuk RA. Gut bacteria in the holometabola: A review of obligate and facultative symbionts[J]. J Insect Sci, 2020, 20(4): 22. DOI:10.1093/jisesa/ieaa084 |
| [7] |
Jing TZ, Qi FH, Wang ZY. Most dominant roles of insect gut bacteria: Digestion, detoxification, or essential nutrient provision?[J]. Microbiome, 2020, 8(1): 38. DOI:10.1186/s40168-020-00823-y |
| [8] |
吕文祥, 刘丽娟, 公茂庆. 昆虫肠道菌群的功能及检测方法研究进展[J]. 热带病与寄生虫学, 2021, 19(5): 284-287, 296. Lyu WX, Liu LJ, Gong MQ. Advances in functions and detection methods of insect intestinal microflora[J]. J Trop Dis Parasitol, 2021, 19(5): 284-287, 296. DOI:10.3969/j.issn.1672-2302.2021.05.012 |
| [9] |
Gao H, Bai L, Jiang YM, et al. A natural symbiotic bacterium drives mosquito refractoriness to Plasmodium infection via secretion of an antimalarial lipase[J]. Nat Microbiol, 2021, 6(6): 806-817. DOI:10.1038/s41564-021-00899-8 |
| [10] |
Fernández-Bravo A, Figueras MJ. An update on the genus Aeromonas: Taxonomy, epidemiology, and pathogenicity[J]. Microorganisms, 2020, 8(1): 129. DOI:10.3390/microorganisms8010129 |
| [11] |
吕文祥, 程鹏, 彭荟, 等. 淡色库蚊不同发育阶段肠道菌群多样性分析[J]. 中国寄生虫学与寄生虫病杂志, 2022, 40(4): 460-467. Lyu WX, Cheng P, Peng H, et al. Diversity analysis of intestinal bacterial flora of Culex pipiens pallens at different developmental stages[J]. Chin J Parasitol Parasit Dis, 2022, 40(4): 460-467. DOI:10.12140/j.issn.1000-7423.2022.04.007 |
| [12] |
刘芷涵, 孙小红, 邢一帆, 等. 淡色库蚊溴氰菊酯敏感品系与抗性种群的肠道菌群多样性分析[J]. 中国媒介生物学及控制杂志, 2020, 31(5): 545-551. Liu ZH, Sun XH, Xing YF, et al. An analysis of gut microbial diversity of deltamethrin-susceptible strains and deltamethrin-resistant populations of Culex pipiens pallens[J]. Chin J Vector Biol Control, 2020, 31(5): 545-551. DOI:10.11853/j.issn.1003.8280.2020.05.009 |
| [13] |
邢一帆, 刘芷涵, 张瑞敏, 等. 中肠共生菌嗜水气单胞菌对淡色库蚊溴氰菊酯抗性的影响[J]. 中国病原生物学杂志, 2021, 16(6): 661-666. Xing YF, Liu ZH, Zhang RM, et al. Effect of the midgut symbiotic Aeromonas hydrophila on the deltamethrin resistance of Culex pipiens pallens[J]. J Path Biol, 2021, 16(6): 661-666. DOI:10.13350/j.cjpb.210609 |
| [14] |
孙涛, 张示渊, 张婷婷, 等. 阿尔泰蝠蛾(鳞翅目: 蝙蝠蛾科)幼虫低温胁迫转录组分析[J]. 应用昆虫学报, 2021, 58(5): 1113-1125. Sun T, Zhang SY, Zhang TT, et al. Gene transcription in Hepialus altaicola (Lepidoptera: Hepialidae) larvae subject to cold stress[J]. Chin J Appl Entomol, 2021, 58(5): 1113-1125. DOI:10.7679/j.issn.2095-1353.2021.112 |
| [15] |
库尔班·吐松, 陆雪莹, 刘小宁, 等. 准噶尔小胸鳖甲短时低温胁迫响应的转录组分析[J]. 昆虫学报, 2016, 59(6): 581-591. Tusong K, Lu XY, Liu XN, et al. Transcriptomic analysis of the desert beetle Microdera punctipennis (Coleoptera: Tenebrionidae) in response to short-term cold stress[J]. Acta Entomol Sin, 2016, 59(6): 581-591. DOI:10.16380/j.kcxb.2016.06.001 |
| [16] |
Link W. Introduction to FOXO biology[J]. Methods Mol Biol, 2019, 1890: 1-9. DOI:10.1007/978-1-4939-8900-3_1 |
| [17] |
Murtaza G, Khan AK, Rashid R, et al. FOXO transcriptional factors and long-term living[J]. Oxid Med Cell Longev, 2017, 2017: 3494289. DOI:10.1155/2017/3494289 |
| [18] |
Tukaj S. Heat shock protein 70 as a double agent acting inside and outside the cell: Insights into autoimmunity[J]. Int J Mol Sci, 2020, 21(15): 5298. DOI:10.3390/ijms21155298 |
| [19] |
Robert JA, Bonnett T, Pitt C, et al. Gene expression analysis of overwintering mountain pine beetle larvae suggests multiple systems involved in overwintering stress, cold hardiness, and preparation for spring development[J]. PeerJ, 2016, 4: e2109. DOI:10.7717/peerj.2109 |
| [20] |
Des Marteaux LE, McKinnon AH, Udaka H, et al. Effects of cold-acclimation on gene expression in Fall field cricket (Gryllus pennsylvanicus) ionoregulatory tissues[J]. BMC Genomics, 2017, 18(1): 357. DOI:10.1186/s12864-017-3711-9 |
| [21] |
Valentine WJ, Hashidate-Yoshida T, Yamamoto S, et al. Biosynthetic enzymes of membrane glycerophospholipid diversity as therapeutic targets for drug development[J]. Adv Exp Med Biol, 2020, 1274: 5-27. DOI:10.1007/978-3-030-50621-6_2 |
 2023, Vol. 34
2023, Vol. 34


