扩展功能
文章信息
- 韦晓慧, 王晓旭, 冀好强, 梁莹, 刘起勇
- WEI Xiao-hui, WANG Xiao-xu, JI Hao-qiang, LIANG Ying, LIU Qi-yong
- 气候变化背景下按蚊伊丽莎白菌全球和中国适生区分布预估研究
- Prediction of suitable habitat distribution of Elizabethkingia anophelis in the world and China under climate change
- 中国媒介生物学及控制杂志, 2023, 34(2): 165-175
- Chin J Vector Biol & Control, 2023, 34(2): 165-175
- 10.11853/j.issn.1003.8280.2023.02.005
-
文章历史
- 收稿日期: 2023-02-02
2 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 传染病预防控制国家重点实验室, 北京 102206;
3 山东大学公共卫生学院, 山东 济南 250100
2 State Key Laboratory of Infectious Disease Prevention and Control, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 School of Public Health, Shandong University, Ji'nan, Shandong 250100, China
气候变化被认为是人类当前面临的最严峻的挑战,微生物通过产生和消耗温室气体等方式,与气候变化息息相关,除此之外,极端天气的增加可以通过降低宿主的耐受性、增加病原微生物及其媒介生物的分布范围等方式威胁人类健康[1]。
伊丽莎白菌属(Elizabethkingia)细菌是一类非发酵革兰阴性杆菌,广泛存在于自然环境中[2],于1959年被美国疾病预防控制中心一名微生物学家发现[3]。2011年,Kämpfer等[4]首次从冈比亚按蚊(Anopheles gambiae)中肠分离出按蚊伊丽莎白菌(E. anophelis),之后中非共和国报道了1例新生儿感染按蚊伊丽莎白菌[5]。近年来,由按蚊伊丽莎白菌临床感染导致的重症或死亡病例越来越多,自发现以来,该菌已经引起至少3次中到大规模的疾病暴发,涉及新加坡、美国、中国香港等地[6-8]。不仅如此,在以往的研究中,许多按蚊伊丽莎白菌分离株,被错误鉴定为脑膜炎伊丽莎白菌(E. meningoseptica)[9],因此该菌的危害可能被低估。另外,有研究表明,伊丽莎白菌属细菌在冈比亚按蚊、亚洲斯氏按蚊(An. stephensi)和埃及伊蚊(Aedes aegypti)肠道内占优势地位,其中按蚊伊丽莎白菌为疟疾媒介冈比亚按蚊肠道中主要菌种[10],且实验引入的按蚊伊丽莎白菌可在冈比亚按蚊肠道中存活并繁殖[11],虽然目前关于冈比亚按蚊是否可以作为按蚊伊丽莎白菌的传播媒介引起人间传播尚不清楚,但该菌作为冈比亚按蚊共生菌的作用不可忽视。细菌对环境适应性强且对环境条件的变化较为敏感[12],按蚊伊丽莎白菌广泛存在于土壤、水体等自然环境中,气候条件的变化对其生长繁殖起着重要作用,而目前我国对该菌的研究大多集中在其临床感染特征及耐药性方面[13],尚未有学者结合气候因素研究其适生区。近年来,物种分布模型(species distribution models,SDMs)在外来入侵物种的控制和管理方面得到越来越广泛的应用[14],其将物种分布数据与环境变量相关联,以揭示物种的潜在分布,从而找到适合该物种生存的区域[15]。最大熵模型(MaxEnt)是目前广泛使用并且被认为是最优秀的一种物种分布模型[16]。本研究基于气候数据、按蚊伊丽莎白菌全球分布数据,使用MaxEnt模型预估按蚊伊丽莎白菌当前及未来在全球及中国的适生区分布,为预防该菌暴发,有效防控该菌在中国的入侵、扩散和蔓延提供参考。
1 材料与方法 1.1 数据收集与整理 1.1.1 按蚊伊丽莎白菌分布数据获取数据收集自全球生物多样性信息数据库(Global Biodiversity Information Facility,GBIF;https://www.gbif.org/)和2篇公开发表的文献[8, 17]。对下载到的分布数据进行过滤,剔除重复点、标本点以及地理坐标存在明显误差的样本点,并使用ENMtools,以环境数据为基准,删除同一栅格内冗余数据以避免过拟合,最终得到21个按蚊伊丽莎白菌分布点,数据以.csv格式文件保存。
1.1.2 环境数据获取环境数据来源于WorldClim网站(https://worldclim.org/),包括历史气候环境监测数据(1970-2000年)及未来预测数据,未来气候数据为中国(北京)气候中心气候系统模式的中等分辨率气候系统(BCC-CSM2-MR)4个共享经济路径(shared socio-economic pathway,SSP)1-2.6、2-4.5、3-7.0、5-8.5下2021-2040、2041-2060、2061-2080和2081-2100年间气候变量。典型关键变量共56个,包括19个生物气候变量(bio1~bio19)、海拔、月最高温、月最低温以及月降水量,所有环境变量下载为TIFF格式,使用ArcGIS 10.5软件转换工具将其转换为ASCII格式供软件使用。
1.1.3 软件及地图数据获取使用maxent 3.4.4软件对按蚊伊丽莎白菌适生区进行预估,使用ArcGIS 10.5软件对模型预估结果进行可视化,使用R 4.2.2软件和DIVA-GIS 7.5.0调整模型参数。世界地图(1∶1 000万)下载自自然地球网站(http://www.naturalearthdata.com),中国地图(1∶400万)下载自国家地理信息中心网站(http://www.ngcc.cn/ngcc/)。
1.2 环境变量筛选及模型参数调整 1.2.1 环境变量筛选为了提高模型准确性,本研究对56个环境变量进行了筛选,首先选择对模型贡献率前20、且≥0.1的环境变量,使用R软件对其进行Pearson相关性分析,相关系数|r| > 0.8,且有统计学意义的,保留贡献率较高的环境变量。
1.2.2 模型参数调整由于分布点数据较少,为提高模型准确度,本研究通过修改特征组合(feature classes,FC)和正则化系数(regularization multiplier,RM)来优化模型。特征组合有5种形式:线性(linear,L)、二次型(quadratic,Q)、乘积型(product,P)、阈值型(threshold,T)及片段化(hinge,H),正则化系数设置有8个水平:0.5、1.0、1.5、2.0、2.5、3.0、3.5和4.0。使用R 4.2.2软件包ENMeval通过赤池信息准则(Akaike information criterion,AIC)得到最佳模型,AIC是评判模型拟合优良性的标准之一,当AIC值最小(本文为612.667)时,即为最优模型。本研究得到最优模型对应的参数为:FC=LQH,RM=3.5。
1.3 模型预估将分布数据与环境数据导入模型,设置特征组合为线性、二次型和片段化,随机选择25.0%的样本点作为测试集,剩余75.0%的样本点作为训练集,正则化系数为3.5,模型重复运行20次,选用“bootstrap”法重采样,使用刀切法(jackknife)测量环境变量贡献率,绘制受试者特征曲线(receiver operating characteristic curve,ROC)并使用曲线下面积(area under the curve,AUC)衡量模型准确度。AUC取值范围为0~1,值越大,代表模型准确度越高。
1.4 适生区划分使用ArcMap重分类工具,将模型预估结果依据其存在概率使用自然断点法分为4个等级:非适生区、低适生区、中适生区及高适生区。
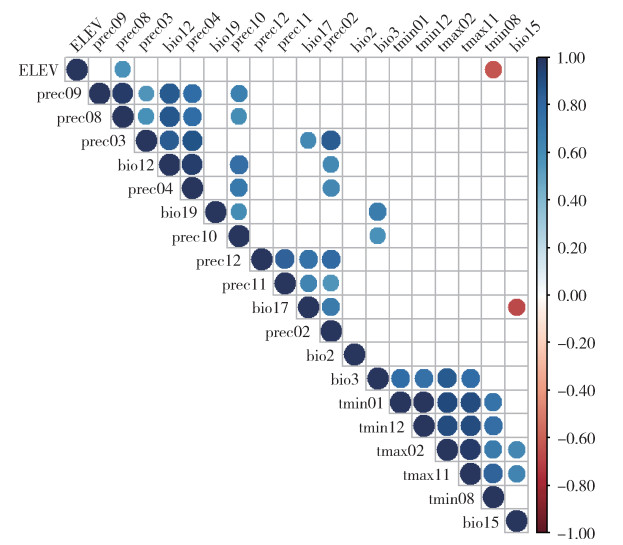
2 结果 2.1 物种分布数据及环境变量筛选得到21个按蚊伊丽莎白菌在全球范围的分布点(图 1)。筛选出对按蚊伊丽莎白菌贡献率位于前20、且≥0.1的环境变量如下:年降水量(bio12)、最冷季度降水量(bio19)、4月降水量(prec04)、9月降水量(prec09)、海拔(elev)、1月最低温(tmin01)、10月降水量(prec10)、最湿季度降水量(bio17)、8月最低温(tmin08)、2月最高温(tmax02)、11月最高温(tmax11)、3月降水量(prec03)、12月最低温(tmin12)、12月降水量(prec12)、平均气温日较差(bio2)、8月降水量(prec08)、11月降水量(prec11)、等温性(bio3)、2月降水量(prec02)、降水量季节性变化(bio15)。对上述20个环境变量进行相关性分析(图 2),筛选出的环境变量如下:bio12、tmin01、bio17、tmin08、bio19、prec10、elev、prec02、prec12、bio15、bio2和bio3,其贡献率分别为27.0%、22.2%、12.1%、10.0%、8.4%、7.9%、7.5%、3.3%、1.2%、0.3%、0.1%和0.1%,这12个气候变量用于最终的模型预估。

|
| 图 1 按蚊伊丽莎白菌当前全球分布 Figure 1 Current distribution of Elizabethkingia anophelis in the world |
| |
|
| 注:图中蓝点表示正相关,红点表示负相关,颜色越深表示相关性越强。 图 2 环境变量Pearson相关性分析 Figure 2 Pearson correlation analysis of environmental variables |
| |
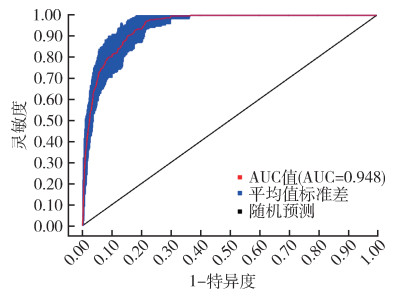
最终模型输出的ROC曲线如图 3所示,AUC值为0.948,模型准确度很高。
|
| 注:AUC曲线下面积。 图 3 模型预测结果受试者工作特征曲线 Figure 3 Receiver operating characteristic curve of model prediction results |
| |
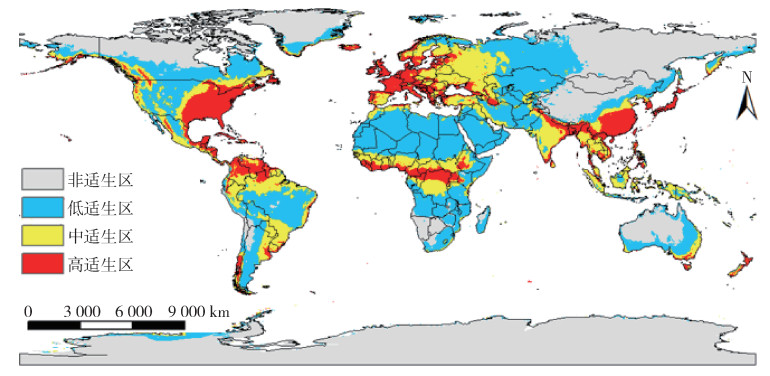
按蚊伊丽莎白菌当前在全球的适生区分布如图 4所示,其适生区总面积为7 666.5万km2,占大陆总面积的51.5%,其中高适生区主要分布在美国东南部、南美洲北部、欧洲西部、非洲中部、亚洲东南部部分地区,面积为1 445.5万km2,占大陆总面积的9.7%;中适生区主要分布在南美洲北部和南部、欧洲东部、俄罗斯西部及亚洲南部部分地区,低适生区则广泛分布在美国西部、加拿大南部、南美洲中部、亚洲西部及非洲大部分地区。
|
| 图 4 当前气候条件下按蚊伊丽莎白菌全球适生区分布 Figure 4 Suitable areas of Elizabethkingia anophelis in the world under current climate condition |
| |
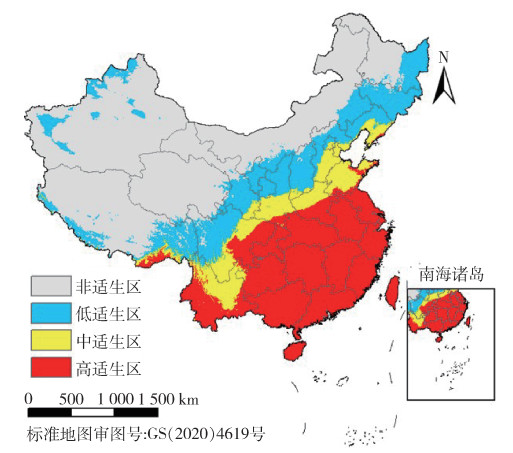
当前按蚊伊丽莎白菌在我国的适生区见图 5,总面积为461.1万km2,占我国国土总面积的48.1%,高适生区主要分布在我国东南部部分省份,如广西、广东、福建、浙江、江苏、湖南、江西、安徽、重庆、湖北、西藏、云南、四川、贵州、陕西、河南等省份以及山东省部分地区,面积为208.5万km2,占我国国土总面积的21.7%。
|
| 图 5 当前气候条件下按蚊伊丽莎白菌中国适生区分布 Figure 5 Suitable areas of Elizabethkingiat anophelis in China under current climate condition |
| |
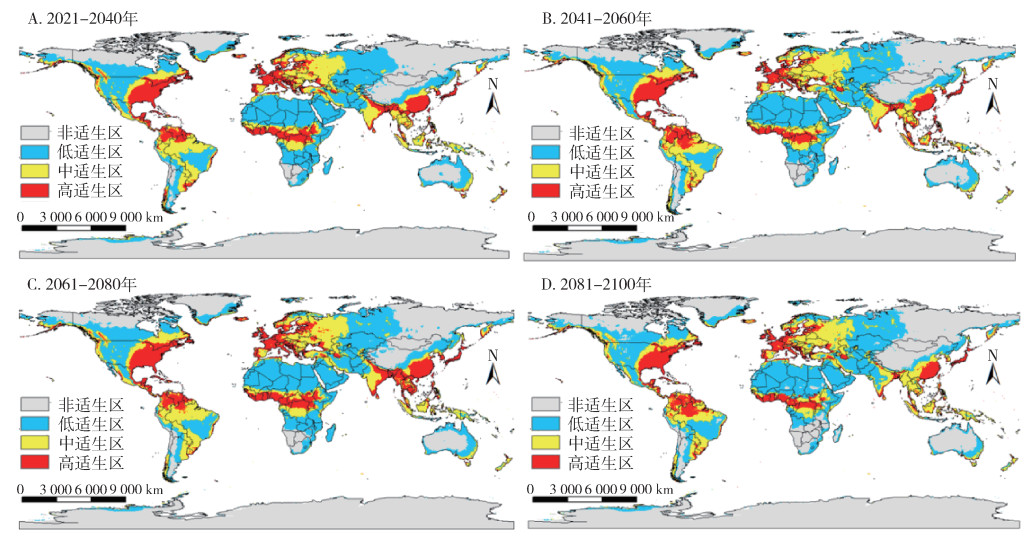
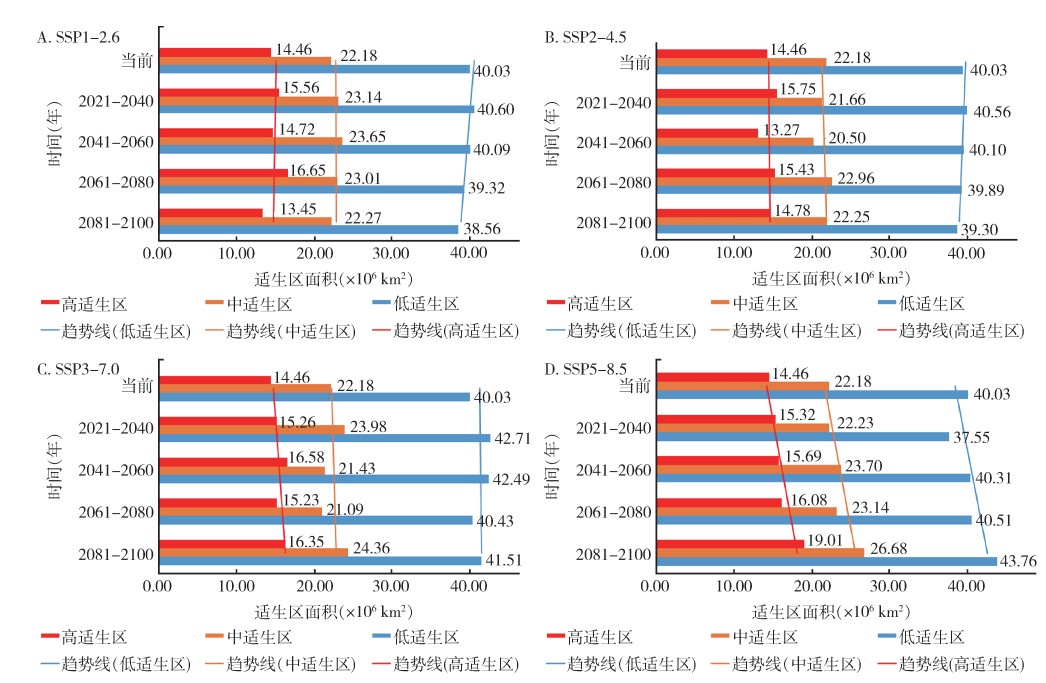
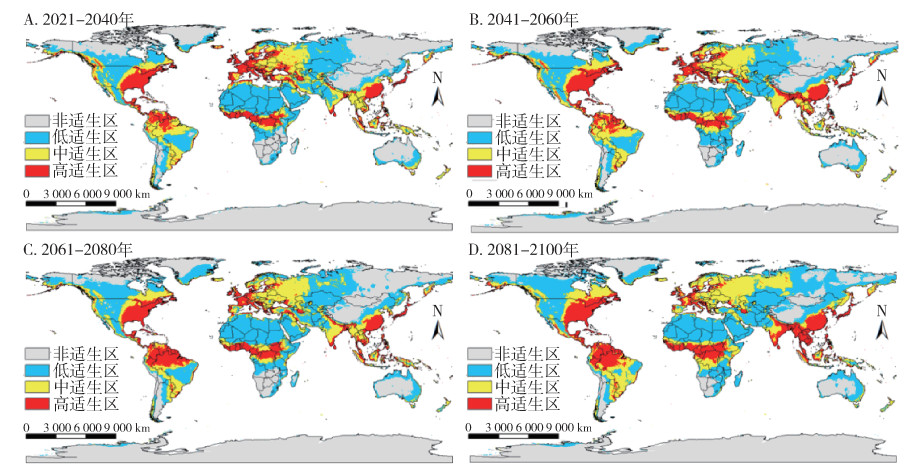
SSP1-2.6情景下,温室气体排放量最低,按蚊伊丽莎白菌全球适生区分布如图 6所示,相对于当前,仅2081-2100年间总适生区面积减少,减少了3.1%,其余各时期总适生区均略增加,高适生区、低适生区面积随时间略减少,中适生区面积随时间略增加(图 7),其中南美洲的高适生区有较为明显的向南扩张趋势。SSP5-8.5情景下,温室气体排放量最高,按蚊伊丽莎白菌全球适生区分布如图 8所示,相对于当前,仅在2021-2040年间,总适生区面积呈缩减态势,减少了2.0%,其余各时期总适生区面积均增加,其中2081-2100年间,总适生区面积增加达16.7%。各等级适生区面积均随时间呈现增加态势,增加速率大致相同(图 7),其中南美洲和亚洲的高适生区有较为明显的扩张趋势。
|
| 图 6 21世纪不同时期在共享社会经济路径1-2.6(SSP1-2.6,至2100年辐射强迫为2.6 W/m2)下按蚊伊丽莎白菌全球适生区分布 Figure 6 Suitable areas of Elizabethkingia anophelis in the world during different periods of the 21st century under shared socioeconomic pathway 1-2.6 (SSP1-2.6, radiative forcing being 2.6 W/m2 in 2100) |
| |
|
| 注:SSP共享社会经济路径。 图 7 各气候情景下2021-2100年按蚊伊丽莎白菌全球适生区相对于当前随时间变化情况 Figure 7 Changes over time in suitable areas for Elizabethkingia anophelis in the world from 2021 to 2100 under various climate scenarios as compared with current suitable areas |
| |
|
| 图 8 21世纪不同时期在共享社会经济路径5-8.5(SSP5-8.5,至2100年辐射强迫为8.5 W/m2)下按蚊伊丽莎白菌全球适生区分布 Figure 8 Suitable areas of Elizabethkingia anophelis in the world during different periods of the 21st century under shared socioeconomic pathway 5-8.5 (SSP5-8.5, radiative forcing being 8.5 W/m2 in 2100) |
| |
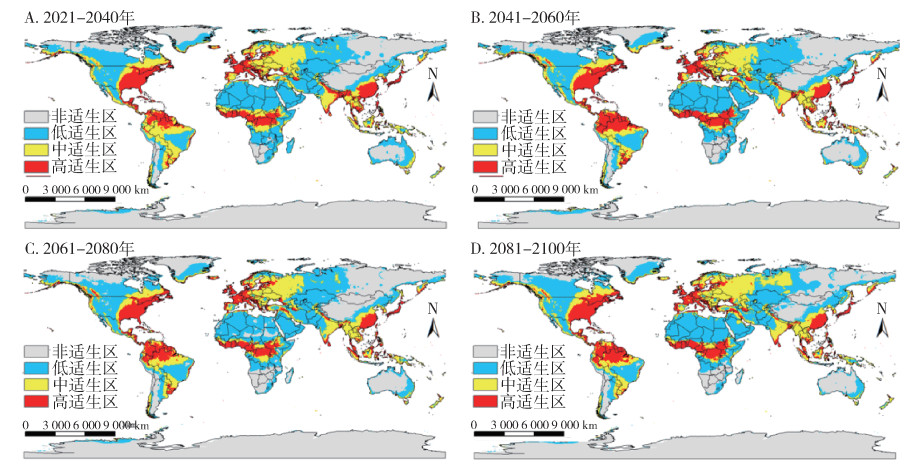
SSP2-4.5(图 9)及3-7.0(图 10)情景下,温室气体排放量处于中等,按蚊伊丽莎白菌全球适生区分布如图所示,相对于当前,SSP2-4.5情景下2041-2060年间适生区总面积减少最多,减少了3.6%,但总体来说变化不明显。中适生区、高适生区面积随时间略增加,低适生区面积随时间略减少。SSP3-7.0情景下相对于当前,各时期总适生区及各等级适生区面积均略有增加。见图 7。

|
| 图 9 21世纪不同时期在共享社会经济路径2-4.5(SSP2-4.5,至2100年辐射强迫为4.5 W/m2)下按蚊伊丽莎白菌全球适生区分布 Figure 9 Suitable areas of Elizabethkingia anophelis in the world during different periods of the 21st century under shared socioeconomic pathway 2-4.5 (SSP2-4.5, radiative forcing being 4.5 W/m2 in 2100) |
| |
|
| 图 10 21世纪不同时期在共享社会经济路径3-7.0(SSP3-7.0,至2100年辐射强迫为7.0 W/m2)下按蚊伊丽莎白菌全球适生区分布 Figure 10 Suitable areas of Elizabethkingia anophelis in the world during different periods of the 21st century under shared socioeconomic pathway 3-7.0 (SSP3-7.0, radiative forcing being 7.0 W/m2 in 2100) |
| |
SSP1-2.6情景下,按蚊伊丽莎白菌中国适生区分布如图 11所示,相对于当前,2081-2100年间总适生区面积减少最多,减少了7.9%,高适生区明显向西南方向缩减,新疆地区的低适生区随时间明显减少,而中适生区面积随时间呈增加趋势(图 12)。而高辐射强迫SSP5-8.5情景下,按蚊伊丽莎白菌中国适生区分布如图 13所示,相对于当前,仅在2021-2040年间,总适生区面积略减少,仅减少了0.3%,其余各时期总适生区面积均增加,与SSP1-2.6气候情景下不同的是,2081-2100年间按蚊伊丽莎白菌在中国的适生区增加尤为明显,总适生区面积增加达46.4%。各等级适生区面积均随时间呈增加趋势,高、中适生区面积增长速率相似,低适生区面积增加尤为迅速。见图 12。
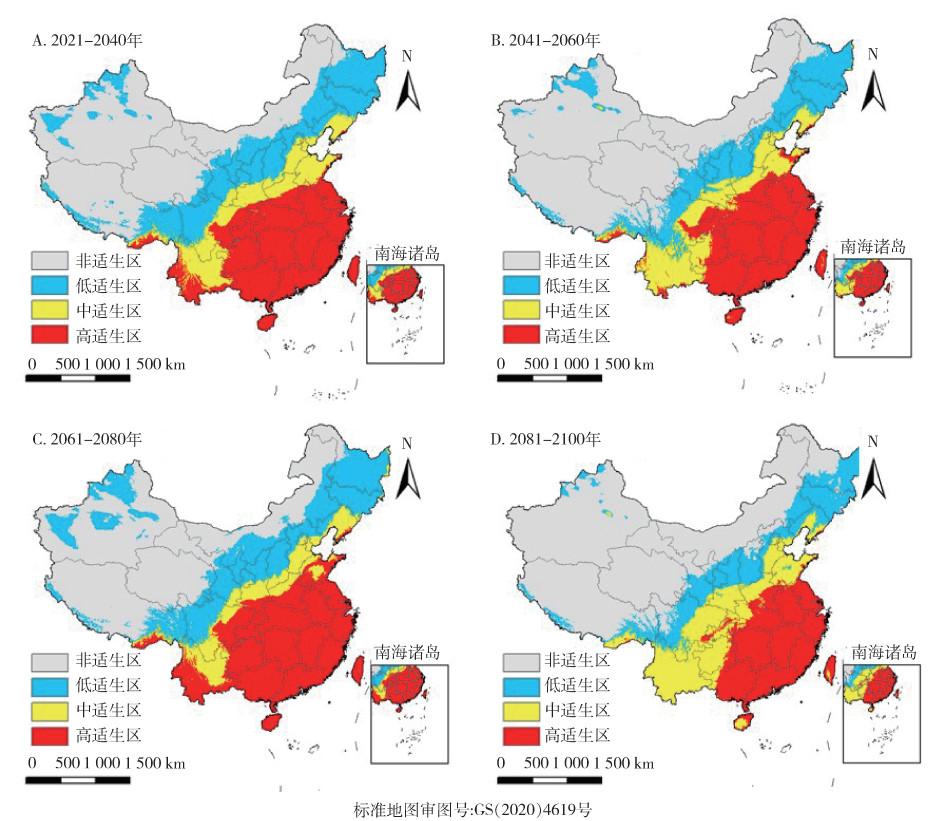
|
| 图 11 21世纪不同时期在共享社会经济路径1-2.6(SSP1-2.6,至2100年辐射强迫为2.6 W/m2)下按蚊伊丽莎白菌中国适生区分布 Figure 11 Suitable areas of Elizabethkingia anophelis in China during different periods of the 21st century under shared socioeconomic pathway 1-2.6 (SSP1-2.6, radiative forcing being 2.6 W/m2 in 2100) |
| |

|
| 注:SSP共享社会经济路径。 图 12 各气候情景下2021-2100年间按蚊伊丽莎白菌中国适生区相对于当前随时间变化情况 Figure 12 Changes over time in suitable areas for Elizabethkingia anophelis in China from 2021 to 2100 under various climate scenarios as compared with current suitable areas |
| |
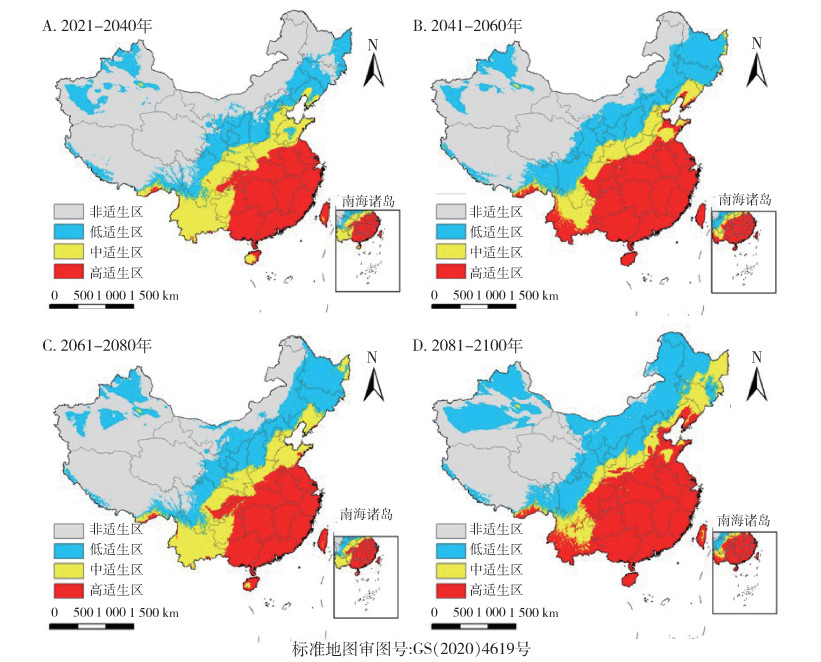
|
| 图 13 21世纪不同时期在共享社会经济路径5-8.5(SSP5-8.5,至2100年辐射强迫为8.5 W/m2)下按蚊伊丽莎白菌中国适生区分布 Figure 13 Suitable areas of Elizabethkingia anophelis in China during different periods of the 21 st century under shared socioeconomic pathway 5-8.5 (SSP5-8.5, radiative forcing being 8.5 W/m2 in 2100) |
| |
中等辐射强迫SSP2-4.5(图 14)及SSP3-7.0(图 15)情景下,按蚊伊丽莎白菌中国适生区分布如图所示,相对于当前,SSP2-4.5情景下仅在2081-2100年间适生区总面积减少,减少了6.1%,其余各时期适生区总面积均增加。中适生区、低适生区面积随时间明显增加,高适生区面积随时间明显减少。SSP3-7.0情景下相对于当前,各时期适生区总面积均增加,但高适生区面积减少。
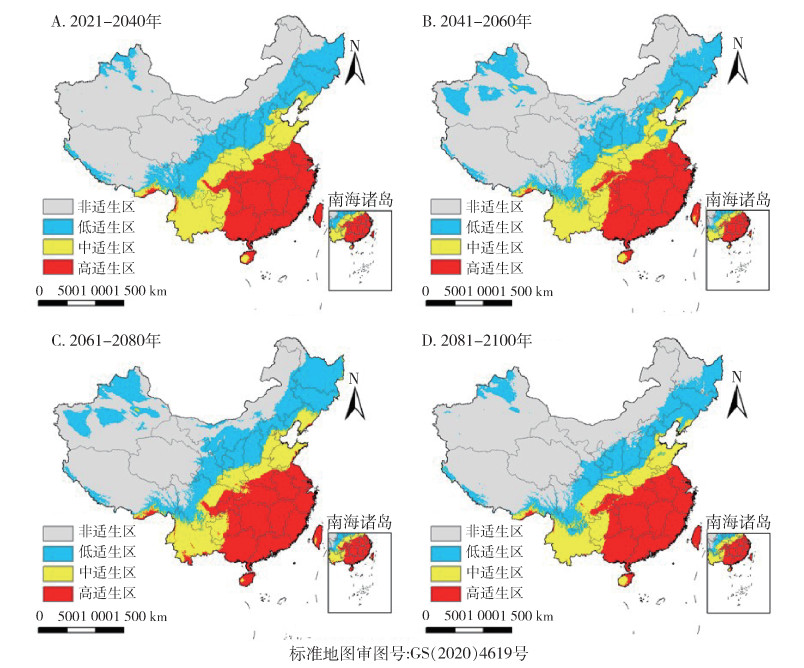
|
| 图 14 21世纪不同时期在共享社会经济路径2-4.5(SSP2-4.5,至2100年辐射强迫为4.5 W/m2)下按蚊伊丽莎白菌中国适生区分布 Figure 14 Suitable areas of Elizabethkingia anophelis in China during different periods of the 21 st century under shared socioeconomic pathway 2-4.5 (SSP2-4.5, radiative forcing being 4.5 W/m2 in 2100) |
| |
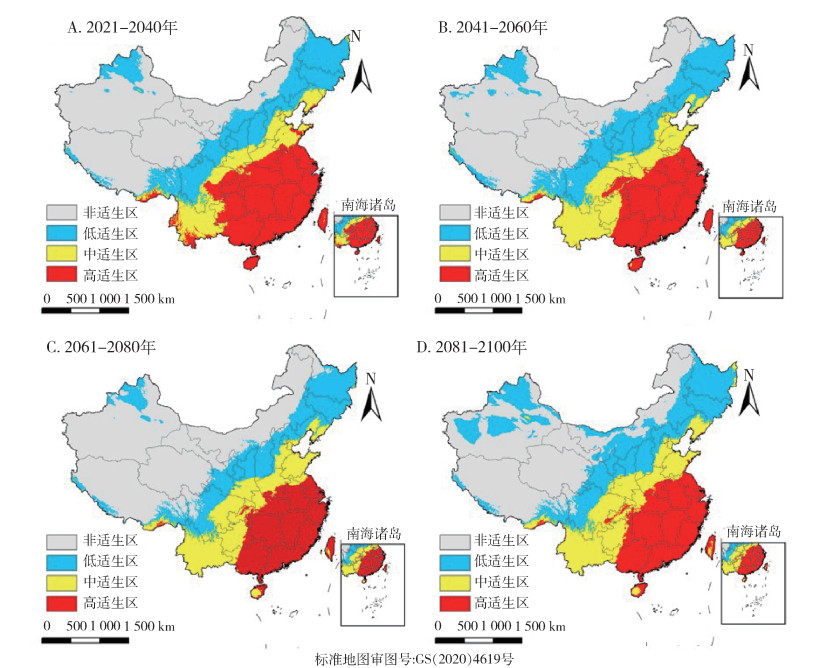
|
| 图 15 21世纪不同时期在共享社会经济路径3-7.0(SSP3-7.0,至2100年辐射强迫为7.0 W/m2)下按蚊伊丽莎白菌中国适生区分布 Figure 15 Suitable areas of Elizabethkingia anophelis in China during different periods of the 21st century under shared socioeconomic pathway 3-7.0 (SSP3-7.0, radiative forcing being 7.0 W/m2 in 2100) |
| |
按蚊伊丽莎白菌隶属于黄杆菌科伊丽莎白菌属,广泛存在于自然环境中,是成人和儿童脓毒症以及新生儿脑膜炎的重要病因[18],该菌不仅存在医院环境中在院内感染方面起着重要作用,同时也可导致社区获得性感染[19]。按蚊伊丽莎白菌在环境中的高持久性导致其若不能被及时发现并采取措施,将会有长期传播的可能性,因此本研究探究了影响按蚊伊丽莎白菌适生区的主要气候因素,研究发现,影响按蚊伊丽莎白菌适生区最重要的气候因素为年降水量,这可能与伊丽莎白菌属细菌通常存在于水环境中有关[20-22],其次是1月最低温,与Onyango等[23]所做研究中饲养温度较低时,按蚊中肠的伊丽莎白菌属鉴定比例较高一致。有研究表明,FC和RM对MaxEnt模型模拟的物种生态位有着密切影响[24],本研究使用AIC得到模型最佳参数,最终得到较为准确的预估结果,模型预测AUC值达0.948。已有研究揭示了按蚊伊丽莎白菌感染大规模暴发和全球快速传播的可能性[25],本研究借助其分布数据及气候因子,使用MaxEnt模型对按蚊伊丽莎白菌当前及未来在全球及中国的适生区进行了预估,结果表明,其适生区面积分布最广泛的国家为美国、西班牙、法国、中国、韩国,与先前报道有按蚊伊丽莎白菌感染的国家基本一致[6, 8, 26-27]。大部分时期气候变化对其全球适生区总面积的增加有推动作用,这将有可能增加人体与该菌的接触机会,影响人类健康。该菌在中国的适生区主要分布在秦岭-淮河线以南湿润地区,基本覆盖了报道有病例的省份[18],气候变化对其在中国的适生区同样大多呈现正面作用,中国总适生区面积增加最高可达近50%,且增长速率高于全球,其中高适生区由秦岭-淮河线以南蔓延至秦岭淮河线以北,有学者研究了全球气候变化对我国南北方气候分界线摆动趋势的影响,结果表明至2100年,亚热带的北界将北移翻越秦岭,直达黄土高原的南沿,在东部平原,将越过黄河,在河北平原上摆动[28]。这种湿润的亚热带气候区的北移,可能对按蚊伊丽莎白菌高适生区由东南沿海地区向中原及西北地区推进起着积极作用,导致气候变化对我国按蚊伊丽莎白菌适生区增加速率较全球更为显著。依据本研究得出的结论,我国内陆省份同样需加强按蚊伊丽莎白菌的监测。另外,本研究存在一定局限性。首先本文收集的物种分布数据来自于GBIF网站及公开发表的文献,收集可能不完全,导致结果存在一定偏差;其次本文所展现的按蚊伊丽莎白菌适生区分布情况,仅仅是在气候因素的影响下所得,但按蚊伊丽莎白菌广泛存在于环境中,且影响该菌感染人体的因素较多,如人体免疫系统功能强弱等,此方面本文尚未涉及,后续会考虑加入其他有意义的影响因素。
综上所述,按蚊伊丽莎白菌在全球及中国均存在较大面积高适生区,因此世界各国特别是美国、南美洲北部、欧洲西部、非洲中部及亚洲东南部部分有高适生区分布的国家应加强按蚊伊丽莎白菌的监测,预防其暴发及扩散。另外,对按蚊伊丽莎白菌适生区贡献率最高的气候变量为年降水量,因此在关注按蚊伊丽莎白菌感染病例的同时,也要重点加强环境尤其是水体中按蚊伊丽莎白菌的检测,避免引起大面积扩散、传播和流行。
利益冲突 无
| [1] |
Tiedje JM, Bruns MA, Casadevall A, et al. Microbes and climate change: A research prospectus for the future[J]. MBio, 2022, 13(3): e0080022. DOI:10.1128/mbio.00800-22 |
| [2] |
王蕾蕾, 郭庆兰, 杨帆. 伊丽莎白菌属细菌生物学特征及耐药性研究进展[J]. 中国感染与化疗杂志, 2020, 20(6): 711-715. Wang LL, Guo QL, Yang F. Research advances on biological characteristics and drug resistance pattern of Elizabethkingia[J]. J Infect Chemother, 2020, 20(6): 711-715. DOI:10.16718/j.1009-7708.2020.06.025 |
| [3] |
King EO. Studies on a group of previously unclassified bacteria associated with meningitis in infants[J]. Am J Clin Pathol, 1959, 31(3): 241-247. DOI:10.1093/ajcp/31.3.241 |
| [4] |
Kämpfer P, Matthews H, Glaeser SP, et al. Elizabethkingia anophelis sp. nov., isolated from the midgut of the mosquito Anopheles gambiae[J]. Int J Syst Evol Microbiol, 2011, 61(11): 2670-2675. DOI:10.1099/ijs.0.026393-0 |
| [5] |
Frank T, Gody JC, Nguyen LBL, et al. First case of Elizabethkingia anophelis meningitis in the Central African Republic[J]. Lancet, 2013, 381(9880): 1876. DOI:10.1016/S0140-6736(13)60318-9 |
| [6] |
Lau SKP, Chow WN, Foo CH, et al. Elizabethkingia anophelis bacteremia is associated with clinically significant infections and high mortality[J]. Sci Rep, 2016, 6(1): 26045. DOI:10.1038/srep26045 |
| [7] |
Teo J, Tan SYY, Tay M, et al. First case of Elizabethkingia anophelis outbreak in an intensive-care unit[J]. Lancet, 2013, 382(9895): 855-856. DOI:10.1016/S0140-6736(13)61858-9 |
| [8] |
Perrin A, Larsonneur E, Nicholson AC, et al. Evolutionary dynamics and genomic features of the Elizabethkingia anophelis 2015 to 2016 Wisconsin outbreak strain[J]. Nat Commun, 2017, 8(1): 15483. DOI:10.1038/ncomms15483 |
| [9] |
Janda JM, Lopez DL. Mini review: New pathogen profiles: Elizabethkingia anophelis[J]. Diagn Microbiol Infect Dis, 2017, 88(2): 201-205. DOI:10.1016/j.diagmicrobio.2017.03.007 |
| [10] |
Kukutla P, Lindberg BG, Pei D, et al. Insights from the genome annotation of Elizabethkingia anophelis from the malaria vector Anopheles gambiae[J]. PLoS One, 2014, 9(5): e97715. DOI:10.1371/journal.pone.0097715 |
| [11] |
Chen SC, Bagdasarian M, Walker ED. Elizabethkingia anophelis: Molecular manipulation and interactions with mosquito hosts[J]. Appl Environ Microbiol, 2015, 81(6): 2233-2243. DOI:10.1128/AEM.03733-14 |
| [12] |
李文玉, 李浩宇, 孙万万, 等. 明永冰川垂直气候带中可培养低温细菌多样性分析[J]. 基因组学与应用生物学, 2019, 38(5): 2070-2077. Li WY, Li HY, Sun WW, et al. Diversity of culturable low-temperature bacteria in vertical climate zones of mingyong glacier[J]. Genomics Appl Biol, 2019, 38(5): 2070-2077. DOI:10.13417/j.gab.038.002070 |
| [13] |
常彦斌. 按蚊伊丽莎白菌菌种鉴定、感染临床特征以及耐药机制的实验研究[D]. 重庆: 重庆医科大学, 2021. DOI: 10.27674/d.cnki.gcyku.2021.001343. Chang YB. Species identification, clinical features and resistance mechanisms of Elizabethkingia anophelis clinical isolates[D]. Chongqing: Chongqing Medical University, 2021. DOI: 10.27674/d.cnki.gcyku.2021.001343.(inChinese) |
| [14] |
Peterson AT. Predicting the geography of species' invasions via ecological niche modeling[J]. Quart Rev Biol, 2003, 78(4): 419-433. DOI:10.1086/378926 |
| [15] |
Thuiller W, Richardson DM, Pyšek P, et al. Niche-based modelling as a tool for predicting the risk of alien plant invasions at a global scale[J]. Glob Chang Biol, 2005, 11(12): 2234-2250. DOI:10.1111/j.1365-2486.2005.001018.x |
| [16] |
Duan RY, Kong XQ, Huang MY, et al. The predictive performance and stability of six species distribution models[J]. PLoS One, 2014, 9(11): e112764. DOI:10.1371/journal.pone.0112764 |
| [17] |
Burnard D, Gore L, Henderson A, et al. Comparative genomics and antimicrobial resistance profiling of Elizabethkingia isolates reveal nosocomial transmission and in vitro susceptibility to fluoroquinolones, tetracyclines, and trimethoprim-sulfamethoxazole[J]. J Clin Microbiol, 2020, 58(9): e00730-20. DOI:10.1128/JCM.00730-20 |
| [18] |
Wang BB, Cheng R, Feng Y, et al. Elizabethkingia anophelis: An important emerging cause of neonatal sepsis and meningitis in China[J]. Pediatr Infect Dis J, 2022, 41(5): e228-e232. DOI:10.1097/INF.0000000000003464 |
| [19] |
Breurec S, Criscuolo A, Diancourt L, et al. Genomic epidemiology and global diversity of the emerging bacterial pathogen Elizabethkingia anophelis[J]. Sci Rep, 2016, 6: 30379. DOI:10.1038/srep30379 |
| [20] |
Yung CF, Maiwald M, Loo LH, et al. Elizabethkingia anophelis and association with tap water and handwashing, Singapore[J]. Emerg Infect Dis, 2018, 24(9): 1730-1733. DOI:10.3201/eid2409.171843 |
| [21] |
Moore LSP, Owens DS, Jepson A, et al. Waterborne Elizabethkingia meningoseptica in adult critical care[J]. Emerg Infect Dis, 2016, 22(1): 9-17. DOI:10.3201/eid2201.150139 |
| [22] |
Kyritsi MA, Mouchtouri VA, Pournaras S, et al. First reported isolation of an emerging opportunistic pathogen (Elizabethkingia anophelis) from hospital water systems in greece[J]. J Water Health, 2018, 16(1): 164-170. DOI:10.2166/wh.2017.184 |
| [23] |
Onyango MG, Lange R, Bialosuknia S, et al. Zika virus and temperature modulate Elizabethkingia anophelis in Aedes albopictus[J]. Parasit Vectors, 2021, 14(1): 573. DOI:10.1186/s13071-021-05069-7 |
| [24] |
朱耿平, 原雪姣, 范靖宇, 等. MaxEnt模型参数设置对其所模拟物种地理分布和生态位的影响: 以茶翅蝽为例[J]. 生物安全学报, 2018, 27(2): 118-123. Zhu GP, Yuan XJ, Fan JY, et al. Effects of model parameters in MaxEnt modeling of ecological niche and geographic distribution: Case study of the brown marmorated stink bug, Halyomorpha haly[J]. J Biosafety, 2018, 27(2): 118-123. |
| [25] |
Hu SH, Xu H, Meng XH, et al. Population genomics of emerging Elizabethkingia anophelis pathogens reveals potential outbreak and rapid global dissemination[J]. Emerg Microbes Infect, 2022, 11(1): 2590-2599. DOI:10.1080/22221751.2022.2132880 |
| [26] |
Guerpillon B, Fangous MS, Le Breton E, et al. Elizabethkingia anophelis outbreak in France[J]. Infect Dis Now, 2022, 52(5): 299-303. DOI:10.1016/j.idnow.2022.05.005 |
| [27] |
Choi MH, Kim M, Jeong SJ, et al. Risk factors for Elizabethkingia acquisition and clinical characteristics of patients, South Korea[J]. Emerg Infect Dis, 2019, 25(1): 42-51. DOI:10.3201/eid2501.171985 |
| [28] |
鲁峰. 浅析秦岭-淮河线[J]. 治淮, 2000(8): 37-38. Lu F. Analysis of Qinling-Huaihe river line[J]. Harnessing Huaihe River, 2000(8): 37-38. |
 2023, Vol. 34
2023, Vol. 34


