扩展功能
文章信息
- 王晓旭, 冀好强, 韦晓慧, 梁莹, 刘起勇
- WANG Xiao-xu, JI Hao-qiang, WEI Xiao-hui, LIANG Ying, LIU Qi-yong
- 中国外来入侵致病菌风险评估研究
- Risk assessment of alien pathogen invasion in China
- 中国媒介生物学及控制杂志, 2023, 34(2): 154-164
- Chin J Vector Biol & Control, 2023, 34(2): 154-164
- 10.11853/j.issn.1003.8280.2023.02.004
-
文章历史
- 收稿日期: 2023-02-06
2 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 传染病预防控制国家重点实验室, 北京 102206;
3 南京医科大学公共卫生学院, 江苏 南京 210000
2 State Key Laboratory of Infectious Disease Prevention and Control, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 School of Public Health, Nanjing Medical University, Nanjing, Jiangsu 210000, China
外来物种入侵(alien species invasive)是指外来物种由原生地经自然或人为途径进入另一个生态环境,并在该生态系统中定居、自行繁殖建群和扩散而逐渐占领新栖息地的一种生态现象[1]。近年来,随着我国商品贸易及人员往来的频繁,外来入侵物种的来源、扩散等途径更加地隐蔽和复杂。同时,因我国多样化的气候条件,很多外来入侵物种能够找到适宜的生存空间,一旦定殖,就难以彻底根除,不仅会严重影响入侵地的生态环境,还会影响入侵地农林渔业经济的可持续发展[2]。外来入侵物种也能直接或间接地危害人类健康。现有的生物入侵研究基本都是围绕地上大型动植物开展的,关于病原微生物的研究较为罕见,又因病毒比致病菌扩散能力强,研究致病菌入侵的论文更是少之又少[3]。然而,通过人类活动有意或无意地将产于境外的致病菌引入我国,这些致病菌快速地生长繁殖,危害本地的生产和生活,改变当地的生态环境,带来很大的危害。
本文依据《中国外来入侵物种名单》《人间传染的病原微生物名录》[4],通过文献筛选、国内外网站查询和专家商谈等方法全面调查我国外来入侵致病菌现状的基础上,结合我国自然状况,对我国外来入侵致病菌进行风险评估,建立一套适宜于我国生态环境和经济发展现状的风险评估指标体系,提出我国外来入侵致病菌的管理和防范对策,为进一步开展全国外来物种普查和预防控制提供技术和方法支撑。
1 材料与方法 1.1 外来入侵致病菌的收集和调查方法根据《中国外来入侵物种名单》《人间传染的病原微生物名录》,通过收集和查阅国内外历年来发表或出版的与外来入侵物种相关的专著、论文集、名单及相关志书、网络数据库(https://www.ncbi.nlm.nih.gov/)、官方网站与其他相关期刊,再进一步结合咨询专家等方式对我国的外来入侵致病菌进行清查并发布外来入侵致病菌名录。文献查阅主要通过中国知网、相关外文文献数据库以及图书馆的文献查询;互联网信息则主要源于中国外来入侵物种数据库、全球入侵物种数据库等国内外的外来入侵物种数据库。调查对象为所有可见的外来致病菌及可疑种类,记录了各个外来入侵致病菌的中文名称、拉丁名、分类学地位、所致疾病、传播途径和媒介、主要宿主、感染症状、基因学信息、首次发现的时间地点和目前的分布、检测和防控方法等数据。部分外来入侵致病菌的来源地、地理经纬度分布等方面信息借助于互联网动态信息和相关学术性文献等资料的查询。候选物种须符合以下条件:①在中国境内无自然分布,即原产地不在中国;②危害人、畜健康或者影响农业生产(优先选择能够导致人类疾病的致病菌),由此初步确定了32种可能的外来入侵致病菌。
1.2 外来入侵致病菌的筛选和商讨通过文献查询及专家会谈筛选并剔除2000年以前就在我国曾出现的外来入侵致病菌10种,分别为单核细胞增生李斯特菌、创伤弧菌、鸟分枝杆菌、瘰疬分枝杆菌、巴西诺卡菌、文氏密螺旋体、溃疡棒状杆菌、迟钝爱德华菌、坏死梭杆菌和摩氏摩根菌。
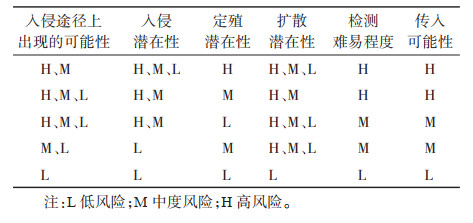
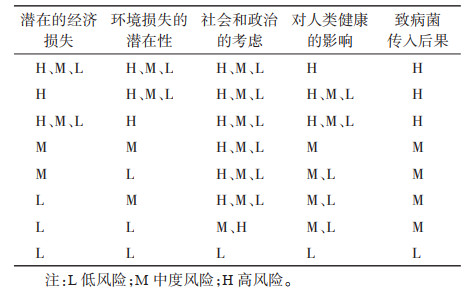
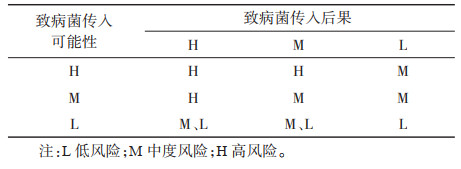
1.3 外来入侵致病菌的风险评估在对外来致病菌类生物入侵过程和机制分析的基础上,确立入侵风险分析框架和风险评估体系。本文将我国外来入侵致病菌风险评估指标体系分成了两部分:一是致病菌传入的可能性,包括入侵途径上出现的可能性、入侵的潜在性、定殖的潜在性、扩散的潜在性、检测的难易程度。二是致病菌传入的后果,包括致病菌潜在的经济损失、环境损失的潜在性、社会和政治的考虑、对人类健康的影响。完整的我国外来入侵致病菌风险评估指标体系见表 1。利用本文已构建的风险评价指标体系,根据致病菌传入可能性评估(表 2)和传入后果评估(表 3),对外来入侵致病菌的入侵风险等级进行综合评估(表 4),最终对外来入侵致病菌风险等级分为3类:L=低风险;M=中度风险;H=高风险。

|
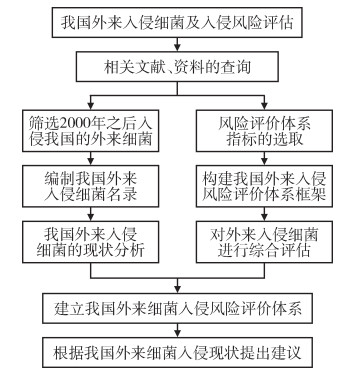
根据上述研究方法,最终确定了22种入侵或可能入侵我国的外来致病菌并进行了风险评估和详细阐述,提出适合我国外来入侵致病菌的防治建议。见图 1。
|
| 图 1 我国外来入侵致病菌调查及入侵风险评估流程图 Figure 1 Flow chart of the investigation and risk assessment of alien pathogen invasion in China |
| |
本研究筛选出2000年之后可能入侵中国的22种致病菌,并进行现状描述及风险性评估,发现17种致病菌为高风险入侵,5种致病菌为中风险入侵,其中有8种致病菌已入侵我国。见表 5。

|
杆菌状巴尔通体是卡瑞恩病(Carrion’s disease)的病原体,于1909年在秘鲁首次被分离[5]。卡瑞恩病表现为2个同时或独立发生的阶段[6],急性期即奥罗亚热(oroya fever),以急性溶血性贫血为特征,在这一阶段,未及时治疗病死率可高达88%[7];慢性期表现为结节性皮肤血管瘤,称为“秘鲁疣”[8]。卡瑞恩病的传播媒介为疣肿罗蛉(Lutzomyia verrucarum)和秘鲁罗蛉(L. peruensis)。受其传播媒介的限制,该病主要在哥伦比亚、厄瓜多尔和秘鲁的安第斯山脉地区流行[9],但其他地区也报告了零星病例。由于目前尚无卡瑞恩病疫苗,因此目前预防该病的措施主要是控制其传播媒介罗蛉[8],包括喷洒杀虫剂、使用蚊帐及在野外穿长袖衣服、长裤等。
2.1.2 伯特尔巴尔通体(B. birtlesii)伯特尔巴尔通体于2000年被首次命名,菌株来自德国一个靠近法国莱茵河的湿地保护区内1只小型哺乳动物体内[10]。其传播媒介为蓖麻硬蜱(Ixodes ricinus)[11],感染伯特尔巴尔通体的小鼠会发生菌血症和生殖障碍[12],尚未有伯特尔巴尔通体感染人的报道。
2.1.3 非洲跳鼠巴尔通体(B. jaculi)非洲跳鼠巴尔通体于2013年在埃及运往日本的跳鼠体内被发现[13],我国于2021年报道在青藏高原柴达木盆地捕获的小型哺乳动物体内分离得到[14]。其宿主为非洲跳鼠,感染人引起细菌性血管瘤病、菌血症[15],其首次在进口动物中被发现,我国在加强本地动物携带病原体监测的同时,也要加强进口动物检验检疫,谨防输入。
2.1.4 米库尔新埃立克体(Candidatus Neoehrlichia mikurensis)米库尔新埃立克体于1999年被荷兰学者首次发现[16],传播媒介为蓖麻硬蜱,宿主为啮齿动物,广泛分布于野生和家养哺乳动物以及鸟类中。我国学者于2003年从褐家鼠(Rattus norvegicus)体内检测到[17]。感染米库尔新埃立克体可出现发热、皮疹、血栓栓塞、血管炎等症状,免疫功能缺陷者可致多器官功能衰竭,甚至死亡[18]。目前,瑞士、瑞典、挪威、德国、波兰、荷兰、捷克共和国、奥地利、斯洛文尼亚、法国以及我国东北地区均有病例被发现,发病率呈逐年上升趋势[19]。目前,防范蜱叮咬是降低疾病发生风险的主要措施,如被蜱叮咬后出现症状,应及时就医,并告知医师相关暴露史,同时相关部门应加强米库尔新埃立克体传播媒介蓖麻硬蜱及宿主动物的入侵监测与管理。
2.1.5 腺热埃立希体(Erlichia sennetsu)腺热埃立希体属立克次体,是单核细胞和巨噬细胞的专性胞内细菌[20],会导致Sennetsu病,也称为传染性单核细胞增多症或腺热。这是一种非传染性疾病,已知在一些病例中由蜱传播[21]。该病的特点是出现淋巴病变、发热、白细胞减少和肝、肾等多器官损害。最早发现于日本西部[22],1987年在美国报道了首例人类埃立克体病病例,自那时以来,美国已经报告了260多例人类埃立克体病例,在某些地理区域,发病率超过了落基山斑点热[23]。此外,在马来西亚也有发生[20]。在流行地区应避免蜱叮咬,在蜱叮咬后应及时对症治疗,Sennetsu病也可用四环素治愈[24]。
2.1.6 土拉弗朗西丝菌新凶手亚种(Francisella tularensis subsp. novicida)土拉弗朗西丝菌新凶手亚种是高度传染性的革兰阴性细菌。由于所致疾病的高病死率和低感染剂量,有可能被用作生物武器。最早发现于美国,后在欧洲、日本也有出现[25]。土拉弗朗西丝菌新凶手亚种所导致的兔热病是一种使人丧失能力的疾病,主要有2种形式:肺炎性或溃疡性。如果不进行抗生素治疗,30%~60%的肺炎患者会死亡[26]。小型动物(例如,兔形目动物和啮齿动物)是土拉弗朗西丝菌的宿主,节肢动物可作为传播的生物媒介。虽然人类通常通过昆虫叮咬或接触受感染的组织而感染,但直接接触土拉弗朗西丝菌存在的环境也可能是另一个传染源[27]。
2.1.7 伊氏李斯特菌(Listeria ivanovii)伊氏李斯特菌是一类革兰阳性、兼性厌氧的胞内病原菌。对外界环境条件耐受能力强,可形成生物膜,在包括低温、高盐、较宽的pH值范围等环境条件下都能定殖并繁殖[28],这种特性使伊氏李斯特菌通常可长期存在于各类环境中[29]。1955年在保加利亚发现,目前分布于美国、加拿大、法国、爱尔兰、比利时和丹麦等国家。伊氏李斯特菌主要感染动物,特别是反刍类动物,可导致动物败血症、乳腺炎、肠炎、流产等[30]。近年来也常有伊氏李斯特菌引起人感染的报道[31]。伊氏李斯特菌引起的人李斯特菌病的报道较单增李斯特菌少,但伊氏李斯特菌在食品中的污染并不少见,人具有摄入伊氏李斯特菌污染食品而感染的风险[32]。
2.1.8 阿尔加西亚立克次体(Rickettsia japonica str. argasii)2018年采集于澳大利亚维多利亚州南部的露氏蝙蝠(Dew’s Australian bat)中分离到1株阿尔加西亚立克次体,并对其进行了全基因组分析和5个核心基因片段的测序。该分离物被命名为阿尔加西亚立克次体(ATCC VR-1665,CSUR R179)[33]。由于该细菌的媒介为可以旅行很远距离的垂缨蝶蝠(Chalinolobus gouldii),因此这种病原体出现在其他地方的可能性很高,据已有研究结果显示这种新的立克次体分离物有可能影响该地区的人类健康,但目前该菌株的致病性尚不清楚。
2.1.9 立式立克次体R株(R. rickettsii str. R)落基山斑疹热(Rocky Mountain spotted fever,RMSF)是美国最严重的蜱传立克次体传染病[34]。其病原体为R. rickettsii,而R亚种为毒性最强的菌株之一,其毒性强、发病快、致死率高[35]。RMSF最早于美国发现,后向北扩散至加拿大南部,向南扩散至南美洲。在北美的主要传播媒介为Dermacentor variabilis,南美洲的主要传播媒介为Amblyomma cajennense[36]。该病发病快,患者初期出现高热、严重头痛、水肿、消化道症状,延迟治疗会出现昏迷、呼吸衰竭、多器官系统损伤等严重后果。在过去未经治疗的患者死亡率高达87%,后经四环素类抗生素治疗后死亡率降至5%以内[34]。在流行地区应避免蜱叮咬,在蜱叮咬后应及时对症治疗。
2.1.10 印度立克次体(Rickettsia sp. Tenjiku01)2011年,印度立克次体被首次发现于印度班加罗尔郊区返回日本旅客的血液样本中,该血液样本的斑点热群立克次体(spotted fever group rickettsia,SFGR)抗体滴度升高[37]。印度立克次体由蜱传播,可引发斑点热群立克次体病,患者会出现发热、头痛、皮疹和视力改变等症状,同时伴随血小板减少症、肝功能障碍、C反应蛋白水平以及丙氨酸转氨酶水平升高[37]。避免蜱叮咬,在流行地区户外活动后检查是否有蜱叮咬为有效的防控方法。
2.1.11 菲利普立克次体(R. philipii)菲利普立克次体是太平洋海岸蜱虫热的病原体,1966年在美国加利福尼亚州首次被发现,其主要传播媒介为西海岸革蜱(D. occidentalis)和血红扇头蜱(Rhipicephalus sanguineus),该媒介蜱主要分布在美国西海岸地区[38]。菲利普立克次体可引发焦痂、发热、头痛等症状,类似于RMSF,但临床症状比其轻,菲利普立克次体所致疾病仍是美国西海岸地区重点关注的蜱传疾病[39]。避免蜱叮咬,在流行地区户外活动后检查是否有蜱叮咬为有效的防控方法。
2.1.12 富尼耶立克次体(R. fournieri)富尼耶立克次体于2013年在澳大利亚昆士兰首次被发现,媒介蜱为Argas polonicus[40]。之后在西班牙多个地区都有定殖,西班牙地区主要的媒介蜱为A. vulgaris和A. polonicus[41]。鸟类为重要的宿主,可能携带该病原体在其他地区定殖。该病原体与黑龙江立克次体同源性最高,并可导致斑点热群立克次体病[40]。有效的防控方法为避免蜱叮咬。
2.2 暂无传播媒介或传播方式不明的外来入侵致病菌 2.2.1 肉色诺卡菌(Nocardia carnea)肉色诺卡菌是一种机会致病菌,隶属于诺卡菌属,在土壤、腐殖质及水环境中较为常见[42],它通常影响免疫功能缺陷者,例如器官移植患者、肿瘤患者等[43]。传播方式为通过吸入或污染的伤口感染。该菌于1891年首次在德国被发现,目前在法国、西班牙[44]等国家也有报道。其具有实验室培养时间长、混合感染难以发现、感染后播散部位广泛等特征,导致该菌识别较难[45],其临床表现也呈现非特异性,导致其临床诊断困难[46]。目前对该菌的防控方法主要是提高自身免疫力,减少与该菌的接触。
2.2.2 按蚊伊丽莎白菌(Elizabethkingia anophelis)按蚊伊丽莎白菌于2011年首次从冈比亚按蚊(Anopheles gambiae)中肠分离出[47],后研究证实,其为疟疾媒介冈比亚按蚊肠道中主要菌种[48],但冈比亚按蚊作为按蚊伊丽莎白菌传播媒介的作用尚未得到证实。此外,按蚊伊丽莎白菌还广泛存在于自然环境中[49]。易感染免疫功能低下的人引起发热、脑膜炎、菌血症等症状,在新加坡[50]、美国[51]、中国香港[52]等地曾发生按蚊伊丽莎白菌感染暴发。由于其大部分感染发生于医院,因此其预防措施主要为提高自身免疫力、预防医院感染。
2.2.3 苍白密螺旋体极细亚种(Treponema pallidum subsp. pertenue)苍白密螺旋体极细亚种可以引起雅司病,表现为面部及四肢慢性溃疡,通过皮肤接触传播,非人类灵长动物是其动物宿主。虽然有学者讨论了苍蝇作为媒介机械传播该疾病的可能性[53],但直接接触传播仍然被认为是种内和种间传播的最可能方式[54],雅司病在一些热带国家,特别是缺乏公共卫生监测的农村地区仍有流行[55]。由于其在非人类灵长动物间的高流行率,控制根除雅司病,需要借助“同一健康”的方法,在管理人类健康的同时,也要对感染动物进行调查[56]。
2.2.4 牛棒状杆菌(Corynebacterium bovis)牛棒状杆菌是一种革兰阳性细菌,菌体短小,一端或两端膨大呈棒状,无荚膜,无鞭毛,不产生芽胞,多为条件致病菌,属于棒状杆菌科。该细菌常见于奶牛乳腺感染中,与奶牛产奶量减少和乳腺炎有关[57-59]。同时,牛棒状杆菌被认为是免疫缺陷裸小鼠的一种条件性致病菌,会导致裸小鼠角化过度皮炎(鳞状皮肤病)[60]。1982年日本首次公开报道了无胸腺裸小鼠的全身性角化过度皮炎感染(临床症状为背部皮肤出现鳞状皮屑),随后美国和意大利也分别在1990和1997年发现了该感染[61]。我国于2010年首次报道该病[62]。在1997年Scanziani等[63]报道,牛棒状杆菌在裸小鼠中的传播速度非常迅速,感染该致病菌后7~10 d发病率可达80%~100%,死亡率相对不高,在1%左右,感染后的临床症状一般会在7~10 d后自发性消失。显微镜下,该致病菌感染造成的皮肤组织学病变特点是明显的棘皮病、角化过度、稀疏的粒细胞和单核细胞浸润真皮层。至今我国尚未将其列入国家标准规定的监测项目,仅在2017年颁布的团体标准中规定了该菌的分离培养和PCR检测方法。
2.2.5 博兹曼军团菌(Legionella bozemanii)博兹曼军团菌是一种罕见的病原体,最初是从1名潜水员肺部接种的材料中分离出来的[64],直到20世纪70年代末才被鉴定为军团菌属的一种[65]。目前,博兹曼军团菌引起的肺炎约占军团菌引起肺炎的3%~5%[66],发病特点为发热、无效咳嗽、白细胞增多,免疫功能低下的患者感染博兹曼军团菌通常会导致肺部空洞性病变。由于目前市面上没有可用的血清学试剂盒能够高度敏感地识别博兹曼军团菌的抗体,鉴定多数通过支气管肺泡灌洗液和胸腔抽吸物标本,以检测支原体和军团菌。此外研究表明利福平与红霉素联合使用可增加肺炎链球菌肺炎的杀菌作用[67]。
2.2.6 非洲分枝杆菌(Mycobacterium africanum)1968年Castets等[68]首先在非洲西部某些病例中分离出非洲分枝杆菌。随后又在非洲人、亚洲人、英国人中发现类似的结核杆菌。非洲分枝杆菌能够引起结核病,临床症状为午后低热、乏力、咳嗽咯血、盗汗、消瘦等,一般会引起咳嗽咳痰或者咳血等。非洲分枝杆菌是西非结核病的一个重要原因,据估计多达50%的结核病病例均是由它引起[69]。非洲分枝杆菌生长不良,对唾吩-2-羧酸肼(TCH)敏感。
2.2.7 溃疡分枝杆菌(M. ulcerans)溃疡分枝杆菌是布鲁里溃疡的病原体,1948年于乌干达首次发现,后广泛流行于赤道附近国家,特别是中非、南非国家的热带雨林地区[34]。布鲁里溃疡是继结核病、麻风病后的第3种最常见的分枝杆菌病,在非洲一些国家的发病率高达20/10万[70]。该细菌喜好湿热,主要由皮肤接触引发疾病,该病好发于皮肤暴露处,特别多见前臂及小腿。溃疡分枝杆菌侵入皮肤后,在局部增殖,分泌一种称为分枝杆菌内酯的细胞毒素,引起皮肤和皮下脂肪广泛坏死而形成溃疡[71-72]。目前已在我国广东地区发现,南方湿热地区应注重该病的预防,避免存在外伤的皮肤接触可能被溃疡分枝杆菌污染的水、土或植物。该病抗生素治疗效果并不理想,外科手术切除是布鲁里溃疡的主要治疗方式[73]。
2.2.8 玛尔摩分枝杆菌(M. malmoense)玛尔摩分枝杆菌为条件致病菌,可引发非结核分枝杆菌病。该菌为不产色分枝杆菌,在25~37 ℃时生长,45 ℃时生长受抑制,轻度需氧。该细菌对培养基去污染剂敏感,又需要复杂的营养且生长缓慢,常易误认为培养阴性[74]。该菌由呼吸道传播,一般引发呼吸道感染,出现以咳嗽为主,其次有咯血、气急、体质量减轻以及发热等结核病相似的临床症状。20世纪于瑞典玛尔摩首次发现,后主要流行于欧美澳地区。有研究发现在非结核分枝杆菌引发的疾病中,玛尔摩分枝杆菌引发的症状最严重[75],且抗生素耐药率较高,治疗效果不理想[74]。2009年在广州地区发现8例玛尔摩分枝杆菌[76],全国调查显示该致病菌未引起广泛传播[77-78],应实施相关措施,防止该致病菌的传播流行。
2.2.9 苏尔加分枝杆菌(M. szulgai)苏尔加分枝杆菌1972年首次在日本发现,属于暗产色分枝杆菌,主要为呼吸道传播,一般引发呼吸道感染,出现结核病相关症状,如咳嗽、咳血、体质量减轻、身体衰弱、发热等结核病相似的临床症状[79]。以注意个人卫生、增强自身免疫力、接种卡介苗等措施来预防苏尔加分枝杆菌的流行。目前该菌在世界范围内流行,21世纪以来在我国上海、福建、云南、江苏等省(直辖市)也陆续发现[80]。虽然没有标准化的治疗方案,但是有研究显示采用利福平、异烟肼、乙胺丁醇等药物组成的联合方案进行治疗能取得较好的效果[81]。
2.2.10 腺热新立克次体(Neorickettsia sennetsu)1950年在日本发现首例由腺热新立克次体感染的患者,目前主要流行于老挝、泰国、马来西亚等东南亚国家[82-83]。患者通过食用生鱼而感染,引发发热、头痛、淋巴结肿大以及传染性单核细胞增多等症状[84]。
3 讨论本研究基于《人间传染的病原微生物名录》等文件收录的158种致病菌类病原微生物逐一筛选,最终纳入22种2000年后入侵中国或未入侵中国的致病菌类病原微生物。此外,通过风险评估矩阵评估可能外来入侵致病菌的传入可能性和传入后果的风险等级。其中共有17种高风险致病菌,5种中风险致病菌,8种在2000年后已经入侵我国。此外,有8种未入侵我国但仍为高风险细菌。该类细菌在我国存在适生区和可以寄生的宿主,其次是该菌一旦入侵,对经济和人类造成较为严重的危害。因此,通过描述各类细菌类病原体的生物学特点、致病性特征等,为相关部门在开展预防、治疗工作时提供依据。
在新型冠状病毒肺炎疫情后,世界各国之间的国际贸易等跨国活动将日益密切,各国之间的人员流动也将逐渐增长,这无疑会增加病原菌入侵我国的风险。病原生物入侵一旦被发现说明它已经在该地区定殖并造成一定的危害,这时再想消灭已经非常困难。因此面对病原菌入侵,最有效的方式是预防。我们需要在实践应用的基础上,对评估体系进一步的改进与优化。同时,应完善动态监测预警体系,大力开展入侵物种信息系统建设,特别是根据普查及监测结果,建立各级行政区域危害情况分布图,不断更新和细化外来入侵物种数据库。从而制定合理的防控管理措施,将有效降低致病菌入侵给我国带来的健康、生态和经济危害,保障国家生物安全。
本研究仍存在一定的局限性:①本研究依据《人间传染的病原微生物名录》等文件收录的细菌类病原体进行筛选,这可能会忽略一些风险更高的致病菌;②本研究研发的入侵致病菌风险评估矩阵是经专家设计、研讨而确定,在评分时可能受到主观影响,从而对评估结果产生一定误差;③由于文献检索的局限性,本研究仅能查询中国知网、PubMed、Web of Science等数据库收录的文献,因此在查询世界范围内入侵致病菌的相关文献时可能有所遗漏。
利益冲突 无
| [1] |
胡隐昌, 宋红梅, 牟希东, 等. 浅议我国外来物种入侵问题及其防治对策[J]. 生物安全学报, 2012, 21(4): 256-261. Hu YC, Song HM, Mu XD, et al. Invasion of exotic species and their control measures taken in China[J]. J Biosaf, 2012, 21(4): 256-261. DOI:10.3969/j.issn.2095-1787.2012.04.003 |
| [2] |
徐媛媛. 我国开始严管外来入侵物种[J]. 生态经济, 2022, 38(11): 9-12. Xu YY. Our country began to regulate alien invasive species[J]. Ecol Econ, 2022, 38(11): 9-12. |
| [3] |
马超. 外来细菌入侵土壤的生物影响因素研究[D]. 南京: 南京农业大学, 2016. Ma C. Influences of biotic factors on alien bacteria invasion in soil[D]. Nanjing: Nanjing Agricultural University, 2016. (in Chinese) |
| [4] |
环境保护部, 中国科学院. 关于发布《中国自然生态系统外来入侵物种名单(第四批)》的公告[R]. 北京: 环境保护部, 中科院, 2016. Ministry of Environmental Protection, Chinese Academy of Sciences. Announcement on the release of the list of alien invasive species in China's natural ecosystems (the fourth batch)[R]. Beijing: Ministry of Environmental Protection, Chinese Academy of Sciences, 2016. (in Chinese) |
| [5] |
Cueto M. Tropical medicine and bacteriology in Boston and Peru: Studies of Carrión's disease in the early twentieth century[J]. Med Hist, 1996, 40(3): 344-364. DOI:10.1017/s0025727300061330 |
| [6] |
Sanchez Clemente N, Ugarte-Gil CA, Solórzano N, et al. Bartonella bacilliformis: A systematic review of the literature to guide the research agenda for elimination[J]. PLoS Negl Trop Dis, 2012, 6(10): e1819. DOI:10.1371/journal.pntd.0001819 |
| [7] |
Gomes C, Pons MJ, del Valle Mendoza J, et al. Carrion's disease: An eradicable illness?[J]. Infect Dis Poverty, 2016, 5(1): 105. DOI:10.1186/s40249-016-0197-7 |
| [8] |
Minnick MF, Anderson BE, Lima A, et al. Oroya fever and verruga peruana: Bartonelloses unique to South America[J]. PLoS Negl Trop Dis, 2014, 8(7): e2919. DOI:10.1371/journal.pntd.0002919 |
| [9] |
Gomes C, Ruiz J. Carrion's disease: The sound of silence[J]. Clin Microbiol Rev, 2018, 31(1): e00056-17. DOI:10.1128/cmr.00056-17 |
| [10] |
Bermond D, Heller R, Barrat F, et al. Bartonella birtlesii sp. nov., isolated from small mammals (Apodemus spp.)[J]. Int J Syst Evol Microbiol, 2000, 50(Pt 6): 1973-1979. |
| [11] |
Reis C, Cote M, Le Rhun D, et al. Vector competence of the tick Ixodes ricinus for transmission of Bartonella birtlesii[J]. PLoS Negl Trop Dis, 2011, 5(5): e1186. DOI:10.1371/journal.pntd.0001186 |
| [12] |
Boulouis HJ, Barrat F, Bermond D, et al. Kinetics of Bartonella birtlesii infection in experimentally infected mice and pathogenic effect on reproductive functions[J]. Infect Immun, 2001, 69(9): 5313-5317. DOI:10.1128/iai.69.9.5313-5317.2001 |
| [13] |
Sato S, Kabeya H, Fujinaga Y, et al.. Bartonella jaculi sp. nov., B. callosciuri sp. nov., B. pachyuromydis sp. nov. and B. acomydis sp. nov., isolated from wild Rodentia[J]. Int J Syst Evol Microbiol, 2013, 63(Pt 5): 1734-1740. DOI:10.1099/ijs.0.041939-0 |
| [14] |
Rao HX, Li SJ, Lu L, et al. Genetic diversity of Bartonella species in small mammals in the Qaidam Basin, western China[J]. Sci Rep, 2021, 11(1): 1735. DOI:10.1038/s41598-021-81508-w |
| [15] |
Okaro U, Addisu A, Casanas B, et al. Bartonella species, an emerging cause of blood-culture-negative endocarditis[J]. Clin Microbiol Rev, 2017, 30(3): 709-746. DOI:10.1128/cmr.00013-17 |
| [16] |
Schouls LM, van de Pol I, Rijpkema SGT, et al. Detection and identification of Ehrlichia, Borrelia burgdorferi sensu lato, and Bartonella species in Dutch Ixodes ricinus ticks[J]. J Clin Microbiol, 1999, 37(7): 2215-2222. DOI:10.1128/jcm.37.7.2215-2222.1999 |
| [17] |
Pan H, Liu SZ, Ma YH, et al. Ehrlichia-like organism gene found in small mammals in the suburban district of Guangzhou of China[J]. Ann N Y Acad Sci, 2003, 990(1): 107-111. DOI:10.1111/j.1749-6632.2003.tb07346.x |
| [18] |
Silaghi C, Beck R, Oteo JA, et al. Neoehrlichiosis: An emerging tick-borne zoonosis caused by Candidatus Neoehrlichia mikurensis[J]. Exp Appl Acarol, 2016, 68(3): 279-297. DOI:10.1007/s10493-015-9935-y |
| [19] |
李紫薇, 尹家祥. 新埃立克体病研究进展[J]. 疾病监测, 2022, 37(12): 1604-1609. Li ZW, Yin JX. Research progress in study of neoehrlichiosis[J]. Dis Surveill, 2022, 37(12): 1604-1609. DOI:10.3784/jbjc.20206270302 |
| [20] |
Zhang YL, Ohashi N, Rikihisa Y. Cloning of the heat shock protein 70 (HSP70) gene of Ehrlichia sennetsu and differential expression of HSP70 and HSP60 mRNA after temperature upshift[J]. Infect Immun, 1998, 66(7): 3106-3112. DOI:10.1128/iai.66.7.3106-3112.1998 |
| [21] |
Rikihisa Y. The tribe Ehrlichieae and ehrlichial diseases[J]. Clin Microbiol Rev, 1991, 4(3): 286-308. DOI:10.1128/cmr.4.3.286 |
| [22] |
Brouqui P, Dumler JS, Raoult D, et al. Antigenic characterization of ehrlichiae: Protein immunoblotting of Ehrlichia canis, E. sennetsu, and E. risticii[J]. J Clin Microbiol, 1992, 30(5): 1062-1066. DOI:10.1128/jcm.30.5.1062-1066.1992 |
| [23] |
Fishbein DB, Kemp A, Dawson JE, et al. Human ehrlichiosis: Prospective active surveillance in febrile hospitalized patients[J]. J Infect Dis, 1989, 160(5): 803-809. DOI:10.1093/infdis/160.5.803 |
| [24] |
Brouqui P, Raoult D. In vitro susceptibility of Ehrlichia sennetsu to antibiotics[J]. Antimicrob Agents Chemother, 1990, 34(8): 1593-1596. DOI:10.1128/aac.34.8.1593 |
| [25] |
Birdsell DN, Stewart T, Vogler AJ, et al. Francisella tularensis subsp. novicida isolated from a human in Arizona[J]. BMC Res Notes, 2009, 2: 223. DOI:10.1186/1756-0500-2-223 |
| [26] |
Inglesby TV, Dennis DT, Henderson DA, et al. Plague as a biological weapon: Medical and public health management. Working Group on Civilian Biodefense[J]. JAMA, 2000, 283(17): 2281-2290. DOI:10.1001/jama.283.17.2281 |
| [27] |
Keim P, Johansson A, Wagner DM. Molecular epidemiology, evolution, and ecology of Francisella[J]. Ann N Y Acad Sci, 2007, 1105(1): 30-66. DOI:10.1196/annals.1409.011 |
| [28] |
Ramage CP, Low JC, McLauchlin J, et al. Characterisation of Listeria ivanovii isolates from the UK using pulsed-field gel electrophoresis[J]. FEMS Microbiol Lett, 1999, 170(2): 349-353. DOI:10.1111/j.1574-6968.1999.tb13394.x |
| [29] |
Vázquez-Villanueva J, Orgaz B, Ortiz S, et al. Predominance and persistence of a single clone of Listeria ivanovii in a Manchego cheese factory over 6 months[J]. Zoonoses Public Health, 2010, 57(6): 402-410. DOI:10.1111/j.1863-2378.2009.01232.x |
| [30] |
Jamali H, Radmehr B. Frequency, virulence genes and antimicrobial resistance of Listeria spp. isolated from bovine clinical mastitis[J]. Vet J, 2013, 198(2): 541-542. DOI:10.1016/j.tvjl.2013.06.012 |
| [31] |
李华信, 刘宇, 蒋欢, 等. 血液和骨髓同时感染伊氏李斯特菌和类志贺邻单胞菌一例[J]. 中华临床医师杂志(电子版), 2012, 6(2): 528-529. Li HX, Liu Y, Jiang H, et al. A case of blood and bone marrow infection with Listeria iberi and Plesiomonas shigelloides[J]. Chin J Clin (Electron Ed), 2012, 6(2): 528-529. DOI:10.3877/cma.j.issn.1674-0785.2012.02.070 |
| [32] |
Alvarez-Ordóñez A, Leong D, Morgan CA, et al. Occurrence, persistence, and virulence potential of Listeria ivanovii in foods and food processing environments in the republic of Ireland[J]. Biomed Res Int, 2015, 2015: 350526. DOI:10.1155/2015/350526 |
| [33] |
Izzard L, Chung M, Dunning Hotopp J, et al. Isolation of a divergent strain of Rickettsia japonica from Dew's Australian bat Argasid ticks [Argas (Carios) dewae] in Victoria, Australia[J]. Ticks Tick Borne Dis, 2018, 9(6): 1484-1488. DOI:10.1016/j.ttbdis.2018.07.007 |
| [34] |
Dantas-Torres F. Rocky Mountain spotted fever[J]. Lancet Infect Dis, 2007, 7(11): 724-732. DOI:10.1016/s1473-3099(07)70261-x |
| [35] |
Anacker RL, List RH, Mann RE, et al. Antigenic heterogeneity in high- and low-virulence strains of Rickettsia rickettsii revealed by monoclonal antibodies[J]. Infect Immun, 1986, 51(2): 653-660. DOI:10.1128/iai.51.2.653-660.1986 |
| [36] |
Parola P, Paddock CD, Socolovschi C, et al. Update on tick-borne rickettsioses around the world: A geographic approach[J]. Clin Microbiol Rev, 2013, 26(4): 657-702. DOI:10.1128/cmr.00032-13 |
| [37] |
Takajo I, Sekizuka T, Fujita H, et al. Possible case of novel spotted fever group rickettsiosis in traveler returning to Japan from India[J]. Emerg Infect Dis, 2016, 22(6): 1079-1082. DOI:10.3201/eid2206.151985 |
| [38] |
Osborne CJ, Wakeman-Hill AJ, Loa SE, et al. Rickettsia spp. in five tick species collected in central California[J]. J Med Entomol, 2020, 57(5): 1596-1603. DOI:10.1093/jme/tjaa080 |
| [39] |
Padgett KA, Bonilla D, Eremeeva ME, et al. The eco-epidemiology of pacific coast tick fever in California[J]. PLoS Negl Trop Dis, 2016, 10(10): e0005020. DOI:10.1371/journal.pntd.0005020 |
| [40] |
Diop A, Barker SC, Eberhard M, et al. Rickettsia fournieri sp. nov., a novel spotted fever group rickettsia from Argas lagenoplastis ticks in Australia[J]. Int J Syst Evol Microbiol, 2018, 68(12): 3781-3784. DOI:10.1099/ijsem.0.003057 |
| [41] |
Palomar AM, Veiga J, Portillo A, et al. Novel genotypes of nidicolous Argas ticks and their associated microorganisms from Spain[J]. Front Vet Sci, 2021, 8: 637837. DOI:10.3389/fvets.2021.637837 |
| [42] |
Provost F, Laurent F, Blanc MV, et al. Transmission of nocardiosis and molecular typing of Nocardia species: A short review[J]. Eur J Epidemiol, 1997, 13(2): 235-258. DOI:10.1023/a:1007324214800 |
| [43] |
Williams E, Jenney AW, Spelman DW. Nocardia bacteremia: A single-center retrospective review and a systematic review of the literature[J]. Int J Infect Dis, 2020, 92: 197-207. DOI:10.1016/j.ijid.2020.01.011 |
| [44] |
Valdezate S, Garrido N, Carrasco G, et al. Epidemiology and susceptibility to antimicrobial agents of the main Nocardia species in Spain[J]. J Antimicrob Chemother, 2017, 72(3): 754-761. DOI:10.1093/jac/dkw489 |
| [45] |
Mehta HH, Shamoo Y. Pathogenic Nocardia: A diverse genus of emerging pathogens or just poorly recognized?[J]. PLoS Pathog, 2020, 16(3): e1008280. DOI:10.1371/journal.ppat.1008280 |
| [46] |
Muñoz J, Mirelis B, Aragón LM, et al. Clinical and microbiological features of nocardiosis 1997-2003[J]. J Med Microbiol, 2007, 56(Pt 4): 545-550. DOI:10.1099/jmm.0.46774-0 |
| [47] |
Kämpfer P, Matthews H, Glaeser SP, et al. Elizabethkingia anophelis sp. nov., isolated from the midgut of the mosquito Anopheles gambiae[J]. Int J Syst Evol Microbiol, 2011, 61(Pt 11): 2670-2675. |
| [48] |
Kukutla P, Lindberg BG, Pei D, et al. Insights from the genome annotation of Elizabethkingia anophelis from the malaria vector Anopheles gambiae[J]. PLoS One, 2014, 9(5): e97715. DOI:10.1371/journal.pone.0097715 |
| [49] |
王蕾蕾, 郭庆兰, 杨帆. 伊丽莎白菌属细菌生物学特征及耐药性研究进展[J]. 中国感染与化疗杂志, 2020, 20(6): 711-715. Wang LL, Guo QL, Yang F. Research advances on biological characteristics and drug resistance pattern of Elizabethkingia[J]. Chin J Infect Chemother, 2020, 20(6): 711-715. DOI:10.16718/j.1009-7708.2020.06.025 |
| [50] |
Teo J, Tan SYY, Tay M, et al. First case of Elizabethkingia anophelis outbreak in an intensive-care unit[J]. Lancet, 2013, 382(9895): 855-856. DOI:10.1016/s0140-6736(13)61858-9 |
| [51] |
Perrin A, Larsonneur E, Nicholson AC, et al. Evolutionary dynamics and genomic features of the Elizabethkingia anophelis 2015 to 2016 Wisconsin outbreak strain[J]. Nat Commun, 2017, 8: 15483. DOI:10.1038/ncomms15483 |
| [52] |
Lau SKP, Chow WN, Foo CH, et al. Elizabethkingia anophelis bacteremia is associated with clinically significant infections and high mortality[J]. Sci Rep, 2016, 6: 26045. DOI:10.1038/srep26045 |
| [53] |
Kumm HW, Turner TB. The transmission of yaws from man to rabbits by an insect vector, hippelates pallipes loew[J]. Am J Trop Med Hyg, 1936, s1-16(3): 245-271. DOI:10.4269/ajtmh.1936.s1-16.245 |
| [54] |
Chuma IS, Batamuzi EK, Collins DA, et al. Widespread Treponema pallidum infection in Nonhuman Primates, Tanzania[J]. Emerg Infect Dis, 2018, 24(6): 1002-1009. DOI:10.3201/eid2406.180037 |
| [55] |
Godornes C, Giacani L, Barry AE, et al. Development of a multilocus sequence typing (MLST) scheme for Treponema pallidum subsp. pertenue: Application to yaws in Lihir Island, Papua New Guinea[J]. PLoS Negl Trop Dis, 2017, 11(12): e0006113. DOI:10.1371/journal.pntd.0006113 |
| [56] |
Webster JP, Gower CM, Knowles SCL, et al. One health: An ecological and evolutionary framework for tackling neglected zoonotic diseases[J]. Evol Appl, 2016, 9(2): 313-333. DOI:10.1111/eva.12341 |
| [57] |
Brooks BW, Barnum DA. Characterization of strains of Corynebacterium bovis[J]. Can J Comp Med, 1984, 48(2): 230-232. |
| [58] |
Chow SK, Bui U, Clarridge JE. Corynebacterium bovis eye infections, Washington, USA, 2013[J]. Emerg Infect Dis, 2015, 21(9): 1687-1689. DOI:10.3201/eid2109.150520 |
| [59] |
Schröder J, Glaub A, Schneider J, et al. Draft genome sequence of Corynebacterium bovis DSM 20582, which causes clinical mastitis in dairy cows[J]. J Bacteriol, 2012, 194(16): 4437. DOI:10.1128/jb.00839-12 |
| [60] |
黎明. 实验动物设施中牛棒状杆菌感染的防治策略[J]. 实验动物与比较医学, 2020, 40(3): 252-256. Li M. Strategies to prevent and eliminate infection of Corynebacterium bovis from laboratory animal facility[J]. Lab Anim Comp Med, 2020, 40(3): 252-256. DOI:10.3969/j.issn.1674-5817.2020.03.014 |
| [61] |
Scanziani E, Gobbi A, Crippa L, et al. Hyperkeratosis-associated coryneform infection in severe combined immunodeficient mice[J]. Lab Anim, 1998, 32(3): 330-336. DOI:10.1258/002367798780559239 |
| [62] |
张强, 熊炜, 李健, 等. 裸鼠过度角化症牛棒状杆菌的分离鉴定[J]. 中国预防兽医学报, 2011, 33(8): 581-584. Zhang Q, Xiong W, Li J, et al. Isolation and identification of Corynebacterium bovis of hyperkeratosis in athymic nude mice[J]. Chin J Prev Vet Med, 2011, 33(8): 581-584. DOI:10.3969/j.issn.1008-0589.2011.08.01 |
| [63] |
Scanziani E, Gobbi A, Crippa L, et al. Outbreaks of hyperkeratotic dermatitis of athymic nude mice in northern Italy[J]. Lab Anim, 1997, 31(3): 206-211. DOI:10.1258/002367797780596310 |
| [64] |
Swinburn CR, Gould FK, Corris PA, et al. Opportunist pulmonary infection with Legionella bozemanii[J]. Thorax, 1989, 44(5): 434-435. DOI:10.1136/thx.44.5.434 |
| [65] |
Cordes LG, Gorman GW, Wilkinson HW, et al. Atypical Legionella-like organisms: Fastidious water-associated bacteria pathogenic for man[J]. Lancet, 1979, 314(8149): 927-930. DOI:10.1016/s0140-6736(79)92623-0 |
| [66] |
Reingold AL, Thomason BM, Brake BJ, et al. Legionella pneumonia in the United States: The distribution of serogroups and species causing human illness[J]. J Infect Dis, 1984, 149(5): 819. DOI:10.1093/infdis/149.5.819 |
| [67] |
Jaeger TM, Atkinson PP, Adams BA, et al. Legionella bozemanii pneumonia in an immunocompromised patient[J]. Mayo Clin Proc, 1988, 63(1): 72-76. DOI:10.1016/s0025-6196(12)62667-6 |
| [68] |
Castets M, Boisvert H, Grumbach F, et al. Tuberculosis bacilli of the African type: Preliminary note[J]. Rev Tuberc Pneumol (Paris), 1968, 32(2): 179-184. |
| [69] |
de Jong BC, Antonio M, Gagneux S. Mycobacterium africanum: Review of an important cause of human tuberculosis in West Africa[J]. PLoS Negl Trop Dis, 2010, 4(9): e744. DOI:10.1371/journal.pntd.0000744 |
| [70] |
Asiedu K, Scherpbier R, Raviglione M. Buruli ulcer: Mycobacterium ulcerans infection[R]. Geneva: World Health Organization, 2000.
|
| [71] |
George KM, Chatterjee D, Gunawardana G, et al. Mycolactone: A polyketide toxin from Mycobacterium ulcerans required for virulence[J]. Science, 1999, 283(5403): 854-857. DOI:10.1126/science.283.5403.854 |
| [72] |
杨正时. 不太引人注目的新发感染病: 溃疡分枝杆菌感染(Buruli溃疡)[J]. 中国微生态学杂志, 2011, 23(3): 283-289. Yang ZS. Less high-profile emerging infection: Mycobacterium ulceration (Buruli ulcer)[J]. Chin J Microecol, 2011, 23(3): 283-289. DOI:10.13381/j.cnki.cjm.2011.03.019 |
| [73] |
周学鲁, 谭学君, 叶伟洪, 等. 溃疡分枝杆菌引发Buruli溃疡的诊断与治疗(附6例报告并文献复习)(英文)[J]. 中国热带医学, 2005, 5(4): 696-699. Zhou XL, Tan XJ, Ye WH, et al. Mycobacterium ulcerans infection (Buruli ulcer) first report of six cases in China with literature review[J]. China Trop Med, 2005, 5(4): 696-699. DOI:10.3969/j.issn.1009-9727.2005.04.018 |
| [74] |
江泽宏. 马尔摩分枝杆菌病[J]. 国外医学. 呼吸系统分册, 1986(4): 184-185, 186. Jiang ZH. Mycobacterium malmosis infection[J]. For Med Respi Syst Vol, 1986(4): 184-185, 186. |
| [75] |
Stout JE, Koh WJ, Yew WW. Update on pulmonary disease due to non-tuberculous mycobacteria[J]. Int J Infect Dis, 2016, 45: 123-134. DOI:10.1016/j.ijid.2016.03.006 |
| [76] |
王维勇, 何间红, 陈华, 等. 88例非结核分枝杆菌的药敏实验分析[J]. 当代医学, 2010, 16(32): 54-55. Wang WY, He JH, Chen H, et al. Drug susceptibility analysis of 88 cases of nontuberculous Mycobacterium[J]. Contemp Med, 2010, 16(32): 54-55. DOI:10.3969/j.issn.1009-4393.2010.32.036 |
| [77] |
Duan HF, Liu G, Wang XB, et al. Evaluation of the ribosomal protein S1 gene (rpsA) as a novel biomarker for Mycobacterium species identification[J]. Biomed Res Int, 2015, 2015: 271728. DOI:10.1155/2015/271728 |
| [78] |
Jing H, Wang HY, Wang Y, et al. Prevalence of nontuberculous mycobacteria infection, China, 2004-2009[J]. Emerg Infect Dis, 2012, 18(3): 527-528. DOI:10.3201/eid1803.110175 |
| [79] |
Marks J, Jenkins PA, Tsukamura M. Mycobacterium szulgai: A new pathogen[J]. Tubercle, 1972, 53(3): 210-214. DOI:10.1016/0041-3879(72)90018-9 |
| [80] |
肖士林, 赵秀芹, 刘志广, 等. 5种中国罕见慢速生长非结核分枝杆菌标准株及临床分离株的药物敏感性分析[J]. 疾病监测, 2020, 35(5): 435-441. Xiao SL, Zhao XQ, Liu ZG, et al. Antibiotic susceptibility of reference and clinical strains of slowly growing nontuberculous mycobacteria of 5 species rarely isolated in China[J]. Dis Surveill, 2020, 35(5): 435-441. DOI:10.3784/j.issn.1003-9961.2020.05.015 |
| [81] |
Gido RDS, Wojciechowski AL, Bajwa RPS. Pulmonary infection with Mycobacterium szulgai: A case report[J]. SAGE Open Med Case Rep, 2019, 7: 2050313x18823448. |
| [82] |
Bhengsri S, Baggett HC, Edouard S, et al. Sennetsu neorickettsiosis, spotted fever group, and typhus group rickettsioses in three provinces in Thailand[J]. Am J Trop Med Hyg, 2016, 95(1): 43-49. DOI:10.4269/ajtmh.15-0752 |
| [83] |
Newton PN, Rolain JM, Rasachak B, et al. Sennetsu neorickettsiosis: A probable fish-borne cause of fever rediscovered in Laos[J]. Am J Trop Med Hyg, 2009, 81(2): 190-194. DOI:10.4269/ajtmh.2009.81.190 |
| [84] |
Dittrich S, Phuklia W, Turner GDH, et al. Neorickettsia sennetsu as a neglected cause of fever in South-East Asia[J]. PLoS Negl Trop Dis, 2015, 9(7): e0003908. DOI:10.1371/journal.pntd.0003908 |
 2023, Vol. 34
2023, Vol. 34