扩展功能
文章信息
- 殷颖璇, 徐安远, 潘筱雯, 何晴, 吴银娟, 李学荣
- YIN Ying-xuan, XU An-yuan, PAN Xiao-wen, HE Qing, WU Yin-juan, LI Xue-rong
- 基于优化MaxEnt模型预测玫瑰蜗牛(Euglandina rosea)在中国的潜在分布区
- Predicting the potential distribution of Euglandina rosea in China using an optimized MaxEnt model
- 中国媒介生物学及控制杂志, 2023, 34(2): 137-144
- Chin J Vector Biol & Control, 2023, 34(2): 137-144
- 10.11853/j.issn.1003.8280.2023.02.002
-
文章历史
- 收稿日期: 2023-01-31
玫瑰蜗牛(Euglandina rosea),又称玫瑰橡子螺,属于软体动物门(Mollusca)腹足纲(Gastropoda)柄眼目(Stylommatophora)橡子螺科(Oleacinidae)真橡蜗牛属(Euglandina),原产于北美洲热带地区,1955年被引入夏威夷群岛,现已传入亚洲(印度、日本、马来西亚)、非洲(马达加斯加、毛里求斯、塞舌尔)、大洋洲(美属萨摩亚、密克罗尼西亚联邦、基里巴斯)的许多国家和地区[1-2],被国际自然保护联盟(IUCN)列为全球100种最具破坏力的入侵物种之一。该螺于2021年作为增补有害生物被我国列入《中华人民共和国进境植物检疫性有害生物名录》[3]。玫瑰蜗牛,贝壳呈长卵圆形或纺锤形,高50~60 mm,宽18~22 mm。壳颜色为玫瑰红色至桃红色,不透明且有光泽,壳内为淡红色。贝壳缝合线明显,边缘齿状,螺旋部高,体螺层膨大不倾斜。软体腹足肌肉发达,呈浅褐并略带灰色,口唇前突呈圆锥形,下触角很长,几乎及地[4]。该螺为肉食性蜗牛,习性凶猛,昼伏夜出,喜阴暗潮湿的环境,适应性强,以其他蜗牛和软体动物为食,可引起入侵地原产蜗牛数量锐减,对当地以无脊椎动物区系为主的生物多样性造成严重威胁。该螺曾作为非洲大蜗牛(Lissachatina fulica)的天敌被引入夏威夷群岛等地以控制螺害[5],然而玫瑰蜗牛更喜食体型较小的当地蜗牛,使得当地以夏威夷金顶树蜗(Achatinella apexfulva)为代表的树栖性蜗牛种群数量锐减甚至濒临灭绝[6],还严重威胁农林业生态安全[7-8]。此外,玫瑰蜗牛还可作为广州管圆线虫(Angiostrongylus cantonensis)的中间宿主传播广州管圆线虫病[9],危害人类健康和公共卫生安全。随着国际化进程的加快和进出口贸易的蓬勃发展,玫瑰蜗牛在我国的潜在生物入侵风险日益增高。虽然中国境内暂未发现玫瑰蜗牛的分布,但福建、深圳等口岸已多次从入境植物产品中截获该蜗牛[10],其对我国的生态环境及农产品贸易等造成潜在威胁,掌握玫瑰蜗牛在我国的潜在分布情况对该螺的防控工作有重要意义。
最大熵模型(MaxEnt)是目前预测物种潜在分布范围最常用的模型之一,由Phillips等[11]基于最大熵原理和Java编程语言设计。该模型根据物种的“存在”分布数据和环境变量为约束条件,探寻此约束条件下最大熵的概率分布,同时结合ArcGIS 10.7软件来绘制该物种在研究区域的潜在适生区分布图。MaxEnt模型具有不依赖物种生物学参数,所需样本量小、受样本数偏差影响小等优点[12],已被广泛用于物种保护,入侵生物预测和疾病预防等[13]。共享社会经济路径(shared socioeconomic pathway,SSP)是政府间气候变化专门委员会(IPCC)于2010年推出的描述全球社会经济发展情景的有力工具,用于定量描述气候变化与社会经济发展路径之间的关系,反映未来社会面临的气候变化适应和减缓挑战。目前共有5个典型路径,分别为可持续路径(sustainability,SSP1)、中间路径(middle of the road,SSP2)、区域竞争路径(regional rivalry,SSP3)、不均衡路径(inequality,SSP4)和化石燃料为主发展路径(fossil-fueled development,SSP5)。本研究基于优化后的MaxEnt模型对我国玫瑰蜗牛当前及未来不同气候情景下的潜在适生区进行预测,并评估各环境因子的影响比重,以期为我国防控该物种的生物入侵提供依据。
1 材料与方法 1.1 环境数据的收集和筛选本研究中使用的所有环境变量均来自WorldClim 2.1版本(http://www.worldclim.org/)提供的最新气候数据图层,空间分辨率为2.5 arc min,包括19个生物气候环境变量数据(bio1~bio19),36个气候变量层(月平均降水量、月最低温度和月最高温度)和海拔[14]。当前气候采用1970-2000年的历史气候数据,未来气候选取最符合中国气候变化的中国(北京)气候中心气候系统模式的中等分辨率气候系统(BCC-CSM2-MR)作为全球气候模型[15],采用2021-2100年的预测气候模式数据,并以20年为间隔划分为4个时期。在4种SSP下预测了玫瑰蜗牛的未来潜在分布:SSP126、SSP245、SSP370和SSP585。
使用ArcGIS 10.7软件(ESRI、Redlands、CA、USA,http://www.esri.com)提取分布点所在栅格的所有环境变量数据。为消除环境变量之间的共线性问题,提高模型的模拟精度,利用GraphPad Prism 8对这些数据进行Pearson相关性分析,当2个环境变量的相关系数绝对值≥0.8时视为显著相关,保留其中1个贡献率较高且更具生物学意义的环境因子,用刀切法(jackknife)检验筛选并保留贡献率 > 1%的环境变量。
1.2 分布数据的收集与处理玫瑰蜗牛的分布数据下载自世界生物多样性信息交换平台(Global Biodiversity Information Facility,GBIF,http://www.gbif.org)。由于获取的分布数据可能会存在重复和过度采样的问题[16],使用ENMTools工具的剔除重复点(removing duplicate occurrences)功能去除同一栅格内重复和无效的坐标点,共获得全球范围内有效的玫瑰蜗牛分布数据780条,转换为CSV格式以便maxent 3.4.1软件读取。
当只有“存在”数据可用时,最大训练灵敏度加特异性逻辑阈值(maximum training sensitivity plus specificity logistic threshold,MTSS)被认为是将MaxEnt连续预测值转换为“存在/不存在”二元图的最可行方法之一[16-17]。maxent 3.4.1软件模拟输出的结果值范围在0~1,值越接近1表示该物种存在的可能性越高。适生区间从低到高分为4个级别:非适生区(0~MTSS)、低适生区(MTSS~0.4)、中适生区(0.4~0.6)和高适生区(0.6~1.0),统计每个等级的栅格数,计算各等级适宜生境面积所占比例。
1.3 分布变化趋势的可视化为了可视化当前和未来4种气候变化情景下玫瑰蜗牛的潜在分布变化情况,利用ArcGIS 10.7软件的SDM toolbox 2.4中的“distribution changes between binary SDMs”工具,以MTSS为阈值进行二元地图的绘制。将2021-2100年4种气候变化情景下的所有二元地图分别与当前气候下的二元地图进行比较,以明晰未来玫瑰蜗牛的分布变化情况。
1.4 模型的优化与评估基于maxent 3.4.1软件进行玫瑰蜗牛潜在适生区的预测,将收集的分布数据和环境气候数据导入maxent 3.4.1软件进行运算,为避免偶然误差进行10次重复的交叉验证。
模型校准、创建和评估在“kuenm”程序中完成,这是一个使用maxent作为建模算法的R包[18]。Maxent 3.4.1软件最重要的2个参数为特征组合(feature combination,FC)与正则化乘数(regularization multiplier,RM)[19]。通过“kuenm”R包优化这2个参数有助于减少模型过拟合和复杂性,从而显著提高模型的预测精度[20-21]。FC包括5个特征,分别为线性(linear,L)、二次型(quadratic,Q)、乘积型(product,P)、阈值性(threshold,T)和片段化(hinge,H),设置9个参数组合(l、lq、lqp、lqh、lqph、lqpth、h、qph、qpth)进行模型的测试。RM参数设置为0.5~4.0(间隔0.5),共设置8个RM值。
利用受试者工作特征曲线(receiver operating characteristic curve,ROC)的曲线下面积(area under the curve,AUC)值评估模拟结果的精确度。AUC值介于0~1.0,当物种分布越偏离随机分布时,其值会越高,此时模型精确度更高,可信度更好。将评估标准划分为4个等级:当0 < AUC≤0.5时,结果判读为“无效”;当0.5 < AUC≤0.7时,判读为“可接受”;当0.7 < AUC≤0.9时,判读为“良好”;当AUC > 0.9时,判读为“极好”。
2 结果 2.1 环境因子筛选和模型优化共评估了72个候选模型,选择其中具有统计学意义,并符合遗漏率和赤池信息量准则(Akaike information criterion corrected,AICc)标准的模型。在该候选模型中(RM=0.5,FC=PQTH),平均AUC值为1.973,部分ROC为0,遗漏率为0.046,AICc为19 000.113,调整后的delta AICc值最小,为0。
共筛选了9个贡献率 > 1%的环境因子进行分析,变量之间的Pearson相关系数如图 1所示。评估各环境变量对MaxEnt模型的相对贡献率和生物学意义,结果显示tmax2对玫瑰蜗牛的分布影响最大,其次是bio17,2个变量的累计贡献率超过70%,是影响MaxEnt模型的主要因素。最终选择了bio17、tmax2、bio13和prec2这4个环境变量来生成模型。见表 1。

|
| 注:bio3等温性;bio4气温季节性变化标准差;bio7年均气温变化范围;bio13最湿月降水量;bio14最干月降水量;bio17最干季降水量;tmax2表示2月最高温;tmax12表示12月最高温;prec2表示2月平均降水量。 图 1 贡献率 > 1%的环境变量的相关系数矩阵(Pearson)热图 Figure 1 Pearson correlation matrix heat map for environmental variables contributing greater than 1% |
| |

|
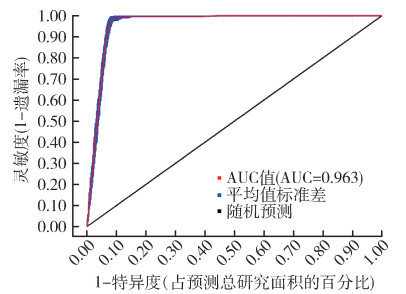
基于上述模型和历史环境变量,对当前玫瑰蜗牛在我国的潜在适生区进行了预测。在历史气候条件下,该螺的潜在适生区主要分布在我国东南地区,集中于福建省南部、广东省东部和广西壮族自治区(广西)中部(图 2)。适生区总面积为198 826.56 km2,占我国国土面积的2.10%。其中中适生区和低适生区生境分别占0.24%和1.86%,无高适生区生境。重复运算的平均AUC值为0.963,标准差(standard deviation,s)为0.003。见图 3。

|
| 图 2 基于MaxEnt模型预测的玫瑰蜗牛当前在中国的潜在适生区 Figure 2 Current potentially suitable areas for Euglandina rosea in China predicted by the MaxEnt model |
| |
|
| 注:在10次重复实验中,优化模型的受试者工作特征(ROC)曲线和曲线下面积(AUC)值显示为红色,蓝色边距表示平均值±标准差。 图 3 基于MaxEnt模型预测玫瑰蜗牛潜在地理分布的ROC曲线 Figure 3 The ROC curve for predicting the potential geographic distribution of Euglandina rosea based on the MaxEnt model |
| |
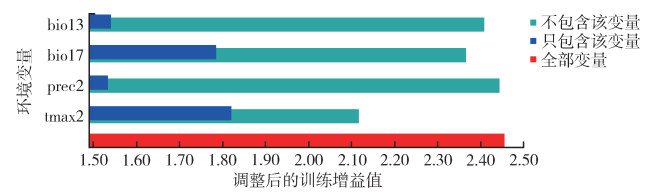
利用刀切法评估4个环境变量在潜在适生区预测中的相对重要性(图 4),结果显示tmax2和bio17是影响模型预测结果的主要因素,同时tmax2包含更多的特有信息。MaxEnt环境变量响应曲线(图 5)显示随着重要环境变量的变化,模型预测的玫瑰蜗牛存在概率的变化情况,存在概率 > 0.166 9(MTSS)的环境被认为是适合玫瑰蜗牛生存的。最适宜玫瑰蜗牛的生长环境如下:最湿月降水量在118.95~276.15 mm;最干季降水量在126.87~442.94 mm;2月平均降水量在52.86~248.98 mm或 > 358.72 mm;2月最高温在13.34~26.13 ℃。
|
| 注:蓝色条带表示单独使用该环境变量时的增益;绿色条带表示除去该环境变量时的增益。 图 4 各气候因子对玫瑰蜗牛当前潜在分布模型的刀切法检验得分 Figure 4 Jackknife test of variable importance in the Euglandina rosea suitability distribution |
| |

|
| 注:红色曲线表示10次重复运行的平均值,蓝色边距表示平均值±标准差。 图 5 玫瑰蜗牛分布模型中主要气候因子的响应曲线 Figure 5 Response curves of environmental variables in the potential distribution model of Euglandina rosea |
| |
图 6显示了从2021-2100年在CMIP6的4种SSP情景下玫瑰蜗牛在我国潜在分布的变化情况,其发展趋势基本一致。根据本次研究建立的模型预测,随着未来气候变化,玫瑰蜗牛在我国的潜在适宜生存范围总体上呈扩张趋势(图 7),且随着SSP等级的提升这种扩张趋势越发明显。其潜在适生区由我国东南沿海地区逐渐向北延伸至中部,主要分布于湖南和江西省以及福建省大部分地区、安徽省中部、湖北省东部、浙江省的部分地区。分布在广东省和广西的部分适生区则略有收缩,使得玫瑰蜗牛潜在适生区的整体分布重心向北移动。

|
| 图 6 2021-2100年4种共同社会经济路径(SSP)下玫瑰蜗牛在中国潜在分布的变化情况 Figure 6 Changes in the potential distribution of Euglandina rosea in China from 2021 to 2100 under four shared socioeconomic pathways |
| |

|
| 图 7 2021-2100年4种共同社会经济路径(SSP)下玫瑰蜗牛在中国总适生面积的比例变化情况 Figure 7 Change in the proportion of total suitable habitats Euglandina rosea in China from 2021 to 2100 under four shared socioeconomic pathways |
| |
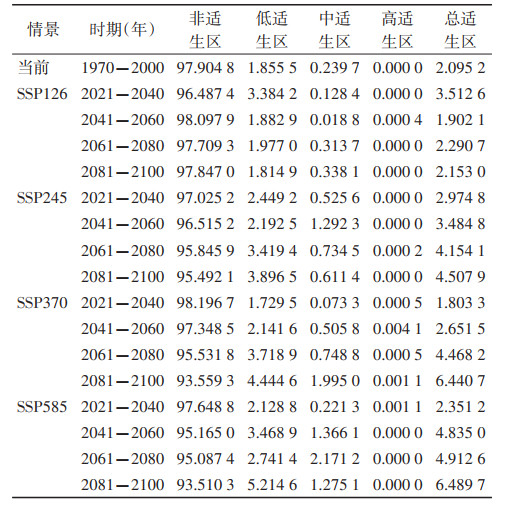
4种SSP情景下的高适生区、中适生区和低适生区以及总适生区占全国面积的比值如表 2所示,每个SSP情景下的总体变化趋势基本一致。随着未来气候条件的变化,高适生区的占比除SSP370情景外,总体保持不变;中适生区的占比在4种SSP情景下均呈上升趋势;低适生区除SSP126情景之外,均呈上升趋势。
|
本研究基于优化后的MaxEnt模型预测了我国当前和未来不同情景气候条件下玫瑰蜗牛的潜在分布情况。玫瑰蜗牛作为世界100种外来入侵物种之一,严重威胁入侵地的生物多样性和生态安全,然而我国对这种蜗牛的相关研究较少。由于我国大陆尚无玫瑰蜗牛的分布数据,因此本研究选取了全球所有可获取的原产地和入侵地的分布数据进行研究,优化后的MaxEnt模型预测AUC值高达0.963,表明该模型对玫瑰蜗牛潜在适生区的预测具有较高的可靠性,能够有效反映其在中国的分布情况。
刀切法结果显示,最干季降水量和2月最高温对玫瑰蜗牛分布的影响最大,均与玫瑰蜗牛的存在概率呈正相关,其次是最湿月降水量和2月平均降水量。玫瑰蜗牛喜欢温暖潮湿的环境,通常在阴天或夜间活跃,当天气干燥时,玫瑰蜗牛会缩入壳内进入休眠状态,并分泌一种白色黏液膜封住壳口[4],然而长期处于干旱无雨的恶劣环境时,玫瑰蜗牛仍会因为缺水而死亡。当降水量适中时,空气湿度增加,有利于蜗牛的活动;但降水量过大时,气温和土壤温度降低限制蜗牛活动,且大量雨水可导致玫瑰蜗牛窒息而亡,因此影响玫瑰蜗牛分布的最主要环境因子为最干季降水量。此外,玫瑰蜗牛通常在12月到次年3月进入冬眠状态以抵御低温环境,有研究表明玫瑰蜗牛能够通过这种方式度过我国台湾省的冬季[22]。冬眠中的玫瑰蜗牛对春季温度的骤然变化十分敏感,气温上升后解眠的蜗牛突然遭到寒流袭击会大批死去,因此2月作为寒潮多发季节,其温度与降水量对玫瑰蜗牛的分布影响很大。
MaxEnt模型预测的结果显示,在历史气候条件下,玫瑰蜗牛的潜在适生区主要分布在我国东南地区,集中于福建和广东省以及广西中部,与王沛等[10]的预测结果一致。随着全球变暖,玫瑰蜗牛的潜在适生区将逐步向北扩大至湖南省、江西省、安徽省中部、湖北省东部以及浙江省的部分地区。其中安徽与湖北省交界处存在大别山脉,而过高海拔不适宜玫瑰蜗牛的生存,因此大别山脉附近玫瑰蜗牛的潜在分布较少。而东南部较低纬度适生区则略有收缩,使得玫瑰蜗牛潜在适生区的整体重心向北移动,这可能是因为随着未来气候变化,低纬度地区出现强降水、高温热浪、低温寒潮等各类极端天气气候事件的可能性大大提高,不适宜玫瑰蜗牛的生存[23-24]。总体而言,我们的预测结果表明玫瑰蜗牛生长在温暖、潮湿和低海拔的环境中,这与其喜湿热的生活习性一致。玫瑰蜗牛栖息生境广泛,森林、灌木、农区、路旁和公园都曾发现其踪迹,对环境的适应能力强,容易在新的栖息地建立种群[25]。而玫瑰蜗牛的生物防治难度大,成本高且难以根除,一旦入侵就有大面积定殖扩散的风险[26]。因此预测结果中玫瑰蜗牛适生区分布广泛的福建、广东、湖南、江西、安徽以及浙江省等地区需加强对玫瑰蜗牛生物入侵的监测和预警,防止其定殖和扩散。其中浙江、安徽、广东和福建省口岸众多,生物入侵风险高,海关应加强口岸监测,重点检查来自玫瑰蜗牛疫区的木质包装材料、集装箱等,对容易隐蔽蜗牛的阴暗蔽光处,应加强带土种苗及繁殖材料的检疫。
玫瑰蜗牛未来的潜在分布结果表明,在全球变暖条件下,其高度适宜生境基本保持低水平不变,低、中等适宜生境明显增加,且随着SSP等级的提高更为明显。不同SSP情景下的适宜分布区域不同,表明气候变化增加了玫瑰蜗牛适宜分布的不确定性。不同SSP情景之间的差异主要是由于温室气体浓度的变化,特别是CO2浓度对气温的影响,高消耗化石燃料的利用开发将导致玫瑰蜗牛适生区的明显扩张和北移。因此走可持续的SSP1或SSP2可能是预防玫瑰蜗牛入侵和扩张的最有效方法之一。需要指出的是,由于自然变率的复杂性以及气候模式和人类排放情景的不确定性,对未来气候情景下玫瑰蜗牛潜在适生区的分析,目前仍难得出确定性结论。此外,在模型建立的过程中,背景样本是默认生成的,这可能导致在人类活动密集的地区出现记录聚类而使得模型不准确[27-28]。虽然我们使用ENMTools减少了采样偏差,但在下一步的工作中仍需继续优化。除了环境变量之外,水体的类型和组成、人口统计数据和植被覆盖等其他环境因子也对物种的栖息地适宜性产生重要影响[29],这些内容在本研究中还不够充分,需要进一步探究。
综上所述,玫瑰蜗牛具有很高的入侵和扩散能力,对潜在入侵地区的生态、人类健康、物种多样性等构成严重威胁,尤其要警惕作为天敌而引入的可能性。全球化和未来气候条件的变化将对玫瑰蜗牛的分布产生重大影响,并产生许多不确定性。因此,预测玫瑰蜗牛的潜在分布和适宜生境对于保护我国生态和人类健康具有重要意义。有关部门应加强监测和及时控制,海关做好定期抽检,采取有效的预防措施,减少其入侵风险。
利益冲突 无
| [1] |
Davis EC, Perez KE, Bennett DJ. Euglandina rosea (Férussac, 1821) is found on the ground and in trees in Florida[J]. Nautilus, 2004, 118(3): 127-128. |
| [2] |
Gargominy O. Beyond the alien invasion: A recently discovered radiation of Nesopupinae (Gastropoda: Pulmonata: Vertiginidae) from the summits of Tahiti (Society Islands, French Polynesia)[J]. J Onchol, 2008, 39(5): 517-536. |
| [3] |
朱崧琪, 梁柱伟, 汪绍文. 《中华人民共和国进境植物检疫性有害生物名录》更新项目简介[J]. 中国海关, 2021(7): 54. Zhu SQ, Liang ZW, Wang SW. Brief introduction to the update project of the "List of plant quarantine pests entering the People's Republic of China"[J]. China Customs, 2021(7): 54. |
| [4] |
周卫川. 玫瑰蜗牛[J]. 植物检疫, 2012, 26(6): 38-40. Zhou WC. Euglandina rosea[J]. Plant Quar, 2012, 26(6): 38-40. |
| [5] |
Clarke B, Murray J, Johnson MS. The extinction of endemic species by a program of biological control[J]. Pac Sci, 1984, 38(2): 97-104. |
| [6] |
Coote T, Loève É. From 61 species to five: Endemic tree snails of the Society Islands fall prey to an ill-judged biological control programme[J]. Oryx, 2003, 37(1): 91-96. DOI:10.1017/S0030605303000176 |
| [7] |
Hadfield MG, Miller SE, Carwile AH. The decimation of endemic Hawai'ian tree snails by alien predators[J]. Am Zool, 1993, 33(6): 610-622. DOI:10.1093/icb/33.6.610 |
| [8] |
Christensen CC, Cowie RH, Yeung NW, et al. Biological control of pest non-marine molluscs: A pacific perspective on risks to non-target organisms[J]. Insects, 2021, 12(7): 583. DOI:10.3390/insects12070583 |
| [9] |
Campbell BG, Little MD. The finding of Angiostrongylus cantonensis in rats in New Orleans[J]. Am J Trop Med Hyg, 1988, 38(3): 568-573. DOI:10.4269/ajtmh.1988.38.568 |
| [10] |
王沛, 胡美玲, 肖颖, 等. 玫瑰蜗牛入侵中国的风险评估[J]. 中国口岸科学技术, 2020(9): 31-36. Wang P, Hu ML, Xiao Y, et al. Risk assessment of Euglandina rosea (Ferussac, 1821) invasion into China[J]. China Port Sci Technol, 2020(9): 31-36. DOI:10.3969/j.issn.1002-4689.2020.09.006 |
| [11] |
Phillips SJ, Anderson RP, Schapire RE. Maximum entropy modeling of species geographic distributions[J]. Ecol Modell, 2006, 190(3/4): 231-259. DOI:10.1016/j.ecolmodel.2005.03.026 |
| [12] |
Merow C, Smith MJ, Silander JA. A practical guide to MaxEnt for modeling species' distributions: What it does, and why inputs and settings matter[J]. Ecography, 2013, 36(10): 1058-1069. DOI:10.1111/j.1600-0587.2013.07872.x |
| [13] |
Adhikari D, Barik SK, Upadhaya K. Habitat distribution modelling for reintroduction of Ilex khasiana Purk., a critically endangered tree species of northeastern India[J]. Ecol Eng, 2012, 40: 37-43. DOI:10.1016/j.ecoleng.2011.12.004 |
| [14] |
Fick SE, Hijmans RJ. WorldClim 2: New 1-km spatial resolution climate surfaces for global land areas[J]. Int J Climatol, 2017, 37(12): 4302-4315. DOI:10.1002/joc.5086 |
| [15] |
Yang H, Jiang ZH, Li L. Biases and improvements in three dynamical downscaling climate simulations over China[J]. Climate Dyn, 2016, 47(9/10): 3235-3251. DOI:10.1007/s00382-016-3023-9 |
| [16] |
Liu CR, White M, Newell G. Selecting thresholds for the prediction of species occurrence with presence-only data[J]. J Biogeogr, 2013, 40(4): 778-789. DOI:10.1111/jbi.12058 |
| [17] |
Freeman EA, Moisen GG. A comparison of the performance of threshold criteria for binary classification in terms of predicted prevalence and kappa[J]. Ecol Modell, 2008, 217(1/2): 48-58. DOI:10.1016/j.ecolmodel.2008.05.015 |
| [18] |
Cobos ME, Peterson AT, Barve N, et al. Kuenm: An R package for detailed development of ecological niche models using MaxEnt[J]. PeerJ, 2019, 7: e6281. DOI:10.7717/peerj.6281 |
| [19] |
Muscarella R, Galante PJ, Soley-Guardia M, et al. ENMeval: An R package for conducting spatially independent evaluations and estimating optimal model complexity for MaxEnt ecological niche models[J]. Methods Ecol Evol, 2014, 5(11): 1198-1205. DOI:10.1111/2041-210X.12261 |
| [20] |
Zeng YW, Low BW, Yeo DCJ. Novel methods to select environmental variables in MaxEnt: A case study using invasive crayfish[J]. Ecol Modell, 2016, 341: 5-13. DOI:10.1016/j.ecolmodel.2016.09.019 |
| [21] |
Radosavljevic A, Anderson RP. Making better MaxEnt models of species distributions: Complexity, overfitting and evaluation[J]. J Biogeogr, 2014, 41(4): 629-643. DOI:10.1111/jbi.12227 |
| [22] |
Chiu SC, Chou KC. Observations on the biology of the carnivorous snail Euglandina rosea Ferussac[J]. Bull Inst Zool Acad Sin, 1962, 1(1): 17-24. |
| [23] |
齐庆华. 未来气候情景下中国东部极端降水和气温的危险性特征[J]. 气象与减灾研究, 2020, 43(4): 256-266. Qi QH. Risk characteristics of precipitation and temperature extremes over eastern China under future climatic scenario[J]. Meteorol Disaster Reduct Res, 2020, 43(4): 256-266. DOI:10.12013/qxyjzyj2020-037 |
| [24] |
Suo H, Guan XX, Wu SL, et al. Energy performance assessment of the container housing in subtropical region of China upon future climate scenarios[J]. Energies, 2023, 16(1): 503. DOI:10.3390/en16010503 |
| [25] |
Hubricht L. The distributions of the native land mollusks of the eastern United States[M]. Chicago: Field Museum of Natural History, 1985: 175-186. DOI:10.5962/bhl.title.3329
|
| [26] |
United States Department of Agriculture. New pest response guidelines: Giant African snails: Snail pests in the family Achatinidae[R]. Washington: United States Department of Agriculture, 2007.
|
| [27] |
Phillips SJ, Dudík M, Elith J, et al. Sample selection bias and presence-only distribution models: Implications for background and pseudo-absence data[J]. Ecol Appl, 2009, 19(1): 181-197. DOI:10.1890/07-2153.1 |
| [28] |
Kramer-Schadt S, Niedballa J, Pilgrim JD, et al. The importance of correcting for sampling bias in MaxEnt species distribution models[J]. Divers Distrib, 2013, 19(11): 1366-1379. DOI:10.1111/ddi.12096 |
| [29] |
Cieplok A, Spyra A. The roles of spatial and environmental variables in the appearance of a globally invasive Physa acuta in water bodies created due to human activity[J]. Sci Total Environ, 2020, 744: 140928. DOI:10.1016/j.scitotenv.2020.140928 |
 2023, Vol. 34
2023, Vol. 34


