扩展功能
文章信息
- 张芃, 周永运, 吕东月, 贺兆锴, 段然, 秦帅, 汤德铭, 肖萌, 景怀琦, 王鑫
- ZHANG Peng, ZHOU Yong-yun, LYU Dong-yue, HE Zhao-kai, DUAN Ran, QIN Shuai, TANG De-ming, XIAO Meng, JING Huai-qi, WANG Xin
- 喜马拉雅旱獭自然感染鼠疫耶尔森菌后部分脏器病理变化的研究
- Pathological changes of some organs of Marmota himalayana naturally infected with Yersinia pestis
- 中国媒介生物学及控制杂志, 2023, 34(1): 9-13
- Chin J Vector Biol & Control, 2023, 34(1): 9-13
- 10.11853/j.issn.1003.8280.2023.01.002
-
文章历史
- 收稿日期: 2022-09-13
2 中国合格评定国家认可中心, 北京 100062;
3 上海市浦东新区疾病预防控制中心, 上海 200120;
4 杭州市疾病预防控制中心, 浙江 杭州 310021
2 China National Accreditation Service for Conformity Assessment, Beijing 100062, China;
3 Shanghai Pudong New Area Center for Disease Control and Prevention, Shanghai 200120, China;
4 Hangzhou Center for Disease Control and Prevention, Hangzhou, Zhejiang 310021, China
鼠疫是由鼠疫耶尔森菌(Yersinia pestis,鼠疫菌)感染引起的一种自然疫源性烈性传染病。鼠疫菌具有嗜淋巴组织的特征[1],也具有抵御巨噬细胞、多形核白细胞(PMN)吞噬和杀灭的能力[2]。侵入机体后,鼠疫菌首先在局部淋巴组织中定居,迅速进行细胞外繁殖[3]并扩散到血液中,抵达全身器官。鼠疫菌可导致被入侵部位的炎症反应,并能趋化吞噬细胞将其吞噬。部分被巨噬细胞吞噬的鼠疫菌能在细胞内继续存活,并跟随巨噬细胞迁移到脾脏等免疫器官内继续繁殖[4]。而脾脏是机体最大的淋巴器官,又是重要的巨噬细胞储存器官[5],所以脾脏就成为鼠疫菌主要侵袭的目标,从而导致其出现充血、水肿等一系列严重的炎症反应。因此观察脾脏的病变程度对于研究鼠疫菌的致病过程有着重要的意义。本文使用喜马拉雅旱獭(Marmota himalayana,旱獭)的脾质量与体质量的比值来比较感染鼠疫菌前后旱獭的脾脏肿大程度,降低了仅用脾质量大小做对比时个体差异的影响。此外本文比较了鼠疫菌感染旱獭与未感染旱獭脾脏、肝脏、肺脏的病理改变,以揭示鼠疫菌自然感染后宿主的病理特征改变。
1 材料与方法 1.1 动物来源活体旱獭和自毙旱獭由中国疾病预防控制中心(疾控中心)传染病预防控制所应急实验室联合甘肃省酒泉市阿克塞县疾控中心在阿尔金山地区鼠疫监测点2020-2021年的监测工作中捕获和收集。登记所获旱獭的年龄、性别,采集地点、经度、纬度等相关信息。
1.2 计算脾质量与体质量的比值分别称取活体旱獭和完整自毙旱獭的体质量(kg)记录数据,活体旱獭采集心脏血,收集自毙旱獭体表的蚤类。分别将处死后的活体旱獭以及完整的自毙旱獭从腹部解剖并摘取肝、脾、肺脏,小心剔除脾脏表面附着的结缔组织和脂肪组织,擦干脾脏表面血迹和水分后放于无菌50 ml离心管中(先用空的50 ml离心管调零电子天平),电子天平称取旱獭脾质量(g)并记录数据,根据下列公式计算脾质量与体质量的比值。
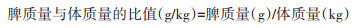
|
将活体旱獭血液标本离心10 min(4 000 r/min)分离血清,使用鼠疫菌抗体检测试剂盒初筛活体旱獭血清样本中鼠疫F1抗体阳性标本。仅有C检测线变为紫色的标本为阴性,C检测线及T检测线均呈现紫红色沉淀为阳性标本。间接血凝试验(IHA)参考《鼠疫诊断标准》(WS 279-2008)[6],用微量滴定板法倍比稀释血清后检测抗体滴度,抗体滴度≥1∶16,判定为阳性。
1.4 鼠疫菌分离及鉴定将所有自毙旱獭的脏器及从自毙旱獭体表采集到的蚤类标本研磨后接种至布氏以及头孢磺啶三氯生新生霉素培养基(CIN选择性培养基),28 ℃培养24 h,将分离纯化出的疑似鼠疫菌在显微镜下观察细菌形态。同时进行鼠疫噬菌体裂解试验鉴定,根据《鼠疫诊断标准》(WS 279-2008)[6]鉴定鼠疫菌。
1.5 组织切片的制作及HE染色观察取感染鼠疫菌自毙旱獭和未感染旱獭的肝、脾、肺脏,观察其整体形态后,使用4%多聚甲醛固定,石蜡包埋切片,苏木精-伊红(HE)染色后,放于显微镜下进行镜检,采集图像并观察分析组织的病理变化。
1.6 统计学分析采用SAS 9.4软件处理和分析本研究所得数据,计数资料以百分比(%)表示。符合正态分布的计量资料以均数±标准差(x±s)表示,两组比较采用t检验,多组比较进行单因素ANOVA方差分析;非正态分布计量资料以中位数(M)表示,两组间比较采用Mann-Whitney U检验,多组间比较采用Kruskal-Wallis H检验。以P < 0.01表示差异有统计学意义。
2 结果 2.1 捕获收集旱獭情况2020年称量体质量和脾质量的活体旱獭为26只,2021年称量体质量和脾质量的活体、自毙旱獭分别为155和42只。活体旱獭总数为181只,采集心脏血并分离血清进行鼠疫F1抗体检测的活体旱獭共170只,F1抗体阳性率为31.76%(54/170),自毙旱獭鼠疫菌分离率为61.90%(26/42)。
2.2 活体旱獭与感染、未感染鼠疫菌旱獭之间脾质量与体质量比值的比较活体旱獭组与未感染鼠疫菌自毙旱獭组脾质量与体质量的比值相比,差异无统计学意义(P=0.394);而感染鼠疫菌自毙旱獭脾质量与体质量的比值明显高于活体旱獭组和未感染鼠疫菌自毙旱獭组,差异有统计学意义(χ2=33.144,P < 0.001)。见表 1。

|
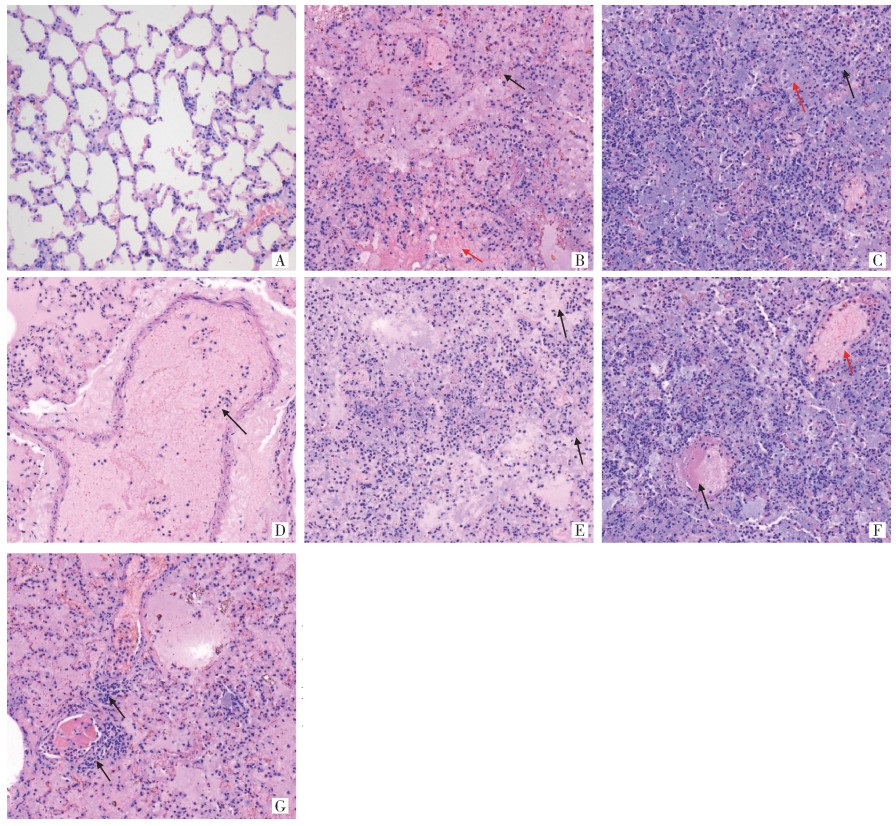
低倍镜下可见旱獭肺组织细胞分布不均匀,肺泡腔隙分辨不清晰;局部组织细胞密集排列,未见有明显的支气管结构。高倍镜下组织内可见含铁血黄素沉积(图 1B);肺泡上皮细胞增生,细胞壁增厚,肺泡腔内充满嗜碱性黏液(图 1C);组织大量肺泡腔内充满粉红色的水肿液,液体中可见大量淋巴细胞和中性粒细胞弥散性分布(图 1D),部分肺泡壁坏死(图 1E);部分血管管壁损伤,可见血栓形成和部分血管扩张(图 1F);管腔内充满黏液,血管内可见各种炎性细胞聚集,血管周围可见炎性细胞(主要为淋巴细胞和中性粒细胞)灶性浸润(图 1G)。
|
| 注: A正常对照组; B含铁血黄素沉积,如黑色箭头所示, 肺泡内充满黏液, 如红色箭头所示; C肺泡上皮细胞增生, 如黑色箭头所示, 肺泡腔内充满碱性黏液, 如红色箭头所示; D血管扩张, 管腔内充满黏液, 并可见炎性细胞分布, 如黑色箭头所示; E部分肺泡壁坏死, 如黑色箭头所示; F血栓形成, 如黑色箭头所示, 血管扩张, 如红色箭头所示; G血管周围可见炎性细胞浸润, 如黑色箭头所示。 图 1 感染鼠疫菌的喜马拉雅旱獭肺脏组织病理变化(HE染色,×200) Figure 1 Pathological changes of lung tissue of Marmota himalayana infected with Yersinia pestis (HE staining, ×200) |
| |
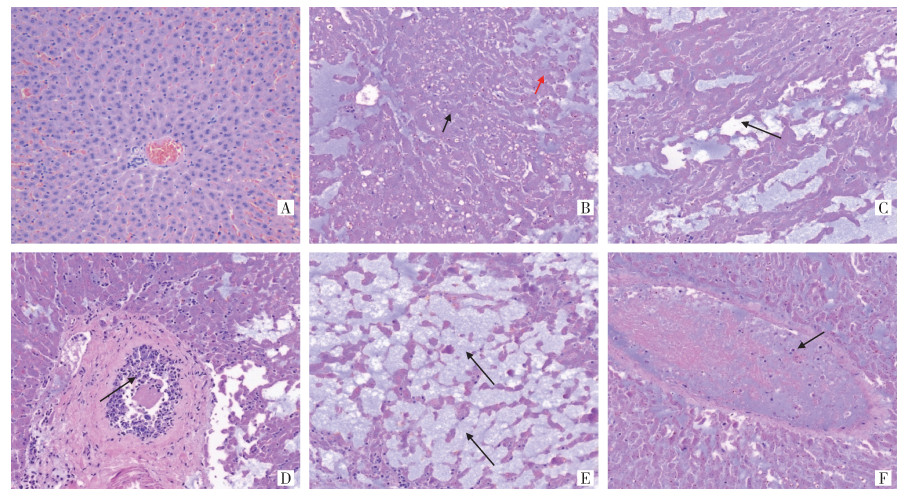
低倍镜下可见旱獭肝细胞索排列紊乱,肝细胞分布不均匀,局部区域细胞排列极疏松,组织间隙显著增大;组织内中央静脉和门管区少见。高倍镜下大量肝细胞脂肪变性,肝血窦内可见含铁血黄素沉积(图 2B);局部组织内肝细胞浆液性坏死,组织可见大量空洞(图 2C);门管区内胆管上皮细胞增生,部分上皮细胞脱落(图 2D);组织中大量肝血窦显著扩张,组织间隙增大,肝血窦内充满大量黏液(图 2E),肝细胞索排列疏松、紊乱;部分血管(中央静脉和汇管区血管)扩张,管腔内充满蛋白黏液,并可见炎性细胞分布(图 2F)。
|
| 注:A正常对照组;B肝细胞脂肪变性,如黑色箭头所示,肝血窦内含铁血黄素沉积,如红色箭头所示;C部分肝细胞浆液性坏死,如黑色箭头所示;D胆管上皮细胞增生,部分上皮细胞脱落,如黑色箭头所示;E肝血窦扩张,如黑色箭头所示;F血管扩张,充满黏液,并可见炎性细胞分布,如黑色箭头所示。 图 2 感染鼠疫菌的喜马拉雅旱獭肝脏组织病理变化(HE染色,×200) Figure 2 Pathological changes of liver tissue of Marmota himalayana infected with Yersinia pestis (HE, ×200) |
| |
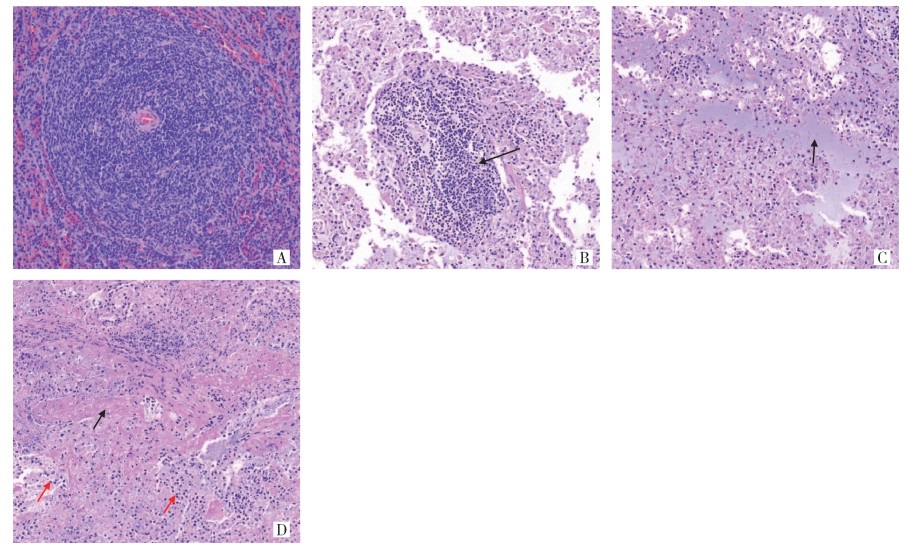
低倍镜下可见旱獭脾组织内脾小结数量减少,脾小结形态不规则,红白髓比例异常。高倍镜下部分脾小结内小淋巴细胞数量减少,未见坏死的细胞碎片,脾小结结构紊乱,红白髓之间界限模糊(图 3B);红髓内部分脾窦扩张,并充满黏液,组织间隙增大(图 3C);红髓内脾小梁结构减少,红髓内大量血管损伤,管腔内可见血栓形成,局部红髓区域可见炎性细胞(淋巴细胞和中性粒细胞)弥散性浸润(图 3D)。
|
| 注: A正常对照组; B脾小结结构散乱, 红白髓界限模糊, 如黑色箭头所示; C脾窦扩张, 如黑色箭头所示; D血管损伤, 血栓形成, 如黑色箭头所示, 红髓内可见炎性细胞浸润, 如红色箭头所示。 图 3 感染鼠疫菌的喜马拉雅旱獭脾脏组织病理变化(HE染色,×200) Figure 3 Pathological changes of spleen tissue of Marmota himalayana infected with Yersinia pestis (HE, ×200) |
| |
脏器的质量可大致判断脏器的病变程度,是动物实验研究中经常使用到的基础数据[7]。脾脏是机体最重要的外周免疫器官,在防御系统中,尤其在抗感染方面发挥着重要作用[5]。因此,研究脾质量变化对于了解自然宿主感染鼠疫菌后的免疫状态意义重大。本研究首次引入脾质量与体质量的比值这项数据,用于鼠疫菌感染的研究,可减小动物个体差异引起的脾质量差异的影响,更加客观直接地体现脾脏肿大程度。实验过程中观察到感染鼠疫菌的自毙旱獭普遍存在脾脏充血水肿的情况,通过研究旱獭脾质量与体质量的比值发现,自毙旱獭中感染鼠疫菌组的脾质量与体质量的比值明显高于未感染鼠疫菌组,且差异有统计学意义(χ2=33.144,P < 0.001),说明脾质量与体质量的比值可大致反映脾脏水肿程度,对于动物鼠疫监测和研究具有重要意义。此外我们还观察到部分未感染鼠疫菌的自毙旱獭的脾质量与体质量的比值比活体旱獭小,可能由于这些未感染鼠疫菌的旱獭死亡后尸体暴露于干燥环境中的时间更长,体内的水分包括脾脏等脏器的水分部分蒸发,脾脏作为储存血液的器官会另外损失血液中的水分[8-9],所以经过长时间干燥后未感染鼠疫的自毙旱獭脾质量与体质量的比值会小于活体旱獭。需要注意的是,有研究证明鼠疫菌感染可导致发炎的淋巴结生长到常规肥大淋巴结大小的2倍以上,并且不再保留其原生结构[10],脾脏又是最大的淋巴器官,所以感染鼠疫菌自毙旱獭的脾脏因肿大而造成的重量增加远远超过组织和血液中失去的水分重量,其脾质量与体质量的比值与未感染鼠疫的自毙旱獭相比会更大。脾脏充血、肿大现象普遍存在于因感染鼠疫致死的旱獭中,提示从事鼠疫监测和研究的人员应对旱獭的脾脏变化给予高度重视。
鼠疫菌具有嗜淋巴组织的特征,侵入体内后立即进入局部淋巴组织中定居并开始在细胞外繁殖,几天内可迅速通过血循环和淋巴循环进一步扩散[1],从而侵袭肝、脾、肺等脏器。关于鼠疫菌感染的组织病理学变化,国内外已有研究报道,但均属于人工感染实验动物的报告。赵忠智等[11]报道豚鼠注射强毒鼠疫菌后肝、脾、肺、肾脏组织呈现一系列急性炎症变化,心脏的炎症变化不明显。王虹等[12]发现鼻滴法吸入鼠疫菌的小鼠肺部可表现出肺鼠疫型病变与非肺鼠疫型病变。李博等[13]发现,大沙鼠注射7.4×105 CFU/ml鼠疫菌后实质器官病变不显著,相较于旱獭、豚鼠等鼠疫宿主对鼠疫菌有较高的耐受性。人工感染鼠疫菌研究因实验方法与实验对象不同,结果差异较为明显。与人工感染的研究相比,鼠疫的自然感染研究更能体现这种疾病的自然疫源性特征,研究结果也更有助于解决实际问题。本研究首次揭示了鼠疫菌自然宿主动物之一旱獭在自然感染鼠疫菌的情况下肝、脾、肺脏发生的病理改变。组织病理切片结果显示,感染鼠疫菌旱獭的肝、脾、肺脏均可发现炎性细胞浸润,组织细胞正常形态被破坏,血管扩张等一系列炎症反应引起的病理变化。被感染的肺、肝脏以渗出和增生性病变为主,而脾脏以细胞和组织的变性、坏死病变为主。感染鼠疫菌旱獭的脾脏有其特征性病变,病理切片可见脾脏内部淋巴小结数量减少,由于淋巴小结中央有生发中心可产生淋巴细胞,其数量减少也导致淋巴细胞数量减少,也说明鼠疫菌噬淋巴组织的特征。边缘区位于红髓和白髓交界处,它与红髓内部均存在丰富的巨噬细胞。由于鼠疫菌具有抗吞噬和在巨噬细胞内繁殖的能力,鼠疫菌可跟随巨噬细胞到达这2个部位时大量裂解巨噬细胞并释放出来;红白髓界限不分明且红髓可见中性粒细胞和大量血管损伤,也体现该部位曾短时间内出现大量细菌并引起急性炎症反应。
综上所述,通过分析感染鼠疫菌的旱獭与正常旱獭脾质量与体质量的比值,观察感染鼠疫菌旱獭的肝、脾、肺脏3种器官的病理学变化,阐述鼠疫菌可引起旱獭机体产生一系列炎症反应,脾脏的肿大及组织病理改变特征明显。揭示了鼠疫菌自然感染、侵袭旱獭的主要致病特点,也为鼠疫菌在自然宿主体内致病的机制研究提供了病理学依据。
利益冲突 无
| [1] |
St John AL, Ang WXG, Huang MN, et al. S1P-Dependent trafficking of intracellular Yersinia pestis through lymph nodes establishes buboes and systemic infection[J]. Immunity, 2014, 41(3): 440-450. DOI:10.1016/j.immuni.2014.07.013 |
| [2] |
Ke YH, Chen ZL, Yang RF. Yersinia pestis: Mechanisms of entry into and resistance to the host cell[J]. Front Cell Infect Microbiol, 2013, 3: 106. DOI:10.3389/fcimb.2013.00106 |
| [3] |
Lukaszewski RA, Kenny DJ, Taylor R, et al. Pathogenesis of Yersinia pestis infection in BALB/c mice: Effects on host macrophages and neutrophils[J]. Infect Immun, 2005, 73(11): 7142-7150. DOI:10.1128/IAI.73.11.7142-7150.2005 |
| [4] |
Arifuzzaman M, Ang WXG, Choi HW, et al. Necroptosis of infiltrated macrophages drives Yersinia pestis dispersal within buboes[J]. JCI Insight, 2018, 3(18): e122188. DOI:10.1172/jci.insight.122188 |
| [5] |
Bohnsack JF, Brown EJ. The role of the spleen in resistance to infection[J]. Annu Rev Med, 1986, 37: 49-59. DOI:10.1146/annurev.me.37.020186.000405 |
| [6] |
中华人民共和国卫生部. WS 279-2008鼠疫诊断标准[S]. 北京: 中国标准出版社, 2008. Ministry of Health of the People's Republic of China. WS 279-2008 Diagnostic criteria for plague[S]. Beijing: Standards Press of China, 2008. (in Chinese) |
| [7] |
Stevens MT. The value of relative organ weights[J]. Toxicology, 1976, 5(3): 311-318. DOI:10.1016/0300-483x(76)90050-0 |
| [8] |
Spencer RP, Pearson HA. The spleen as a hematological organ[J]. Semin Nucl Med, 1975, 5(1): 95-102. DOI:10.1016/s0001-2998(75)80007-9 |
| [9] |
Heimer J, Chatzaraki V, Schweitzer W, et al. Effects of blood loss on organ attenuation on postmortem CT and organ weight at autopsy[J]. Int J Legal Med, 2022, 136(2): 649-656. DOI:10.1007/s00414-021-02731-8 |
| [10] |
Sebbane F, Gardner D, Long D, et al. Kinetics of disease progression and host response in a rat model of bubonic plague[J]. Am J Pathol, 2005, 166(5): 1427-1439. DOI:10.1016/S0002-9440(10)62360-7 |
| [11] |
赵忠智, 于守鸿, 张爱萍, 等. 豚鼠感染鼠疫菌脏器的病理改变[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 84-85. Zhao ZZ, Yu SH, Zhang AP, et al. Pathological changes in solid viscera of Guinea pigs infected with Yersinia pestis[J]. Chin J Vector Biol Control, 2015, 26(1): 84-85. DOI:10.11853/j.issn.1003.4692.2015.01.023 |
| [12] |
王虹, 刘海洪, 吴小红, 等. 小鼠吸入性鼠疫病理学和毒力相关基因的体内转录[J]. 解放军医学杂志, 2006, 31(12): 1169-1172. Wang H, Liu HH, Wu XH, et al. Studies on histopathology and transcription of the important virulence-related genes of Yersinia pestis after inhalation of the bacteria in mice[J]. Med J Chin PLA, 2006, 31(12): 1169-1172. DOI:10.3321/j.issn:0577-7402.2006.12.013 |
| [13] |
李博, 阿扎提·热合木, 布仁明德, 等. 准噶尔盆地大沙鼠感染鼠疫耶尔森菌的组织病理与超微病理变化实验观察[J]. 中华预防医学杂志, 2017, 51(2): 172-175. Li B, Azhati R, Burenmingde, et al. Experimental observation on the histopathological and ultrastructural pathology of great gerbils (Rhombomys opimus) in the Junggar Basin by subcutaneous injecting of Yersinia pestis[J]. Chin J Prev Med, 2017, 51(2): 172-175. DOI:10.3760/cma.j.issn.0253-9624.2017.02.014 |
 2023, Vol. 34
2023, Vol. 34


