扩展功能
文章信息
- 王蓉, 马敏, 王忠发, 刘吉洛
- WANG Rong, MA Min, WANG Zhong-fa, LIU Ji-luo
- 一种高效检测致病性钩端螺旋体PCR改良方法及效果评价
- Evaluation of an improved PCR assay in detection of pathogenic Leptospira
- 中国媒介生物学及控制杂志, 2023, 34(1): 77-81
- Chin J Vector Biol & Control, 2023, 34(1): 77-81
- 10.11853/j.issn.1003.8280.2023.01.014
-
文章历史
- 收稿日期: 2022-08-29
2 定海区疾病预防控制中心, 浙江 舟山 316000;
3 海军军医大学海军医学系, 上海 200433
2 Dinghai Center for Disease Control and Prevention, Zhoushan, Zhejiang 316000, China;
3 Department of Naval Medicine, Naval Military Medical University, Shanghai 200433, China
钩端螺旋体(钩体)病(leptospirosis)是由致病性钩体——问号钩体(Leptospira interrogans)感染引起的世界性分布的人兽共患病。我国绝大多数地区都有不同程度的流行,尤以南方各省较严重。21世纪以来,全国钩体病发病率、死亡率呈逐步下降态势,近10年已处于较低水平,但局部地区仍然有报道存在小范围的散发或者暴发疫情[1]。近年来随着生态恢复,鼠类等野生动物的增多,钩体病的复燃风险随之提高,浙江省东部地区开始出现消失已久的钩体病例。钩体病的临床表现不一,症状轻重相差悬殊,但若不及早诊断和治疗,可能发展为以肝、肾、肺功能障碍或出血表现为特征的严重疾病,少量感染者在感染过程早期也会出现肺出血性综合征等症状[2],重症患者在病程早期就可导致死亡,因此早期诊断尤为重要。原卫生部颁布的《钩端螺旋体病诊断标准》(WS 290-2008)[3]的3条实验室确诊条件中,只有从血液、尿液或脑脊液中检出钩体核酸这一条适合早期诊断,因此本研究基于《全国病媒生物病原学监测方案(试行)》(中疾控传发〔2020〕13号)[4],建立一种以16S rRNA为靶基因的反转录实时荧光定量聚合酶链式反应(RT-qPCR)方法用于钩体病人的早期诊断及疫源地鼠类的带菌监测,为国家有关部门制定钩体病早期诊断及防控方案提供参考依据。
1 材料与方法 1.1 试剂核酸提取试剂购自QIAGEN公司。One Step PrimeScriptTM RT-PCR Kit(Perfect Real Time)(RR064A)、Premix Ex TaqTM(RR390A)、Premix TaqTM(Ex TaqTM Version 2.0 plus dye)(RR902A)、PrimeScriptTM One Step RT-PCR Kit(RR057A)、EASY dilution均购自TaKaRa公司。钩体IgM、IgG抗体ELISA检测试剂购自德国维润赛润公司。
1.2 标本来源血清标本为2例临床诊断病人血清样本,病例1血清采自发病后3和62 d,病例2血清采自发病后4和10 d,保存于-70 ℃。鼠肾标本:笼夜法捕获野外鼠100只,取鼠肾0.5~1 g放入装有0.5 ml MEM培养液和3颗ϕ3 mm氧化锆小珠的2 ml圆底EP管中,使用研磨仪低温碾磨匀浆,4 ℃,13 500 g,离心10 min。核酸提取试剂盒提取病人和鼠肾中的致病性钩体RNA/DNA。
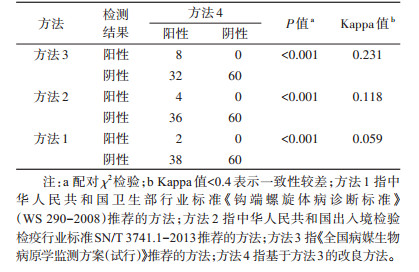
1.3 4种PCR检测方法 1.3.1 方法1中华人民共和国卫生部行业标准《钩端螺旋体病诊断标准》(WS 290-2008)[3]推荐,以致病性钩体secY基因为靶基因的普通聚合酶链式反应(PCR)法。Premix Taq™进行扩增,反应体系(25 μl):2×Premix Taq 12.5 μl,25 μmol/L正、反向引物各1 μl,模板5 μl,ddH2O 5.5 μl。扩增产物用1%的琼脂糖凝胶电泳,紫外灯下观察结果。
1.3.2 方法2中华人民共和国出入境检验检疫行业标准《国境口岸鼠类携带病原体检测方法第1部分:致病性钩端螺旋体PCR检测方法》[5](SN/T 3741.1-2013)推荐,以致病性钩体23S rDNA为靶基因的普通PCR法。Premix Taq™进行扩增,反应体系(20 μl):2×Premix Taq 10 μl,10 μmol/L正、反向引物各0.5 μl,模板2 μl,ddH2O 7 μl。扩增产物用2%的琼脂糖凝胶电泳,紫外灯下观察结果。
1.3.3 方法3《全国病媒生物病原学监测方案(试行)》(中疾控传发〔2020〕13号)[4]推荐,主要参数同文献[6-7],以致病性钩体16S rDNA为靶基因的实时荧光定量PCR(qPCR)法。Premix Ex Taq™进行扩增,反应体系(20 μl):2×Premix Ex Taq 10 μl,10 μmol/L正、反向引物各0.8 μl,10 μmol/L探针0.4 μl,模板4 μl,ddH2O 4 μl。无菌去离子水作为阴性对照。
1.3.4 方法4引物、探针同方法3,仅增加一步反转录过程(42 ℃5 min),以问号钩体16S rRNA和16S rDNA为靶基因的RT-qPCR法。One Step PrimeScript™ RT-PCR Kit进行扩增,反应体系(20 μl):2×One Step RT-PCR buffer Ⅲ 10 μl,Ex Taq HS 0.4 μl,RT Enzyme Mix Ⅱ 0.4 μl,10 μmol/L正、反向引物各0.8 μl,10 μmol/L探针0.4 μl,模板4 μl,ddH2O 2.8 μl。无菌去离子水作为阴性对照。
1.4 灵敏度评价选取1份钩端螺旋体强阳性的鼠肾标本,提取核酸后,用EASY dilution对核酸进行10倍连续稀释,稀释比例为10-1~10-8,分别采用4种方法对各稀释度标本进行检测,比较各方法的检出范围。4种检测方法主要参数见表 1。

|
分别采用4种方法对100份新鲜鼠肾标本及2例临床诊断病人急性期血清进行PCR扩增检测,比较各方法的阳性检出率。2例临床诊断病人的急性期和恢复期血清采用钩体IgM和IgG抗体ELISA检测试剂盒进行结果验证。在100份鼠肾标本中,选取浓度符合测序要求的钩体阳性核酸(标本编号为5、19、24、29、47、60、64、65、66、73、74、86和87)进行23S rRNA的反转录PCR扩增,引物同方法2,扩增条件为50 ℃30 min;94 ℃ 2 min;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 60 s,40个循环;72 ℃ 10 min。扩增产物经1.5%琼脂糖电泳后,出现特异性条带送上海万浦生物科技公司进行测序。测序结果在GenBank数据库中进行BLAST比对,确认其基因型,用于验证方法4的特异性。
1.6 统计学方法Q-Q图用于数据的正态分布检验,重复测量资料均值比较采用Student’s配对t检验方法,重复测量资料构成比组间比较采用配对χ2检验(McNemar检验),Kappa值被计算用于比较不同试验方法之间阳性检出率的一致性。以上统计学检验均在SPSS 18.0软件中操作完成,以P < 0.05为差异有统计学意义。小提琴图和Q-Q图在R语言(v 4.2.1)中由ggplot2软件包操作完成。
2 结果 2.1 灵敏度评价图 1(左)为钩体阳性标本[方法4中每个反应管内荧光信号达到设定的阈值时所经历的循环数(Ct)为11.40]在10-1~10-8 8个稀释度下,2种qPCR方法检出的Ct值。方法4以16S rRNA为靶基因的RT-qPCR方法,检出限为10-7稀释度,而方法3的检出限仅为10-4稀释度,方法4的灵敏度为方法3的1 000倍,且在同一稀释度下(10-1~10-4),方法4与方法3的阳性Ct值差值为9.6~10.5,均值为10.3,结果稳定。
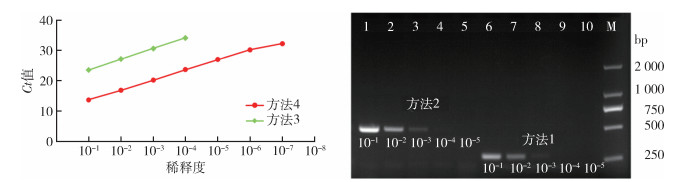
|
| 注:图中稀释度为经方法4(《全国病媒生物病原学监测方案(试行)》推荐的钩端螺旋体检测方法改进的方法)检测Ct值为11.40的钩体阳性标本连续10倍稀释;M核酸分子质量标准;Ct每个反应管内荧光信号达到设定的阈值时所经历的循环数。 图 1 致病性钩端螺旋体4种PCR检测方法的检出能力 Figure 1 Detection power of four PCR methods for pathogenic Leptospira |
| |
图 1(右)为钩体阳性标本在10-1~10-8 8个稀释度下,2种普通PCR的检出情况。孔1~5为方法2的扩增产物,稀释度为10-1~10-5,在约500 bp处可见清晰条带,符合482 bp的预期长度,检出限为10-3稀释度。孔6~10为方法1的扩增产物,产物长度约为300 bp,符合285 bp的预期长度,检出限为10-3稀释度。方法4的灵敏度均为方法1、方法2的10 000倍。
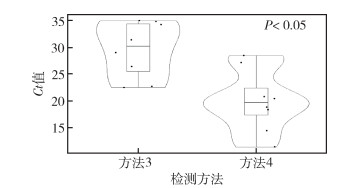
2.2 现场标本检出能力评价 2.2.1 鼠肾标本4种PCR方法平行检测100份鼠肾标本中的致病性钩体,方法1、2、3、4的阳性检出率分别为2.00%、4.00%、8.00%和40.00%。方法4检测结果为阴性的60份标本中,其他3种方法均未检出阳性结果。如表 2、3所示,在相同标本中,方法4的阳性检出率显著高于其他3种方法(均P < 0.001)。方法1、2、3间的阳性检出率差异无统计学意义(P > 0.05)。对方法3和4检测共同阳性的8份鼠肾标本进行平行检测,方法3测得8份鼠肾标本的Ct值为29.34±4.70,方法4的Ct值为19.86±5.23,经Student’s配对t检验分析(图 2),方法4的Ct值显著低于方法3,且Ct值差值分布在6.33~13.36,平均为9.48,灵敏度差异约1 000倍左右,与结果2.1一致。

|
|
|
| 注:方法3指《全国病媒生物病原学监测方案(试行)》推荐的方法;方法4指基于方法3的改良方法;Ct每个反应管内荧光信号达到设定的阈值时所经历的循环数。 图 2 方法3和4对8份致病性钩端螺旋体阳性标本检测结果的Ct值差异 Figure 2 Differences in the Ct value of eight pathogenic Leptospira positive samples by methods 3 and 4 |
| |
用4种PCR方法平行检测2例临床诊断病例急性期血清中的钩体核酸,方法1、2、3检测结果均为阴性,仅方法4检测结果为核酸阳性(Ct值分别为31.10与32.17)。用ELISA方法检测2例临床诊断病人的抗体阳转情况,结果显示2例疑似病人的急性期血清中仅病例2的IgM抗体为弱阳性;恢复期血清中(病例1为发病后62 d、病例2为发病后10 d采样)钩体IgM和IgG抗体均转为阳性,证实2例临床诊断标本确为钩体感染,方法4的核酸阳性结果准确。
2.2.3 钩体测序结果13份鼠肾标本中的钩体序列结果经BLAST比对,均为致病性钩体,其中24、29、60为博氏钩体(L. borgpetersenii),与登录号CP026671.1等博氏钩体株同源性为100%,其余10份为问号钩体,与登录号CP048830.1等问号钩体株同源性为100%。
3 讨论细菌体内16S rRNA的含量明显多于16S rDNA,伍卫华和戴保民[8]1994年发现以钩体16S rDNA和16S rRNA作为检测对象的RT-PCR方法可使凝胶电泳的肉眼可见带检测水平较16S rDNA的PCR扩增提高2个等级(即检测灵敏度提高了100倍),由此可见钩体中16S rRNA的数量远多于16S rDNA,而现行标准扩增靶标均为DNA。本研究建立的RT-qPCR(方法4)与方法3所选的引物探针一致,但方法3扩增的靶基因为含有较少的16S rDNA[7],是造成方法3灵敏度较低的主要原因。方法4以16S rDNA和16S rRNA为扩增对象,仅增加一步反转录反应过程,使得PCR初始扩增模板量明显增加,从而使阳性检出率显著提高,目前国内未见相关报道。由于探针引物与文献[7]完全一致,本研究仅对部分符合测序要求的标本进行23S rRNA的RT-PCR扩增及测序,与其他3种方法结果一致,均为致病性钩体的特异性序列。该方法在基本保证特异性的基础上,使其灵敏度提高了约1 000倍。
目前钩体的检测主要应用于居民区、农田林地等生境中宿主动物的带菌监测,可用于评估媒介生物传染病的风险。此外,口岸及海关监管区作为出入境的特殊区域,其出入境人员相对复杂,对这些区域的监测能有效控制钩体的传入和传出。宁波、江西口岸调查结果显示,采用secY和23S rDNA基因对野鼠进行钩体检测,阳性率分别为6.9%和11.2%[9-10]。近2年浙江省监测报告显示全省的钩体阳性率在10%左右。本研究建立的方法在100只鼠肾中的阳性检出率高达40.00%,而另外3种方法的检出率与其他研究调查较为一致,推断钩体的实际阳性率由于检测方法导致有所低估。因此选择一种高灵敏度和高特异性的检测方法刻不容缓。目前3种现行标准方法之间的检出阳性率虽有差异但不具有显著性(均P > 0.05),而本方法的灵敏度显著高于其他3种标准方法(均P < 0.001)。高灵敏度的检测方法用于钩体病传染源带菌率监测,能有效提高疫情监测质量,上述现象应引起国家相关部门的重视。
该方法在临床标本的检测中也有突出表现。在2例临床诊断病例中,3种标准方法均无法在早期血清标本中检出钩体,仅有方法4显示钩体核酸阳性。由于标本浓度较低,不符合测序要求,但经抗体IgM/IgG检测间接证明了方法4的特异性。临床上有部分钩体病患者因误诊、漏诊延误了治疗而导致肺弥漫性出血、肝肾功能衰竭而死亡,因此实验室高灵敏度的检测方法对临床病人的早期诊断显得尤为重要。
利益冲突 无
| [1] |
张翠彩, 张汀兰, 徐建民, 等. 2016-2018年江西省钩端螺旋体病鼠类动物流行病学调查与分离菌株鉴定[J]. 中国人兽共患病学报, 2019, 35(12): 1080-1084. Zhang CC, Zhang TL, Xu JM, et al. Epidemiological survey and identification of pathogenic Leptospira isolated from rats in Jiangxi province during 2016-2018[J]. Chin J Zoonoses, 2019, 35(12): 1080-1084. DOI:10.3969/j.issn.1002-2694.2019.00.185 |
| [2] |
李喆, 徐颖华, 辛晓芳. 我国钩端螺旋体分子分型研究进展[J]. 疾病监测, 2022, 37(4): 512-516. Li Z, Xu YH, Xin XF. Progress in research of molecular typing of Leptospira in China[J]. Dis Surveill, 2022, 37(4): 512-516. DOI:10.3784/jbjc.202109130500 |
| [3] |
中华人民共和国卫生部. WS 290-2008钩端螺旋体病诊断标准[S]. 北京: 人民卫生出版社, 2008. Ministry of Health of the People's Republic of China. WS 290-2008 Diagnostic criteria for leptospirosis[S]. Beijing: People's Medical Publishing House, 2008. (in Chinese) |
| [4] |
中国疾病预防控制中心. 全国病媒生物病原学监测方案(试行)[Z]. 北京: 中国疾病预防控制中心, 2020. Chinese Center for Disease Control and Prevention. National vector etiology surveillance program (Trial)[Z]. Beijing: Chinese Center for Disease Control and Prevention, 2020. (in Chinese) |
| [5] |
国家质量监督检验检疫总局. SN/T 3741.1-2013国境口岸鼠类携带病原体检测方法第1部分: 致病性钩端螺旋体PCR检测方法[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3741.1-2013 Detection for pathogens of rodents at frontier ports-Part 1: Detection for pathogenic Leptospira[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [6] |
张翠彩, 李秀文, 聂一新, 等. 致病性钩端螺旋体TaqMan real-time PCR检测技术的建立及其应用[J]. 中华流行病学杂志, 2011, 32(10): 1018-1021. Zhang CC, Li XW, Nie YX, et al. Establishment and application of TaqMan real-time PCR for the detection of pathogenic Leptospira species[J]. Chin J Epidemiol, 2011, 32(10): 1018-1021. DOI:10.3760/cma.j.issn.0254-6450.2011.10.015 |
| [7] |
Smythe LD, Smith IL, Smith GA, et al. A quantitative PCR (TaqMan) assay for pathogenic Leptospira spp.[J]. BMC Infect Dis, 2002, 2: 13. DOI:10.1186/1471-2334-2-13 |
| [8] |
伍卫华, 戴保民. 钩端螺旋体16S rRNA逆转录聚合酶链反应[J]. 华西医科大学学报, 1994, 25(2): 166-169. Wu WH, Dai BM. 16S rRNA reverse transcription-polymerase chain reaction of leptospires[J]. J West China Univ Med Sci, 1994, 25(2): 166-169. |
| [9] |
赵明惠, 徐铁龙, 张强, 等. 江西口岸及国检监管区鼠类感染钩端螺旋体的检测及基因序列分析[J]. 中国人兽共患病学报, 2016, 32(7): 674-678. Zhao MH, Xu TL, Zhang Q, et al. Detection and sequencing analysis of Leptospira carried by rats from Jiangxi port and entry-exit inspection and quarantine Bureau's supervision areas[J]. Chin J Zoonoses, 2016, 32(7): 674-678. DOI:10.3760/cma.j.issn.0254-6450.2011.10.015 |
| [10] |
胡群, 马思杰, 邹春颖, 等. 鼠类感染钩端螺旋体的PCR检测和基因序列分析[J]. 中国病原生物学杂志, 2015, 10(5): 427-429, 434. Hu Q, Ma SJ, Zou CY, et al. Detection and phylogenetic analysis of Leptospira spp. carried by rodents[J]. J Pathog Biol, 2015, 10(5): 427-429, 434. DOI:10.13350/j.cjpb.150511 |
 2023, Vol. 34
2023, Vol. 34


