扩展功能
文章信息
- 梁秋果, 杨茜, 程金芝, 吴家红
- LIANG Qiu-guo, YANG Xi, CHENG Jin-zhi, WU Jia-hong
- 贵州省不同地理株中华按蚊mtDNA-COⅠ基因遗传多态性分析
- Genetic polymorphism of mtDNA-COⅠ gene of Anopheles sinensis from different geographical strains in Guizhou province, China
- 中国媒介生物学及控制杂志, 2023, 34(1): 14-20
- Chin J Vector Biol & Control, 2023, 34(1): 14-20
- 10.11853/j.issn.1003.8280.2023.01.003
-
文章历史
- 收稿日期: 2022-08-12
2 贵州医科大学基础医学院现代病原生物学特色重点实验室/人体寄生虫学教研室, 贵州 贵阳 550025
2 Key Laboratory of Modern Pathogen Biology and Characteristics/Department of Human Parasitology, Basic Medical College, Guizhou Medical University, Guiyang, Guizhou 550025, China
中华按蚊(Anopheles sinensis)是我国重要的疟疾传播媒介,广泛分布于我国除新疆维吾尔自治区(新疆)和青海省以外的各省(直辖市、自治区)[1]。在广大平原地区,特别是水稻种植区,因中华按蚊种群数量仍然较大,一旦有输入性疟疾病例,引起暴发性流行的风险极高[2-3]。贵州省位于中国西南部,属亚热带湿润季风气候,相对湿度较大,各种自然条件都有利于蚊虫的生长和繁衍,中华按蚊是贵州省夏季稻田的优势蚊种,其种群数量较大,分布广泛[4]。近年来,贵州省原来疟疾流行区传疟媒介蚊虫的种群数量和结构均发生了改变,传疟媒介蚊虫密度呈逐年上升趋势,并且中华按蚊取代了微小按蚊(An. minimus)和雷氏按蚊(An. lesteri)成为主要传疟媒介[5],而贵州省2012-2018年累计报告疟疾病例近200例,均为输入性病例[6]。在这种输入性疟疾病例数较多叠加主要传疟媒介中华按蚊密度较大的情况下,输入性疟疾病例引发本地传播的风险较高,给贵州省疟疾防控工作带来了巨大的考验。因此,了解并掌握贵州省不同地理株中华按蚊的种群结构和可能的扩散途径,进而制定科学、合理、有效的蚊虫防治策略来控制本地区中华按蚊等媒介蚊虫的种群密度显得尤为重要和迫切。
常用于蚊虫种群遗传学研究的分子标记主要有线粒体DNA和微卫星DNA,其中线粒体DNA细胞色素C氧化酶亚基Ⅰ(mtDNA-COⅠ)基因序列因其结构简单、进化速率快、母系遗传、发生重组的概率极低且多态性位点广泛存在等特点,已被用于多种蚊虫分子鉴定和种群遗传分析研究[7-8]。目前,已有研究报道了国内多地中华按蚊种群遗传特征,但对贵州省中华按蚊的研究仅限于个别种群[9-10],缺乏全面、系统的研究。为此,我们在贵州省12个采样点进行采样,能在一定程度上代表贵州省不同地理株中华按蚊的种群结构,了解贵州省中华按蚊种群遗传多样性、遗传分化和种群扩张情况等种群遗传特征,以期为中华按蚊种群遗传学研究提供部分基础数据。
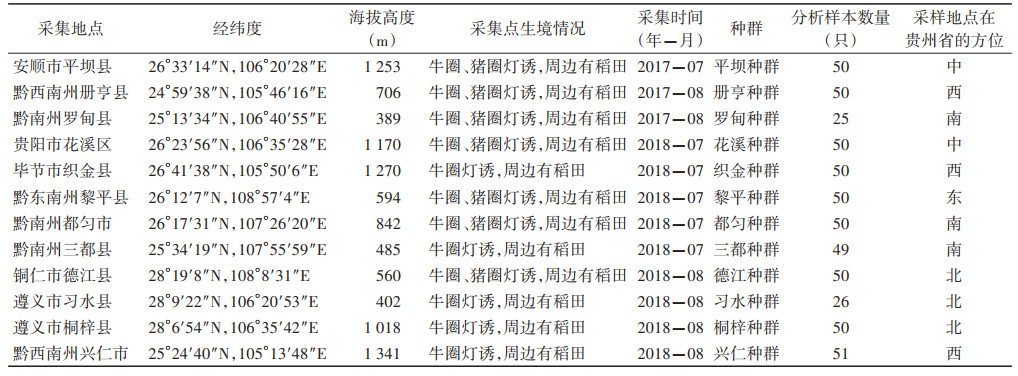
1 材料与方法 1.1 中华按蚊野外种群的采集与形态学鉴定本研究所用中华按蚊样本于2017-2018年在贵州省东、西、南、北、中5个方位的12个采样点用灯诱法采集,采样点的具体信息、在贵州省的方位及每个种群分析的样本数量见表 1。所使用的LTS-MO2诱蚊灯为武汉吉星环保科技有限公司生产,在采样点当地农户猪圈或牛圈合适位置悬挂诱蚊灯,于日落前1 h开启至次日日出后1 h关闭,收集集蚊纱袋放入冰箱冷冻致死,低温保存尽快带回实验室。参照蚊虫检索表[11]在体视显微镜下进行形态学鉴定,经鉴定的中华按蚊放入冻存管做好标记后放于-20 ℃冰箱保存备用。
|
HH-4数显恒温水浴锅由常州国华电器有限公司生产,Z383K高速冷冻离心机由德国赫默公司生产,A24811PCR热循环仪由赛默飞世尔科技(中国)有限公司生产,DYY-6C凝胶电泳仪由北京市六一仪器厂生产,Tanon 3 500R凝胶图像处理系统由上海天能科技有限公司生产;TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0(Code No.9765)购自宝日医生物技术(北京)有限公司,Dream Taq Green PCR Master Mix购自赛默飞世尔科技(中国)有限公司,D2000 DNA Ladder购自北京索莱宝科技有限公司,4S GelRed核酸染料(10 000×水溶液)购自生工生物工程(上海)股份有限公司。
1.3 中华按蚊基因组DNA提取与分子鉴定依次取各个采样点的单只中华按蚊样本,用眼科剪去除饱血腹部后将剩余组织按照TaKaRa MiniBEST Universal Genomic DNA Extraction Kit Ver.5.0试剂盒的使用说明提取中华按蚊基因组DNA,保存于-20 ℃备用;采用目前国内外学者常用mtDNA-COⅠ基因法[12]对现场采集经形态学鉴定的中华按蚊进行分子生物学鉴定。以上述提取的DNA为模板,参考Folmer等[13]研究所用特异性引物,合成COⅠ引物(COⅠ-F:5'-GGTCAACAAATCATAAAGATATTGG-3';COⅠ-R:5'-TAAACTTCAGGGTGACCAAAAAATCA- 3'),目的基因片段长度为709 bp,PCR扩增mtDNA-COⅠ基因的反应体系为:DNA模板(10~ 15 ng/μl)2 μl,COⅠ-F(10 μmol/L)和COⅠ-R(10 μmol/L)各1 μl,Dream Taq Green PCR Master Mix 12.00 μl,灭菌双蒸水9 μl,总体积为25.00 μl;PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,52 ℃退火60 s,72 ℃延伸60 s,共35个循环;72 ℃延伸10 min;4 ℃保存。用1%琼脂糖凝胶经电泳(120 V,40 min)后,用紫外系统成像仪成像检测扩增条带并拍照记录结果。将在D2000 DNA Ladder的500和750 bp条带之间出现条带的PCR产物送至生工生物工程(上海)股份有限公司,用正、反向引物进行双向测序。用DNAStar 5.0软件将测序得到的序列与测序峰图核对后进行拼接,将得到的序列在美国国立生物技术信息中心(NCBI)进行在线BLAST比对,根据核苷酸相似性大小对蚊虫种类进行分子鉴定,与已知中华按蚊核苷酸相似性在99%以上即鉴定为中华按蚊mtDNA-COⅠ基因序列,可用于后续中华按蚊种群遗传学分析。
1.4 中华按蚊mtDNA-COⅠ基因种群遗传学分析使用DnaSP 5.1软件分析中华按蚊mtDNA-COⅠ基因的单倍型多样性(haplotype diversity,Hd)、核苷酸多样性(nucleotide diversity,Pi),并计算各种群间分化系数(Fst)和基因流(Nm)大小,进行中性检验,以明确各种群之间的分化程度和种群扩张情况。使用MEGA 7.1软件计算各种群间和种群内的遗传距离,判断种群之间的遗传变异程度;根据采样点经纬度计算种群间的地理距离,与对应的遗传距离进行相关性检验,以分析两者的相关性。
2 结果 2.1 中华按蚊蚊种分子鉴定对贵州省12个采样点采集的蚊虫经形态学鉴定为中华按蚊的标本提取DNA后进行PCR扩增,将扩增产物经凝胶电泳,用紫外成像检测在D2000 DNA Ladder的500和750 bp条带之间靠近750 bp条带的位置出现目的条带。经双向测序拼接后获得长度为709 bp的基因序列,将得到的序列在NCBI进行在线BLAST比对,共得到核苷酸相似性在99%以上的序列551条。
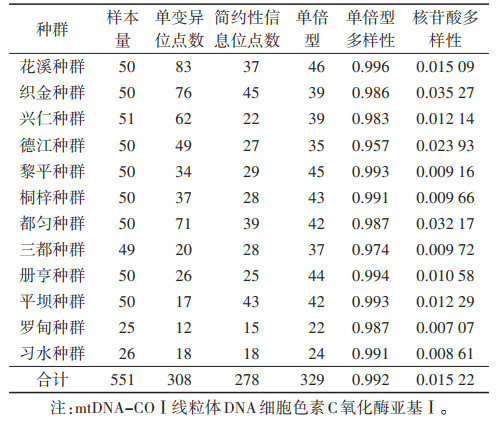
2.2 中华按蚊mtDNA-COⅠ基因序列碱基组成及多样性分析551条中华按蚊mtDNA-COⅠ基因序列中A、T、G和C 4种碱基的平均含量分别为30.18%、38.39%、16.22%和15.21%,碱基(A+T)含量为68.57%,(G+C)含量为31.43%,(A+T)含量高于(G+C)含量。mtDNA-COⅠ基因序列709个位点中保守位点有586个,变异位点有123个,单态位点有189个,简约性信息位点有278个,无插入和缺失位点。551条序列共检出单倍型329种,其中特有单倍型263种,共享单倍型66种,共享单倍型占所有单倍型的比例为20.06%,共享单倍型中有4种在10条以上的中华按蚊样本mtDNA-COⅠ基因序列中出现,分别为:COⅠ-Hap_25(33)、COⅠ-Hap_61(24)、COⅠ- Hap_78(13)和COⅠ-Hap_83(11),其中COⅠ-Hap_25(33)在12个种群中都有出现。DNA多样性指数分别为:Hd=0.992,Pi=0.015 22,各种群Hd范围在0.957(德江种群)~0.996(花溪种群),Pi范围在0.007 07(罗甸种群)~0.035 27(织金种群)。见表 2。
|
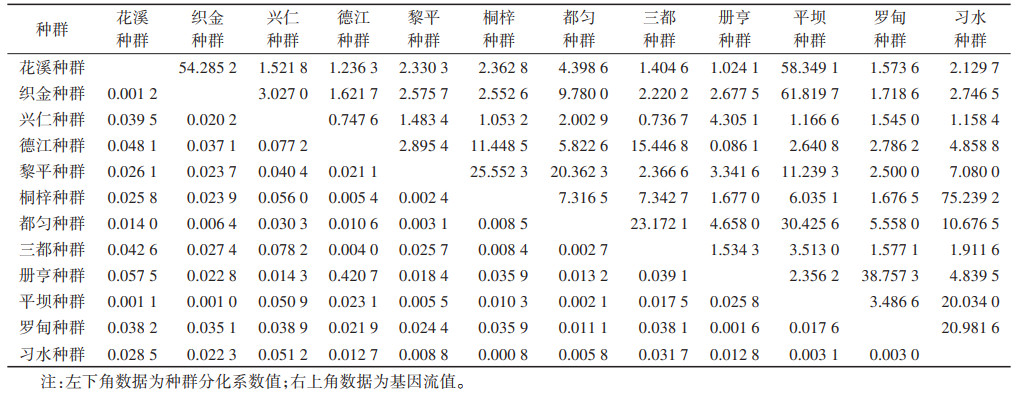
12个中华按蚊种群的Fst在0.000 8~0.420 7,其中德江种群与册亨种群间Fst值最大,且 > 0.25,而其Nm < 1,Fst > 0.05的还有:三都种群与兴仁种群(0.078 2)、德江种群与兴仁种群(0.077 2)、册亨种群与花溪种群(0.057 5)、桐梓种群与兴仁种群(0.056 0)、习水种群与兴仁种群(0.051 2)和平坝种群与兴仁种群(0.050 9)。Nm值在0.086 1~75.239 2,其中Nm > 30的有:习水种群与桐梓种群(75.239 2)、织金种群与平坝种群(61.819 7)、花溪种群和平坝种群(58.349 1)、花溪种群与织金种群(54.285 2)、罗甸种群与册亨种群(38.757 3)和都匀种群与平坝种群(30.425 6),其余大部分种群之间的Nm在1~10。见表 3。
|
12个中华按蚊种群中性检验Tajima’s D的D值均 < 0,其中花溪种群、织金种群、兴仁种群、德江种群、黎平种群、桐梓种群和都匀种群的D值差异有统计学意义(均P < 0.05),而其余5个种群的D值差异无统计学意义(均P > 0.10)。基于Fu and Li’s F和Fu and Li’s D的中性检验也显示出类似的结果。将12个种群看成一个整体来分析,Tajima’s D、Fu and Li’s F和Fu and Li’s D的检验统计量均 < 0(均P < 0.001)。见表 4。
12个中华按蚊种群内遗传距离范围在0.007 1~0.052 9,其中织金种群和都匀种群内遗传距离较其他种群大;12个中华按蚊种群间的遗传距离范围在0.007 9~0.052 2,其中织金种群和都匀种群与其他种群之间的遗传距离较大。12个种群之间地理距离最远的是德江种群与册亨种群(438.36 km),其次是德江种群与兴仁种群(433.53 km),种群之间地理距离在300 km以上的共有17组。见表 5。

|
以中华按蚊各种群之间的地理距离为横坐标,遗传距离为纵坐标,绘制散点图(图 1),可得到12个中华按蚊种群遗传距离与地理距离之间相关性分析的散点图,由散点图可知,两者之间无相关关系。

|
| 图 1 中华按蚊种群遗传距离与地理距离相关性分析散点图 Figure 1 Scatter diagram of correlation analysis between the genetic distance and geographical distance of Anopheles sinensis populations |
| |
本研究获得了551条mtDNA-COⅠ基因序列,序列长度为709 bp,(A+T)含量高于(G+C)含量,具有明显的AT偏向性,符合线粒体DNA的特性[14],这些序列中共检出329种单倍型,占总样本数的59.71%,各种群单倍型占其样本数的70.00%以上,而Hd值在0.99以上,Pi值在0.015以上,说明贵州省中华按蚊整体的遗传多样性较高。不同种群的遗传多样性存在一定的差异,单倍型多样性最高的是花溪种群,核苷酸多样性最高的是织金种群,这两地位于贵州省的中部,在贵州省蚊类地理区划上属于黔中高原丘陵区Ⅴ(ⅥB4),海拔在1 200 m左右,气候湿润,生态环境良好,物种丰富,离省会贵阳市较近,经济发展相对较好,居民对环境卫生条件的要求较高,环境选择压力较大,有利于丰富中华按蚊的遗传多样性。种群遗传分化和基因交流分析表明,贵州省12个中华按蚊种群间的Fst值在0.000 8~0.420 7,Nm值在0.086 1~75.239 2,大部分种群之间遗传分化较小,基因交流比较丰富,而德江种群、习水种群与册亨种群、兴仁种群等种群之间的Fst值较大,种群之间的基因交流较弱,存在一定的遗传分化,从地理位置上看,这些种群之间相距较远,而中华按蚊自身体型较小,自然条件下难以实现长距离迁移,加之贵州省境内山脉众多,重峦叠峰,绵延纵横,种群之间的基因交流会受到地理距离的限制,而产生一定的遗传分化和隔离。中性检验结果显示,贵州省中华按蚊种群中性检验统计值均为负值,表明贵州省中华按蚊种群在历史上经历了种群扩张,而不同种群的扩张程度有所不同,织金种群、都匀种群扩张程度明显(P < 0.001),而三都种群、册亨种群、平坝种群等5个种群扩张程度不明显(P > 0.10),发展则相对缓慢,提示贵州省中华按蚊种群近期经历了区域性的扩张发展。种群遗传距离结果显示,织金种群、都匀种群内的遗传距离较大,与其他种群之间的遗传距离也较大,表明这2个种群存在较明显的遗传变异,推测可能是由于历史上种群发生了明显的扩张而使得种群内遗传变异程度较大。本研究中12个中华按蚊种群遗传距离与地理距离之间无相关关系,可能存在一定地理隔离现象,但这种地理隔离和地理距离无相关关系,可能是其他因素造成的地理隔离。
一定时期内的气候和地质变化是影响种群扩张变化和产生地理隔离的主要因素[15],相关研究发现温度、湿度和降雨量等气象因素对媒介生物种群数量、密度、分布等产生了显著影响,并存在时空异质性[16]。贵州省地处扬子陆块与江南造山带的过渡区,历史上发生过多次地壳运动,最为重要和强烈的燕山运动使贵州前下白垩统普遍发生褶皱、断裂和变形,而新近纪以来的地壳运动,明显切割了先期构造形迹和地质体,新的环境变化使得许多物种进入繁荣发展时代,中华按蚊种群可能在这一时期得以迅速扩张发展。随后青藏高原强烈隆升,形成了现代云贵高原,产生了北部大娄山、东南苗岭、西部乌蒙山、东北武陵山四大山系[17],使得一些种群之间的交流被阻断,从而产生一定的遗传分化和地理隔离。另一方面,相关研究发现种群产生遗传分化和隔离的程度还会受其所处生态环境作用的强度和方向影响,若生态环境作用的强度和方向差别不大,即使种群相隔甚远,也难以产生明显的遗传分化[18]。中华按蚊主要的生活环境是稻田,贵州省粮食作物中,水稻的种植面积最大,毒死蜱、敌敌畏等是稻田常用的杀虫剂[19],中华按蚊生活环境的选择压力大体一致,使得不同地区中华按蚊种群的遗传分化没有那么明显。同时,在人为因素(物流运输等)和自然因素(河水流动等)作用下,部分中华按蚊可能出现远距离迁移,而实现种群间的基因交流。贵州省地形西部高,中部稍低,北、东、南三面倾斜,水系顺地势由西部、中部向北、东、南三面分流[20],这在一定程度也增加了不同种群间基因交流的机会。
在本次研究中,中华按蚊标本采集点分布在贵州省历史上的疟疾高流行区和低流行区,且包括了贵州省的东、南、西、北、中各个方位,具有一定的代表性。基于中华按蚊mtDNA-COⅠ基因的种群遗传多态性分析结果表明,贵州省不同地理株中华按蚊种群遗传多态性较高,不同种群间存在一定程度的遗传分化和地理隔离,但在一定范围内种群间也有基因交流,呈现出交流与隔离并存的分布格局。贵州省中华按蚊种群间的这种遗传特征从一定程度上也反映了环境、媒介和人类活动之间的关系,而种群间的遗传分化和地理隔离是否能引起其抗药性和传播蚊媒病毒能力的差异,则有待进一步的研究。
志谢 本研究中蚊虫采集、鉴定以及实验过程得到了浙江出入境检验检疫局的王刚博士、郑伟博士等以及贵州省各地疾病预防控制中心各位老师的悉心指导和热情帮助,在此志谢利益冲突 无
| [1] |
诸欣平, 苏川, 吴忠道, 等. 人体寄生虫学[M]. 北京: 人民卫生出版社, 210: 210. Zhu XP, Su C, Wu ZD, et al. Human parasitology[M]. Beijing: People's Medical Publishing House, 210: 210. |
| [2] |
刘起勇. 新时代媒介生物传染病形势及防控对策[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 1-6, 11. Liu QY. Epidemic profile of vector-borne diseases and vector control strategies in the new era[J]. Chin J Vector Biol Control, 2019, 30(1): 1-6, 11. DOI:10.11853/j.issn.1003.8280.2019.01.001 |
| [3] |
丰俊, 张丽, 涂宏, 等. 从消除到消除后: 中国输入性疟疾的疫情特征、挑战及防止再传播策略[J]. 中国热带医学, 2021, 21(1): 5-10. Feng J, Zhang L, Tu H, et al. From elimination to post-elimination: Characteristics, challenges and re-transmission preventing strategy of imported malaria in China[J]. China Trop Med, 2021, 21(1): 5-10. DOI:10.13604/j.cnki.46-1064/r.2021.01.02 |
| [4] |
王昭孝, 刘兴梅, 王武, 等. 贵州自然疫源性疾病[M]. 贵阳: 贵州科技出版社, 2015: 22. Wang ZX, Liu XM, Wang W, et al. Natural foci diseases in Guizhou[M]. Guiyang: Guizhou Science and Technology Press, 2015: 22. |
| [5] |
丁旭, 师伟芳, 张玉琼, 等. 2005-2019年贵州省传疟媒介按蚊密度及种群监测[J]. 中国血吸虫病防治杂志, 2021, 33(3): 274-280. Ding X, Shi WF, Zhang YQ, et al. Surveillance of malaria vector Anopheles in Guizhou province from 2005 to 2019[J]. Chin J Schisto Control, 2021, 33(3): 274-280. DOI:10.16250/j.32.1374.2021058 |
| [6] |
周光荣, 龙琴英, 袁有树, 等. 2012-2018年贵州省输入性疟疾流行特征分析[J]. 现代预防医学, 2020, 47(16): 2921-2924. Zhou GR, Long QY, Yuan YS, et al. Analysis of imported malaria in Guizhou province from 2012 to 2018[J]. Mod Prev Med, 2020, 47(16): 2921-2924. |
| [7] |
Wang X, Tu WC, Huang EJ, et al. Identification of disease-transmitting mosquitoes: Development of species-specific probes for DNA chip assay using mitochondrial COⅠ and ND2 genes and ribosomal internal transcribed spacer 2[J]. J Med Entomol, 2016, 54(2): 396-402. DOI:10.1093/jme/tjw195 |
| [8] |
曾旭灿, 许翔, 杨锐, 等. 云南省中华按蚊种群mtDNA-COⅠ基因序列的遗传结构分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 265-270. Zeng XC, Xu X, Yang R, et al. A genetic structure analysis of mtDNA COⅠ gene sequence of Anopheles sinensis populations in Yunnan province, China[J]. Chin J Vector Biol Control, 2021, 32(3): 265-270. DOI:10.11853/j.issn.1003.8280.2021.03.002 |
| [9] |
Ma YJ, Yang MN, Fan Y, et al. Population structure of the malaria vector Anopheles sinensis (Diptera: Culicidae) in China: Two gene pools inferred by microsatellites[J]. PLoS One, 2011, 6(7): e22219. DOI:10.1371/journal.pone.0022219 |
| [10] |
常雪莲, 钟代斌, 李小聪, 等. 基于mtDNA-COⅠ基因序列分析我国中华按蚊种群的遗传结构[J]. 南方医科大学学报, 2015, 35(2): 234-238, 247. Chang XL, Zhong DB, Li XC, et al. Analysis of population genetic structure of Anopheles sinensis based on mitochondrial DNA cytochrome c oxidase subunitⅠgene fragment[J]. J South Med Univ, 2015, 35(2): 234-238, 247. DOI:10.3969/j.issn.1673-4254.2015.02.15 |
| [11] |
陆宝麟, 等. 中国动物志. 昆虫纲. 第九卷. 双翅目: 蚊科(下)[M]. 北京: 科学出版社, 1997: 7-12. Lu BL, et al. Fauna sinica Insecta, Vol. 9, Diptera: CulicidaeⅡ[M]. Beijing: Science Press, 1997: 7-12. |
| [12] |
郭秀霞, 程鹏, 刘丽娟, 等. 9种蚊虫细胞色素C氧化酶亚基Ⅰ基因的分子进化分析[J]. 中国媒介生物学及控制杂志, 2017, 28(6): 530-534. Guo XX, Chen P, Liu LJ, et al. Molecular evolution analysis of mitochondrial DNA cytochrome c oxidase subunitⅠgene among nine mosquito species[J]. Chin J Vector Biol Control, 2017, 28(6): 530-534. DOI:10.11853/j.issn.1003.8280.2017.06.004 |
| [13] |
Folmer O, Black M, Hoeh W, et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunitⅠ from diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294-299. |
| [14] |
Yuan Y, Li Q, Kong LF, et al. The complete mitochondrial genome of the grand jackknife clam, Solen grandis (Bivalvia: Solenidae): A novel gene order and unusual non-coding region[J]. Mol Biol Rep, 2012, 39(2): 1287-1292. DOI:10.1007/s11033-011-0861-8 |
| [15] |
杨飞龙, 李旭东, 闫振天, 等. 云南中华按蚊的遗传变异和种群结构[J]. 生态学报, 2015, 35(16): 5449-5457. Yang FL, Li XD, Yan ZT, et al. Genetic variation and population structure of Anopheles sinensis (Diptera: Culicidae) in Yunnan[J]. Acta Ecol Sin, 2015, 35(16): 5449-5457. DOI:10.5846/stxb201311172746 |
| [16] |
刘起勇. 气候变化对中国媒介生物传染病的影响及应对: 重大研究发现及未来研究建议[J]. 中国媒介生物学及控制杂志, 2021, 32(1): 1-11. Liu QY. Impact of climate change on vector-borne diseases and related response strategies in China: Major research findings and recommendations for future research[J]. Chin J Vector Biol Control, 2021, 32(1): 1-11. DOI:10.11853/j.issn.1003.8280.2021.01.001 |
| [17] |
徐伟钧, 黄波, 范中学. 贵州省大地构造特征分析[J]. 有色金属, 2018, 70(6): 79-82. Xu WJ, Huang B, Fan ZX. Analysis on geotectonic characteristics of Guizhou province[J]. Nonferr Metals, 2018, 70(6): 79-82. DOI:10.3969/j.issn.1671-4172.2018.06.016 |
| [18] |
Kelley ST, Farrell BD, Mitton JB. Effects of specialization on genetic differentiation in sister species of bark beetles[J]. Heredity, 2000, 84(2): 218-227. DOI:10.1046/j.1365-2540.2000.00662.x |
| [19] |
胡小宏. 水稻绿色生态种植技术分析[J]. 农业技术与装备, 2021(3): 155-156. Hu XH. Analysis of rice green ecological planting technology[J]. Agric Technol Equip, 2021(3): 155-156. DOI:10.3969/j.issn.1673-887X.2021.03.073 |
| [20] |
张静, 李贵云, 唐福德, 等. 独特而珍贵的贵州高原湿地[J]. 中国周刊, 2017, 5(2): 30-39. Zhang J, Li GY, Tang FD et al. Unique and precious Guizhou plateau wetland[J]. China weekly, 2017, 5(2): 30-39. |
 2023, Vol. 34
2023, Vol. 34



