扩展功能
文章信息
- 刘锦, 黄淑丽, 李宏梅, 哈斯宝力道, 图雅, 张晓敏, 李超, 黄文吉
- LIU Jin, HUANG Shu-li, LI Hong-mei, Hasibaolidao, TU Ya, ZHANG Xiao-min, LI Chao, HUANG Wen-ji
- 草原道路对狭颅田鼠肝毛细线虫感染率影响的初步调查
- A preliminary investigation of effects of grassland road on Capillaria hepatica infection rate in Microtus gregalis
- 中国媒介生物学及控制杂志, 2023, 34(1): 109-113
- Chin J Vector Biol & Control, 2023, 34(1): 109-113
- 10.11853/j.issn.1003.8280.2023.01.020
-
文章历史
- 收稿日期: 2022-10-08
2 海南省崖州湾种子实验室, 海南 三亚 527000;
3 中国热带农业科学院热带生物技术研究所, 海南 海口 571101;
4 中国科学院动物研究所农业虫害鼠害综合治理国家重点实验室, 北京 100101;
5 四川大学生命科学学院, 四川 成都 610065
2 Hainan Yazhou Bay Seed Laboratory, Sanya, Hainan 527000, China;
3 Institute of Tropical Bioscience and Biotechnology, Chinese Academy of Tropical Agricultural Sciences, Haikou, Hainan 571101, China;
4 State Key Laboratory of Integrated Management of Pest Insects and Rodents, Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China;
5 College of Life Sciences, Sichuan University, Chengdu, Sichuan 610065, China
肝毛细线虫病是一种寄生虫病,是由肝毛细线虫(Capillaria hepatica)成虫寄生在鼠类或其他哺乳动物肝脏内而导致的疾病[1-2]。据目前的研究表明,鼠类是肝毛细线虫病最大的宿主类群,世界各地均有鼠类被其寄生的案例[3-4]。人类也是肝毛细线虫的宿主之一,人类被肝毛细线虫寄生后,肝脏会受到极大的损伤,表现为肝脏炎症、纤维化,严重的会导致人类死亡[5-6]。
狭颅田鼠(Microtus gregalis)又称群栖田鼠,栖息地广泛,遍及高山草原、森林草原、荒漠化草原以及农田。该鼠种在内蒙古自治区(内蒙古)主要分布于锡林郭勒盟和呼伦贝尔盟的东部[7]。肝毛细线虫作为狭颅田鼠的主要寄生虫,在我国多个省份均有分布。其中内蒙古锡林郭勒盟地区是肝毛细线虫病的自然疫源地之一,该地区栖息着布氏田鼠(Lasiopodomys brandtii)、长爪沙鼠(Meriones Unguiculatus)、黑线毛足鼠(Phodopus campbelli)、小毛足鼠(P. roborovskii)和黑线仓鼠(Cricetulus barabensis)等多种草原鼠类,这些鼠类的分布区与肝毛细线虫分布区有极高的重叠度[8]。宛新荣等[9]对肝毛细线虫病自然疫源地与鼠类分布相关性研究发现,肝毛细线虫在锡林郭勒盟的分布区与狭颅田鼠栖息地存在重叠情况。因此,狭颅田鼠理论上存在被肝毛细线虫寄生的较高概率,但是目前有关野外狭颅田鼠个体感染肝毛细线虫病的资料还较为缺乏。为探究草原道路对狭颅田鼠肝毛细线虫病感染率的影响,我们选择内蒙古锡林郭勒盟东乌珠穆沁旗的西北部草场为取样地点,开展相关的研究,旨在探究狭颅田鼠肝毛细线虫感染率与草原道路的关系,并为草原鼠源性疾病防控、保护草原生态文明建设提供相关理论依据。
1 材料与方法 1.1 研究地点研究样地位于内蒙古锡林郭勒盟西乌珠穆沁旗东边的狭颅田鼠鼠害草场(北纬44°29′,东经117°48′,海拔1 051 m)。基于前期野外随机调查发现,草场内的狭颅田鼠存在被肝毛细线虫寄生的情况。2006年7月下旬在该草场上随机选择2块样地,其中1块紧邻草原道路的样地,记作实验组,另1块距草原道路500 m的样地记作对照组。每个样地平均分为6个30 m×80 m的方形小样区。选取的2块样地内除狭颅田鼠以外,还分布着黑线仓鼠、达乌尔黄鼠(Spermophilus dauricus)、五趾跳鼠(Allactaga sibirica)等,不过其余鼠种占比极低,对本次实验不存在显著影响。
2块样地内的植被主要为克氏针茅(Stipa krylovii)、羊草(Leymus chinensis)、菊叶委陵菜(Potentilla tanacetifolia)、二裂委陵菜(P. bifurca)、麻花头(Klasea centauroides)、糙隐子草(Cleistogenes squarrosa)、冷蒿(Artemisia frigida)、冰草(Agropyron cristatum)、杂花苜蓿(Medicago varia)、瓣蕊唐松草(Thalictrum petaloideum)和蒲公英(Taraxacum mongolicum)等。相较于对照组样地,实验组样地内还有较高比例的雾冰藜(Bassia dasyphylla)和猪毛菜(Salsola collina)等杂草。
1.2 小样区划分和实验鼠的采集实验组6个小样区编号为A1~A6,对照组6个小样区编号为B1~B6。其中A1与B1平行,A2与B2平行,以此类推。在编号完成后,通过全球定位系统(GPS)定位每个小样区内狭颅田鼠洞群分布,再用密集型布置的方法进行木制捕鼠夹的夹捕。每个洞群区域内最低放置10个捕鼠夹,以新鲜花生米作诱饵。为了基本捕尽样地内所有的狭颅田鼠,每天08:00以及16:00布放捕鼠夹。每隔2 h收集一次捕获的鼠类,并重新布放被触发的鼠夹,每天重复2次布放,连续布放3 d。将每次捕获的狭颅田鼠装进密封的塑料桶内保存,并倒入适量的三氯甲烷熏蒸灭蚤。将实验鼠带回实验室进行常规解剖,解剖时观察实验鼠肝毛细线虫感染情况[10]。
1.3 肝毛细线虫感染率的计算被肝毛细线虫感染的狭颅田鼠个体的肝脏会出现淡黄色或白色斑点,严重的会出现丝状或絮状斑纹[11-12]。解剖野外带回的样品,记录其感染情况,有以上感染症状的个体记为阳性[13]。计算公式如下:

|
宛新荣等[14-15]对肝毛细线虫感染度数据获取的方法为肉眼对实验鼠肝脏进行观测,并将感染度分为4个级别:无感染(肝脏病变面积为0,感染度记为0)、轻度感染(肝脏病变面积为0~10%,感染度记为1)、中度感染(肝脏病变面积为10%~30%,感染度记为2)、重度感染(肝脏病变面积 > 30%,感染度记为3)。由于该方法在野外实验中较容易实现,故采用该方法获取数据。在本研究解剖过程中发现,有的个体感染情况十分严重,整个肝脏红白相间,白色丝状斑纹明显,有的个体感染程度轻微,只有部分肝脏出现白斑。通过对感染实验鼠肝脏的直接观测,评估其感染度,计算感染个体的平均感染度。
1.5 数据统计检验方法使用以上计算方法,计算实验组和对照组内共计12个小样区的狭颅田鼠感染率以及感染个体的平均感染度,在SPSS 22.0统计软件中,采用独立样本t检验,对比实验组和对照组的狭颅田鼠感染率、平均感染度以及该鼠种群密度(每个小区之间不进行对比),检验水准取0.05,由于感染率为百分比数据,经反正弦平方根变换后进行显著性比较。
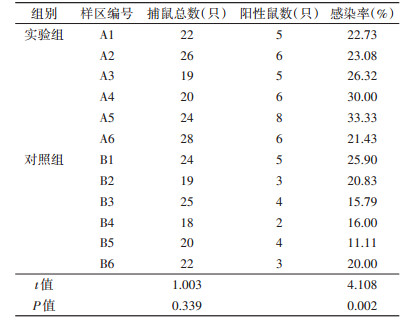
2 结果 2.1 肝毛细线虫感染率与种群密度在实验组样地中共捕获狭颅田鼠139只,感染个体36只,组内6个小样区平均感染率为(26.15±4.28)%,平均捕获个体数为(23.17±3.18)只。对照组样地中共捕获狭颅田鼠128只,感染个体21只,组内6个小样区平均感染率为(16.23±3.38)%,对感染率数据进行t检验,实验组样地内的狭颅田鼠感染率显著高于对照组(n=12,t=4.108,P=0.002)。平均捕获个体数为(21.33±2.56)只,对各样区内捕获个体数量的统计分析显示,实验组样地内的狭颅田鼠种群密度略高于对照组,但差异无统计学意义(n=12,t=1.003,P=0.339)。2组样地感染个体与健康个体数量见图 1。各小样区内的感染率见表 1。

|
| 图 1 内蒙古锡林郭勒盟西乌珠穆沁旗狭颅田鼠鼠害草场2个样地狭颅田鼠感染个体与健康个体数量 Figure 1 Numbers of infected and healthy narrow-skulled in experimental and control plots of Microtus gregalis-infested grassland in West Ujimqin Banner, Xilin Gol League, Inner Mongolia |
| |
|
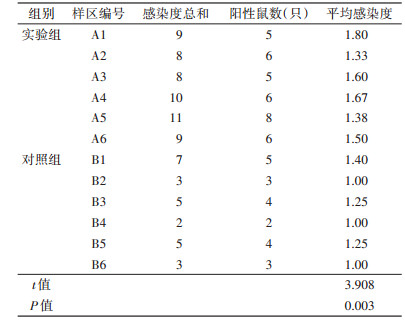
通过对解剖的狭颅田鼠个体进行肝毛细线虫感染度评估,计算各样区内的感染度总和,分析小样区内感染个体的平均感染度(未感染的个体不列入感染度计算的分母)。实验组的6个小样区内个体平均感染度为1.55±0.16,对照组的6个小样区内个体平均感染度为1.15±0.16,t检验结果显示,实验组的实验鼠肝毛细线虫平均感染度显著高于对照组(n=12,t=3.908,P=0.003)。各小样区内肝毛细线虫感染度见表 2。
|
郭艳梅等[16]对肝毛细线虫的生物学描述,该虫属土源性线虫,其整个生活史中,无需中间宿主,属直接发育类线虫。成虫在动物肝脏内所产虫卵无法直接发育,需要宿主死亡后,将虫卵释放到适宜的环境中才能继续发育。鼠类感染肝毛细线虫主要是通过取食含有线虫虫卵的食物造成的,进入鼠类体内的肝毛细线虫虫体将会终生保留在宿主体内[17]。相关的研究也表明肝毛细线虫的寿命在50 d左右,成虫在宿主肝脏内死亡后,虫体逐渐分解,最终遗留大量虫卵[18]。
鼠类作为多种寄生虫病的常见宿主[19-21],已有研究表明,当群体密度升高时,鼠类受到的捕食压力会显著增加[22-23],从而促使集群扩散,而在扩散过程中,携带寄生虫的鼠类个体不仅会加剧疾病的传播,还会与其他鼠类产生交叉感染[14]。杨进荣等[13]在研究长爪沙鼠(Meriones unguiculatus)肝毛细线虫病与其天敌之间的关系时就发现,天敌的存在会加剧肝毛细线虫的传播。据宛新荣等[24]对小型鼠类的调查发现,草原公路是人类与鼠类最大的交汇点之一,也是动物源性疾病的主要传播途径之一。Silva等[25]对寄生野外猫科动物的寄生虫进行研究时发现,道路上因车辆致死的猫科动物数量极多,在这些因道路致死的动物体内发现大量的寄生虫,道路极有可能促进宿主体内寄生虫的传播。杨进荣等[13]对长爪沙鼠的研究表明,道路旁较高数量的猛禽对长爪沙鼠的捕食行为将缩短肝毛细线虫病的传播周期。我们在野外调查过程中也发现,在草原道路的某些地段,由于车辆的来往,大量的狭颅田鼠被碾压致死,这些尸体会吸引其他的捕食者进行捕食。在此过程中,如果感染了肝毛细线虫的狭颅田鼠个体被车辆碾压致死,其肝脏内的线虫虫卵将会被释放出来,并可能在泥质草原的道路上发育,最终污染土壤并促进肝毛细线虫的进一步传播。而捕食者取食带有线虫虫卵的田鼠内脏后,也将会极大地扩散线虫的传播范围。因此草原道路对肝毛细线虫虫卵的释放以及传播都存在一定的影响。我们的研究结果也表明,相较于远离草原道路的狭颅田鼠种群,紧邻草原道路的狭颅田鼠种群被肝毛细线虫寄生的概率更高,种群中被寄生的个体所占比例更大,感染程度更严重,说明草原道路对肝毛细线虫的传播起到一定促进作用。该研究验证了草原道路的存在能够有效促进肝毛细线虫病的感染与传播,因此,应当加强公路边的鼠害防控,进而减少寄生虫的危害。
3.2 草原道路对狭颅田鼠种群密度的影响Hegrová等[26]对道路两旁生态系统的监测发现,道路的存在会对生态系统组成产生重大影响,导致紧邻道路的植被与远离道路的植被产生差异。Macpherson等[27]对蛇类的研究表明,道路会对蛇类的种群密度产生影响,而蛇类也是鼠类的天敌之一。这些研究均表明,道路对生物生存的生态系统环境的影响是重大的,不仅能改变鼠类栖息地植被群落,而且能影响鼠类天敌的分布情况。本研究表明了草原道路可能影响狭颅田鼠的肝毛细线虫感染率以及感染度,因此可能对种群密度产生一定的影响,但我们对2组样地种群密度的调查未发现显著差异。基于以上的研究结果,我们认为草原道路对生态环境产生的影响是复杂且多样的,这可能是本实验中两样地狭颅田鼠种群密度差异不大的主要原因,而关于草原道路所引起的狭颅田鼠肝毛细线虫感染率的改变是否会影响其种群密度这一问题,有待更具针对性的实验来进一步研究。
3.3 治理办法本研究表明草原道路对肝毛细线虫的感染和传播可能具有一定的促进作用。虽然人类不是肝毛细线虫的主要宿主,但在误食具有感染性的肝毛细线虫虫卵后依然能被其寄生[28]。为此,提出以下几点建议:(1)远离草原道路上死亡的鼠类或其他野生动物,无防护的情况下个人不要轻易触碰,请联系专业人员进行处理。(2)禁止猎杀取食野生动物。(3)在野外不饮用不明水源,不生食野菜。
志谢 内蒙古自治区草原动物生态研究站和中国科学院内蒙古草原生态系统定位研究站为本研究提供了野外工作平台,一并志谢利益冲突 无
| [1] |
Sazmand A, Khordadmehr M, Nourian A, et al. Hepatic Capillaria hepatica (Bancroft, 1893) infection in cat (Felis catus)-histopathological findings and first report from Iran[J]. Parasitol Res, 2021, 120(4): 1489-1491. DOI:10.1007/s00436-021-07056-4 |
| [2] |
Fuehrer HP, Igel P, Auer H. Capillaria hepatica in man: An overview of hepatic capillariosis and spurious infections[J]. Parasitol Res, 2011, 109(4): 969-979. DOI:10.1007/s00436-011-2494-1 |
| [3] |
Ceruti R, Sonzogni O, Origgi F, et al. Capillaria hepatica infection in wild brown rats (Rattus norvegicus) from the urban area of Milan, Italy[J]. J Vet Med Ser B, 2001, 48(3): 235-240. DOI:10.1046/j.1439-0450.2001.00436.x |
| [4] |
Park JH, Novilla MN, Song J, et al. The first case of Capillaria hepatica infection in a nutria (Myocastor coypus) in Korea[J]. Korean J Parasitol, 2014, 52(5): 527-529. DOI:10.3347/kjp.2014.52.5.527 |
| [5] |
Ferreira LA, Andrade ZA. Capillaria hepatica: A cause of septal fibrosis of the liver[J]. Mem Inst Oswaldo Cruz, 1993, 88(3): 441-447. DOI:10.1590/s0074-02761993000300015 |
| [6] |
Gomes AT, Cunha LM, Bastos CG, et al. Capillaria hepatica in rats: Focal parasitic hepatic lesions and septal fibrosis run independent courses[J]. Mem Inst Oswaldo Cruz, 2006, 101(8): 895-898. DOI:10.1590/s0074-02762006000800012 |
| [7] |
崔志强, 刘新宇, 宋士一, 等. 狭颅田鼠的代谢特征及体温调节[J]. 兽类学报, 2019, 39(3): 295-301. Cui ZQ, Liu XY, Song SY, et al. The characteristics of metabolism and thermoregulation of Microtus gregalis[J]. Acta Theriol Sin, 2019, 39(3): 295-301. DOI:10.16829/j.slxb.150226 |
| [8] |
唐宇, 赛那, 郭聪, 等. 肝毛细线虫对雌性布氏田鼠繁殖参数的影响[J]. 动物学杂志, 2018, 53(1): 55-60. Tang Y, Sai N, Guo C, et al. The influence of Capillaria hepatica on the breeding parameters of female Brandt's vole (Lasiopodomys brandtii)[J]. Chin J Zool, 2018, 53(1): 55-60. DOI:10.13859/j.cjz.201801007 |
| [9] |
宛新荣, 经宇, 赵天飙, 等. 锡林郭勒地区肝毛细线虫病自然疫源地与鼠类分布的关系[J]. 动物学杂志, 2007, 42(1): 14-19. Wan XR, Jing Y, Zhao TB, et al. Nature epidemic disease reservoir of Capillaria hepatica and the relationship with the distribution of rodent in Xilinguole district, Inner Mongolia[J]. Chin J Zool, 2007, 42(1): 14-19. DOI:10.13859/j.cjz.2007.01.006 |
| [10] |
邹永波, 王安蕤, 郭聪, 等. EP不育剂对莫氏田鼠种群繁殖的控制效果[J]. 中国媒介生物学及控制杂志, 2014, 25(6): 506-508. Zou YB, Wang AR, Guo C, et al. Inhibitory effect of a contraceptive compound (EP-1) on reproduction in field populations of Maximowicz's vole (Microtus maximowiczii)[J]. Chin J Vector Biol Control, 2014, 25(6): 506-508. DOI:10.11853/j.issn.1003.4692.2014.06.005 |
| [11] |
吕艳, 张莉, 李海龙. 我国肝毛细线虫感染研究现状[J]. 中国媒介生物学及控制杂志, 2020, 31(2): 239-246. Lyu Y, Zhang L, Li HL. Current research status of Capillaria hepatica infection in China[J]. Chin J Vector Biol Control, 2020, 31(2): 239-246. DOI:10.11853/j.issn.1003.8280.2020.02.026 |
| [12] |
Hong IH, Kang SY, Kim JH, et al. Histopathological findings in wild Nutrias (Myocastor coypus) with Capillaria hepatica infection[J]. J Vet Med Sci, 2016, 78(12): 1887-1891. DOI:10.1292/jvms.16-0174 |
| [13] |
杨进荣, 刘志霄, 赛那, 等. 长爪沙鼠的肝毛细线虫感染率与鼠类及猛禽密度的关系[J]. 动物学杂志, 2017, 52(6): 973-979. Yang JR, Liu ZX, Sai N, et al. Relationship between infective characters of Capillaria hepatica in Mongolian gerbil (Meriones unguiculatus) and the density of rodents and raptors[J]. Chin J Zool, 2017, 52(6): 973-979. DOI:10.13859/j.cjz.201706006 |
| [14] |
宛新荣, 经宇, 王广和, 等. 黑线毛足鼠年龄和种群密度与肝毛细线虫感染率的关系[J]. 生态学杂志, 2007, 26(4): 515-518. Wan XR, Jing Y, Wang GH, et al. Relationships between Phodopus campbelli age and population density and Capillaria hepatica infective rate[J]. Chin J Ecol, 2007, 26(4): 515-518. |
| [15] |
宛新荣, 刘伟, 赵天飙, 等. 布氏田鼠肝毛细线虫感染率与其体重的关系[J]. 兽类学报, 2007, 27(2): 165-169. Wan XR, Liu W, Zhao TB, et al. Relationship between the infective characters of Capillaria hepatica and the body mass of the Brandt's vole (Lasiopodomys brandtii)[J]. Acta Theriol Sin, 2007, 27(2): 165-169. DOI:10.16829/j.slxb.2007.02.011 |
| [16] |
郭艳梅, 胡俊杰, 杨艳芬, 等. 肝毛细线虫及肝毛细线虫病的研究概况[J]. 中国人兽共患病学报, 2014, 30(6): 651-654, 662. Guo YM, Hu JJ, Yang YF, et al. Research of Capillaria hepatica and hepatica capillariasis[J]. Chin J Zoonoses, 2014, 30(6): 651-654, 662. DOI:10.3969/cjz.j.issn.1002-2694.2014.06.021 |
| [17] |
Spratt DM, Singleton GR. Studies on the life cycle, infectivity and clinical effects of Capillaria hepatica (Bancroft) (Nematoda) in mice, Mus musculus[J]. Aust J Zool, 1986, 34(5): 663-675. DOI:10.1071/zo9860663 |
| [18] |
张雅兰, 朱岩昆, 高丽君, 等. 肝毛细线虫体外培养及小鼠感染模型的建立[J]. 中国寄生虫学与寄生虫病杂志, 2019, 37(6): 676-680. Zhang YL, Zhu YK, Gao LJ, et al. Establishment of a mouse model of Capillaria hepatica infection[J]. Chin J Parasitol Parasit Dis, 2019, 37(6): 676-680. DOI:10.12140/j.issn.1000-7423.2019.06.010 |
| [19] |
Berentsen AR, Vogt S, Guzman AN, et al. Capillaria hepatica infection in black rats (Rattus rattus) on Diego Garcia, British Indian Ocean territory[J]. J Vet Diagn Invest, 2015, 27(2): 241-244. DOI:10.1177/1040638715573298 |
| [20] |
Tijjani M, Majid RA, Abdullahi SA, et al. Detection of rodent-borne parasitic pathogens of wild rats in Serdang, Selangor, Malaysia: A potential threat to human health[J]. Int J Parasitol Parasites Wildl, 2020, 11: 174-182. DOI:10.1016/j.ijppaw.2020.01.008 |
| [21] |
Tung KC, Hsiao FC, Wang KS, et al. Study of the endoparasitic fauna of commensal rats and shrews caught in traditional wet markets in Taichung city, Taiwan[J]. J Microbiol Immunol Infect, 2013, 46(2): 85-88. DOI:10.1016/j.jmii.2012.01.012 |
| [22] |
贾举杰, 李锋, 倪亦非, 等. 内蒙古典型草原区狭颅田鼠集群数量与被捕食风险的关系[J]. 生态学报, 2016, 36(24): 8128-8135. Jia JJ, Li F, Ni YF, et al. Relationship between predation risk and group size of narrow-skulled vole in the typical steppe of Inner Mongolia[J]. Acta Ecol Sin, 2016, 36(24): 8128-8135. DOI:10.5846/stxb201506031118 |
| [23] |
黄文吉, 杨维薇, 李绍才, 等. 内蒙古达乌尔鼠兔越冬群体大小与捕食风险的研究[J]. 动物学杂志, 2021, 56(5): 641-647. Huang WJ, Yang WW, Li SC, et al. Study on predation risk and group size of Daurian pika in Inner Mongolia[J]. Chin J Zool, 2021, 56(5): 641-647. DOI:10.13859/j.cjz.202105001 |
| [24] |
宛新荣, 陈立军, 霍英军. 呼伦贝尔草原啮齿动物生物多样性调查报告[M]. 呼伦贝尔: 内蒙古文化出版社, 2011: 85-105. Wan XR, Chen LJ, Huo YJ. A survey of rodent biodiversity in Hulunbuir grassland[M]. Hulunbuir: Inner Mongolia Culture Publishing House, 2011: 85-105. |
| [25] |
Silva ACDS, Paschoal ATP, Bernardes JC, et al. Parasites in road-killed wild felines from North of Paraná state, Brazil[J]. Rev Bras Parasitol Vet, 2021, 30(1): e016320. DOI:10.1590/s1984-296120201090 |
| [26] |
Hegrová J, Prokeš L, Anděl P, et al. Monitoring of the impact of road salting on spruce forest ecosystem in the vicinity of the highway D1 in the Bohemian-Moravian Highlands, Czech Republic[J]. Environ Sci Pollut Res, 2022, 29(8): 11232-11242. DOI:10.1007/s11356-021-16468-9 |
| [27] |
Macpherson MR, Litzgus JD, Weatherhead PJ, et al. Barriers for big snakes: Incorporating animal behaviour and morphology into road mortality mitigation design[J]. Glob Ecol Conserv, 2021, 26: e01471. DOI:10.1016/j.gecco.2021.e01471 |
| [28] |
Da Rocha EJG, De Almeida Basano S, De Souza MM, et al. Study of the prevalence of Capillaria hepatica in humans and rodents in an urban area of the city of Porto Velho, Rondônia, Brazil[J]. Rev Inst Med Trop São Paulo, 2015, 57(1): 39-46. DOI:10.1590/S0036-46652015000100006 |
 2023, Vol. 34
2023, Vol. 34


