扩展功能
文章信息
- 谭若云, 林君芬, 李傅冬, 谢璐, 张欣悦, 马海燕
- TAN Ruo-yun, LIN Jun-fen, LI Fu-dong, XIE Lu, ZHANG Xin-yue, MA Hai-yan
- 基于疫情不同发展阶段的蚊媒传染病预警技术研究进展
- Research progress of early warning technology for mosquito-borne disease based on different developmental stages of epidemic
- 中国媒介生物学及控制杂志, 2022, 33(6): 912-918
- Chin J Vector Biol & Control, 2022, 33(6): 912-918
- 10.11853/j.issn.1003.8280.2022.06.027
-
文章历史
- 收稿日期: 2022-08-18
2 浙江省疾病预防控制中心公共卫生监测与业务指导所,浙江 杭州 310051;
3 浙江省传染病疫苗与预防控制研究重点实验室, 浙江 杭州 310051
2 Department of Public Health Surveillance & Advisory, Zhejiang Provincial Center for Disease Control and Prevention, Hangzhou, Zhejiang 310051, China;
3 Key Laboratory for Vaccine, Prevention and Control of Infectious Disease of Zhejiang Province, Hangzhou, Zhejiang 310051, China
蚊媒传染病是指寄生虫、病毒和细菌等病原体通过蚊媒传播引起的人类疾病,如登革热、疟疾等[1]。这些疾病的负担在热带和亚热带地区最高,并严重影响贫困地区的人口。消除蚊媒依然是控制蚊媒传染病疫情的最佳方式[2],然而在疫情高峰期的媒介控制行动已为时已晚[3],因此有效的监测预警也是应对疫情的重要组成部分。目前,传染病的预警手段呈现多元化且向大数据发展的趋势,本文根据传染病疫情的发生发展过程,将预警分为了3个阶段。为推动蚊媒传染病的多阶段多点预警研究,本文对国内外蚊媒传染病不同阶段的预警提出探讨。
1 蚊媒传染病分阶段预警的概念界定 1.1 传染病分阶段预警的意义在传染病流行的初期,传染病的发生及传播受多因素的影响,如环境、社会等因素。传染病的早期探测是指在传染病暴发前或起始时,及时地从驱动因素的变化、病例数的改变等一系列复杂的动态变化中探测暴发或流行的可能[4]。
传染病的流行是一个多阶段过程,大多可以分为传入期、扩散期、暴发流行期、下降期和终止期5个阶段[5]。传入期为传染病流行的初期,该时期出现首个传染源但疾病尚未传播,此时控制病例、切断传播途径即可抑制疫情的发展,是进行疫情控制的最佳时期。如果病例未得到及时有效控制,且当地存在传播条件,则进入扩散期。疫情随着人口流动出现大规模扩散,即暴发流行期。当疫情得到控制,新发病例数逐渐下降直到病例数为0,即暴发流行期之后的下降期和终止期。根据传染病流行的发生发展过程,传染病的预警在暴发流行期前皆是有效的,但是不同时期的预警方法和数据源都不尽相同,因此为实现不同阶段的精准防控,应对预警阶段进行划分。
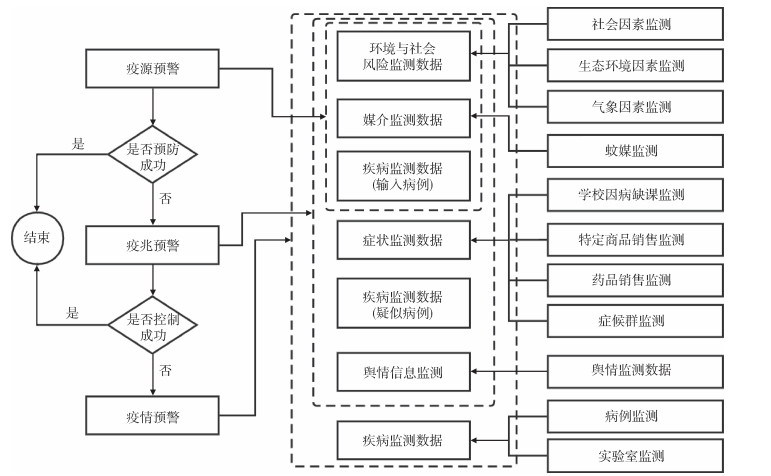
1.2 预警阶段划分根据预警的不同时期,在综合考虑数据的来源及可获得性后,可将预警的3个阶段命名为疫源预警、疫兆预警和疫情预警。见图 1。
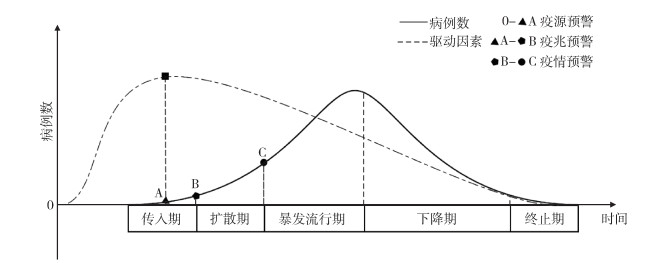
|
| 图 1 传染病暴发分阶段预警示意图 Figure 1 Schematic diagram of phased early warning of infectious disease outbreak |
| |
疫源预警(0-A段):是病例传入前及传入初期的预警,通过对与疫情发生密切相关的危险因素进行监测并发出预警。在此时期,易感人群处于暴露阶段,存在被感染可能,发生预警后应对危险因素进行针对性的干预,包括减少传播媒介、加强易感人群个人防护等[6]。
疫兆预警(A-B段):通常发生在出现病例并有扩散征兆的初期,即传入期至扩散初期。在该时期已有病例出现,但由于发病至确诊之间存在一定的时间间隔,传染病尚未被发现,但已有一些非特异性的症状或现象出现,如药品购买量增加、集体单位因病缺勤/学校因病缺课人数增多等。此时的预警主要通过监测传染病症候群及人群行为异常,预测疾病暴发或流行的可能。
疫情预警(B-C段):是通过病例监测,对即将到来或已经在暴发初期的疫情进行预测预警,通常发生在扩散期及暴发流行初期。我国目前采用的依托于医院病例数据的国家传染病自动预警系统(CIDARS)即疫情预警的一种,该系统对登革热预警采用的是移动百分位数法与空间探测法相组合的时空模型,筛选出病例空间聚集区域发出预警[7]。疫情预警通常是对病例时间与空间上聚集的探测,主要目的是控制疫情的发展,将社会、经济损失减小到最少。
1.3 蚊媒传染病分阶段预警的必要性蚊媒传染病大多是由病媒蚊虫传播的自然疫源性疾病,在传播方面存在着特异性。首先,蚊媒传染病存在季节性强,受环境影响大的特点。蚊虫最适宜的生存温度为25~28 ℃,在季节变换明显的地区,蚊虫的活动呈季节性变化[8]。在全球化进程的过程中,许多因素都会影响蚊媒传染病的传播,如土地使用、社会经济变化等[9]。而气象条件、气候变化也会对蚊媒的繁衍和密度以及它们传播的病原体产生不同的影响[10]。其次,我国的蚊媒传染病多由输入引起,主要的输入来源地为东南亚地区。对于输入性传染病,在出入境进行卫生检疫、早期发现早期隔离是最有效的传染病控制手段,然而传染病的潜伏期及部分患者不明显的症状表现使得卫生检疫难以甄别。处于潜伏期或隐性感染的患者亦是传染源,存在传播给他人的可能,构成了疫情暴发的潜在风险。
这些特异性使得蚊媒传染病的分阶段预警具有了必要性,除常规的疫情预警外,疫源预警能通过监测媒介、环境等影响因素的变化来对蚊媒传染病的到来提前做好准备,疫兆预警能通过捕捉异常征兆进行提前预警,都达到了早期预警的效果。
2 蚊媒传染病的3个阶段预警 2.1 监测数据源的分类监测数据是传染病预警的前提,根据监测类型,可将监测数据划分为疾病监测数据、症状监测数据、媒介监测数据、环境与社会因素监测数据、舆情监测数据等。见表 1。

|
疾病监测数据是用于蚊媒传染病预警的传统数据源,通常来源于卫生机构法定传染病的常规报告,医疗机构主要对确诊或临床诊断病例进行报告,通过实验室检查,还可能发现隐性感染者或病原携带者并进行报告。根据患者的流行病学史,可将病例分为输入病例及本地病例。
2.1.2 症状监测数据症状监测是系统持续地收集临床确诊前出现的、与疾病暴发相关的信息,这些信息包括临床症状及非临床症状。临床症状数据即以临床症状和体征为基础的数据,通常对症候群进行监测,如无特征性皮疹的全身发热性疾病可指示疟疾、登革热。非临床症状数据包含药品销售数据、学校因病缺课数据、工作单位因病缺勤数据、特定商品销售数据等,这些监测数据可以作为特征信号较早期地指示传染病的暴发。
2.1.3 媒介监测数据由于蚊媒传染病是一种通过蚊虫传播的疾病,病媒监测是蚊媒传染病监测必不可少的一部分,蚊媒密度与蚊媒传染病的发生与流行呈现出极高的相关性[19]。蚊媒密度监测可包含布雷图指数(BI)、诱蚊诱卵指数(MOI)、标准间指数(SSI)、成蚊密度(ADI)等,其中BI应用较为广泛。
2.1.4 环境与社会因素监测数据环境因素与蚊媒传染病的传播及流行有较大影响,其中气象因素和生态环境因素起主要作用[7]。气象因素与蚊媒的孳生及繁衍息息相关,同时它也在直接或间接地影响着蚊媒传染病的传播,极端气候也会为蚊媒的孳生带来影响[20]。此外,河流密度等地质因素同样影响着蚊媒的孳生;社会因素也是蚊媒传染病传播的影响因素之一,人口密度会影响疾病的传播,同时,全球化所带来的人口输入是蚊媒传染病最主要的驱动因素[19]。
2.1.5 舆情监测数据在互联网技术不断发展的今日,许多学者也在探索利用互联网大数据对传染病预测预警,例如关键词搜索频次等。在2011年,谷歌开发了Google登革热趋势(GDT)[21]。事实证明,基于互联网数据源的方法可作为对登革热疫情追踪的补充[22]。而在国内,由于百度搜索引擎使用的广泛性,学者多使用百度搜索指数(BSI)进行预测预警。除此以外,其余网站关键词搜索频度及新闻媒体等舆情信息也可作为预测预警的数据源。
2.2 预警模型的选择预警模型也称为预警算法,根据最常见的分类方法可分为时间预警模型、空间预警模型、时空预警模型[7]。不同类型算法在国内外蚊媒传染病预警研究中体现了较好的适应性。见表 2。

|
时间预警模型可分为定性与定量两大类,定性预警主要根据历史数据规律,估计疾病的发生、发展趋势,定量预警根据时间进程建立模型,定量预测疾病发展趋势[54]。时间预警多采用定量预警,如时间序列法、回归分析法、马尔科夫链预测法、灰色模型等。移动百分位数法是我国CIDARS使用的方法,以研究疾病/指标同期历史数据为基线,计算出百分位数作为候选的预警阈值,建立预警模型。时间序列分析在传染病预测预警方面体现了较高的稳定性,作为一种常用的时间序列模型,差分自回归滑动平均模型(ARIMA)能够较好地处理连续数据的随机相关性。作为回归分析法,多元回归模型也曾用于登革热的预警,并体现了良好的适应性[55]。广义线性模型适用于处理计数资料,可用于揭示疾病与影响因素之间的关联,同时它也适用于罕见病。根据数据的分布特点,Poisson回归及负二项回归常被选作蚊媒传染病的预警模型。随着计算机技术的快速发展,除传统统计模型外,越来越多的学者开始使用机器学习的方式进行数据挖掘并建模。相较于传统的统计模型,机器学习法能处理自变量共线性,适合高维数据,具有精确、可处理的数据多、自动化的特点,但机器学习法具有过于依赖数据的局限性,目前学者拥有的样本较难做出精确的预测,仍有待更新的尝试。
2.2.2 空间预警模型空间维度的预警模型能发现传染病在地理空间上的聚集性,主要使用地理信息系统(GIS)、卫星遥感遥测技术(RS)和全球定位系统(GPS)相结合的“3S”技术,实现地理探测及空间层面的预警[56]。了解传染病的空间分布是传染病控制中非常重要的环节,随着地理信息技术的不断发展,越来越多的学者将GIS与数学模型相结合,Sudre等[16]曾使用环境与地形变量,结合非线性判别分析,开发了疟疾传播的区域疾病风险图,为拦截疟疾提供了极大的帮助。Peterson等[57]使用规则集预测的遗传算法(GARP)结合GIS生态景观图,预测登革热病例与蚊媒在空间上的动态相关。空间自相关分析分为全局自相关及局部自相关,局部自相关可辨别聚集所在地[57]。空间扫描分析亦可发现局部区域的病例聚集,结合空间的监测为疾病预警与防控提供了一个真实的平台,但需要注意地图的准确性,且危险因素往往需要进一步论证,具有尺度效应。
2.2.3 时空预警模型时空预警模型能够识别高风险的时空聚集区,获取时间及空间上的聚集信息。近年来,有不少学者将空间与时间结合,这使得预警模型更加的完整且具有实用性。顾蓉艳[50]曾使用时空重排扫描统计量针对云南省勐腊县登革热进行预警,但该方法判断少数病例的聚集性较为困难。除此以外的预测方法还有贝叶斯网络时空模型、人群异常监测与评价(population-wide anomaly detection and assessment,PANDA)模型等。但上述时空模型仍然有危险因素多样化,且关联机制复杂的问题,难以考虑全面。
2.3 蚊媒传染病预警3个阶段的数据源及模型选择的比较疫源预警、疫兆预警、疫情预警分别有各自的特点,不同阶段的预警模型使用不同的监测数据源和预警方法(表 3、图 2)。目前,建立蚊媒传染病的预警模型的空间尺度最小为县(区)级,最大为多国家范围。预警模型的最小时间间隔为日,最大时间间隔为月。
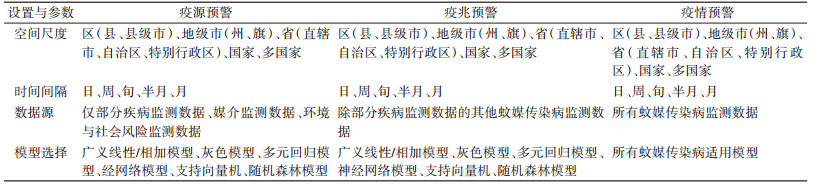
|
|
| 图 2 蚊媒传染病3个阶段预警的监测指标示意图 Figure 2 Schematic diagram of monitoring indicators for three-stage early warning of mosquito-borne diseases |
| |
疫源预警主要通过影响因素进行预测,其中输入病例、媒介、气象等对预警有着较大影响。疫源预警通常使用回归分析法及机器学习法对多源数据进行处理,同时也会使用空间预警模型对与疾病相关性强的影响因素进行分析,获得早期预警的可能。影响因素对病例的发生存在滞后效应,这是由于气象环境的改变对蚊虫的发育有一定的作用时间,病毒在蚊虫体内复制再转移到人体也需要一定的时间。根据滞后效应推算,疫源预警可较疾病暴发提前至少1个月[58]。疫源预警具有早期、及时的特点,但由于是通过影响因素等间接指标对疫情进行预测,有较大可能会出现错误预警。
疫兆预警主要通过疫情初期出现的非特异性征兆进行预测,有时也可辅以影响因素指标来提升预警模型的准确性,主要包含作为早期征兆的疑似病例数据、症状监测数据、舆情信息监测数据以及作为影响因素的几项监测指标。由于数据类型的相似,疫兆预警可使用与疫源预警相似的模型算法。疫兆预警与疫情发生相隔时间通常不长,较疫源预警会有更高的准确性,但由于使用的是非特异性症状监测数据,仍然存在错误预警的可能,同时由于药品销售、特殊商品购买、学校缺勤分属于不同的部门管辖,数据共享成为一个难题。疫情预警发生在已有病例确诊时,从过去的规律推断未来暴发的可能,有一定的延迟性,但疫情预警最为准确,模型可选择时间预警模型、空间预警模型及时空预警模型。
3 挑战和展望首先,数据质量尚需提高。准确的监测数据是传染病预警的前提和基础,不精确的监测数据会给模型带来限制,例如气象台站的地理限制,可能会影响数据的空间代表性及预测的准确性。其次,蚊媒监测数据通常由专业人员定点采样,所耗费人力较大,时间跨度较长,采样数据存在地理限制,蚊媒监测在技术上的难度也使样本存在偏倚可能。除影响因素外,症候群的监测也存在困难,由于法律上没有规定对症候群进行监测报告,只有部分省(自治区、直辖市)的部分医院作为定点医院进行监测,在缺乏监测标准的情况下,症候群的监测质量层次不齐。
第二,数据可及性仍有欠缺。多源数据可为蚊媒传染病的监测预警带来更多的可能,但是由于预警所需的监测数据牵涉到不同领域、不同监测单位,如何及时、准确地获取数据,并使用监测数据进行预警成为一大难题。
第三,预警机制单一。目前我国对蚊媒传染病的预警大多归于疫情预警,通过研究疾病的发展趋势,并根据规律进行预测。这种预警模式的数据源过于单一,且疫情预警较前2个阶段的预警存在着滞后的问题,早期预警缺乏,可能会出现干预过晚,无法及时防控的现象。基于大数据的疫情监测、分析和趋势预测可以为资源调配提供更加精确、有效的决策依据。
综上所述,为提升蚊媒传染病预测预警水平,首先,应加大疫源预警与疫兆预警的相关研究,将蚊媒传染病的预警与防控时间提前。其次,应加强各方面的监测体系,对监测技术人员进行培训,提高监测质量。与此同时,我国可考虑建立汇聚多源数据的监测信息平台,各地区可利用该平台实现基于多源监测数据的综合预警,为我国的防疫做出贡献,同时在不违背伦理的情况下,研究者们可以通过申请在该平台获得科研所需的监测数据,真正实现数据共享。
利益冲突 无
| [1] |
World Health Organization. Vector-borne diseases[EB/OL]. (2020-03-02)[2022-03-27]. https://www.who.int/news-room/fact-sheets/detail/vector-borne-diseases.
|
| [2] |
World Health Organization. Global vector control response 2017-2030: A strategic approach to tackle vector-borne diseases[EB/OL]. (2017-10-02)[2022-03-27]. https://www.who.int/publications/i/item/WHO-HTM-GVCR-2017.01.
|
| [3] |
World Health Organization. Global strategy for dengue prevention and control 2012-2020[R]. Geneva: WHO, 2012: 14.
|
| [4] |
Tekola B, Myers L, Lubroth J, et al. International health threats and global early warning and response mechanisms[J]. Rev Sci Tech, 2017, 36(2): 657-670. DOI:10.20506/rst.36.2.2683 |
| [5] |
Kucharski A. The rules of contagion: Why things spread - and why they stop[M]. London: Wellcome Collection, 2020: 4.
|
| [6] |
Schorderet-Weber S, Noack S, Selzer PM, et al. Blocking transmission of vector-borne diseases[J]. Int J Parasitol Drugs Drug Resist, 2017, 7(1): 90-109. DOI:10.1016/j.ijpddr.2017.01.004 |
| [7] |
杨维中. 传染病预警理论与实践[M]. 北京: 人民卫生出版社, 2012: 41-43, 57-60, 166, 169. Yang WZ. Early warning of infectious disease theory and practice[M]. Beijing: People's Medical Publishing House, 2012: 41-43, 57-60, 166, 169. |
| [8] |
World Health Organization. Dengue and severe dengue[EB/OL]. (2022-01-10)[2022-03-27]. https://www.who.int/news-room/fact-sheets/detail/dengue-and-severe-dengue.
|
| [9] |
Franklinos LHV, Jones KE, Redding DW, et al. The effect of global change on mosquito-borne disease[J]. Lancet Infect Dis, 2019, 19(9): e302-e312. DOI:10.1016/S1473-3099(19)30161-6 |
| [10] |
Ogden NH, Lindsay LR. Effects of climate and climate change on vectors and vector-borne diseases: Ticks are different[J]. Trends Parasitol, 2016, 32(8): 646-656. DOI:10.1016/j.pt.2016.04.015 |
| [11] |
Sang SW, Yin WW, Bi P, et al. Predicting local dengue transmission in Guangzhou, China, through the influence of imported cases, mosquito density and climate variability[J]. PLoS One, 2014, 9(7): e102755. DOI:10.1371/journal.pone.0102755 |
| [12] |
Macedo GA, De Araújo JMG, Schatzmayr HG, et al. Virological surveillance for early warning of dengue epidemics in the state of Rio de Janeiro, Brazil[J]. Trans R Soc Trop Med Hyg, 2013, 107(3): 141-146. DOI:10.1093/trstmh/trs091 |
| [13] |
Chang CJ, Chen CS, Tien CJ, et al. Epidemiological, clinical and climatic characteristics of dengue fever in Kaohsiung city, Taiwan with implication for prevention and control[J]. PLoS One, 2018, 13(1): e0190637. DOI:10.1371/journal.pone.0190637 |
| [14] |
Aryaprema VS, Xue RD. Breteau index as a promising early warning signal for dengue fever outbreaks in the Colombo district, Sri Lanka[J]. Acta Trop, 2019, 199: 105155. DOI:10.1016/j.actatropica.2019.105155 |
| [15] |
Poh KC, Chaves LF, Reyna-Nava M, et al. The influence of weather and weather variability on mosquito abundance and infection with west Nile virus in Harris county, Texas, USA[J]. Sci Total Environ, 2019, 675: 260-272. DOI:10.1016/j.scitotenv.2019.04.109 |
| [16] |
Sudre B, Rossi M, Van Bortel W, et al. Mapping environmental suitability for malaria transmission, Greece[J]. Emerg Infect Dis, 2013, 19(5): 784-786. DOI:10.3201/eid1905.120811 |
| [17] |
Sirisena P, Noordeen F, Kurukulasuriya H, et al. Effect of climatic factors and population density on the distribution of dengue in Sri Lanka: A GIS based evaluation for prediction of outbreaks[J]. PLoS One, 2017, 12(1): e0166806. DOI:10.1371/journal.pone.0166806 |
| [18] |
Teng Y, Bi DH, Xie GG, et al. Dynamic forecasting of Zika epidemics using Google trends[J]. PLoS One, 2017, 12(1): e0165085. DOI:10.1371/journal.pone.0165085 |
| [19] |
Pergantas P, Papanikolaou NE, Malesios C, et al. Towards a semi-automatic early warning system for vector-borne diseases[J]. Int J Environ Res Public Health, 2021, 18(4): 1823. DOI:10.3390/ijerph18041823 |
| [20] |
Nosrat C, Altamirano J, Anyamba A, et al. Impact of recent climate extremes on mosquito-borne disease transmission in Kenya[J]. PLoS Negl Trop Dis, 2021, 15(3): e0009182. DOI:10.1371/journal.pntd.0009182 |
| [21] |
Strauss RA, Castro JS, Reintjes R, et al. Google dengue trends: An indicator of epidemic behavior. The Venezuelan case[J]. Int J Med Inform, 2017, 104: 26-30. DOI:10.1016/j.ijmedinf.2017.05.003 |
| [22] |
Yang SH, Kou SC, Lu F, et al. Advances in using internet searches to track dengue[J]. PLoS Comput Biol, 2017, 13(7): e1005607. DOI:10.1371/journal.pcbi.1005607 |
| [23] |
解华山, 刘凌云. 荆门市常见传染病季节性分布特征动态分析[J]. 公共卫生与预防医学, 2011, 22(2): 45-48. Xie HS, Liu LY. Dynamic analysis for the seasonal distribution of common infectious diseases in Jingmen[J]. J Pub Health Prev Med, 2011, 22(2): 45-48. |
| [24] |
杨维中, 邢慧娴, 王汉章, 等. 七种传染病控制图法预警技术研究[J]. 中华流行病学杂志, 2004, 25(12): 1039-1041. Yang WZ, Xing HX, Wang HZ, et al. A study on early detection for seven infectious diseases[J]. Chin J Epidemiol, 2004, 25(12): 1039-1041. DOI:10.3760/j.issn:0254-6450.2004.12.007 |
| [25] |
Chen P, Fu XJ, Ma S, et al. Early dengue outbreak detection modeling based on dengue incidences in Singapore during 2012 to 2017[J]. Stat Med, 2020, 39(15): 2101-2114. DOI:10.1002/sim.8535 |
| [26] |
Pelecanos AM, Ryan PA, Gatton ML. Outbreak detection algorithms for seasonal disease data: A case study using Ross River virus disease[J]. BMC Med Inform Decis Mak, 2010, 10: 74. DOI:10.1186/1472-6947-10-74 |
| [27] |
尹遵栋, 罗会明, 李艺星, 等. 时间序列分析(自回归求和移动平均模型)在流行性乙型脑炎预测中的应用[J]. 中国疫苗和免疫, 2010, 16(5): 457-461. Yin ZD, Luo HM, Li YX, et al. The application of autoregressive integrated moving average model on the prediction of Japanese encephalitis cases[J]. Chin J Vac Immun, 2010, 16(5): 457-461. |
| [28] |
Bi P, Tong SL, Donald K, et al. Climate variability and the dengue outbreak in Townsville, Queensland, 1992-1993[J]. Environmental Health, 2001, 1(4): 54-60. |
| [29] |
Akinbobola A, Omotosho JB. Predicting malaria occurrence in southwest and north central Nigeria using meteorological parameters[J]. Int J Biometeorol, 2013, 57(5): 721-728. DOI:10.1007/s00484-012-0599-6 |
| [30] |
赵丹. 基于影响因素的登革热预警技术研究[D]. 北京: 中国疾病预防控制中心, 2012. Zhao D. Study on early warning technique of dengue fever based on imported cases, vectors and climate factors[D]. Beijing: Chinese Center for Disease Control and Prevention, 2012. (in Chinese) |
| [31] |
Polwiang S. The time series seasonal patterns of dengue fever and associated weather variables in Bangkok (2003-2017)[J]. BMC Infect Dis, 2020, 20(1): 208. DOI:10.1186/s12879-020-4902-6 |
| [32] |
张蕾洁. 甘肃省流行性乙型脑炎发病状态及预测预警研究[D]. 兰州: 兰州大学, 2020. DOI: 10.27204/d.cnki.glzhu.2020.000582. Zhang LJ. Study on the epidemic dynamics of Japanese encephalitis and the development of corresponding forecast and precaution model in Gansu province[D]. Lanzhou: Lanzhou University, 2020. DOI: 10.27204/d.cnki.glzhu.2020.000582.(in Chinese) |
| [33] |
Zhang HL, Li ZJ, Lai SJ, et al. Evaluation of the performance of a dengue outbreak detection tool for China[J]. PLoS One, 2014, 9(8): e106144. DOI:10.1371/journal.pone.0106144 |
| [34] |
郭海强, 丁海龙, 曲波, 等. 1988-2010年全国疟疾发病率的灰色预测模型研究[J]. 热带医学杂志, 2011, 11(6): 639-640, 643. Guo HQ, Ding HL, Qu B, et al. A study on the trend of malaria incidence in China in the recent 20 years with GM (1, 1)[J]. J Trop Med, 2011, 11(6): 639-640, 643. |
| [35] |
官金兰, 陈芷棋, 邵思铭, 等. 广州市登革热传染病的灰色预测模型[J]. 佳木斯职业学院学报, 2016(9): 413. Guan JL, Chen ZQ, Shao SM, et al. Grey prediction model of dengue fever infectious disease in Guangzhou city[J]. J Jiamusi Vocat Inst, 2016(9): 413. |
| [36] |
陶长余, 陈郁, 章士军. 中国乙脑发病率趋势分析及预测[J]. 医学动物防制, 2016, 32(3): 323-324, 327. Tao CY, Chen Y, Zhang SJ. Analysis and prediction on the epidemic encephalitis B incidences in China[J]. J Med Pest Control, 2016, 32(3): 323-324, 327. DOI:10.7629/yxdwfz201603028 |
| [37] |
叶烨, 劳飞翔, 韦斯亮, 等. 1950-2014年广西横县疟疾疫情流行病学分析及Markov模型预测[J]. 微生物学免疫学进展, 2019, 47(1): 54-59. Ye Y, Lao FX, Wei SL, et al. Epidemiological analysis and Markov model prediction of malaria epidemics from 1950 to 2014 in Heng county, Guangxi[J]. Prog Microbiol Immunol, 2019, 47(1): 54-59. DOI:10.13309/j.cnki.pmi.2019.01.010 |
| [38] |
Shi BY, Lin S, Tan Q, et al. Inference and prediction of malaria transmission dynamics using time series data[J]. Infect Dis Poverty, 2020, 9(1): 95. DOI:10.1186/s40249-020-00696-1 |
| [39] |
张轩, 贺娟. 基于中医运气理论探讨流行性乙型脑炎高发与前期气象因素的相关性并建立预测模型[J]. 北京中医药大学学报, 2015, 38(1): 8-13. Zhang X, He J. Correlation between incidence of Japanese encephalitis and meteorological factors and establishment of forecast model based on theory of five circuits and six qi[J]. J Beijing Univ Trad Chin Med, 2015, 38(1): 8-13. DOI:10.3969/j.issn.1006-2157.2015.01.002 |
| [40] |
Ayanlade A, Nwayor IJ, Sergi C, et al. Early warning climate indices for malaria and meningitis in tropical ecological zones[J]. Sci Rep, 2020, 10(1): 14303. DOI:10.1038/s41598-020-71094-8 |
| [41] |
Althouse BM, Ng YY, Cummings DAT. Prediction of dengue incidence using search query surveillance[J]. PLoS Negl Trop Dis, 2011, 5(8): e1258. DOI:10.1371/journal.pntd.0001258 |
| [42] |
Verma AK, Kuppili V, Srivastava SK, et al. A new backpropagation neural network classification model for prediction of incidence of malaria[J]. Front Biosci (Landmark Ed), 2020, 25(2): 299-334. DOI:10.2741/4808 |
| [43] |
陈业滨, 李卫红, 华家敏, 等. 基于机器学习的登革热时空扩散预测模型对比分析[J]. 地理信息世界, 2016, 23(6): 8-14. Chen YB, Li WH, Hua JM, et al. Comparing of spatio-temporal diffusion prediction models of dengue fevers based on machine learning[J]. Geomatics World, 2016, 23(6): 8-14. DOI:10.3969/j.issn.1672-1586.2016.06.002 |
| [44] |
黄宇琳, 赵永谦, 曹峥, 等. 基于随机森林回归模型的登革热风险评估研究[J]. 华南预防医学, 2019, 45(1): 26-31. Huang YL, Zhao YQ, Cao Z, et al. Risk assessment of dengue fever based on random forest model[J]. South China J Prev Med, 2019, 45(1): 26-31. DOI:10.13217/j.scjpm.2019.0026 |
| [45] |
Keyel AC, Timm OE, Backenson PB, et al. Seasonal temperatures and hydrological conditions improve the prediction of west Nile virus infection rates in Culex mosquitoes and human case counts in New York and Connecticut[J]. PLoS One, 2019, 14(6): e0217854. DOI:10.1371/journal.pone.0217854 |
| [46] |
Buczak AL, Baugher B, Guven E, et al. Fuzzy association rule mining and classification for the prediction of malaria in South Korea[J]. BMC Med Inform Decis Mak, 2015, 15: 47. DOI:10.1186/s12911-015-0170-6 |
| [47] |
杨慧欣, 赵晨皓, 雒静静, 等. 2011-2018年我国登革热疫情时间序列分析及空间自相关分析[J]. 中华疾病控制杂志, 2019, 23(10): 1250-1254. Yang HX, Zhao CH, Luo JJ, et al. Time series analysis and spatial autocorrelation analysis of dengue data in China from 2011 to 2018[J]. Chin J Dis Control Prev, 2019, 23(10): 1250-1254. DOI:10.16462/j.cnki.zhjbkz.2019.10.018 |
| [48] |
Costa SDSB, Branco MDRFC, Vasconcelos VV, et al. Autoregressive spatial modeling of possible cases of dengue, chikungunya, and Zika in the capital of Northeastern Brazil[J]. Rev Soc Bras Med Trop, 2021, 54: e0223. DOI:10.1590/0037-8682-0223-2021 |
| [49] |
魏孔福, 刘新凤, 任晓卫, 等. Flexible空间扫描统计量在甘肃省自然疫源性疾病空间聚集性研究中的应用[J]. 中国媒介生物学及控制杂志, 2015, 26(5): 454-457. Wei KF, Liu XF, Ren XW, et al. Study on the application of flexible spatial scan statistic to spatial aggregation of the natural foci diseases[J]. Chin J Vector Biol Control, 2015, 26(5): 454-457. DOI:10.11853/j.issn.1003.4692.2015.05.006 |
| [50] |
顾蓉艳. 基于时空重排扫描统计量的勐腊县登革热症候群预警参数筛选[D]. 昆明: 昆明医科大学, 2020. DOI: 10.27202/d.cnki.gkmyc.2020.000252. Gu RY. Screening of early warning parameters of dengue fever syndrome in Mengla county based on space-time rearrangement scanning statistics[D]. Kunming: Kunming Medical University, 2020. DOI: 10.27202/d.cnki.gkmyc.2020.000252.(in Chinese) |
| [51] |
Xia J, Cai SX, Zhang HX, et al. Spatial, temporal, and spatiotemporal analysis of malaria in Hubei province, China from 2004–2011[J]. Malar J, 2015, 14: 145. DOI:10.1186/s12936-015-0650-2 |
| [52] |
敖琳珺, 张昱勤, 许欢, 等. 评估气象对广东省登革热时空预测模型的贡献[J]. 现代预防医学, 2020, 47(16): 2899-2903. Ao LJ, Zhang YQ, Xu H, et al. Assessing the contribution of meteorology to the spatio-temporal prediction model of dengue in Guangdong province[J]. Mod Prev Med, 2020, 47(16): 2899-2903. |
| [53] |
Haddawy P, Hasan AHMI, Kasantikul R, et al. Spatiotemporal Bayesian networks for malaria prediction[J]. Artif Intell Med, 2018, 84: 127-138. DOI:10.1016/j.artmed.2017.12.002 |
| [54] |
赵丹, 李中杰, 周航, 等. 登革热预警技术研究进展[J]. 中华流行病学杂志, 2012, 33(5): 540-543. Zhao D, Li ZJ, Zhou H, et al. Review on the research progress of early-warning system on dengue fever[J]. Chin J Epidemiol, 2012, 33(5): 540-543. DOI:10.3760/cma.j.issn.0254-6450.2012.05.022 |
| [55] |
Halide H, Ridd P. A predictive model for dengue hemorrhagic fever epidemics[J]. Int J Environ Health Res, 2008, 18(4): 253-265. DOI:10.1080/09603120801966043 |
| [56] |
王晓东, 赵彤言. 3S技术简介及在研究蚊及蚊媒传染病分布和控制中的应用[J]. 中国媒介生物学及控制杂志, 2004, 15(3): 241-244. Wang XD, Zhao TY. Introduction of "3S" technique and application in study on control and prevention of vector-borne diseases[J]. Chin J Vector Biol Control, 2004, 15(3): 241-244. DOI:10.3969/j.issn.1003-4692.2004.03.034 |
| [57] |
Peterson AT, Martínez-Campos C, Nakazawa Y, et al. Time-specific ecological niche modeling predicts spatial dynamics of vector insects and human dengue cases[J]. Trans R Soc Trop Med Hyg, 2005, 99(9): 647-655. DOI:10.1016/j.trstmh.2005.02.004 |
| [58] |
杨迎宇, 王莹莹, 陈芸, 等. 上海市宝山区登革热媒介伊蚊密度指数与气象因素滞后效应分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 286-290. Yang YY, Wang YY, Chen Y, et al. An analysis of lag effects of meteorological factors on Aedes density indices in Baoshan district, Shanghai, China[J]. Chin J Vector Biol Control, 2021, 32(3): 286-290. DOI:10.11853/j.issn.1003.8280.2021.03.006 |
 2022, Vol. 33
2022, Vol. 33


