扩展功能
文章信息
- 张丹, 色拥军, 付国明, 贺兆锴, 吕东月, 春花, 段然, 秦帅, 梁俊容, 肖萌, 景怀琦, 王鑫
- ZHANG Dan, SE Yong-jun, FU Guo-ming, HE Zhao-kai, LYU Dong-yue, CHUN Hua, DUAN Ran, QING Shuai, LIANG Jun-rong, XIAO Meng, JING Huai-qi, WANG Xin
- 甘肃省野生岩羊不明原因死亡分析
- Analysis of unexplained deaths of wild Pseudois nayaur in Gansu province, China
- 中国媒介生物学及控制杂志, 2022, 33(6): 888-894
- Chin J Vector Biol & Control, 2022, 33(6): 888-894
- 10.11853/j.issn.1003.8280.2022.06.023
-
文章历史
- 收稿日期: 2022-06-26
2 甘肃盐池湾国家级自然保护区管理局,甘肃 肃北 736300;
3 甘肃省肃北蒙古族自治县疾病预防控制中心, 甘肃 肃北 736300;
4 杭州市疾病预防 控制中心, 浙江 杭州 310021;
5 浦东新区疾病预防控制中心, 上海 200120
2 Yanchiwan National Nature Reserve Administration of Subei, Subei, Gansu 736300, China;
3 Subei Mongolian Autonomous County Center for Disease Control and Prevention, Subei, Gansu 736300, China;
4 Hangzhou Center for Disease Control and Prevention, Hangzhou, Zhejiang 310021, China;
5 Pudong New Area Center for Disease Control and Prevention, Shanghai 200120, China
岩羊又名崖羊、石羊、青羊和蓝羊等,隶属于偶蹄目牛科羊亚科岩羊属,为我国二级重点保护野生动物,是典型的高山动物,栖息于高原、丘原和高山裸岩与山谷间的草地,群居生活,是珍稀动物雪豹的主要食物来源,对维持生态系统的稳定和多样性具有重要意义。我国的野生岩羊分布在以青藏高原为中心并向四周扩散的区域,其北部界线位于祁连山[1]。2018-2020年间,在祁连山地区发现35只不明原因死亡的野生岩羊。这些岩羊死亡地点在海拔3 237~3 550 m,2020年1月采集的13只和2020年4月采集的2只岩羊死亡地点都非常集中。近年来不断有野生动物疫病传染给人的报道,岩羊的致病原因可能给人类健康带来潜在的风险[2-3]。为探明这些死亡野生岩羊的具体原因,开展了针对这些岩羊的死因探索。
1 材料与方法 1.1 主要材料来源2019年1月、2020年1和4月甘肃省不明原因死亡野生岩羊采样地点见图 1。中国疾病预防控制中心(疾控中心)传染病预防控制所应急实验室联合甘肃盐池湾国家级自然保护区管理局和甘肃省肃北蒙古族自治县疾控中心在甘肃省共同采集了16只不明原因死亡岩羊的血液、肝、肺、粪肠、骨髓组织标本共计24份。
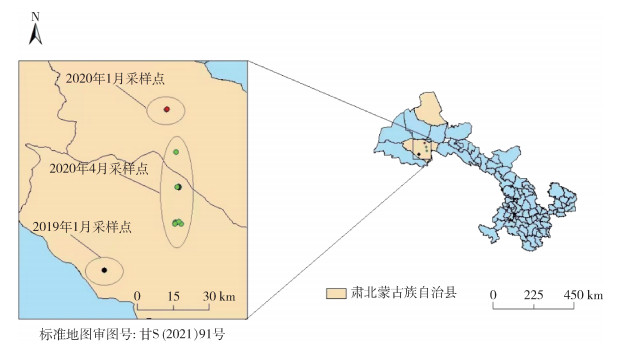
|
| 图 1 2019-2020年甘肃省不明原因死亡野生岩羊采样点 Figure 1 Sampling sites of wild Pseudois nayaur with unexplained death in Gansu province in 2019-2020 |
| |
使用组织核酸提取试剂盒(QIAGEN DNeasy Blood & Tissue,250),依据说明书提取方法对标本提取核酸。已提核酸为模板,分别使用鼠疫菌特异性基因pla、caf1和土拉菌特异性基因Tul4、16S rRNA基因引物进行PCR[4-5]。引物序列见表 1。
以标本核酸为模板,采用16S rRNA通用引物(27F/1492R)进行基因扩增。扩增产物凝胶电泳后,对于多条带的情况,在1 500 bp左右进行切胶,回收胶采用Quick Gel Extraction Kit(北京启研生物科技有限公司)试剂盒进行产物纯化。对于只有单条带的,采用E.Z.N.A. Cycle Pure Kit(美国Omega Bio-tek)试剂盒直接纯化。纯化后的产物使用克隆试剂盒(TransGen pEASY-T3 CT301-2北京全式金生物技术股份有限公司),按照试剂盒使用说明书进行连接、转化,转化后涂布含有氨苄抗生素LB平板。以氨苄西林抗性和蓝白斑筛选阳性克隆子。采用说明书上PCR方法鉴定阳性克隆,对电泳结果中存在1 600 bp左右阳性克隆产物,送北京擎科生物科技有限公司双向测通。
1.2.3 16S rRNA基因序列比对测序后得到的序列,用Lasergene的SeqMan进行拼接后,使用美国国家生物技术信息中心(NCBI)的碱基局部对准检索工具(Nucleotide BLAST)进行核酸序列比对。剔除宿主核苷酸序列、严重双峰序列和同源性 < 98.7%的序列,计算各岩羊组织中不同种属细菌16S rRNA基因克隆子序列的丰度。
1.2.4 鞭毛蛋白基因多重PCR检测对所有不明原因死亡野生岩羊标本核酸进行溶血梭状芽孢杆菌、A型诺维梭状芽孢杆菌、B型诺维梭状芽孢杆菌、败血梭状芽孢杆菌和鸣疽梭状芽孢杆菌的鞭毛蛋白基因(fliC)多重PCR扩增,扩增产物用2%琼脂糖凝胶电泳[6]。将鞭毛蛋白基因多重PCR产物,送北京擎科生物科技有限公司双向测通。
2 结果 2.1 鼠疫菌和土拉菌PCR检测结果16只死亡野生岩羊的24个标本核酸中均未检测出鼠疫菌pla、caf1和土拉菌tul4、16S rRNA基因。见表 2。

|
对16只岩羊的血液、肝、脾、肺、骨髓组织和粪肠标本,提取核酸进行16S rRNA基因扩增,凝胶电泳显示,15只岩羊标本核酸中的17份扩增出16S rRNA片段。见表 2。
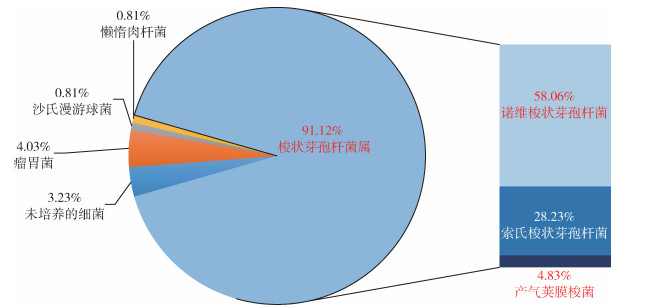
2.3 16S rRNA基因片段克隆子测序比对结果在其中4只岩羊的5个组织标本中比对到了致病梭状芽孢杆菌属细菌的16S rRNA基因(表 3)。在2019年1月岩羊的肝、脾组织(GS2019SBYY1GP)中比对到了26条梭状芽孢杆菌属的16S rRNA基因(61.90%),丰度由高到低依次为诺维梭状芽孢杆菌的16S rRNA基因24条(57.14%),产气荚膜梭菌和索氏梭状芽孢杆菌的16S rRNA基因各1条(2.38%)。在同一只岩羊的粪肠组织(GS2019SBYY1FC)中比对到了56条梭状芽孢菌属的16S rRNA基因(66.67%),其中产气荚膜梭菌的16S rRNA基因27条(32.14%),索氏梭状芽孢杆菌的16S rRNA基因29条(34.53%);在2020年1月死亡的1只岩羊(GS2020SBYY3Gu)骨髓组织中,比对到了19条梭状芽孢菌属的16S rRNA基因(16.86%),其丰度仅次于第1位的屎肠球菌(68.14%),其中腐败梭状芽孢杆菌的16S rRNA基因18条(15.93%),产气荚膜梭菌的16S rRNA基因1条(0.93%)。在同时间发现的另1只岩羊(GS2020SBYY11Gu)中只比对到了1条产气荚膜梭菌的16S rRNA基因(1.28%);在2020年4月发现的1只岩羊(GS2020SBYY14F)肺组织中,比对到113条梭状芽孢菌属的16S rRNA基因(91.12%),丰度由高到低依次为诺维梭状芽孢杆菌的16S rRNA基因72条(58.06%),索氏梭状芽孢杆菌的16S rRNA基因35条(28.23%),产气荚膜梭菌的16S rRNA基因6条(4.83%)。见图 2~5。
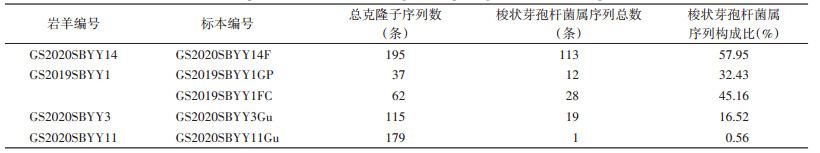
|

|
| 图 2 2019年1月发现岩羊的肝、脾组织(GS2019SBYY1GP)细菌丰度 Figure 2 Bacterial abundance in the liver and spleen tissues of Pseudois nayaur (GS2019SBYY1GP) found in January 2019 |
| |
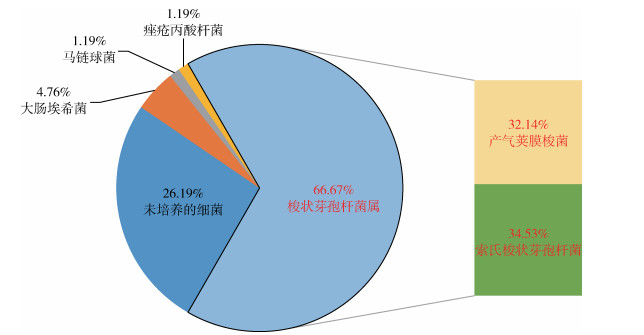
|
| 图 3 2019年1月发现岩羊的粪肠组织(GS2019SBYY1FC)细菌丰度 Figure 3 Bacterial abundance in the fecal and intestinal tissue of Pseudois nayaur (GS2019SBYY1FC) found in January 2019 |
| |
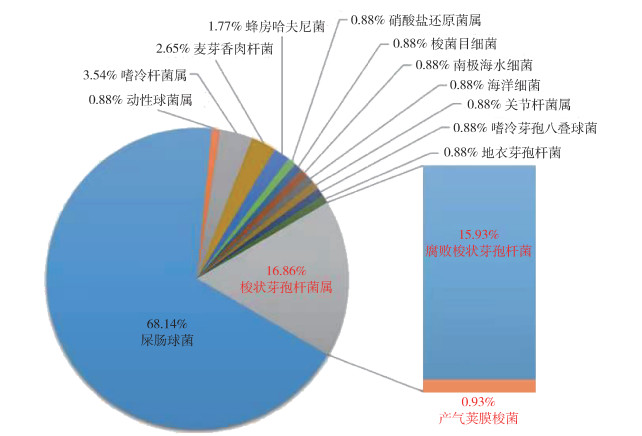
|
| 图 4 2020年1月岩羊骨髓组织(GS2020SBYY3Gu)细菌丰度 Figure 4 Bacterial abundance in the bone marrow tissue of Pseudois nayaur (GS2020SBYY3Gu) found in January 2020 |
| |
|
| 图 5 2020年4月发现的岩羊肺组织(GS2020SBYY14F)细菌丰度 Figure 5 Bacterial abundance in the lung tissue of Pseudois nayaur (GS2020SBYY14F) found in April 2020 |
| |
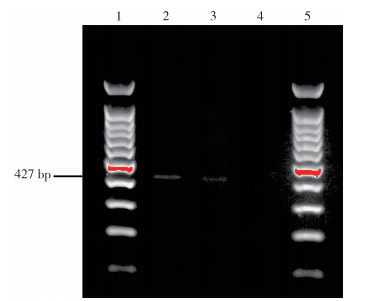
所有不明原因死亡岩羊的标本核酸经过溶血梭状芽孢杆菌、A型诺维梭状芽孢杆菌、B型诺维梭状芽孢杆菌、败血梭状芽孢杆菌和鸣疽梭状芽孢杆菌的fliC多重PCR检测后,发现2019年1月岩羊的肝脾组织(GS2019SBYY1GP)和2020年4月发现的1只岩羊肺组织(GS2020SBYY14F)核酸中均检测到427 bp大小的扩增产物(图 6),其产物序列和诺维梭状芽孢杆菌ATCC25758的fliC相匹配。其余岩羊组织核酸中未检测到溶血梭状芽孢杆菌、A型诺维梭状芽孢杆菌、B型诺维梭状芽孢杆菌、败血梭状芽孢杆菌和鸣疽梭状芽孢杆菌的fliC。
|
| 注:呈现出427 bp鉴定为B型诺维梭状芽孢杆菌鞭毛蛋白基因的特异片段;1、5表示DNA分子梯度;2、3表示扩增模板分别为GS2020SBYY14F、GS2019SBYY1GP标本核酸;4阴性对照。 图 6 鞭毛蛋白基因(fliC)多重聚合酶链式反应电泳结果 Figure 6 Multiplex polymerase chain reaction and electrophoresis results of flagellin gene (fliC) |
| |
我国岩羊主要分布于新疆、西藏、宁夏、甘肃、青海、内蒙古、四川和云南等省(自治区)。祁连山山脉位于中国青海省东北部与甘肃省西部边境,西接阿尔金山。在阿尔金山和祁连山地区常发生较多岩羊不明原因死亡的现象,据当地疾病预防控制(疾控)人员描述,仅2010年6月就有1 000多只岩羊不明原因死亡,当地相关部门均采取了无害化处理,但仍然未终止大量野生岩羊异常死亡的发生。这些不明原因死亡岩羊具有明显特点:死亡地点较为集中,死亡时间均在寒冷的冬春季节,缺乏自然衰老死亡和被捕食者猎杀死亡的证据。本研究对这些不明原因死亡野生岩羊的组织核酸进行了分子生物学检测,已排除羊鼠疫、羊土拉菌病。本研究还将所采标本送至中国疾控中心寄生虫病预防控制所沈玉娟教授团队和江苏省疾控中心理化实验室,但未找到羊肝吸虫感染和常见毒物致死的证据(这些检测结果未在本文中展示)。
虽然梭菌病可由1种致病梭状芽孢杆菌或同时由多种致病梭状芽孢杆菌共同感染导致[7],但目前关于致病梭状芽孢杆菌感染动物的报道还是以1种梭状芽孢杆菌为主。本研究在2018-2020年间发现死亡的野生岩羊中存在多种致病梭状芽孢杆菌感染的情况,并以诺维梭状芽孢杆菌为主,索氏梭状芽孢杆菌、产气荚膜梭菌和腐败梭状芽孢杆菌次之,属于多种梭状芽孢杆菌属细菌共同感染。其原因:一方面可能与本研究采用16S rRNA基因片段克隆子测序比对分析的方法有关,该方法在16S rRNA基因扩增后直接测序分析的基础上,能进一步分析各种菌的丰度;另一方面这些死亡岩羊发病前机体可能产生了有利于多种致病梭状芽孢杆菌大量繁殖的厌氧环境。
B型诺维梭状芽孢杆菌在2只岩羊标本核酸中丰度最高,常感染羊、牛和猪,主要引起感染动物传染性坏死性肝炎,也叫“羊黑疫”,严重的可引起动物间疫情,偶尔可见马和人感染病例[8-10]。这是首次在野生岩羊中发现B型诺维梭状芽孢杆菌感染并导致死亡的报道。感染诺维梭状芽孢杆菌后,病情发展迅速,如未经治疗往往在1~2 d内猝死[7-8, 11]。索氏梭状芽孢杆菌和产气荚膜梭菌都是人和动物气性坏疽的致病菌,这2种细菌和诺维梭状芽孢杆菌一样可引起致命中毒性休克综合征,具有高度致死性并且也可引发猝死[12-14]。因此索氏梭状芽孢杆菌和产气荚膜梭菌联合感染导致的气性坏疽很有可能加速了这些野生岩羊的死亡。除此之外还在1只岩羊的骨髓组织中检测到的腐败梭状芽孢杆菌,与前述3种细菌一样严格厌氧且同属梭状芽孢杆菌属致病菌,是“羊快疫”的病原菌[7]。因此多种梭状芽孢杆菌属细菌共同感染被认为是这些不明原因死亡岩羊的主要致死原因。
岩羊是典型的营集群生活的动物,每群30只左右[1]。2020年4月发现的2只死亡岩羊其距离不到10 m,推测这2只岩羊很可能来自同一种群,2020年1月发现的13只死亡岩羊间隔距离也非常集中,这13只岩羊则可能来自另一种群,因为2批岩羊死亡地点直线距离约29 km。值得注意的是,该地区近年曾发生数起类似的大量野生岩羊死亡的事件,说明梭菌病在该地区岩羊群中可能已有小范围的流行。病羊是主要的传染源,主要经由粪便排泄物污染栖息洞穴、牧草以及饮水,并以消化道途径导致同群其他岩羊发病。
此外在2020年1月发现的死亡岩羊血液标本中发现了较多的瘤胃菌及少量布劳特氏菌属细菌、副拟杆菌属细菌、脱硫弧菌属细菌、克里斯滕森菌属细菌、颤螺旋菌科细菌、拟杆菌门细菌存在,在骨髓标本中发现了较多的肠球菌属、瘤胃菌,还发现少量普氏菌属、不动杆菌属、密螺旋体属和韦荣氏球菌属细菌存在(结果未在本文中呈现)。这些细菌属于反刍动物肠道内正常菌群或者主要分布于肠道的机会致病菌[15-16]。有研究发现肠道细菌易位(bacterial translocation,BT)常发生于机体处于应激状态时,引起严重的炎症反应和肠源性内毒素血症,甚至多器官功能衰竭和死亡[17]。本研究在死亡野生岩羊的血液和骨髓中发现了肠道正常细菌和肠道机会致病菌的异常分布。因此肠道细菌易位可能是这些野生岩羊的次要致死原因,而由梭状芽孢杆菌属细菌导致的肝脏严重感染或许是继发肠道细菌易位的诱因。
利益冲突 无
| [1] |
陈晨, 张楚婕, 汪沐阳, 等. 岩羊生态生物学研究进展[J]. 四川动物, 2021, 40(5): 592-600. Chen C, Zhang CJ, Wang MY, et al. Research progress on ecology and biology of blue sheep[J]. Sichuan J Zool, 2021, 40(5): 592-600. DOI:10.11984/j.issn.1000-7083.20210016 |
| [2] |
Ye ZW, Yuan SF, Yuen KS, et al. Zoonotic origins of human coronaviruses[J]. Int J Biol Sci, 2020, 16(10): 1686-1697. DOI:10.7150/ijbs.45472 |
| [3] |
He ZK, Wei BQ, Zhang YJ, et al. Distribution and characteristics of human plague cases and Yersinia pestis isolates from 4 Marmota plague foci, China, 1950-2019[J]. Emerg Infect Dis, 2021, 27(10): 2544-2553. DOI:10.3201/eid2710.202239 |
| [4] |
Wang YH, Hai R, Zhang ZK, et al. Genetic relationship between Francisella tularensis strains from China and from other countries[J]. Biomed Environ Sci, 2011, 24(3): 310-314. DOI:10.3967/0895-3988.2011.03.015 |
| [5] |
Forsman M, Sandström G, Sjöstedt A. Analysis of 16S ribosomal DNA sequences of Francisella strains and utilization for determination of the phylogeny of the genus and for identification of strains by PCR[J]. Int J Syst Bacteriol, 1994, 44(1): 38-46. DOI:10.1099/00207713-44-1-38 |
| [6] |
Sasaki Y, Kojima A, Aoki H, et al. Phylogenetic analysis and PCR detection of Clostridium chauvoei, C. haemolyticum, C. novyi types A and B, and C. septicum based on the flagellin gene[J]. Vet Microbiol, 2002, 86(3): 257-267. DOI:10.1016/s0378-1135(02)00002-0 |
| [7] |
叶力克·阿勒泰别克. 羊梭菌病的流行病学、临床症状、剖检变化及其防控[J]. 现代畜牧科技, 2018(3): 102. Aletaibieke Y. Epidemiology, clinical symptoms, necropsy changes and prevention and control of Clostridium disease in sheep[J]. Mod Anim Husb Sci Technol, 2018(3): 102. DOI:10.19369/j.cnki.2095-9737.2018.03.097 |
| [8] |
Jeong CG, Seo BJ, Nazki S, et al. Characterization of Clostridium novyi isolated from a sow in a sudden death case in Korea[J]. BMC Vet Res, 2020, 16(1): 127. DOI:10.1186/s12917-020-02349-9 |
| [9] |
García A, Ayuso D, Benítez JM, et al. Clostridium novyi infection causing sow mortality in an Iberian pig herd raised in an outdoor rearing system in Spain[J]. J Swine Health Prod, 2009, 17(5): 264-268. |
| [10] |
Farias LD, Azevedo MDS, Trost ME, et al. Acute myonecrosis in horse caused by Clostridium novyi type A[J]. Braz J Microbiol, 2014, 45(1): 221-224. DOI:10.1590/S1517-83822014005000023 |
| [11] |
Nyaoke AC, Navarro MA, Beingesser J, et al. Infectious necrotic hepatitis caused by Clostridium novyi type B in a horse: Case report and review of the literature[J]. J Vet Diagn Invest, 2018, 30(2): 294-299. DOI:10.1177/1040638717737125 |
| [12] |
Chong E, Winikoff B, Charles D, et al. Vaginal and rectal Clostridium sordellii and C. perfringens presence among women in the United States[J]. Obstet Gynecol, 2016, 127(2): 360-368. DOI:10.1097/AOG.0000000000001239 |
| [13] |
Aronoff DM. Clostridium novyi, sordellii, and tetani: Mechanisms of disease[J]. Anaerobe, 2013, 24: 98-101. DOI:10.1016/j.anaerobe.2013.08.009 |
| [14] |
Sacco SC, Ortega J, Navarro MA, et al. Clostridium sordellii-associated gas gangrene in 8 horses, 1998-2019[J]. J Vet Diagn Invest, 2020, 32(2): 246-251. DOI:10.1177/1040638719877844 |
| [15] |
杜梅, 梁泽毅, 张剑搏, 等. 反刍动物肠道菌群与宿主肠道黏膜免疫互作及其调控研究进展[J]. 动物营养学报, 2021, 33(5): 2483-2494. Du M, Liang ZY, Zhang JB, et al. Recent advances on interaction and regulation between intestinal microflora and host mucosal immune system of ruminants[J]. Chin J Anim Nutr, 2021, 33(5): 2483-2494. DOI:10.3969/j.issn.1006-267x.2021.05.009 |
| [16] |
Donaldson GP, Lee SM, Mazmanian SK. Gut biogeography of the bacterial microbiota[J]. Nat Rev Microbiol, 2016, 14(1): 20-32. DOI:10.1038/nrmicro3552 |
| [17] |
陈烨, 姜泊. 肠道细菌易位的机制、后果及治疗[J]. 内科急危重症杂志, 2013, 19(6): 324-328. Chen Y, Jiang B. Mechanism, consequence and treatment of intestinal bacterial translocation[J]. J Crit Care Inter Med, 2013, 19(6): 324-328. DOI:10.11768/nkjwzzzz20130602 |
 2022, Vol. 33
2022, Vol. 33



