扩展功能
文章信息
- 曾文博, 李中秋, 魏子昕, 程东慧, 杨丽敏, 方圆, 张仪
- ZENG Wen-bo, LI Zhong-qiu, WEI Zi-xin, CHENG Dong-hui, YANG Li-min, FANG Yuan, ZHANG Yi
- 上海地区不同生境游离蜱分布调查
- An investigation of questing ticks collected from different habitats in Shanghai, China
- 中国媒介生物学及控制杂志, 2022, 33(6): 879-887
- Chin J Vector Biol & Control, 2022, 33(6): 879-887
- 10.11853/j.issn.1003.8280.2022.06.022
-
文章历史
- 收稿日期: 2022-08-18
2 上海交通大学医学院, 国家热带病研究中心全球健康学院, 上海 200025
2 School of Global Health, Shanghai Jiao Tong University School of Medicine and Chinese Center for Tropical Diseases Research, Shanghai 200025, China
蜱是以脊椎动物血液为食的体外寄生虫。蜱可以传播多种疾病,是世界上危害性仅次于蚊虫的重要传播媒介[1]。目前蜱传病原体与蜱传疾病在世界范围内广泛传播流行,给人体健康和生产生活带来极大危害。例如梨形虫病(包括巴贝虫病和泰勒虫病)是热带和亚热带地区最常见的血液寄生虫病之一,其主要通过硬蜱的叮咬在人和动物间传播[2]。上海周边省、市蜱传疾病与蜱咬人事件屡有发生,严重危害当地居民的生命健康安全。2006年首次在安徽省报道了人粒细胞无形体病[3];2010-2015年,江苏、安徽省共确诊发热伴血小板减少综合征(SFTS)286例,病死率为16.1%[4]。2011-2016年安徽省安庆市有137例SFTS病例报告[5]。蜱是动物体表非永久性寄生虫[6],大多数蜱在饱血后脱离宿主,落到地面,经过蜕皮,发育到下一阶段,受精的雌蜱脱离宿主后,在栖息地产卵繁殖[7]。蜱的一生有94%~97%的时间脱离宿主,在自然界中营自由生活,因此植被中有大量游离蜱存在[6]。而以往上海地区蜱调查局限于寄生蜱,对游离蜱的关注较少[8-10]。因此,开展游离蜱调查,对蜱传疾病的预警预测及预防和控制具有十分重要的意义[11]。
上海市位于长江三角洲冲积平原前缘,土质松软,地势低平,陆地地势总体呈现由东向西低微倾斜,平均海拔4 m,除西部有少数海拔近100 m的山丘外,均为坦荡低平的平原,整个平原河港如网[12]。上海市属于北亚热带湿润季风气候区,温暖潮湿多雨,四季分明[13],适宜的自然环境为蜱的生存提供了有利条件。李中秋等[14]预测上海大部分地区是蜱的高度适存区。为了解上海地区植被中媒介蜱的种类及分布等情况,我们选择山坡林地、农村荒地、公园/景区和城市绿地等生境开展了游离蜱调查。
1 材料与方法 1.1 调查点及时间于2021年4-7和9-11月,抽样选择上海市松江、黄浦、崇明、宝山、嘉定、普陀、静安和闵行区的山坡林地、农村荒地、公园/景区和城市绿地等13个调查点,空间分布见图 1。各调查点详细地理信息见表 1。

|
| 图 1 2021年上海地区游离蜱调查点与蜱种空间分布 Figure 1 Spatial distribution of questing tick surveillance sites and tick species in Shanghai, China |
| |

|
游离蜱的采集采用布旗法,按照《全国病媒生物监测实施方案》(2016)进行。布旗由900 mm×600 mm白绒布制成,布旗的一端固定在杆上。在灌木丛和较高的草丛上左右摆动布旗;或将旗子平铺于地面,在较平整的草地上拖拉杆子匀速前进,每步行10 m停下检视附着的蜱,将附着在布旗上和拖蜱者身上的蜱用镊子捡起装入管内,立即旋紧管盖。采集时间不少于30 min,每一采样点拖旗不少于500 m。每一样地的蜱放入同一试管内,分别编号、登记。
1.3 蜱种鉴定 1.3.1 蜱的形态学鉴定带回实验室的蜱标本放入乙醇溶液或培养箱中保存,在体视镜下进行分类鉴定。鉴定后的标本保存在-80 ℃下备用。
1.3.2 蜱的分子生物学鉴定 1.3.2.1 蜱的基因组DNA提取取单只蜱置1.5 ml离心管中,用磷酸缓冲盐溶液(PBS)洗2次,去离子水洗2次,研磨后,使用DNeasy Blood & Tissue Kit(Qiagen公司)提取蜱基因组总DNA,具体操作参照试剂盒说明书。每个采样点采获的蜱经形态学鉴定以及发育阶段鉴定后,不同蜱种的成蜱、若蜱以及幼蜱各选取4~5只提取DNA。
1.3.2.2 16S rRNA基因和COⅠ基因的扩增以提取的DNA为模板,16S+1和16S-1[15]为引物扩增16S rRNA基因片段,以HCO2198和LCO1490[16]为引物扩增COⅠ基因片段。PCR扩增体系包括:Mix12.5 μl,正、反向引物(10 mmol/L)各1 μl,模板2.0 μl,补充无菌水使总体积达到25 μl。16S rRNA基因的PCR反应条件:95 ℃ 5 min;92 ℃ 1 min,48 ℃ 1 min,72 ℃ 1 min,10个循环;92 ℃ 1 min,54 ℃ 35 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。COⅠ基因的PCR反应条件:94 ℃ 1 min;94 ℃ 1 min,45 ℃ 1.5 min,72 ℃ 1.5 min,5个循环;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1.5 min,35个循环;72 ℃ 10 min。将PCR产物经1.5%琼脂糖凝胶电泳,阳性产物送生工生物工程(上海)股份有限公司测序。
1.3.2.3 蜱种鉴定分子生物学鉴定与形态学鉴定的结果共同确定蜱的种类。将测序结果与美国国立生物技术信息中心(NCBI)数据库比对。
1.4 数据分析用Excel 2019软件对调查数据进行列表分析和统计汇总,计算构成比。
1.5 系统进化树分析将测定的核苷酸序列用MEGA Ⅹ软件进行比对,以邻接法(neighbor-joining method,NJ法)构建系统进化树,并进行bootstrap 1 000次的检验。
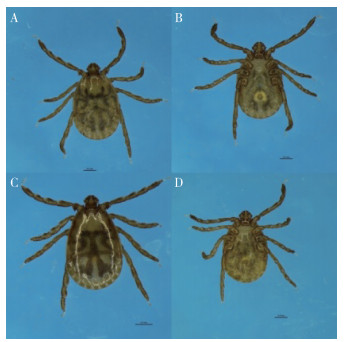
2 结果 2.1 形态学鉴定采获的1 937只成蜱经形态分类鉴定为长角血蜱(Haemaphysalis longicornis)(图 2)和褐黄血蜱(H. flava)(图 3)。长角血蜱成蜱形态特征:无眼,有缘垛;假头基矩形。须肢外缘向外侧中度突出,成角状;须肢第3节腹部有一锥形长刺。基节Ⅱ~Ⅳ内距稍大,超出后缘。盾板上刻点中等大小,分布均匀而较稠密;雌蜱盾板呈亚圆形,雄蜱盾板呈卵圆形。褐黄血蜱成蜱形态特征:无眼,有缘垛;假头基矩形。须肢外缘向外侧中度突出,成角状;须肢第3节腹刺粗短。基节Ⅰ内距短钝:基节Ⅱ~Ⅳ短,三角形,末端尖细。盾板上刻点细而浅,分布均匀;雌蜱盾板呈亚圆形,雄蜱盾板呈卵圆形。
|
| 注:A、C蜱背面;B、D蜱腹面;A、B雌蜱;C、D雄蜱。 图 2 长角血蜱 Figure 2 Haemaphysalis longicornis |
| |

|
| 注:A、C蜱背面;B、D蜱腹面;A、B雄蜱;C、D雌蜱。 图 3 褐黄血蜱 Figure 3 Haemaphysalis flava |
| |
16S rRNA和COⅠ基因的PCR产物经1.5%琼脂糖凝胶电泳,分别在300~500 bp(图 4)以及700 bp(图 5)左右出现目的条带,与预期的460和706 bp相符。得到的PCR阳性产物送生工生物工程(上海)股份有限公司测序,得到的序列结果通过NCBI中的BLAST分析功能进行序列比对分析,鉴定为2属3种,分别是褐黄血蜱、长角血蜱和微小扇头蜱(Rhipicephalus microplus)。因调查中未采集到微小扇头蜱的成蜱,故微小扇头蜱仅有分子生物学鉴定结果。

|
| 注:M表示marker;1~2微小扇头蜱;3~4长角血蜱;5~8褐黄血蜱。 图 4 16S rRNA基因扩增结果 Figure 4 PCR amplification of 16S rRNA fragment from ticks |
| |

|
| 注:M表示marker;1~4褐黄血蜱;5~6长角血蜱;7~8微小扇头蜱。 图 5 细胞色素C氧化酶亚基Ⅰ基因扩增结果 Figure 5 PCR amplification of cytochrome c oxidase subunit Ⅰ gene fragment from ticks |
| |
根据不同发育阶段蜱的形态特征鉴定成蜱、幼蜱与若蜱。①幼蜱:3对足,无生殖孔;②若蜱:4对足,无生殖孔;③成蜱:4对足,有生殖孔。本次调查共采获游离蜱1 937只,在采获的蜱种中,褐黄血蜱1 789只,占采获蜱总数的92.36%;长角血蜱129只,占6.66%,微小扇头蜱19只,占0.98%。蜱的发育阶段见表 2。

|
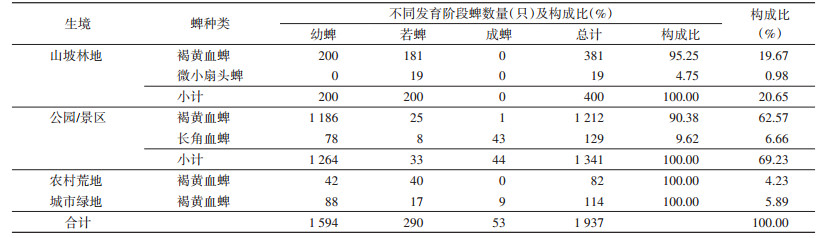
在公园/景区生境中,共采获褐黄血蜱和长角血蜱2种1 341只,分别占该生境蜱总数的90.38%和9.62%;山坡林地生境中,共采获褐黄血蜱和微小扇头蜱2种400只,分别占95.25%和4.75%;农村荒地生境和城市绿地生境均只采获褐黄血蜱1种。不同生境中,公园/景区生境蜱的数量最多,占捕获蜱总数的69.23%,山坡林地占20.65%,城市绿地占5.89%,农村荒地占4.23%。见表 3。
|
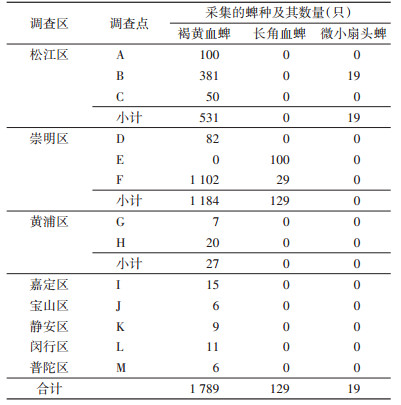
在松江区的3个采样点采获褐黄血蜱和微小扇头蜱共550只,分别占该地区采获蜱总数的96.55%和4.45%。崇明区3个采样点采获褐黄血蜱和长角血蜱2种共1 313只,分别占90.18%和9.82%。黄浦区的2个采样点仅采获褐黄血蜱27只。其他地区采获蜱情况见表 4。蜱种空间分布见图 1。
|
经BLAST比对,本研究中长角血蜱、褐黄血蜱的16S rRNA基因和COⅠ基因序列片段以及微小扇头蜱的COⅠ基因分别与GenBank中长角血蜱、褐黄血蜱与微小扇头蜱对应序列相似度最高,它们与最接近序列的相似度均在98.0%~100%;本研究的微小扇头蜱16S rRNA基因与GenBank中长角血蜱和微小扇头蜱对应序列相似度最高,而它们与最接近的序列相似度在96.0%~99.5%。将所获得的16S rRNA、COⅠ基因序列提交至NCBI,分别获得它们的GenBank登录号。见表 5。

|
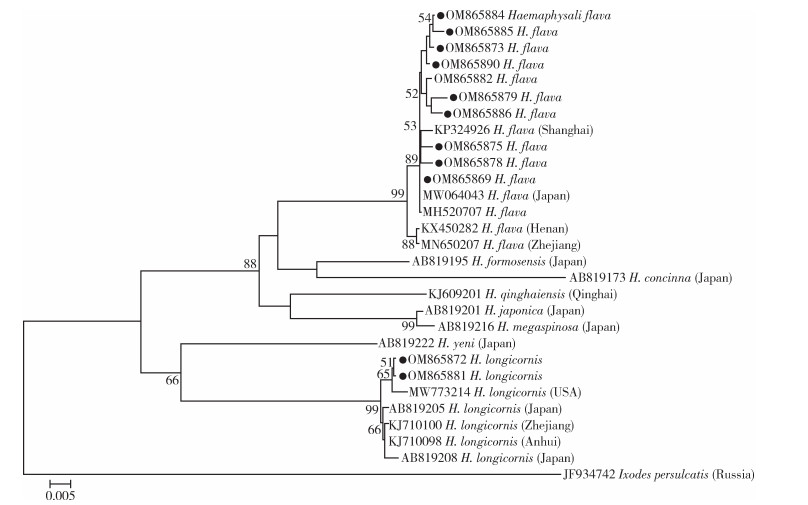
根据形态学以及BLAST比对结果,本次调查所获得蜱种中有长角血蜱和褐黄血蜱2种。基于获得的褐黄血蜱、长角血蜱的16S rRNA和COⅠ基因序列及GenBank上下载的16S rRNA和COⅠ基因序列(登录号见图 6、7)构建血蜱属部分蜱种16S rRNA和COⅠ基因系统发育树。结果显示,本研究的长角血蜱与GenBank中长角血蜱均位于同一个大分支上;本研究的褐黄血蜱与GenBank中褐黄血蜱均位于同一个分支上。血蜱属部分蜱种16S rRNA基因系统发育树(图 6)显示,本研究的褐黄血蜱与日本的褐黄血蜱(登录号:MW064043)以及上海市既往研究的褐黄血蜱(登录号:KP324926)位于同一分支上;本研究的长角血蜱与美国的长角血蜱(登录号:MW773214)位于同一分支上。血蜱属部分蜱种COⅠ基因系统发育树(图 7)显示,本研究的褐黄血蜱与日本的褐黄血蜱(登录号:MW066331)位于同一分支上;而本研究的长角血蜱与浙江省的长角血蜱(登录号:JQ737092)位于同一分支上。
|
| 注:●本研究标本16S rRNA基因GenBank登录号。 图 6 血蜱属部分蜱种16S rRNA基因系统发育树 Figure 6 Phylogenetic comparison of 16SrRNA sequences of Haemaphysalis spp. |
| |

|
| 注:●本研究标本细胞色素C氧化酶亚基Ⅰ基因GenBank登录号。 图 7 血蜱属部分蜱种细胞色素C氧化酶亚基Ⅰ基因系统发育树 Figure 7 Phylogenetic comparison of cytochrome c oxidase subunit Ⅰ gene sequences of Haemaphysalis spp. |
| |
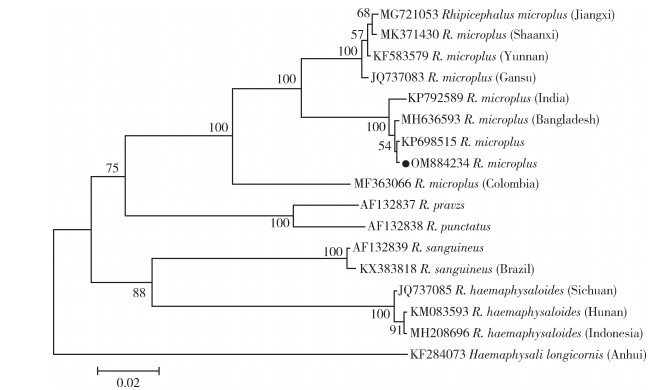
根据BLAST比对结果,本次调查所获的1种扇头蜱,即微小扇头蜱。基于获得的微小扇头蜱的16S rRNA和COⅠ基因序列及GenBank上下载的16S rRNA和COⅠ基因序列(登录号见图 8、9)构建扇头蜱属部分蜱种16S rRNA和COⅠ基因系统发育树。结果显示,本研究的微小扇头蜱与GenBank中微小扇头蜱均位于同一个大分支上。扇头蜱属部分蜱种16S rRNA基因系统发育树(图 8)显示,本研究的微小扇头蜱与我国云南省、巴基斯坦和印度的褐黄血蜱(登录号分别为KU664521、MK495912和KP210056)位于同一分支上。扇头蜱属部分蜱种COⅠ基因系统发育树(图 9)显示,本研究的微小扇头蜱与印度以及孟加拉国的褐黄血蜱(登录号为KP792589和MH636593)位于同一分支上。

|
| 注:●本研究GenBank登录号。 图 8 扇头蜱属部分蜱种16S rRNA基因系统发育树 Figure 8 Phylogenetic comparison of 16S rRNA sequences of Rhipicephalus spp. |
| |
|
| 注:●本研究标本细胞色素C氧化酶亚基Ⅰ基因GenBank登录号。 图 9 扇头蜱属部分蜱种细胞色素C氧化酶亚基Ⅰ基因系统发育树 Figure 9 Phylogenetic comparison of cytochrome c oxidase subunit Ⅰ gene sequences of Rhipicephalus spp. |
| |
上海地区8月台风频发且天气多雨,考虑到蜱采样的天气要求,故未计划8月采样。上海地区不同植被类型中分布有褐黄血蜱、长角血蜱和微小扇头蜱3种,其中褐黄血蜱占92.28%,为本地游离蜱的优势蜱种,而以往文献报道的上海地区游离蜱和寄生蜱的优势蜱种分别为长角血蜱、血红扇头蜱(R. sanguineus)[8-10, 17]。褐黄血蜱常生活于混交林与野地,其宿主主要为猪、猪獾、马、绵羊等;长角血蜱主要生活于次生林、山地或丘陵边缘地带,其宿主主要为牛、马、绵羊、山羊、熊、刺猬等;而血红扇头蜱出现在农区或野外,其倾向于在室内活动,通常被认为属于主动寻找宿主型,犬是其主要宿主[18]。上海地区存在大量宠物犬,且既往大多数寄生蜱研究主要调查犬体寄生蜱。蜱能携带多种病原体,能传播多种人兽共患病,是重要的贮存宿主和传播媒介。褐黄血蜱主要携带的病原体有埃立克体、日本立克次体、克里米亚-刚果出血热病毒、卡布托山病毒、铜绿假单胞菌以及乌拉尔立克次体等[19];长角血蜱携带的病原体有发热伴血小板减少综合征病毒(SFTSV)、人粒细胞无形体、斑点热群立克次体、巴贝虫等[20];微小扇头蜱携带的病原体有立克次体、无形体、柯克斯体和弗朗西斯菌等[21]。上海地区游离蜱的种类有限,但其对人和畜牧业的潜在危害性不得忽视。我国蜱传新发疾病近40年以来也呈高发趋势。自1980年以来,在我国大陆地区新发现了34种蜱传病原体,包括斑点热群立克次体8种、无形体科7种、伯氏疏螺旋体6种、巴贝虫11种,以及SFTSV和阿龙山病毒[22-23]。越来越多新的蜱传疾病和病原体被发现,如2009年发现的SFTSV造成多人死亡[24-26],2019年新发现的阿龙山病毒与蜱传脑炎病毒临床病例的临床症状相似[23],最近日本北海道地区新发现了内罗毕病毒属的新种Yezo病毒,也造成多人感染[24]。然而,对于大多数蜱传疾病来说,疫苗或效力不明,或尚未开发[27]。因此开展蜱媒监测与防制,对蜱传疾病的预警预测及预防和控制具有十分重要的意义。
上海地区的公园/景区、城市绿地、山坡林地和农村荒地4种生境中,褐黄血蜱分别占90.38%、100%、95.25%和100%,均为各生境的优势蜱种。农村荒地和城市绿地中蜱种较单一,仅采获褐黄血蜱1种,山坡林地和公园/景区蜱种相对丰富,均采获2种。蜱的分布与气候、地势、土壤、植被和宿主有关,其中温度、降水量和湿度等因素直接影响蜱的栖息地,同时影响植被及宿主的多样性和丰富度,从而对蜱产生间接影响[11]。上海市境内因地形、纬度等差异,形成各种独特的小气候以及在快速城市化和全球气候变暖的背景下[28],气候的差异和不同的生态植被类型,导致上海地区蜱种分布有所不同。系统发育树显示,本研究上海地区的同一蜱种位于同一分支且与GenBank上的同一蜱种位于同一大分支上,与NCBI上比对结果一致,既说明分子鉴定结果的可靠性,又表明与典型基因序列数据相比上海地区各蜱种并未出现遗传分化现象。最终证实本研究13个调查点所采获蜱的种类,它们的分子生物学鉴定结果与形态学方法鉴定的结果一致。上海地区的褐黄血蜱与日本的褐黄血蜱关系亲缘较近,且是当今上海市本地优势蜱种;长角血蜱与美国和我国浙江省的长角血蜱亲缘关系较近,且与上海市既往长角血蜱的序列不在同一小分支上;而上海地区微小扇头蜱与南亚和我国云南省的微小扇头蜱在同一小分支上。褐黄血蜱与长角血蜱一般生活在野外,微小扇头蜱主要寄生在牛体表,另外在啮齿类动物中也有发现[18]。
微小扇头蜱为单一宿主蜱,即该蜱的幼虫、若虫和成虫均在同一宿主上完成,到饱血成蜱才脱离宿主。本次采获游离微小扇头蜱若蜱的原因可能为宿主死亡,若蜱脱离宿主。松江区B调查点的生态环境良好,有包括兔、鼠在内的众多野生动物,存在微小扇头蜱的寄生宿主,不过调查中未在采获微小扇头蜱的区域采集到野生动物的尸体。本次调查的公园/景区、城市绿地、山坡林地和农村荒地4种生境的植被类型及自然环境与各蜱种的自然栖息地基本一致。
以往的研究曾在上海地区犬体表采集到铃头血蜱(H. campanulata)[29],上海市周边的苏州市近年也采集到游离的铃头血蜱[11],本次并未采获该蜱种。原因可能有以下几个方面:铃头血蜱主要生活于农区、草原地带;其主要寄生于犬,分布于北京、河北、黑龙江、湖北、江苏、内蒙古、山东等省(直辖市、自治区)[18];除了环境的变化会影响其生存外,农药的使用也有可能对其生存产生不利影响。上海地区近年频繁发生蜱咬人事件,相关人员会对城区的公园/景区、山坡林地、城市绿地喷洒杀虫剂进行灭蜱,农村荒地毗邻农田,村民定期喷洒农药以防治害虫和除草。蜱对杀虫剂比较敏感,在环境中难以继续生存,导致环境中蜱的数量很低[11]。崇明区的F公园蜱的密度较高,建议开展蜱内病原体监测以及生物或者化学灭蜱工作。
世界卫生组织警告以蚊虫和蜱传播的病毒为代表的虫媒病原体正在不断构成风险,并且很可能导致下一波病毒大流行。而本研究的上海地区蜱种监测数据与魏子昕等[17]综述的既往调查结果有所不同,上海地区有必要加强蜱扩散分布和蜱传病原体的研究与监测,并进一步揭示其内在机制,为防治蜱传疾病暴发和流行提供支持和参考。
志谢 上海市疾病预防控制中心(疾控中心)范明秋老师、黄浦区疾控中心温和毅老师等在现场调查工作中给予协助,特此志谢利益冲突 无
| [1] |
Dantas-Torres F, Chomel BB, Otranto D. Ticks and tick-borne diseases: A One Health perspective[J]. Trends Parasitol, 2012, 28(10): 437-446. DOI:10.1016/j.pt.2012.07.003 |
| [2] |
于志军, 刘敬泽. 蜱传疾病及其媒介蜱类研究进展[J]. 应用昆虫学报, 2015, 52(5): 1072-1081. Yu ZJ, Liu JZ. Progress in research on tick-borne diseases and vector ticks[J]. Chin J Appl Entomol, 2015, 52(5): 1072-1081. DOI:10.7679/j.issn.2095?1353.2015.128 |
| [3] |
张芳. 我国土拉弗氏菌分子流行病学调查研究[D]. 北京: 中国人民解放军军事医学科学院, 2008. Zhang F. Molecular epidemiological investigation on Francisella tularensis in China[D]. Beijing: Academy of Military Medical Sciences, 2008. (in Chinese) |
| [4] |
Liu Q, He B, Huang SY, et al. Severe fever with thrombocytopenia syndrome, an emerging tick-borne zoonosis[J]. Lancet Infect Dis, 2014, 14(8): 763-772. DOI:10.1016/s1473-3099(14)70718-2 |
| [5] |
汪金生, 龚磊, 李贤相, 等. 安庆市137例发热伴血小板减少综合征流行病学调查及传播媒介蜱虫监测结果[J]. 职业与健康, 2019, 35(4): 516-520. Wang JS, Gong L, Li XX, et al. Epidemiological investigation of 137 cases of severe fever with thrombocytopenia syndrome and monitoring results of vehicle ticks in Anqing city[J]. Occup Health, 2019, 35(4): 516-520. DOI:10.13329/j.cnki.zyyjk.2019.0141 |
| [6] |
Davari B, Alam FN, Nasirian H, et al. Seasonal distribution and faunistic of ticks in the Alashtar county (Lorestan province), Iran[J]. Pan Afr Med J, 2017, 27: 284. DOI:10.11604/pamj.2017.27.284.10341 |
| [7] |
Haut M, Król N, Obiegala A, et al. Under the skin: Ixodes ticks in the subcutaneous tissue of red foxes (Vulpes vulpes) from Germany[J]. Parasit Vectors, 2020, 13(1): 189. DOI:10.1186/s13071-020-04061-x |
| [8] |
刘洪霞, 范明秋, 刘曜, 等. 2015-2016年上海地区动物体表及其周边环境蜱侵害调查[J]. 上海预防医学, 2018, 30(8): 649-651. Liu HX, Fan MQ, Liu Y, et al. Investigation of ticks parasitizing animal body surface and surroundings in Shanghai, 2015-2016[J]. Shanghai J Prev Med, 2018, 30(8): 649-651. DOI:10.19428/j.cnki.sjpm.2018.18784 |
| [9] |
刘琴, 危芙蓉, 朱丹, 等. 上海市犬体表媒介蜱寄生情况初步调查[J]. 中国血吸虫病防治杂志, 2012, 24(5): 537-539, 543. Liu Q, Wei FR, Zhu D, et al. Investigation of ticks parasitizing on bodies of dogs in Shanghai[J]. Chin J Schisto Control, 2012, 24(5): 537-539, 543. DOI:10.16250/j.32.1374.2012.05.012 |
| [10] |
张维谊, 姚佳玲, 周珂珂, 等. 上海市警犬寄生蜱种鉴定及其携带的原虫及微生物组分析[J]. 中国动物传染病学报, 2019, 27(6): 48-53. Zhang WY, Yao JL, Zhou KK, et al. Analysis on protozoa species and microbial populations of ticks from police dogs in Shanghai, China[J]. Chin J Anim Infect Dis, 2019, 27(6): 48-53. |
| [11] |
马桢红, 陈学良, 顾灯安, 等. 江苏省苏州地区不同植被类型中游离蜱的调查[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 92-95. Ma ZH, Chen XL, Gu DA, et al. An investigation of questing ticks collected from the habitats with different vegetation types in Suzhou, Jiangsu province, China[J]. Chin J Vector Biol Control, 2020, 31(1): 92-95. DOI:10.11853/j.issn.1003.8280.2020.01.019 |
| [12] |
许世远, 黄仰松, 范安康. 上海市地貌类型与地貌分区[J]. 华东师范大学学报(自然科学版), 1986(4): 75-82. Xu SY, Huang YS, Fan AK. An analysis on geomorphology typesl and zonation of the Shanghai municipality area[J]. J East China Normal Univ (Nat Sci Ed), 1986(4): 75-82. |
| [13] |
田旗. 上海自然植被季相与城市绿化[J]. 园林, 2006(2): 42-43. Tian Q. Seasonal phase of natural vegetation and urban greening in Shanghai[J]. Garden, 2006(2): 42-43. |
| [14] |
李中秋, 李兰花, 殷会军, 等. 长三角城市群蜱媒分布及适生区分析[J]. 中国血吸虫病防治杂志, 2021, 33(4): 365-372. Li ZQ, Li LH, Yin HJ, et al. Distribution and suitable habitats of ticks in the Yangtze River Delta urban agglomeration[J]. Chin J Schisto Control, 2021, 33(4): 365-372. DOI:10.16250/j.32.1374.2021068 |
| [15] |
Black Ⅳ WC, Piesman J. Phylogeny of hard- and soft-tick taxa (Acari: Ixodida) based on mitochondrial 16S rDNA sequences[J]. Proc Natl Acad Sci USA, 1994, 91(21): 10034-10038. DOI:10.1073/pnas.91.21.10034 |
| [16] |
Chitimia L, Lin RQ, Cosoroaba I, et al. Genetic characterization of ticks from southwestern Romania by sequences of mitochondrial cox1 and nad5 genes[J]. Exp Appl Acarol, 2010, 52(3): 305-311. DOI:10.1007/s10493-010-9365-9 |
| [17] |
魏子昕, 方圆, 张仪. 上海市蜱种类、分布及其携带病原[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 120-124. Wei ZX, Fang Y, Zhang Y. Ticks species, distribution and pathogens in Shanghai, China[J]. Chin J Vector Biol Control, 2022, 33(1): 120-124. DOI:10.11853/j.issn.1003.8280.2022.01.022 |
| [18] |
陈泽, 杨晓军. 蜱的系统分类学[M]. 北京: 科学出版社, 2021: 653. Chen Z, Yang XJ. Systematics of ticks[M]. Beijing: Science Press, 2021: 653. |
| [19] |
Fang LZ, Lei SC, Yan ZJ, et al. Detection of multiple intracellular bacterial pathogens in Haemaphysalis flava ticks collected from hedgehogs in central China[J]. Pathogens, 2021, 10(2): 115. DOI:10.3390/pathogens10020115 |
| [20] |
Zhao L, Li J, Cui XM, et al. Distribution of Haemaphysalis longicornis and associated pathogens: Analysis of pooled data from a China field survey and global published data[J]. Lancet Planet Health, 2020, 4(8): E320-E329. DOI:10.1016/s2542-5196(20)30145-5 |
| [21] |
Sumrandee C, Baimai V, Trinachartvanit W, et al. Molecular detection of Rickettsia, Anaplasma, Coxiella, and Francisella bacteria in ticks collected from Artiodactyla in Thailand[J]. Ticks Tick-Borne Dis, 2016, 7(5): 678-689. DOI:10.1016/j.ttbdis.2016.02.015 |
| [22] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in mainland China: An increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/s1473-3099(15)00177-2 |
| [23] |
Wang ZD, Wang B, Wei F, et al. A new segmented virus associated with human febrile illness in China[J]. N Engl J Med, 2019, 380(22): 2116-2125. DOI:10.1056/NEJMoa1805068 |
| [24] |
Liu SL, Chai CL, Wang CM, et al. Systematic review of severe fever with thrombocytopenia syndrome: Virology, epidemiology, and clinical characteristics[J]. Rev Med Virol, 2014, 24(2): 90-102. DOI:10.1002/rmv.1776 |
| [25] |
Kodama F, Yamaguchi H, Park E, et al. A novel nairovirus associated with acute febrile illness in Hokkaido, Japan[J]. Nat Commun, 2021, 12(1): 5539. DOI:10.1038/s41467-021-25857-0 |
| [26] |
Xu BL, Liu LC, Huang XY, et al. Metagenomic analysis of fever, thrombocytopenia and leukopenia syndrome (FTLS) in Henan province, China: Discovery of a new bunyavirus[J]. PLoS Pathog, 2011, 7(11): e1002369. DOI:10.1371/journal.ppat.1002369 |
| [27] |
Batool M, Blazier JC, Rogovska YV, et al. Metagenomic analysis of individually analyzed ticks from Eastern Europe demonstrates regional and sex-dependent differences in the microbiota of Ixodes ricinus[J]. Ticks Tick-Borne Dis, 2021, 12(5): 101768. DOI:10.1016/j.ttbdis.2021.101768 |
| [28] |
沈钟平, 梁萍, 何金海. 上海城市热岛的精细结构气候特征分析[J]. 大气科学学报, 2017, 40(3): 369-378. Shen ZP, Liang P, He JH. Analysis on the climatic characteristics of the fine structure of the urban heat island in Shanghai[J]. Trans Atmos Sci, 2017, 40(3): 369-378. DOI:10.13878/j.cnki.dqkxxb.20160922001 |
| [29] |
刘琴, 张仪, 方圆, 等. 基于16S rDNA和COⅠ基因的3种血蜱分子生物学鉴定[J]. 国际医学寄生虫病杂志, 2015, 42(3): 146-151. Liu Q, Zhang Y, Fang Y, et al. Identification of Haemaphysalis longicornis, H. flava and H. campanulata based on molecular markers of 16S rDNA and COⅠ gene[J]. Int J Med Parasit Dis, 2015, 42(3): 146-151. |
 2022, Vol. 33
2022, Vol. 33


