扩展功能
文章信息
- 段彪, 张雪花, 赵彩凤, 洪梅, 苏丽琼, 杨智明, 卜丹娅
- DUAN Biao, ZHANG Xue-hua, ZHAO Cai-feng, HONG Mei, SU Li-qiong, YANG Zhi-ming, PU Dan-ya
- 云南省新发野鼠鼠疫疫源地主要宿主动物、媒介蚤的物种构成和种群生态特征分析
- Species composition and population ecological characteristics of main host animals and vector fleas in an emerging field rodent plague focus in Yunnan province, China
- 中国媒介生物学及控制杂志, 2022, 33(6): 809-814
- Chin J Vector Biol & Control, 2022, 33(6): 809-814
- 10.11853/j.issn.1003.8280.2022.06.008
-
文章历史
- 收稿日期: 2022-07-30
2 鹤庆县疾病预防控制中心, 云南 大理 671500;
3 大理白族自治州人民医院, 云南 大理 671000
2 Heqing County Center for Diseases Control and Prevention, Dali, Yunnan 671500, China;
3 Dali Bai Autonomous Prefecture People's Hospital, Dali, Yunnan 671000, China
鼠疫曾是人类历史上感染人数最多、死亡率最高和发生面积最大的传染病,在我国政府强有力的组织控制下,该病现已达到接近消除状态[1]。云南省鹤庆县曾经在18世纪中后期有过3次鼠疫流行,随后进入静息期将近130年,于20世纪80年代在草海镇马厂村的动物(犬)血清中检测到鼠疫抗体放射免疫阳性,遂将该村定为鼠疫固定监测点并常年开展监测工作,未再检出阳性材料。时至2017年4月,鼠防工作人员在草海镇马厂村的监测样本中分离到10株鼠疫耶尔森菌(鼠疫菌),证实了该区域内正在流行鼠间鼠疫。草海镇马厂村疫点位于26°50′63″N,100°06′17″E,海拔2 986.67 m,年平均气温9.33 ℃,年降水量500 mm,与2005年10月暴发人间肺鼠疫的丽江市玉龙县黄山镇南溪村鹿子自然村属于同一山系[2],无天然屏障且相距较近。
近年来,气候变化[3-7]、生态变化等多重因素导致媒介生物种群、密度和分布等发生了新的变化,对媒介生物传染病的流行产生重要影响[8]。本文通过2012-2021年云南省鹤庆县马厂村委会监测点鼠疫监测数据分析主要宿主动物和体表寄生蚤构成、分布、种群消长趋势等特征,旨在探讨其群落和种群生态特征与鼠疫流行规律的关联性,为制订鼠疫预防和控制方案提供科学依据。
1 材料与方法 1.1 数据来源本研究数据来自全国鼠疫防治管理信息系统中鹤庆县2012-2021年的鼠疫宿主动物及媒介蚤监测数据。
1.2 监测方法按照《全国鼠疫监测方案》(2005年8月30日,卫生部)中齐氏姬鼠(Apodemus chevrieri)、大绒鼠(Eothenomys miletus)鼠疫疫源地的监测内容及指标进行监测。监测范围以鹤庆县草海镇马厂村委会为中心,在半径5 km内每月开展监测工作。监测时间为1-12月,以3-8和12月为重点,每次连续布放3 d。野外宿主动物监测选择菜园、耕地、灌木丛3种生境,用5 m布笼(夹)法,每月每种生境布放300笼(夹)次,根据捕获率测定小兽密度。根据捕获的小兽种类,计算构成比。媒介监测为每月梳检活的小兽体蚤,并对蚤形态分类鉴定,计算蚤指数和染蚤率。
1.3 统计学处理采用Excel 2010软件对研究数据进行整理和分析。计算公式如下:

|

|

|

|
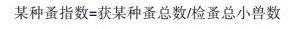
|
2012-2021年,鹤庆县草海镇监测点共发现小兽4目6科11属13种。采用5 m布笼(夹)法布笼86 681个,捕获小兽3 618只,捕获率为4.17%;种类构成比分别为:大绒鼠(Eothenomys miletus)占73.52%(2 660/3 618),齐氏姬鼠(Apodemus chevrieri)占18.71%(677/3 618),这2个鼠种为优势种;臭鼩(Suncus murinus)、黄胸鼠(Rattus tanezumi)和褐家鼠(R. norvegicus)分别占3.93%(142/3 618)、1.85%(67/3 618)和1.30%(47/3 618),其他小兽包括小家鼠(Mus musculus,11只)、灰麝鼩(Crocidura attenuata,5只)、北社鼠(Niviventer confucianus,2只)、北树鼩(Tupaia belangeri,1只)、赤腹松鼠(Callosciurus erythraeus,1只)、黑缘齿鼠(R. andamanensis,3只)、灰尾兔(Lepus oiostolus,1只)和大足鼠(R. nitidus,1只),共占0.69%(25/3 618)。
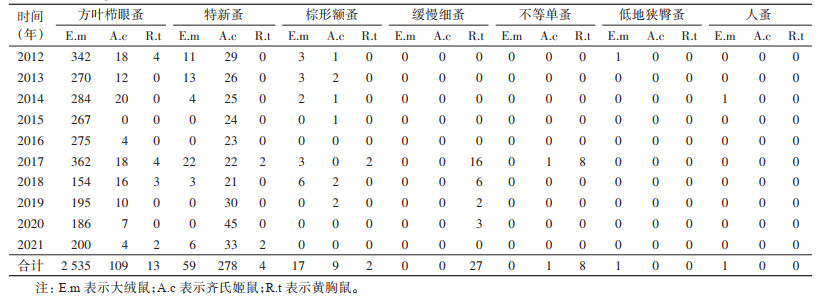
2.2 小兽体蚤及其构成2012-2021年,鹤庆县草海镇监测点检获鼠体蚤4科7属7种共3 082匹,其中方叶栉眼蚤(Ctenophthalmus quadratus)2 658匹,为优势种;其他还有特新蚤(Neopsylla specialis,356匹)、棕形额蚤(Frontopsylla spadix,28匹)、缓慢细蚤(Leptopsylla segnis,27匹)、不等单蚤(Monopsyllus anisus,9匹)、低地狭臀蚤(Stenischia humilis,1匹)和人蚤(Pulex irritans,1匹)。根据宿主动物构成,主要分析作为鼠疫宿主动物的大绒鼠、齐氏姬鼠鼠体蚤构成比。检获大绒鼠鼠体蚤2 613匹,种类构成比为:方叶栉眼蚤占97.01%(2 535/2 613),特新蚤占2.26%(59/2 613),棕形额蚤占0.65%(17/2 613),低地狭臀蚤占0.04%(1/2 613),人蚤占0.04%(1/2 613);检获齐氏姬鼠鼠体蚤397匹,种类构成比为:特新蚤占70.02%(278/397),方叶栉眼蚤占27.46%(109/397),棕形额蚤占2.27%(9/397),不等单蚤占0.25%(1/397)。特新蚤和棕形额蚤为主要媒介蚤,方叶栉眼蚤为次要媒介蚤。
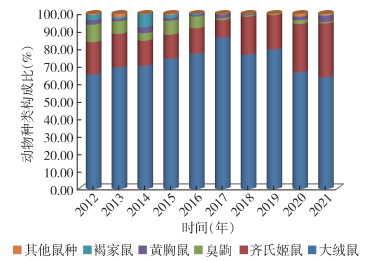
2.3 不同年度动物种类构成每年采用5 m布笼(夹)法捕鼠,2012-2021年分别捕获340、357、326、327、329、547、428、256、306和402只,动物种类构成比见图 1。
|
| 图 1 2012-2021年云南省鹤庆县草海镇监测点不同年度动物种类构成 Figure 1 Host animal species composition at the monitoring site in Caohai town, Heqing county, Yunnan province, 2012-2021 |
| |
按年度分别统计大绒鼠、齐氏姬鼠和黄胸鼠3种主要宿主动物鼠体蚤的数量(表 1),每年大绒鼠鼠体方叶栉眼蚤构成比均不低于93.54%(362/387),特新蚤构成比均不高于5.68%(22/387);齐氏姬鼠鼠体方叶栉眼蚤构成比不高于43.90%(18/41),特新蚤构成比均不低于53.66%(22/41)。每年黄胸鼠鼠体蚤构成比变化较大,10年中有4年未检获到鼠体蚤,2017年检获黄胸鼠鼠体蚤种类最多,数量最大。
|
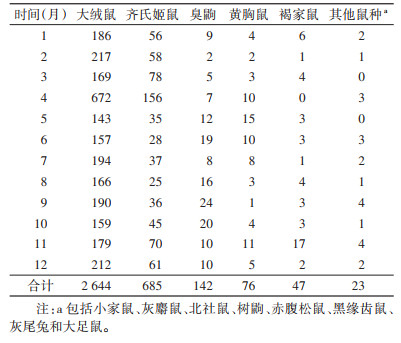
将2012-2021年每年每个对应的月份共10个月的动物监测数量相加作为一个累积变量,小家鼠、灰麝鼩、北社鼠、树鼩、赤腹松鼠、黑缘齿鼠、灰尾兔、大足鼠等鼠种数量极少,多为少见种或稀有种,将此9种动物设为其他鼠种,统计不同月份动物捕获量(表 2)。大绒鼠构成比在61.51%~79.15%,4月呈现最大值(672/849,79.15%)、11月呈现最小值(179/291,61.51%);齐氏姬鼠构成比在11.63%~30.12%,3月呈现最大值(78/259,30.12%)、8月呈现最小值(25/215,11.63%);黄胸鼠在4月数量最多,构成比为82.24%(88/107),而构成比在7、8月呈现最大值(100%),但数量仅为1和7只。
|
将2012-2021年每年每个对应的月份共10个月的3种主要宿主动物鼠体蚤数量相加作为一个累积变量,统计不同月份动物鼠体蚤检获量(表 3)。每月大绒鼠鼠体方叶栉眼蚤构成比均不低于90.27%(206/224),6月最高为99.44%(176/177);特新蚤构成比以2月最高(8.85%),其次为4月(6.98%);棕形额蚤构成比以4月最高(2.24%)。齐氏姬鼠鼠体方叶栉眼蚤构成比以10月最低(8.33%),11月最高(50.00%);特新蚤构成比以11月最低(43.33%),10月最高(91.67%);棕形额蚤构成比在2、4和11月较高,其他月份很低或为0。黄胸鼠鼠体蚤检获数量较少,有7个月未检获到鼠体蚤,但4月种类最多,数量也最多,其中缓慢细蚤构成比3月最高,为76.92%(10/13),其次是4月,为56.67%(17/30),其余月份均为0。
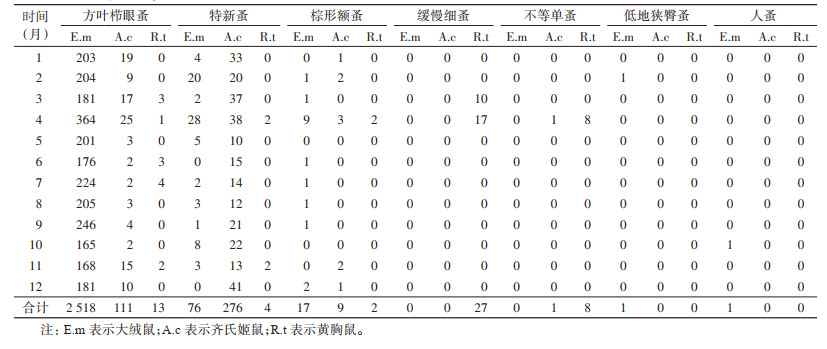
|
大绒鼠捕获率的年度消长呈单峰状,以2017年最高(5.99%),其余年份在2.31%~3.38%;齐氏姬鼠捕获率在0.47%~1.41%,且有逐年上升的趋势(图 2A)。大绒鼠捕获率的季度消长呈单峰状,以4月最高(6.20%),其余月份在2.24%~3.19%;齐氏姬鼠捕获率亦在4月最高(1.43%),但波动不大(图 2B)。黄胸鼠捕获率的年度变化较大,以2017年突然达到高峰,随后逐年降低,其季度变化呈单峰状,5月出现高峰。
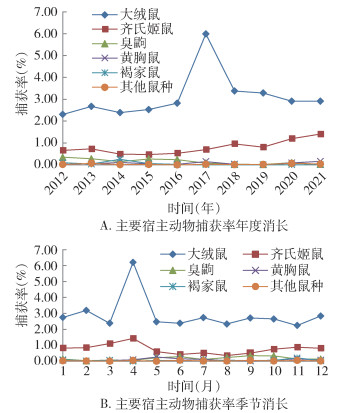
|
| 图 2 2012-2021年云南省鹤庆县草海镇监测点主要宿主动物(小兽)密度消长 Figure 2 Density fluctuation of the main host animal (small mammals) at the monitoring site in Caohai town, Heqing county, Yunnan province, 2012-2021 |
| |
3种主要宿主动物体表蚤种构成及蚤指数存在较大差异(图 3A)。3种主要宿主动物鼠体染蚤率比较,大绒鼠 > 齐氏姬鼠 > 黄胸鼠(图 3B)。大绒鼠鼠体染蚤率1-4月逐渐降低,4月达最低值(29.02%),随后逐渐升高,8月达到最高值(61.21%),后又逐渐降低;齐氏姬鼠鼠体染蚤率1月最高,4月最低,呈现4个峰值,季节波动最为显著;黄胸鼠鼠体染蚤率季节波动较显著,在3、6、11月呈现峰值。大绒鼠鼠体方叶栉眼蚤蚤指数随季节变动较为明显,以4月最小,9月最大;特新蚤和棕形额蚤蚤指数随季节波动不明显,且维持在较低的水平(图 3C)。齐氏姬鼠鼠体方叶栉眼蚤蚤指数的季节消长呈“U”型;特新蚤蚤指数的季节消长波动最为显著,在3、6、9、12月呈现峰值,且在12月最大(图 3D)。

|
| 图 3 2012-2021年云南省鹤庆县草海镇监测点主要宿主动物鼠体蚤指数消长 Figure 3 Fluctuation of fleas indices of main host animals at the monitoring site in Caohai town, Heqing county, Yunnan province, 2012-2021 |
| |
啮齿动物为我国鼠疫自然疫源地的主要宿主[9],其种群生态学特征对鼠疫自然疫源性的延续和鼠疫流行趋势、程度具有高度的影响。本研究宿主动物种类构成比显示,该新发鼠疫疫源地的主要宿主动物是大绒鼠和齐氏姬鼠,二者数量之比约为4∶1,同时伴有少量黄胸鼠的存在,这增加了该鼠疫疫源地宿主动物结构的复杂性。不同年度大绒鼠的种类构成比在63.68%~86.29%,呈现出在2012-2017年逐渐增大,并在2017年达到最大值,随后又逐年降低的现象;齐氏姬鼠的种类构成比在10.05%~30.85%,呈现出在2012-2017年逐渐降低,并在2017年达到最小值,随后又逐年增大的现象;更值得注意的是,2017年大绒鼠的种类构成比为86.29%,齐氏姬鼠的种类构成比为10.05%,其比值约为8∶1;黄胸鼠的数量构成比变化无规律性,可能是因为野外不是其主要生境。不同月份不同动物的数量或构成比峰值在3-4月,但最小值的月份并不相同。大绒鼠的年度消长和月度消长呈单峰状,峰值出现在该鼠疫疫源地暴发的2017年4月;齐氏姬鼠捕获率有逐年上升的趋势,月度波动不大,但以4月最高;黄胸鼠年度变化较大,2017年突然上升并达到峰值,3-4月和8-9月出现2次峰值。据此可以推测,在该鼠疫疫源地内大绒鼠和齐氏姬鼠的种类构成比发生显著变化,尤其是大绒鼠的鼠密度突然倍增时,有可能预示着鼠疫正在流行,也可作为鼠疫流行回顾性调查的依据。鼠疫防控专业人员可依据主要宿主动物的季节消长趋势制订合理的灭鼠计划,及时有效地控制动物的种群密度,防止鼠间鼠疫的流行。
3.2 鼠疫媒介蚤物种构成、种群生态特征与鼠疫流行的关系及监测意义蚤类种群特征与鼠疫生态系统密切相关[10],其特征的变化往往受宿主数量及分布的影响。有研究表明,鼠体蚤指数与鼠密度呈正相关关系,鼠密度增加则染蚤率相应增高[11]。但本研究发现,主要宿主动物的鼠密度与鼠体染蚤率、蚤指数在季节消长上并不一致。在3-4月,大绒鼠和齐氏姬鼠进入密度高峰,鼠密度均呈上升趋势,其染蚤率均呈下降趋势;鼠体蚤指数消长因蚤种而异,大绒鼠鼠体方叶栉眼蚤蚤指数呈下降趋势,而特新蚤和棕形额蚤蚤指数呈上升趋势;齐氏姬鼠鼠体方叶栉眼蚤和特新蚤蚤指数呈下降趋势,而棕形额蚤蚤指数略呈上升趋势。本研究中的主要宿主动物鼠体蚤的优势种存在明显差异,这可能与蚤类的寄主特异性有关。特新蚤和棕形额蚤数量相对较少,但这2种蚤具有媒介效能,承担着传播鼠疫的功能[9],因此特新蚤和棕形额蚤是主要媒介蚤,尤其是棕形额蚤蚤指数与鼠密度呈正相关性,在监测工作中更应引起关注。不同年度大绒鼠、齐氏姬鼠鼠体方叶栉眼蚤和特新蚤构成比呈波动变化,而这些界值恰巧出现在暴发动物鼠疫疫情的2017年。在这块鼠疫疫源地内,当大绒鼠鼠体方叶栉眼蚤构成比最小、特新蚤构成比最大,且齐氏姬鼠鼠体方叶栉眼蚤构成比最大、特新蚤构成比最小时,提示4月存在动物间鼠疫流行的最高潜在风险,这对预测鼠疫的流行具有重要意义。
近年来,云南省鼠疫疫源地逐渐活跃,呈现出人间鼠疫偶发和动物间鼠疫多地连年发生的状态。从种群生态学角度研究鼠疫自然疫源地中主要宿主动物和媒介蚤数量[12-13]、季节消长[14-15]、种群结构[16]等特征成为探讨鼠疫自然疫源地性质和鼠疫流行规律的研究热点。长期、持续、系统地开展鼠疫常规性监测是预防和控制鼠疫流行的根本措施,对预测预警鼠疫的流行具有极其重要的实践意义。
志谢 鹤庆县疾病预防控制中心鼠疫防治同仁给予支持,特此志谢利益冲突 无
| [1] |
Qian Q, Zhao J, Fang LQ, et al. Mapping risk of plague in Qinghai-Tibetan Plateau, China[J]. BMC Infect Dis, 2014, 14: 382. DOI:10.1186/1471-2334-14-382 |
| [2] |
宋志忠, 夏连续, 梁云, 等. 云南玉龙及古城区鼠疫自然疫源地判定及初步研究[J]. 中国地方病防治杂志, 2008, 23(1): 3-7. Song ZZ, Xia LX, Liang Y, et al. Confirmation and study of plague natural foci for Yulong county and Guchengqu in Yunnan province[J]. Chin J Ctrl Endem Dis, 2008, 23(1): 3-7. DOI:10.3969/j.issn.1001-1889.2008.01.002 |
| [3] |
Liang SY, Linthicum KJ, Gaydos JC. Climate change and the monitoring of vector-borne disease[J]. JAMA, 2002, 287(17): 2286. DOI:10.1001/jama.287.17.2286-JMS0501-5-1 |
| [4] |
Patz JA, Frumkin H, Holloway T, et al. Climate change: Challenges and opportunities for global health[J]. JAMA, 2014, 312(15): 1565-1580. DOI:10.1001/jama.2014.13186 |
| [5] |
Woodward A, Smith KR, Campbell-Lendrum D, et al. Climate change and health: On the latest IPCC report[J]. Lancet, 2014, 383(9924): 1185-1189. DOI:10.1016/S0140-6736(14)60576-6 |
| [6] |
Xu L, Liu QY, Stige LC, et al. Nonlinear effect of climate on plague during the third pandemic in China[J]. Proc Natl Acad Sci USA, 2011, 108(25): 10214-10219. DOI:10.1073/pnas.1019486108 |
| [7] |
Xiang JJ, Hansen A, Liu QY, et al. Impact of meteorological factors on hemorrhagic fever with renal syndrome in 19 cities in China, 2005-2014[J]. Sci Total Environ, 2018, 636: 1249-1256. DOI:10.1016/j.scitotenv.2018.04.407 |
| [8] |
Liu QY, Xu WB, Lu S, et al. Landscape of emerging and re-emerging infectious diseases in China: Impact of ecology, climate, and behavior[J]. Front Med, 2018, 12(1): 3-22. DOI:10.1007/s11684-017-0605-9 |
| [9] |
俞东征. 鼠疫动物流行病学[M]. 北京: 科学出版社, 2009: 28-85. Yu DZ. Epizootiology of plague[M]. Beijing: Science Press, 2009: 28-85. |
| [10] |
叶超, 古丽阿依·包开西, 柳园园, 等. 准噶尔盆地鼠疫自然疫源地东部区域大沙鼠体蚤群落结构分析[J]. 疾病预防控制通报, 2017, 32(3): 1-4. Ye C, Baokaixi G, Liu YY, et al. Community structure of parasitic fleas on Rhombomys opimus in eastern area of the Junggar Basin plague focus[J]. Bull Dis Control Prev, 2017, 32(3): 1-4. DOI:10.13215/j.cnki.jbyfkztb.1703015 |
| [11] |
王鼎盛, 徐大琴, 格鹏飞, 等. 阿拉善黄鼠寄生蚤数量与宿主数量和气象因素的关系[J]. 中华地方病学杂志, 2018, 37(12): 965-968. Wang DS, Xu DQ, Ge PF, et al. The relationship between fleas density of Spermophilus alaschanicue and host density and meteorological factors[J]. Chin J Endemiol, 2018, 37(12): 965-968. DOI:10.3760/cma.j.issn.2095-4255.2018.12.004 |
| [12] |
闫东, 史献明, 王再山, 等. 河北省鼠疫疫源地宿主动物种群结构研究[J]. 中华卫生杀虫药械, 2016, 22(4): 381-384. Yan D, Shi XM, Wang ZS, et al. Research on the population structure of plague host animals in plague foci in Hebei province[J]. Chin J Hyg Insect Equip, 2016, 22(4): 381-384. DOI:10.19821/j.1671-2781.2016.04.024 |
| [13] |
张涛, 李丽, 卢世堂, 等. 甘宁黄土高原鼠疫自然疫源地50年防控概述[J]. 疾病预防控制通报, 2014, 29(2): 4-6. Zhang T, Li L, Lu ST, et al. Overview of prevention and control in Loess Plateau plague natural foci in Gansu and Ningxia for 50 years[J]. Bull Dis Control Prev, 2014, 29(2): 4-6. DOI:10.13215/j.cnki.jbyfkztb.1309018 |
| [14] |
李胜, 杨建国, 冯建萍, 等. 青海省2006-2015年鼠疫流行病学分析[J]. 中国地方病防治杂志, 2016, 31(10): 1095-1096. Li S, Yang JG, Feng JP, et al. Epidemiological analysis on plague in Qinghai province from 2006 to 2015[J]. Chin J Ctrl Endem Dis, 2016, 31(10): 1095-1096. |
| [15] |
张渝疆, 阿布力克木, 王诚, 等. 新疆维吾尔自治区准噶尔盆地2007-2016年鼠疫流行态势分析[J]. 中华流行病学杂志, 2017, 38(10): 1394-1398. Zhang YJ, Abulikemu, Wang C, et al. Epidemics and risk factors of plague in Junggar Basin, Xinjiang Uygur Autonomous Region, 2007-2016[J]. Chin J Epidemiol, 2017, 38(10): 1394-1398. DOI:10.3760/cma.j.issn.0254-6450.2017.10.020 |
| [16] |
张家勇, 丁俊, 白玉银, 等. 辽宁省2006-2015年鼠类密度及种群结构分析[J]. 中国媒介生物学及控制杂志, 2017, 28(1): 51-55. Zhang JY, Ding J, Bai YY, et al. Analysis of rodent density and constituent in Liaoning province, China, during 2006-2015[J]. Chin J Vector Biol Control, 2017, 28(1): 51-55. DOI:10.11853/j.issn.1003.8280.2017.01.014 |
 2022, Vol. 33
2022, Vol. 33


