扩展功能
文章信息
- 李植涛, 刘德星, 陈健, 李婷婷, 魏晓雅, 岳巧云, 甘翔, 丁锦颜, 刘环宇, 邱德义
- LI Zhi-tao, LIU De-xing, CHEN Jian, LI Ting-ting, WEI Xiao-ya, YUE Qiao-yun, GAN Xiang, DING Jin-yan, LIU Huan-yu, QIU De-yi
- 2020-2022年中山口岸不同港区小型哺乳动物及其携带体表寄生虫和病原体监测分析
- Analysis of surveillance data on small mammals and their ectoparasites and pathogens in different port areas of Zhongshan port, China, 2020-2022
- 中国媒介生物学及控制杂志, 2022, 33(6): 793-799
- Chin J Vector Biol & Control, 2022, 33(6): 793-799
- 10.11853/j.issn.1003.8280.2022.06.005
-
文章历史
- 收稿日期: 2022-08-25
2 中山海关技术中心国家医学媒介生物监测重点实验室, 广东 中山 528403;
3 中山火炬职业技术学院, 广东 中山 528436;
4 广东省化妆品工程技术研究中心, 广东 中山 528403
2 State Key Laboratory of Medical Vector Surveillance, Zhongshan Customs Technology Center, Zhongshan, Guangdong 528403, China;
3 Zhongshan Torch Polytechnic, Zhongshan, Guangdong 528436, China;
4 Guangdong Cosmetics Engineering & Technology Research Center, Zhongshan, Guangdong 528403, China
小型哺乳动物是鼠传疾病病原体的重要传染源及中间宿主,与人类生活密切相关,不仅能破坏人类居住环境,同时还容易将携带的病毒、细菌、真菌、寄生虫等传播给人类,引发相关疾病,如钩端螺旋体(钩体)病(leptospirosis)、肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)、斑疹伤寒(scrubtyphus)、巴尔通体病(bartonellosis)等[1]。定期对口岸小型哺乳动物本底进行监测可以为控制小型哺乳动物密度、开展鼠传疾病预防控制工作提供依据,也有利于及时发现输入性鼠患并采取相应措施[2]。
中山市地处广东省中南部,是粤港澳大湾区重要节点城市之一,交通发达,全市约50%的货运量、60%的集装箱运输任务由中山口岸承担[3]。中山口岸包括中山、神湾、小榄和黄圃港区4个港区,主要经营来自沿海地区、香港、澳门及国外的散杂货物、集装箱运输及旅客运载。2017-2018年对中山口岸神湾港区的小型哺乳动物调查结果显示该港区平均鼠密度达4.08%,69只小型哺乳动物中2只感染汉坦病毒、3只感染钩体、8只感染巴尔通体,且有1只存在以上3种病原体混合感染的情况,存在较高风险[4],其余3个港区尚缺乏监测数据分析。
本文对2020年5月-2022年5月在中山口岸的神湾、中山、黄圃和小榄港区进行的小型哺乳动物监测进行总结,分析汇总包括各港区小型哺乳动物种类及其携带体表寄生虫和自然感染鼠类病原体的情况。
1 材料与方法 1.1 监测地点和方法2020年5月-2022年5月,采用笼夜法每个季度在中山口岸4个港区监测范围内布放1次鼠笼,诱饵为炸花生米,室内每15 m2放置1笼,室外每5 m放置1笼,每次布放不少于50笼,晚放晨收。将捕获的小型哺乳动物连同鼠笼一起放入鼠袋中,扎紧袋口,记录数据,及时带回实验室。
1.2 捕获样本处理在通风橱内将鼠袋放入可密封塑料箱内,用乙醚棉球将捕获小型哺乳动物麻醉处死后取出。在生物安全柜中将小型哺乳动物放在白瓷盘内测量记录小型哺乳动物体质量、体长、尾长、右后足长、右耳高,并剪下鼠尾组织,用于小型哺乳动物物种分子生物学鉴定。梳捡体表寄生虫,记录每只小型哺乳动物携带寄生虫数量,标识并保存于75%乙醇溶液中。解剖腹腔取肝、脾、肺、肾4个器官的组织分别装入加有核酸保护液的冻存管内,保存于-80 ℃冰箱,用于小型哺乳动物携带病原体检测。
1.3 试剂核酸保护液(目录号:9750)购于广州美基生物科技有限公司;血液/细胞/组织基因组DNA提取试剂盒(目录号:DP304-03)购于天根生化科技(北京)有限公司;磁珠柱法RNA提取试剂盒(目录号:Z-ME-0025)购于上海之江生物科技股份有限公司;反转录试剂盒(目录号:R1012)购于广州东盛生物科技有限公司;引物均由上海生工生物工程有限公司合成。
1.4 样本检测 1.4.1 小型哺乳动物种类鉴定参照《中国国境口岸医学媒介鉴定图谱》对小型哺乳动物进行形态学鉴定;使用血液/细胞/组织基因组DNA提取试剂盒提取鼠尾基因组DNA,并以脊椎动物通用引物Batl5310和R6036R[5]进行扩增分析,开展分子生物学鉴定。
1.4.2 体表寄生虫鉴定使用血液/细胞/组织基因组DNA提取试剂盒(目录号:DP304-03)对寄生虫整体消化过夜,进行无损组织基因组DNA提取[6],核酸提取后制作成玻片标本,进行形态学鉴定。使用线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)基因通用引物LCO1490、HCO2198[7]开展物种分子生物学鉴定。
1.4.3 小型哺乳动物病原体检测使用血液/细胞/组织基因组DNA提取试剂盒提取肝、脾、肾组织基因组DNA,磁珠柱法RNA提取试剂盒提取肺组织RNA,使用反转录试剂盒将RNA反转录为cDNA。参照国境口岸鼠类病原体检测的行业标准[8-11],以肝、脾组织DNA为模板进行PCR扩增检测鼠疫耶尔森菌(鼠疫菌)和土拉弗朗西斯菌(土拉菌),以脾、肾组织DNA为模板进行PCR扩增检测巴尔通体,以肾组织DNA为模板进行PCR扩增检测致病性钩体,用肺组织cDNA为模板进行PCR扩增检测汉坦病毒。
1.4.4 测序及序列分析扩增产物由广州天一辉远基因科技有限公司进行双向测序。测序结果使用DNAman、Primer Premier 5和MEGA 7软件进行拼接及校正,在GenBank和BOLD Systems v4中对序列进行同源性比对。在MEGA 7软件中采用邻接法(neighbor-jointing method,NJ法)构建基于Kimura-2-Parameter(K2P)模型的系统发育树,自展值为1 000。
1.5 数据分析用Excel 2013软件对数据进行整理,SPSS 20.0软件进行统计学分析,病原体阳性率及染虫率的比较使用χ2检验,关联强度用Pearson列联系数r衡量,

|

|

|

|

|
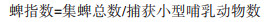
|

|

|
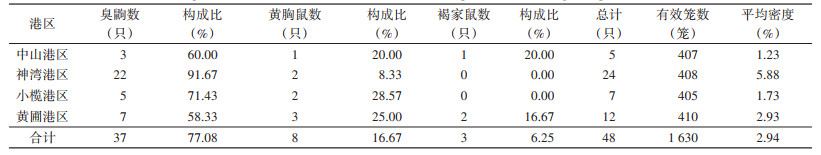
2020年5月-2022年5月,在中山口岸4个港区内共收回有效笼1 630笼次,捕获小型哺乳动物48只,平均密度为2.94%,其中中山港区共布放407笼次,捕获小型哺乳动物5只,平均密度为1.23%,神湾港区布放408笼次,捕获小型哺乳动物24只,平均密度为5.88%,小榄港区布放405笼次,捕获小型哺乳动物7只,平均密度为1.73%,黄圃港区布放410笼次,捕获小型哺乳动物12只,平均密度为2.93%(表 1)。对各港区小型哺乳动物平均密度进行χ2检验,差异有统计学意义(χ2=18.610,P < 0.001)。
|
48只小型哺乳动物隶属于2目2科3属3种,包括臭鼩(Suncus murinus)、黄胸鼠(Rattus tanezumi)和褐家鼠(R. norvegicus)。3个鼠种形态学特征分别为:臭鼩头骨扁大狭长,吻部尖削且明显超出下颌前方,体侧具一囊状臭腺;黄胸鼠尾长大于体长,耳大而透明,向前折可遮住眼睛;褐家鼠尾长小于或等于体长,耳朵厚且短小,尾背面为黑褐色,尾腹面呈白色。DNA条形码鉴定结果与形态学鉴定结果一致。中山和黄圃港区优势种为臭鼩、黄胸鼠和褐家鼠,神湾港区优势种为臭鼩,小榄港区优势种为臭鼩和黄胸鼠(表 1)。对各港区间鼠种分布情况进行χ2检验,差异无统计学意义(χ2=9.090,P=0.169)。
2.2 小型哺乳动物携带体表寄生虫情况共11只小型哺乳动物携带34只体表寄生虫,虱17只,其中2只为太平洋甲胁虱(Hoplopleura pacifica),另外15只未能鉴定到种。小型哺乳动物总染虱率为10.42%,虱指数为0.35,染虱鼠种为臭鼩和黄胸鼠;蚤4匹,其中2匹为猫栉首蚤指名亚种(Ctenocephalides felis felis),1匹为适存病蚤(Nosopsyllus nicanus),1匹未能鉴定到种,总染蚤率为6.25%,蚤指数为0.08;粒形硬蜱(Ixodes granulatus)1只,染蜱鼠种为黄胸鼠,染蜱率为2.08%,蜱指数为0.02;螨12只,其中太原厉螨(Laelaps taingueni)1只、毒厉螨(La. echidninus)1只、纳氏厉螨(La. nuttalli)4只,厉螨科(Laelapidae)3只,另外3只未能鉴定,总染螨率为12.50%,螨指数为0.25(表 2)。未鉴定出种类的体表寄生虫均为若虫或虫体部分缺损,难以进行形态学鉴定,且由于个体较小,提取基因组DNA浓度过低而无法进行DNA条形码鉴定。

|
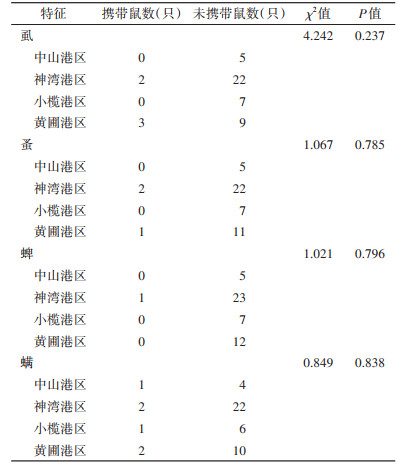
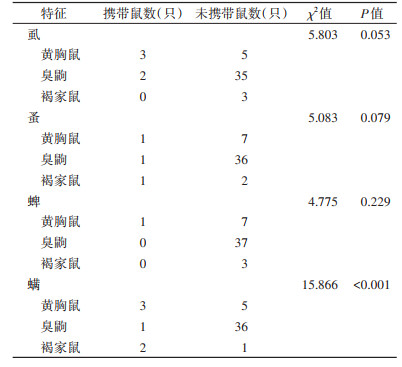
各港区小型哺乳动物携带体表寄生虫种类差异无统计学意义(均P > 0.05)(表 3)。虱、蚤、蜱携带率在各鼠种间差异无统计学意义(均P > 0.05),螨携带率在各鼠种间差异有统计学意义(χ2=15.866,P < 0.001),褐家鼠染螨率(66.67%)高于黄胸鼠(37.50%)和臭鼩(2.70%)。见表 2、4。
|
|
捕获的48只小型哺乳动物中共3种10只检出感染病原体,均为巴尔通体,巴尔通体总阳性率为20.83%,其中神湾港区4只,阳性率为16.67%(4/24),黄圃港区6只,阳性率为50.00%(6/12),中山港区和小榄港区未检出;对各港区间巴尔通体的阳性率进行χ2检验,差异有统计学意义(χ2=9.600,P=0.022),黄圃港区巴尔通体感染率高于神湾、中山和小榄港区。感染巴尔通体的10只小型哺乳动物中,5只为臭鼩,4只为黄胸鼠,1只为褐家鼠。对各鼠种感染巴尔通体情况进行χ2检验,差异有统计学意义(χ2=5.549,P=0.040),黄胸鼠的巴尔通体阳性率高于褐家鼠和臭鼩。
检测捕获小型哺乳动物感染鼠疫菌、汉坦病毒、土拉菌及致病性钩体情况,结果均为阴性。
在GenBank中对检测得到的10条巴尔通体rpoB基因序列[编号B1~B10,B1(OP500040)宿主为褐家鼠,B2(OP500041)、B3(OP500042)、B4(OP500043)、B6(OP500045)、B9(OP500048)宿主为臭鼩,B5(OP500044)、B7(OP500046)、B8(OP500047)、B10(OP500049)宿主为黄胸鼠]进行同源性比对,根据测序结果比对建立进化树如图 1所示,B1与Bartonella tribocorum同源性为100%,B7与B. queenslandensis同源性为99%,B8和B10与B. phoceensis同源性均为100%,B5与其他序列未聚为一支。对B2~B6、B9进行同源性比对,B3和B4同源性为100%,B6和B9同源性为100%。对鼠种与巴尔通体种类关联性进行χ2检验,差异有统计学意义(χ2=14.150,P=0.028),即鼠种与巴尔通体种类间有关联性,关联强度为r=0.765。

|
| 注:B1~B10为本研究所获序列,B1宿主为褐家鼠,B2~B4、B6和B9宿主为臭鼩,B5、B7、B8和B10宿主为黄胸鼠。 图 1 巴尔通体rpoB基因系统进化树 Figure 1 Phylogenetic tree of Bartonella rpoB gene |
| |
2020年5月-2022年5月,在中山口岸4个港区共监测到小型哺乳动物48只,优势种主要为臭鼩(77.08%)和黄胸鼠(16.67%),这与广东省各口岸小型哺乳动物监测结果一致[13-14];总平均密度(2.94%)高于2016年的调查结果(2.03%)[13],表明小型哺乳动物数量有上升趋势,其中神湾港区捕获的小型哺乳动物数量最多,占小型哺乳动物总数的50.00%(24/48),这可能与神湾港区的地理位置和环境有关,神湾港区位于磨刀岛,且与大片绿化带、农田相邻,为小型哺乳动物提供了适宜生存、繁殖的环境。臭鼩属于食虫目动物,已被证实可携带和传播鼠疫菌、钩体、汉坦病毒[15]、星状病毒[16]、巴尔通体[17]等病原体,应和其他小型哺乳动物一样加以重视并采取控制措施。
捕获的小型哺乳动物体表寄生虫主要为太原厉螨、毒厉螨、纳氏厉螨、适存病蚤和太平洋甲胁虱,其中螨的种类与云南省的革螨调查情况类似[18]。这些体表寄生虫除直接叮刺人体可引发皮炎外,还可携带多种病原体,如鼠疫菌、钩体、伯氏疏螺旋体、立克次体等[19],我国台湾省曾在捕获的鼠蚤和虱体内分离出巴尔通体[20]。定期开展防鼠灭鼠工作有利于控制鼠体表寄生虫。如表 2所示,各鼠种中染虱、染蜱和染螨的黄胸鼠均最多,这可能与黄胸鼠栖息环境广泛相关,同时黄胸鼠具有在住宅区与农田区进行迁移的习性,应当在住宅区加以防范[21]。4个港区间小型哺乳动物体表寄生虫携带率无统计学意义。虱、蚤、蜱携带率在各鼠种间差异也无统计学意义,可能由于本阶段捕获的褐家鼠仅3只,与另外2个鼠种样本量相差较大(臭鼩37只,黄胸鼠8只),且虱、蚤、蜱3类体表寄生虫中仅在1只褐家鼠体表检获1匹蚤,样本量不均衡可能导致了数据分析结果偏离真实情况。
本阶段监测中检测到的鼠类病原体均为巴尔通体,总阳性率为20.83%,与广东省小型哺乳动物携带巴尔通体的调查结果(19.47%)[22]接近,其中黄圃(50.00%)和神湾港区(16.67%)明显高于中山和小榄港区(均未检出),这可能与黄圃及神湾港区的自然环境有关。不同于中山和小榄港区,黄圃和神湾港区较为偏僻,且远离居民区,与树林、灌木丛、草地、农田等相邻,为小型哺乳动物感染病原体和媒介昆虫提供了有利条件,而黄圃港区感染率高于神湾港区可能是由于黄圃港区捕获的巴尔通体感染率较高的黄胸鼠和褐家鼠数量相对较多,神湾港区则以臭鼩(22只)居多,而臭鼩的巴尔通体感染率较低,黄胸鼠(2只)较少,褐家鼠无捕获。本阶段监测中检测到的巴尔通体为B. tribocorum、B. queenslandensis和B. phoceensis,已有病例报道表明B. tribocorum与人类疾病相关[23],感染人体可引起菌血症、猫抓病、心内膜炎、视网膜炎等疾病[24]。同一港区内不同小型哺乳动物感染的巴尔通体经比对有序列相似度达100%,表明巴尔通体可能在小型哺乳动物间出现了传染现象,应在后续的监测工作中持续关注。臭鼩、黄胸鼠及褐家鼠的巴尔通体阳性率差异有统计学意义,但褐家鼠样本量太少(3只),代表性较差,臭鼩的阳性率(13.51%)与之前的调查结果(13.79%)接近,黄胸鼠((50.00%))则高于之前的调查结果(33.33%)[4]。鼠种与巴尔通体种类间关联强度较高,臭鼩感染的巴尔通体未鉴定到种,有待进一步研究。
就本阶段监测结果而言,中山口岸4个港区的小型哺乳动物密度较高,且携带体表寄生虫情况在各港区间无差异,感染病原体主要为巴尔通体,以黄圃港区和神湾港区较为严重,应对各港区加强卫生管理,定期消杀灭鼠,同时加强鼠传疾病监测预警及健康教育。
利益冲突 无
| [1] |
赵哲, 贺真, 龙泳. 我国常见鼠传疾病流行病学特点及防治研究现状[J]. 中华卫生杀虫药械, 2021, 27(6): 578-581. Zhao Z, He Z, Long Y. Research progress on epidemiology and control of main rodent-borne diseases in China[J]. Chin J Hyg Insect Equip, 2021, 27(6): 578-581. DOI:10.19821/j.1671-2781.2021.06.024 |
| [2] |
丁均. 国境口岸媒介生物监测与防控[J]. 口岸卫生控制, 2011, 16(2): 50-53. Ding J. Surveillance and protection for vector at frontier ports[J]. Port Health Control, 2011, 16(2): 50-53. DOI:10.3969/j.issn.1008-5777.2011.02.017 |
| [3] |
吴燕子, 姜伟, 李强. 中山市港口发展分析[J]. 珠江水运, 2020(16): 92-93. Wu YZ, Jiang W, Li Q. Analysis of Zhongshan port development[J]. Pearl River Water Transp, 2020(16): 92-93. DOI:10.14125/j.cnki.zjsy.2020.16.041 |
| [4] |
陈利伟, 岳巧云, 邱德义, 等. 中山市神湾港鼠形动物携带病原体调查[J]. 中国国境卫生检疫杂志, 2019, 42(1): 33-36. Chen LW, Yue QY, Qiu DY, et al. Investigation on the pathogens carried by rodents at Shenwan port in Zhongshan city[J]. Chin J Front Health Quar, 2019, 42(1): 33-36. DOI:10.16408/j.1004-9770.2019.01.009 |
| [5] |
Robins JH, Hingston M, Matisoo-Smith E, et al. Identifying Rattus species using mitochondrial DNA[J]. Mol Ecol Notes, 2007, 7(5): 717-729. DOI:10.1111/j.1471-8286.2007.01752.x |
| [6] |
单振菊, 邱德义, 岳巧云. 一种具厚几丁质外壳微小节肢动物无损伤凭证标本高质量DNA模板的获取方法[J]. 中国媒介生物学及控制杂志, 2017, 28(1): 27-30. Shan ZJ, Qiu DY, Yue QY. A method of obtaining high quality DNA templates from tiny thick-chitin arthropods without damaging morphology of the voucher specimens[J]. Chin J Vector Biol Control, 2017, 28(1): 27-30. DOI:10.11853/j.issn.1003.8280.2017.01.008 |
| [7] |
Folmer O, Black M, Hoeh W, et al. DNA primers for amplification of mitochondrial cytochrome c oxidase subunit Ⅰ from diverse metazoan invertebrates[J]. Mol Mar Biol Biotechnol, 1994, 3(5): 294-299. |
| [8] |
中华人民共和国国家质量监督检验检疫总局. SN/T 3741.1-2013国境口岸鼠类携带病原体检测方法第1部分: 致病性钩端螺旋体PCR检测方法[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3741.1-2013 Detection for pathogens of rodents at frontier ports-part 1: Detection for pathogenic leptospira[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [9] |
中华人民共和国国家质量监督检验检疫总局. SN/T 3741.2-2013国境口岸鼠类携带病原体检测方法第2部分: 土拉弗朗西斯菌PCR检测方法[S]. 北京: 中国标准出版社, 2014. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3741.2-2013 Detection for pathogens of rodents at frontier ports-part 2: Detection for Francisella tularensis[S]. Beijing: Standards Press of China, 2014. (in Chinese) |
| [10] |
中华人民共和国国家质量监督检验检疫总局. SN/T 2616-2010国境口岸鼠携带鼠疫杆菌和汉坦病毒快速检测方法[S]. 北京: 中国标准出版社, 2010. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 2616-2010 Rapid detection of Yersinia pestis and Hantavirus on rodents at frontier port[S]. Beijing: Standards Press of China, 2010. (in Chinese) |
| [11] |
中华人民共和国国家质量监督检验检疫总局. SN/T 4616-2016国境口岸巴尔通体PCR检测方法[S]. 北京: 中国标准出版社, 2017. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 4616-2016 Detection with PCR for Bartonella at frontier port[S]. Beijing: Standards Press of China, 2017. (in Chinese) |
| [12] |
徐正会, 杨比伦, 胡刚. 西双版纳片断山地雨林蚁科昆虫群落研究[J]. 动物学研究, 1999, 20(4): 288-293. Xu ZH, Yang BL, Hu G. Formicidae ant communities in fragments of montane rain forest in Xishuangbanna, China[J]. Zool Res, 1999, 20(4): 288-293. DOI:10.3321/j.issn:0254-5853.1999.04.009 |
| [13] |
高云霞, 李小波, 方盛藩, 等. 广东口岸鼠形动物间鼠疫耶尔森菌和汉坦病毒感染状况调查[J]. 中国媒介生物学及控制杂志, 2016, 27(2): 137-140. Gao YX, Li XB, Fang SF, et al. Investigation of Yersinia pestis and Hantavirus carried by small mammal hosts at Guangdong entry-exit ports[J]. Chin J Vector Biol Control, 2016, 27(2): 137-140. DOI:10.11853/j.issn.1003.8280.2016.02.011 |
| [14] |
郭惠琳, 魏怀波, 郭天宇, 等. 2014-2015年全国口岸及边境线鼠类监测报告[J]. 中国国境卫生检疫杂志, 2017, 40(1): 1-10. Guo HL, Wei HB, Guo TY, et al. Surveillance on the native rodents at ports of China in 2014-2015[J]. Chin J Front Health Quar, 2017, 40(1): 1-10. DOI:10.16408/j.1004-9770.2017.01.001 |
| [15] |
王詝, 李博琦, 李永久, 等. 鼩鼱科动物携带汉坦病毒科病毒的研究进展[J]. 病毒学报, 2021, 37(5): 1252-1259. Wang Z, Li BQ, Li YJ, et al. Current progress regarding carrying of Hantaviridae virus in Soricidae[J]. Chin J Virol, 2021, 37(5): 1252-1259. DOI:10.13242/j.cnki.bingduxuebao.003954 |
| [16] |
邱旻. 广州和厦门鼠类及臭鼩鼱携带星状病毒情况调查及其基因分析[D]. 广州: 南方医科大学, 2017. Qiu M. Investigation and gene analysis of Astroviruses from rats and musk shrews in Guangzhou and Xiamen[D]. Guangzhou: Southern Medical University, 2017. (in Chinese) |
| [17] |
叶曦, 姚美琳, 李国伟, 等. 福建沿海臭鼩鼱感染巴尔通体调查研究[J]. 中国人兽共患病学报, 2010, 26(6): 601-603, 606. Ye X, Yao ML, Li GW, et al. Study on the prevalence and genotypes of Bartonella species in Suncus murinus from Fujian coastal region[J]. Chin J Zoonoses, 2010, 26(6): 601-603, 606. DOI:10.3969/j.issn.1002-2694.2010.06.023 |
| [18] |
刘哲. 云南省黄胸鼠等三种家鼠体表革螨生态研究[D]. 大理: 大理大学, 2020. Liu Z. Ecological researches on Gamasid mites on three species of domestic rodents (Rattus tanezumi, R. norvegicus and Mus musculus) in Yunnan province, Southwest China[D]. Dali: Dali University, 2020. (in Chinese) |
| [19] |
Kuo CC, Lee PL, Wang HC. Molecular detection of Rickettsia species and host associations of Laelaps mites (Acari: Laelapidae) in Taiwan[J]. Exp Appl Acarol, 2020, 81(4): 547-559. DOI:10.1007/s10493-020-00522-1 |
| [20] |
Tsai YL, Chuang ST, Chang CC, et al. Bartonella species in small mammals and their ectoparasites in Taiwan[J]. Am J Trop Med Hyg, 2010, 83(4): 917-923. DOI:10.4269/ajtmh.2010.10-0083 |
| [21] |
严慧, 刘世友, 齐顺祥, 等. 黄胸鼠的分布与迁移[J]. 医学动物防制, 2022, 38(5): 463-466. Yan H, Liu SY, Qi SX, et al. Distribution and migration of Rattus tanezumi[J]. J Med Pest Control, 2022, 38(5): 463-466. DOI:10.7629/yxdwfz202205014 |
| [22] |
李雪云, 陈经雕, 黎聪荣, 等. 广东省鼠形动物携带巴尔通体的调查和基因特征分析[J]. 中国人兽共患病学报, 2018, 34(5): 482-486, 491. Li XY, Chen JD, Li CR, et al. Genotype characteristics of Bartonella and the infection in rodents in Guangdong province, China[J]. Chin J Zoonoses, 2018, 34(5): 482-486, 491. DOI:10.3969/j.issn.1002-2694.2018.00.062 |
| [23] |
Vayssier-Taussat M, Moutailler S, Féménia F, et al. Identification of novel zoonotic activity of Bartonella spp., France[J]. Emerg Infect Dis, 2016, 22(3): 457-462. DOI:10.3201/eid2203.150269 |
| [24] |
马洁琼, 栗冬梅, 陈忠科, 等. 鼠传巴尔通体流行概况[J]. 疾病监测, 2018, 33(1): 7-14. Ma JQ, Li DM, Chen ZK, et al. Epidemiological characteristics of rodent-borne Bartonella[J]. Dis Surveill, 2018, 33(1): 7-14. DOI:10.3784/j.issn.1003-9961.2018.01.004 |
 2022, Vol. 33
2022, Vol. 33


