扩展功能
文章信息
- 王丹, 陈丹丹, 田冬冬, 徐秀平, 周敬祝, 师伟芳, 梁文琴
- WANG Dan, CHEN Dan-dan, TIAN Dong-dong, XU Xiu-ping, ZHOU Jing-zhu, SHI Wei-fang, LIANG Wen-qin
- 贵州省铜仁市白纹伊蚊抗药性及代谢酶活性监测研究
- Insecticide resistance and metabolic enzyme activity monitoring for Aedes albopictus in Tongren of Guizhou province, China
- 中国媒介生物学及控制杂志, 2022, 33(6): 787-792
- Chin J Vector Biol & Control, 2022, 33(6): 787-792
- 10.11853/j.issn.1003.8280.2022.06.004
-
文章历史
- 收稿日期: 2022-07-01
2 贵州医科大学公共卫生与健康学院, 贵州 贵阳 550025;
3 铜仁市疾病预防控制中心, 贵州 铜仁 554300
2 Public Health School of Guizhou Medical University, Guiyang, Guizhou 550025, China;
3 Tongren Center for Disease Control and Prevention, Tongren, Guizhou 554300, China
白纹伊蚊(Aedes albopictus)是登革热、基孔肯雅热、寨卡病毒病等急性传染病的重要传播媒介。近年来,新发及再肆虐的蚊媒传染病疫情在世界各地不断蔓延流行,导致全球防控形势异常严峻,蚊媒传染病已成为日益严重的公共卫生问题[1-2]。有效控制媒介伊蚊密度是降低蚊媒传染病流行风险的关键,自化学杀虫剂问世以来,具备高效广谱、收效迅速、操作简便等独特优点的化学防治法成为了蚊媒控制的主要手段,但长期施用化学杀虫剂不可避免地会导致蚊虫抗药性的产生及发展。代谢抗性是蚊虫对常用化学杀虫剂产生抗药性的主要机制之一,研究指出,蚊虫体内多功能氧化酶(mixed function oxidases,MFO)、非特异性酯酶(non-specific esterase,NSE)、谷胱甘肽-S-转移酶(glutathione-S-transferase,GST)与蚊虫对菊酯类、有机磷类和氨基甲酸酯类等杀虫剂的抗性形成相关[3-4]。本研究对铜仁市白纹伊蚊野外种群及敏感品系进行抗药性测定,同时对幼蚊体内3种重要酶系的活性进行检测,探讨白纹伊蚊幼蚊代谢酶的活性及其变化特征。
1 材料与方法 1.1 试虫来源白纹伊蚊敏感品系引自中国疾病预防控制中心(疾控中心)传染病预防控制所媒介生物控制室,由贵州省疾控中心昆虫饲养室常规饲养。野外种群于2020年8月采自贵州省铜仁市下辖的碧江区及万山区,采集地点分布在铜仁市城区东、南、西、北、中5个方位。利用吸管和捞勺从万和星城小区、冲广坪小区、东太大道税务局小区、坞坭社区、中南门古城及其附近居民区共计52个小型积水容器中采集白纹伊蚊幼蚊约3 700条带回实验室鉴定,将不同采集地点的试虫合并后,以等比例混配的馒头猪肝粉饲喂幼蚊,成蚊血源为小白鼠新鲜血液,平时供给10%葡萄糖水,繁殖1~2代。选择Ⅲ龄末Ⅳ龄初健康幼蚊及羽化后3~5 d未吸血健康雌蚊进行抗药性测定,并测定Ⅲ龄末Ⅳ龄初幼蚊的NSE、MFO及GST 3种代谢酶活性。
1.2 杀虫剂原药及药膜98.6%溴氰菊酯、95.8%高效氯氰菊酯、96.22%氯菊酯、90.1%双硫磷、98.32%残杀威原药,0.03%溴氰菊酯、0.4%高效氯氰菊酯、0.4%氯菊酯、0.5%马拉硫磷、0.05%残杀威药膜及实验对照用纸,均由中国疾控中心传染病预防控制所媒介生物控制室提供。
1.3 主要仪器万分之一电子天平(赛多利斯BSA224S)、人工气候箱(杭州汇尔仪器设备有限公司RZH-1000D)、酶标仪(Thermo Scientific Multiskan FC)、电动组织研磨器(天根OSE-Y50)、台式高速冷冻离心机(Sigma 3-18K)、pH计(梅特勒FiveGo F2型)、不同量程单道及多道移液器(Eppendorf)。
1.4 主要试剂二喹啉甲酸(bicinchoninic acid,BCA)蛋白含量测定试剂盒,购自Thermo Scientific公司;PBS片剂,购自生工生物工程(上海)股份有限公司;α-乙酸萘酯(1-Naphthyl acetate)、3,3',5,5'-四甲基联苯胺盐酸盐(3,3',5,5'-Tetramethylbenzidine,TMBZ),购自Sigma公司;α-萘酚(1-Naphthol)购自德国CNW公司;固蓝B盐(Fast Blue B salt),购自上海源叶生物科技有限公司;细胞色素C(Cytochrome C,cyt c),购自中国食品药品检定研究院;1-氯-2,4二硝基苯(1-Chloro-2,4-dinitrobenzene,CDNB)、还原型谷胱甘肽(Glutathione,GSH),购自Sigma-Aldrich;30% H2O2,购自浙江中星化工试剂有限公司;甲醇、丙酮、乙酸钠,购自国药集团化学试剂有限公司。
1.5 实验条件饲养室和测试室温度为(26±1)℃,相对湿度为(75±5)%,光照周期(L∶D)=14 h∶10 h。
1.6 实验方法 1.6.1 抗药性测定 1.6.1.1 幼虫浸渍法以丙酮将杀虫剂原药配制成5 mg/ml母液,通过预实验确定幼蚊10%~90%死亡的药液浓度,将母液按等差或等比稀释成5~7个系列浓度。各取100 μl不同浓度的药液加入每个盛有199.9 ml脱氯水的250 ml烧杯中,对照组加入100 μl丙酮。按浓度由低到高的顺序在各杯中分别加入试虫20只,24 h后观察并记录试虫死亡数,计算死亡率,实验重复3次。死亡判断标准[5]:以锐器触动虫体不动或仅震颤即判为死亡。
1.6.1.2 成蚊接触筒法将恢复筒固定在隔板的一侧,用吸蚊器吸取25~30只供试雌蚊轻轻吹入恢复筒,平行放置15 min。将衬垫有药膜滤纸的接触筒各自固定在隔板的另一侧,同时设空白对照。抽开隔板,将恢复筒内蚊虫轻轻吹入接触筒,迅速关闭隔板,将筒平放,开始计算接触时间。接触60 min后抽开隔板,将蚊虫吹至恢复筒内,关闭隔板,取下恢复筒直立放置并饲以10%葡萄糖水,24 h后观察死亡数,计算死亡率,实验重复4次。死亡判断标准[6]:试虫完全不动,或仅躯体、足、翅或触角等震颤而无存活的可能性,视为死亡。
1.6.1.3 结果判定幼蚊或成蚊抗药性测定过程中,若对照组死亡率 < 5%,可不必校正,如在5%~20%之间,用Abbott公式校正实验组死亡率:校正死亡率(%)=(实验组死亡率-对照组死亡率)/(1-对照组死亡率)×100。若对照组死亡率 > 20%或幼蚊化蛹率 > 10%,则实验结果无效。
1.6.2 代谢酶活力测定白纹伊蚊幼蚊NSE、MFO及GST活力利用酶标仪进行测定[4, 7]。
1.6.2.1 酶源的制备取单条幼蚊于1.5 ml离心管,加入100 μl PBS缓冲液(50片PBS片剂+1 000 ml蒸馏水,pH值7.2左右,下同),用电动研磨器在5 000 r/min的转速下研磨约20 s,补加入900 μl PBS缓冲液后,4 ℃条件下15 000×g,离心15 min,取上清液做酶源。
1.6.2.2 蛋白质含量测定按照BCA蛋白含量测定试剂盒说明书,向酶标板的各孔中加入25 μl酶源及200 μl BCA工作液,震荡30 s充分混匀。将酶标板密封,在37 ℃孵育30 min。将酶标板取出冷却到室温,使用酶标仪测定560 nm处的吸光度(A560),根据牛血清白蛋白标准曲线,得出各样本的蛋白质含量,单位为mg/ml。
1.6.2.3 NSE测定向酶标板中分别加入100 μl酶液、100 μl α-乙酸萘酯溶液(14 mg α-乙酸萘酯+5 ml丙酮+20 ml PBS缓冲液),室温下反应15 min,加入100 μl浓度为1 mg/ml固蓝溶液(50 mg固蓝B盐+50 ml PBS缓冲液),再放置5 min,测定A620。重复3次。用α-萘酚标准品获得其标准曲线,根据公式计算NSE酶活力,单位用“nmol α-萘酚/(min·mg pr)”表示。
1.6.2.4 MFO测定向酶标板中分别加入100 μl酶液、200 μl TMBZ溶液[10 mg TMBZ+5 ml甲醇+25 ml 0.25 mol/L乙酸钠缓冲液(乙酸钠缓冲液用乙酸调整pH值至5.0)]和25 μl 3%H2O2溶液。室温反应5 min,测定A620。用标准品获得细胞色素C标准曲线,根据公式计算MFO酶活力,单位用“nmol cyt c/mg pr”表示。
1.6.2.5 GST测定向酶标板中分别加入100 μl酶液、100 μl GSH溶液(12.2 mg GSH+20 ml PBS缓冲液)和100 μl CDNB溶液(12 mg CDNB+6 ml丙酮+54 ml PBS缓冲液),即刻测定A340,室温放置10 min后再次测定A340,用CDNB的消光系数9.6 mmol/L将A值转化成酶比活力[nmol/(min·mg pr)]。
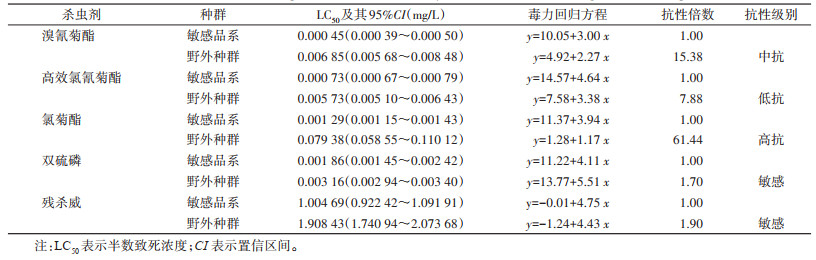
1.7 统计与计算 1.7.1 抗药性测定分析 1.7.1.1 计算公式应用SPSS 24.0软件进行统计学分析,得到幼蚊对每种杀虫剂的半数致死浓度(LC50)及95%置信区间(95%CI)、毒力回归方程及抗性倍数(R/S)。R/S=野外种群LC50 /敏感品系LC50。
1.7.1.2 判定标准野外种群幼蚊根据R/S判定抗性级别,R/S < 3为敏感,3≤R/S < 10为低抗,10≤R/S < 40为中抗,R/S≥40为高抗[8]。野外种群成蚊以诊断剂量下的死亡率作为抗性判断标准,待测蚊虫种群的死亡率≥98%为敏感种群,80%≤死亡率 < 98%为可能抗性种群,死亡率 < 80%为抗性种群[9]。
1.7.2 代谢酶活力统计分析 1.7.2.1 计算公式
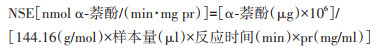
|
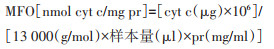
|
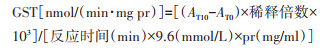
|
式中,mg pr表示每条测定幼蚊制备酶液后样品中的蛋白质量(mg)。AT0和AT10分别代表测定GST时加入反应物后即时和反应10 min后的A值。
1.7.2.2 分析方法应用SPSS 24.0软件对3种代谢酶活力分布进行正态性检验(Shapiro-Wilk,W检验),如种群酶活力呈正态分布,统计描述采用均数±标准差,若呈偏态分布,则采用中位数(四分位数间距)即M(P25~P75)描述;再进行Wilcoxon秩和检验比较敏感品系与野外种群酶活力差异,检验水准α=0.05。NSE、MFO及GST活力频率分布图制作使用Minitab 20软件。
2 结果 2.1 白纹伊蚊抗性测定 2.1.1 幼蚊抗性测定铜仁市白纹伊蚊幼蚊对双硫磷及残杀威的抗性倍数分别是敏感品系的1.70及1.90倍,属于敏感水平;对拟除虫菊酯类杀虫剂均已产生不同程度的抗药性,抗性倍数由高到低依次是氯菊酯为61.44倍,达高抗水平,溴氰菊酯为15.38倍,属中抗水平,高效氯氰菊酯为7.88倍,为低抗水平。见表 1。
|
铜仁市白纹伊蚊成蚊对残杀威敏感,死亡率为100%,对马拉硫磷表现为抗性,死亡率为79.25%;在调查的3种拟除虫菊酯类杀虫剂中,溴氰菊酯死亡率最低,为0,对氯菊酯及高效氯氰菊酯的死亡率分别为2.13%和58.00%,均表现为抗性。见表 2。
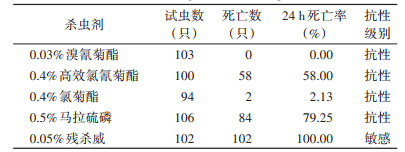
|
通过生化水平测定,实验室敏感品系白纹伊蚊幼蚊Shapiro-Wilk正态性检验提示WNSE =0.852,P < 0.001;WMFO=0.804,P < 0.001;WGST=0.893,P < 0.001。铜仁市白纹伊蚊幼蚊Shapiro-Wilk正态性检验提示WNSE=0.938,P < 0.001;WMFO=0.857,P < 0.001;WGST=0.857,P < 0.001。白纹伊蚊野外种群NSE、MFO、GST活力是敏感品系的1.21、0.28和0.34倍,经Wilcoxon秩和检验,差异有统计学意义(ZNSE=-2.699,P=0.007;ZMFO=-10.095,P < 0.001;ZGST=-9.627,P < 0.001)。见表 3。
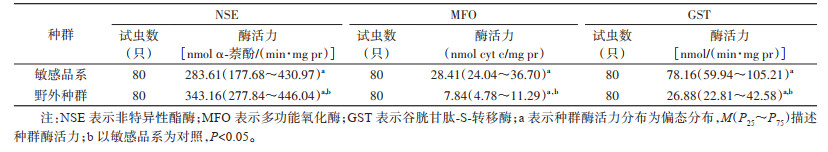
|
铜仁市白纹伊蚊幼蚊的NSE、MFO及GST活力分布均呈正偏态分布,NSE酶活力分布略右移,与实验室敏感品系多有重合;MFO及GST酶活力分布较实验室敏感品系明显左移,个体酶活力值集中,与敏感品系相比酶活力变化范围较小。见图 1。
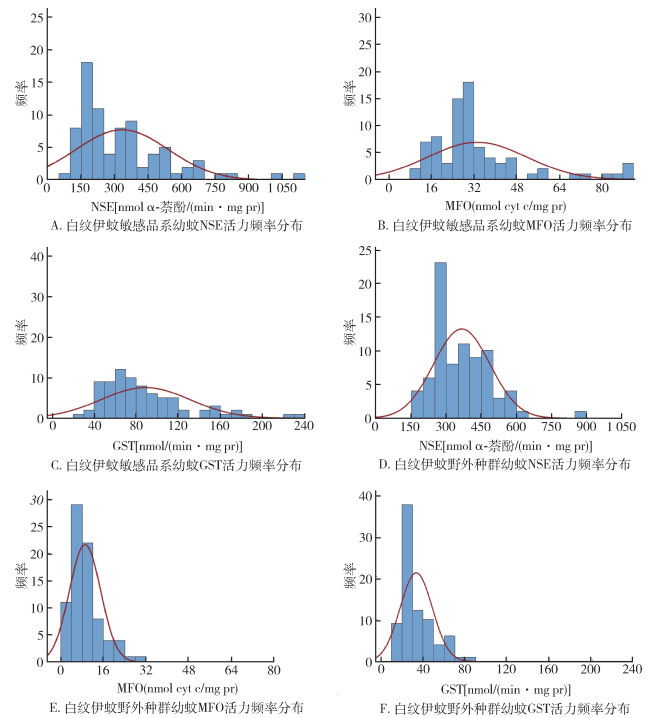
|
| 注:NSE表示非特异性酯酶;MFO表示多功能氧化酶;GST表示谷胱甘肽-S-转移酶。 图 1 2020年贵州省铜仁市白纹伊蚊幼蚊的3种代谢酶活力频率分布 Figure 1 Frequency distribution of the activities of three metabolic enzymes in Aedes albopictus larvae in Tongren, Guizhou province, 2020 |
| |
拟除虫菊酯类、有机磷类及氨基甲酸酯类化合物是现今市面上化学杀虫剂的主要原料,其中,拟除虫菊酯类杀虫剂因具备安全、高效、低毒等独特优点而在世界范围内被广泛应用。溴氰菊酯、高效氯氰菊酯、氯菊酯是拟除虫菊酯类杀虫剂的代表,2019年赵春春[10]通过全国病媒生物监测系统收集分析我国15个省份登革热媒介白纹伊蚊抗药性数据,结果表明大部分地区幼蚊或成蚊均对该3种拟除虫菊酯类杀虫剂产生了较高抗性,贵州省2018年以来白纹伊蚊抗药性监测情况与该结果一致[11-12]。通过监测发现,贵州省白纹伊蚊对有机磷及氨基甲酸酯类杀虫剂多为低抗或敏感水平,这可能与贵州省的历史用药情况或过度依赖拟除虫菊酯类杀虫剂有关。这两类杀虫剂自拟除虫菊酯类出现后便开始在市场中失去优势,使用频次被大大降低,而抗性发展与杀虫剂的使用存在很大关系,杀虫剂用量的减少会延缓蚊虫抗药性的产生或造成抗性水平降低[13]。本研究中,铜仁市白纹伊蚊幼蚊及成蚊对残杀威均为敏感水平,对3种拟除虫菊酯类杀虫剂均表现出较为一致的抗药性,但不同虫态对有机磷类杀虫剂的抗药性却无明显相关性。当地白纹伊蚊幼蚊对双硫磷敏感,成蚊对同类的马拉硫磷却表现为抗性,这可能与蚊虫在不同虫态下存在不同的抗性机制或抗性相关基因在不同虫期表达模式不同有关[14],提示对同一类杀虫剂而言,不同虫态的抗药性水平可能并不相同,幼蚊的抗药性结果不能成为指导成蚊防控的依据,反之亦然。
NSE、MFO及GST 3种代谢解毒酶均能在白纹伊蚊对拟除虫菊酯类、有机磷类及氨基甲酸酯类杀虫剂的抗药性形成过程中发挥作用。本研究生测结果显示,铜仁市白纹伊蚊对3种拟除虫菊酯类杀虫剂均已产生抗性,但通过代谢酶活性测定发现,NSE活力高于敏感品系,而MFO及GST活力却低于敏感品系,提示白纹伊蚊对拟除虫菊酯类杀虫剂产生抗药性是由多种机制导致的,代谢酶活性与其抗药性产生的相互关系仅比较实验室敏感品系与野外种群代谢酶活性的基线并不能得出相关结论,这与高景鹏[15]观点一致。陈翰明等[16]也认为以敏感品系基线作为参照的代谢酶活性比较方法不适合作为检测白纹伊蚊种群对菊酯类杀虫剂抗性的单因素标志。本研究中白纹伊蚊野外种群与敏感品系采集地区不同,经实验室饲养后不同品系的Ⅲ龄末Ⅳ龄初幼蚊的个体大小亦不相同,这可能是导致结论不同的原因之一。
综上所述,笔者提出以下防制建议:(1)采取合理的综合防治措施,强化当地环境卫生设施配置,广泛动员群众清除蚊虫孳生地,加强物理防治,推广生物防治,选用高效生物杀虫剂或尝试将其与化学杀虫剂复配使用,以获得良好增效作用[17]。(2)贵州省铜仁市应尽量暂停或限制使用氯菊酯及溴氰菊酯等拟除虫菊酯类杀虫剂单剂,优先采用敏感或低抗药剂,并通过交替使用不同作用机制杀虫剂的方式延缓蚊虫抗药性的产生及发展。(3)建议当地每1~2年开展一次白纹伊蚊抗药性监测,根据抗药性水平变化趋势合理制定杀虫剂使用计划,对用药种类及时作出调整。加强当地化学杀虫剂应用技术培训,为杀虫剂的科学施用提供指导。
利益冲突 无
| [1] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. DOI:10.3969/j.issn.1005-0507.2019.03.009 |
| [2] |
张海林. 新发和再肆虐虫媒病毒病是当前面临的重要公共卫生问题[J]. 中国媒介生物学及控制杂志, 2011, 22(2): 101-102, 120. Zhang HL. A public health problem on emerging and re-emerging arboviral diseases[J]. Chin J Vector Biol Control, 2011, 22(2): 101-102, 120. |
| [3] |
Smith LB, Kasai S, Scott JG. Pyrethroid resistance in Aedes aegypti and Ae. albopictus: Important mosquito vectors of human diseases[J]. Pestic Biochem Physiol, 2016, 133: 1-12. |
| [4] |
曾杜娟. 深圳市坪山区白纹伊蚊密度与气象因素关系及其抗药机制研究[D]. 广州: 广东药科大学, 2020. DOI: 10.27690/d.cnki.ggdyk.2020.000114. Zeng DJ. Relationship between Aedes albopictus density and meteorological factors and its insecitide resistance mechanism in Pingshan district, Shenzhen[D]. Guangzhou: Guangdong Pharmaceutical University, 2020. DOI: 10.27690/d.cnki.ggdyk.2020.000114.(inChinese) |
| [5] |
中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 26347-2010蚊虫抗药性检测方法生物测定法[S]. 北京: 中国标准出版社, 2011. Ministry of Health of the People's Republic of China, Standardization Administration of China. GB/T 26347-2010 Test methods of mosquito resistance to insecticides-Bioassay methods[S]. Beijing: Standards Press of China, 2011. (in Chinese) |
| [6] |
韦凌娅, 孔庆鑫, 王慧敏, 等. 杭州市2017年登革热疫情应急控制前后白纹伊蚊抗药性调查[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 678-681. Wei LY, Kong QX, Wang HM, et al. Comparison of insecticide resistance of Aedes albopictus before and after emergency control of dengue fever in Hangzhou, China, 2017[J]. Chin J Vector Biol Control, 2019, 30(6): 678-681. DOI:10.11853/j.issn.1003.8280.2019.06.020 |
| [7] |
李袁飒. 白纹伊蚊种群杀虫剂代谢酶活性及与抗药性的关系[D]. 北京: 中国疾病预防控制中心, 2013. Li YS. The metabolic enzyme activity to insecticide of Aedes albopictus and the relationship with insecticide resistance [D]. Beijing: Chinese Center for Disease Control and Prevention, 2013. (in Chinese) |
| [8] |
Zhang K, Zhang W, Zhang S, et al. Susceptibility of Sogatella furcifera and Laodelphax striatellus (Hemiptera: Delphacidae) to six insecticides in China[J]. J Econ Entomol, 2014, 107(5): 1916-1922. DOI:10.1603/EC14156 |
| [9] |
World Health Organization. "Insecticide resistance in mosquito vectors of disease", Report of a regional working group meeting Salatiga (Indonesia)[R]. New Delhi: World Health Organization, 1997: 6.
|
| [10] |
赵春春. 我国白纹伊蚊抗药性及kdr基因分布研究[D]. 北京: 中国疾病预防控制中心, 2019. Zhao CC. Study on insectcides resistance and kdr gene distribution of Aedes albopictus in China [D]. Beijing: Chinese Center for Disease Control and Prevention, 2019. (in Chinese) |
| [11] |
梁文琴, 林懿, 黎红, 等. 贵阳市白纹伊蚊对常用杀虫剂的抗性研究[J]. 中华卫生杀虫药械, 2018, 24(4): 348-351. Liang WQ, Lin Y, Li H, et al. Resistance of Aedes albopictus to commonly used insecticides in Guiyang city of China[J]. Chin J Hyg Insect Equip, 2018, 24(4): 348-351. DOI:10.19821/j.1671-2781.2018.04.009 |
| [12] |
王丹, 史鹏, 赵文平, 等. 贵州省兴义及赤水市白纹伊蚊抗药性监测分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 302-306. Wang D, Shi P, Zhao WP, et al. Monitoring and analysis of insecticide resistance of Aedes albopictus in Xingyi and Chishui cities of Guizhou province, China[J]. Chin J Vector Biol Control, 2021, 32(3): 302-306. DOI:10.11853/j.issn.1003.8280.2021.03.009 |
| [13] |
郑建忠, 李华民, 高燕, 等. 咸宁市致倦库蚊季节消长及其对3种杀虫剂的抗性调查[J]. 中华卫生杀虫药械, 2017, 23(5): 433-435. Zheng JZ, Li HM, Gao Y, et al. Population dynamics and resistance of Culex pipiens quinquefasciatus to three insecticides in Xianning city[J]. Chin J Hyg Insect Equip, 2017, 23(5): 433-435. DOI:10.19821/j.1671-2781.2017.05.010 |
| [14] |
马敏, 马晓, 徐明, 等. 浙江省宁波地区登革热疫情前后白纹伊蚊抗药性调查[J]. 疾病监测, 2021, 36(9): 906-909. Ma M, Ma X, Xu M, et al. Comparison of insecticide resistance of Aedes albopictus before and after dengue fever epidemic in Ningbo, Zhejiang[J]. Dis Surveill, 2021, 36(9): 906-909. DOI:10.3784/jbjc.202105310287 |
| [15] |
高景鹏. 我国白纹伊蚊对拟除虫菊酯类杀虫剂的敏感性检测与抗性机制研究[D]. 上海: 中国人民解放军海军军医大学, 2018. Gao JP. Susceptiblity detection and resistance mechanism of Aedes albopictus (Diptera: Culicidae) to pyrethroid insecticides in China [D]. Shanghai: Naval Medical University, 2018. (in Chinese) |
| [16] |
陈翰明, 高景鹏, 石华, 等. 代谢解毒酶活性变化和击倒抗性基因突变在白纹伊蚊菊酯类杀虫剂抗性产生中的作用[J]. 第二军医大学学报, 2019, 40(5): 512-519. Chen HM, Gao JP, Shi H, et al. Role of metabolic detoxification enzyme activity and knockdown resistance gene mutations in resistance of Aedes albopictus to pyrethroid insecticides[J]. Acad J Second Mil Med Univ, 2019, 40(5): 512-519. DOI:10.16781/j.0258-879x.2019.05.0512 |
| [17] |
宋晓, 程鹏, 王海防, 等. 淡色库蚊对苏云金杆菌及化学杀虫剂的抗性研究[J]. 中华卫生杀虫药械, 2019, 25(1): 13-16. Song X, Cheng P, Wang HF, et al. Resistance of Culex pipiens pallens to Bacillus thuringiensis and chemical insecticides[J]. Chin J Hyg Insect Equip, 2019, 25(1): 13-16. DOI:10.19821/j.1671-2781.2019.01.004 |
 2022, Vol. 33
2022, Vol. 33


