扩展功能
文章信息
- 关晴晴, 戴雨琪, 覃盛锋, 钱坤
- GUAN Qing-qing, DAI Yu-qi, QIN Sheng-feng, QIAN Kun
- 淡色库蚊精氨酸激酶基因CpAK1和CpAK2对逆境胁迫的响应
- Responses of arginine kinase genes CpAK1 and CpAK2 in Culex pipiens pallens to adversity stresses
- 中国媒介生物学及控制杂志, 2022, 33(6): 781-786
- Chin J Vector Biol & Control, 2022, 33(6): 781-786
- 10.11853/j.issn.1003.8280.2022.06.003
-
文章历史
- 收稿日期: 2022-06-30
精氨酸激酶(arginine kinase,AK),是一类在生物体内催化三磷酸腺苷(ATP)转移高能磷酸键的磷酸原激酶,广泛存在无脊椎动物、原生动物和细菌中[1-6],能够参与精氨酸和ATP的可逆反应,产生MgADP和磷酸精氨酸,从而在能量代谢和储存有着重要作用[7]。AK是昆虫体内唯一有效的磷酸原激酶,不仅在能量代谢、免疫调节上扮演重要的角色,而且在逆境胁迫中发挥作用,已逐渐成为害虫防治的新型高选择性潜在靶标[8]。温度是昆虫正常生长发育环境的重要因子,已有较多关于温度胁迫下AK的响应研究。在逆境胁迫下褐飞虱(Nilaparvata lugens)AK功能研究中,与未沉默AK的对照组相比,沉默AK组的褐飞虱成虫高温下显著加快了死亡速率[9]。不同温度处理黄野螟(Heortia vitessoides)4龄幼虫,发现高、低温均会使黄野螟AK基因HvAK表达量上调,在4 ℃温度下HvAK的表达上调16.63倍[10]。通过高低温度、吡丙醚、百草枯、过氧化氢、维生素C、氯化镉、辛硫磷等处理中华蜜蜂(Apes cerana),发现均会使中华蜜蜂AK基因AccAK的反转录水平显著提高[11]。在西花蓟马(Frankliniella occidentali)和二化螟(Chilo suppressalis)研究中发现,经高温、低温处理后,2种AK mRNA水平均上调[12]。以上结果表明在昆虫生存的不利条件下,通过调节AK的表达可以缓解逆境胁迫下的应激能量需求。对于蚊虫来说,温度和湿度是关键的环境因子,有研究表明温度、降雨量和相对湿度是影响蚊虫密度的主要气候因素[13]。越冬是蚊虫应对气候变化产生的一种生理适应现象,吴治明和褚宏亮[14]在对江苏省城市环境蚊虫越冬状况调查中发现,淡色库蚊(Culex pipiens pallens)的成蚊可在平均温度为9.71 ℃,平均湿度为65.90%的场所越冬。为了明确AK是否参与蚊虫对温度和湿度逆境的适应,比较2种AK对逆境胁迫的响应特性,本文通过模拟淡色库蚊生存环境中温度和湿度的逆境胁迫,通过实时荧光定量PCR(RT-qPCR)和蛋白免疫印迹法(Western blot)检测2种AK基因CpAK1和CpAK2的mRNA和蛋白水平,比较CpAK1和CpAK2对逆境胁迫的响应,为进一步了解2种AK的功能以及蚊虫对逆境胁迫的适应机制奠定基础。
1 材料与方法 1.1 供试虫源淡色库蚊品系引自江苏省疾病预防控制中心,扬州大学园艺与植物保护学院养虫室连续多代饲养,饲养条件:温度(27±2)℃、湿度(70±5)%、光周期12 h∶12 h,幼虫期饲喂全营养鼠粮,成虫期饲喂5%~10%蔗糖溶液,用小白鼠给血繁殖。
1.2 主要试剂和仪器 1.2.1 主要试剂HiScript® Ⅱ Q RT SuperMix for qPCR(+gDNA wiper)试剂、ChamQ Universal SYBR qPCR Master Mix购于诺唯赞生物公司,Tissue Protein Extraction Kit试剂盒购于康为世纪公司,10%TGX FastCast Acrylamide Kit、过硫酸氨(APS)、HRP-coupled secondary anti-rabbit、anti-mouse antibodies、Tanon™ High-sig ECL Western Blotting Kit、TRIZol® reagent,75%乙醇溶液、三氯甲烷、异丙醇、RNase-free ddH2O。
一抗(2种AK抗体):分别以CpAK1的C端CIYDISNKRRMGLTE氨基酸序列和CpAK2的C端MASREAFRKYLEGAC氨基酸序列,合成肽段作为抗原注射进兔体内进行多克隆抗体制备,相关制备过程由金斯瑞生物科技公司完成。
二抗:Goat Anti-rabbit IgG/HRP antibody,购于索莱宝生物公司。
1.2.2 主要仪器ChemiDoc™ Touch Imaging System、CFX96™ real-time PCR Systems、PCR扩增仪Mastercycler nexus GX2、5424R高速冷冻离心机、微量移液器、DYY-6C型电泳仪、DYCP-31CN电泳槽、捷达凝胶成像系统、RXZ型智能人工气候箱。
1.3 实验方法 1.3.1 逆境胁迫处理 1.3.1.1 胁迫处理温度、湿度的确定依据李菊林等[15]2017年的研究,选取0~5和35~40 ℃进行预实验,发现超过38 ℃和低于4 ℃的处理蚊虫死亡率较高,确定38和4 ℃为胁迫处理温度。选取相对湿度10%、20%和30%进行预实验,发现低于20%的处理死亡率较高,确定相对湿度20%和人工气候箱能设置的最高湿度100%为胁迫处理湿度。
1.3.1.2 不同温度胁迫处理收集羽化3 d后雌性淡色库蚊于干净蚊笼中,实验组置于温度38 ℃恒温气候箱和4 ℃冷藏柜中,保持其他饲养条件不变,同时以正常饲养条件下雌成蚊作为对照组。分别在1、2、6和12 h时收样,每个时间段的处理组设置3个重复,每个重复10只淡色库蚊。
1.3.1.3 不同湿度胁迫处理收集羽化3 d后雌性淡色库蚊于干净蚊笼中,置于恒温气候箱中,设置温度25 ℃,相对湿度20%或100%,在1、2、6和12 h时收集样品,同时设立正常饲养条件下雌性成蚊为对照组,每个时间段的处理组设置3个重复,每个重复10只淡色库蚊。
1.3.2 RNA的提取和第一链cDNA合成采用Trizol法对淡色库蚊样品进行RNA提取,将获得的RNA保存于-80 ℃超低温冰箱备用。参照cDNA合成试剂盒(TransScript®Ⅱ One-Step gDNA Removal and cDNA Synthesis SuperMix)步骤,合成qPCR备用的第一链cDNA模板,保存于-20 ℃。
1.3.3 实时荧光定量PCR根据已获得CpAK1(MZ491206)和CpAK2(MZ491207)基因序列设计特异性荧光定量引物,以淡色库蚊的肌动蛋白β-actin基因作为内参基因,合成特异性引物见表 1。
荧光定量10 μl的反应体系:2×SYBR Premix ExTaq Ⅰ 5 μl、正反向引物各0.4 μl、cDNA 1 μl、ddH2O 3.2 μl。将配置好的溶液,短暂离心混匀。使用CFX96™荧光定量PCR仪(Bio-Rad),反应步骤如下:95 ℃预变性30 s;95 ℃变性5 s,58 ℃退火30 s,65 ℃延伸5 s,循环20次。扩增反应的特异性可以通过熔解曲线分析检测。
1.3.4 组织蛋白提取使用Tissue Protein Extraction Kit试剂盒提取蛋白。实验前取出Tissue Protein Extraction Reagent进行预冷,主要步骤如下:①收集每个时间段逆境处理的淡色库蚊,随后立即进行虫体蛋白提取;②配制1×工作液,取适量预冷的Tissue Protein Extraction Reagent,抽提蛋白2~3 min,按照1∶99比例加入Protease Inhibitor Cocktail;③根据0.1 g组织加入1 ml 1×工作液的比例加入足量工作液,转移至灭菌后匀浆器中,在冰上匀浆处理,随后冰上孵育20 min;④10 000×g离心20 min,转移上清液至新的离心管中,使用BCA试剂盒,进行蛋白浓度测定,稀释同浓度蛋白进行蛋白活性测定。
1.3.5 蛋白印迹法测定按照10% TGX FastCast Acrylamide Kit(Bio-Rad)说明书制蛋白胶;将提取的蛋白沸水中煮沸变性10 min,随后蛋白上样,进行聚丙烯酰胺凝胶电泳(SDS-PAGE);随后在冰上将蛋白胶置于转膜装置,定流200 mA,90 min;用蒸馏水洗涤聚偏二氟乙烯(PVDF)膜,将PVDF膜放于5%脱脂牛奶封闭60 min;一抗孵育,置于摇床(60 r/min)室温下1 h或过夜;回收一抗,多次洗涤PVDF膜,二抗孵育,置于摇床(60 r/min)室温下,使用ECL(enhanced chemiluminescence)化学发光底物试剂盒,配置显色液,滴在PVDF膜上,5 min后观察并拍照。
1.4 统计学分析所有数据均以平均值±标准误表示,使用SPSS 13.0软件进行数据分析,采用One-Way方差分析,并用LSD检验对差异性进行分析,P < 0.05表示差异有统计学意义。
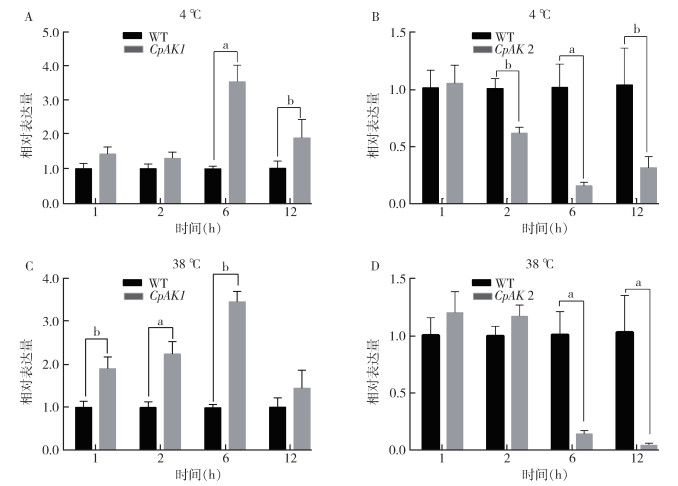
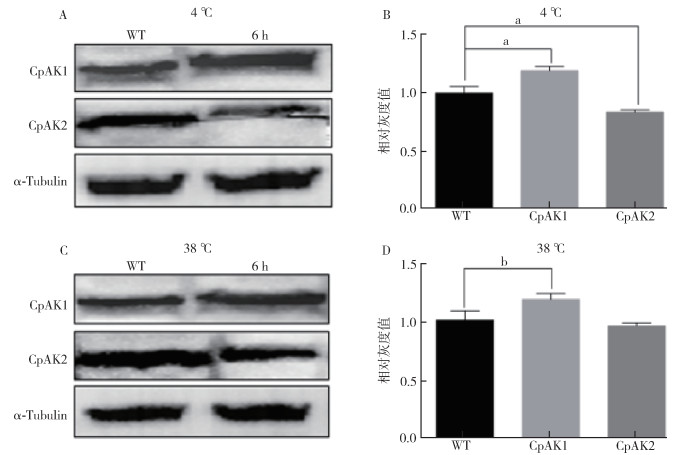
2 结果 2.1 CpAK1和CpAK2对不同温度胁迫的响应在4 ℃胁迫下CpAK1的mRNA水平在低温处理1、2 h时无显著变化,在6 h出现极显著增加,为对照组(Wild type,WT)的3.53倍(图 1A)。而CpAK2的mRNA水平在4 ℃胁迫下整体呈现显著下降,在6 h时达到最低值,下调至15.19%(图 1B)。进一步对2种AK的蛋白水平验证,在4 ℃胁迫6 h时CpAK1的蛋白水平显著增加,而CpAK2的蛋白水平显著下调(图 2A、B),与mRNA的水平一致。
|
| 注:A 4 ℃时CpAK1的相对表达量;B 4 ℃时CpAK2的相对表达量;C 38 ℃时CpAK1的相对表达量;D 38 ℃时CpAK2的相对表达量;所有数据均为平均值±标准误;a表示P < 0.01;b表示P < 0.05;WT为对照组(Wild type)。 图 1 不同温度诱导淡色库蚊精氨酸激酶的mRNA水平 Figure 1 mRNA levels of CpAK1 and CpAK2 induced by different temperatures |
| |
|
| 注:A 4 ℃时CpAK1和CpAK2蛋白水平;B 4 ℃时CpAK1和CpAK2蛋白对应的灰度值;C 38 ℃时CpAK1和CpAK2蛋白水平;D 38 ℃时CpAK1和CpAK2蛋白对应的灰度值;所有数据均为平均值±标准误;a表示P < 0.01;b表示P < 0.05;WT为对照组(Wild type)。 图 2 不同温度诱导6 h淡色库蚊精氨酸激酶的蛋白水平 Figure 2 Protein levels of CpAK1 and CpAK2 induced by different temperatures for 6 h |
| |
在38 ℃胁迫下CpAK1的mRNA水平显著提高,且在胁迫6 h内呈现持续上升的趋势,6 h达到峰值,是对照组的3.46倍,在12 h时表达水平出现下降趋势(图 1C)。而CpAK2在逆境胁迫1、2 h时mRNA表达无明显变化,在6、12 h出现极显著的下降(图 1D)。进一步对蛋白水平分析,在不同温度胁迫下6 h提取蛋白,与对照组相比,CpAK1蛋白水平显著上调,而CpAK2的蛋白水平略有下降(图 2C、D)。
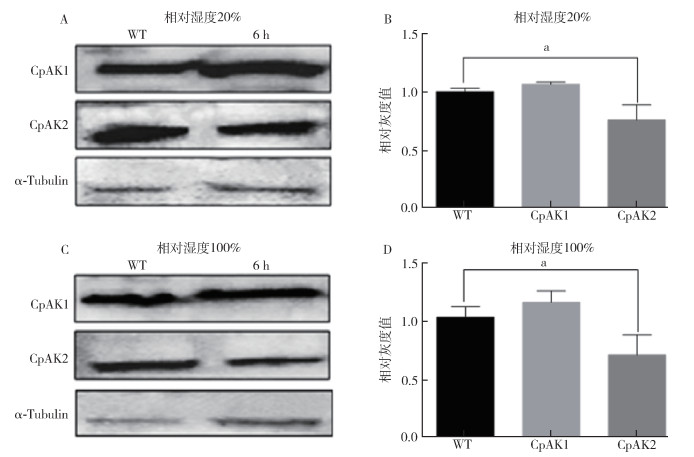
2.2 CpAK1和CpAK2对不同相对湿度胁迫的响应在相对湿度20%下处理淡色库蚊,检测CpAK1和CpAK2的mRNA及蛋白水平。发现相对湿度20%的条件下1~2 h内CpAK1的转录水平无显著变化,随后在6 h转录水平显著上调4.30倍,12 h降低到与对照组相同的转录水平(图 3A)。而CpAK2的mRNA水平在1~2 h无明显变化,在6 h后反转录水平出现下降,在12 h反转录水平显著下降至45.45%(图 3B)。对低湿胁迫6 h的淡色库蚊进行蛋白水平的检测,与对照相比CpAK1蛋白水平略有增加,而CpAK2蛋白水平显著下调(图 4A、4B)。

|
| 注:A相对湿度20%时CpAK1的相对表达量;B相对湿度20%时CpAK2的相对表达量;C相对湿度100%时CpAK1的相对表达量;D相对湿度100%时CpAK2的相对表达量;所有数据均为平均值±标准误;a表示P < 0.01;b表示P < 0.05;WT为对照组(Wild type)。 图 3 不同湿度诱导淡色库蚊精氨酸激酶的mRNA水平 Figure 3 mRNA levels of CpAK1 and CpAK2 induced by different humidities |
| |
|
| 注:A相对湿度20%时CpAK1和CpAK2蛋白水平;B相对湿度20%时蛋白表达对应的灰度值;C相对湿度100%时CpAK1和CpAK2蛋白水平;D相对湿度100%时蛋白表达对应的灰度值;所有数据均为平均值±标准误;a表示P < 0.05;WT为对照组(Wild type)。 图 4 不同湿度诱导6 h淡色库蚊精氨酸激酶的蛋白水平 Figure 4 Protein levels of CpAK1 and CpAK2 induced by different humidities for 6 h |
| |
在相对湿度100%环境下测定CpAK1和CpAK2的mRNA及蛋白表达水平,结果表明,淡色库蚊CpAK1的mRNA表达水平在12 h内先增后降,但是与对照相比变化不显著(图 3C)。而淡色库蚊CpAK2的mRNA水平总体是下降的,在相对湿度100%处理1和12 h出现极显著下降(图 3D)。在蛋白水平方面,相对湿度100%胁迫6 h时CpAK1的蛋白水平无显著变化(图 4A、4B),而CpAK2的蛋白水平显著下调,结果与反转录水平一致(图 4C、4D)。
3 讨论维持能量代谢的平衡对生命体至关重要,AK通过催化精氨酸与ATP之间的可逆反应,将能量储存于磷酸精氨酸的高能磷酸键中或将磷酸精氨酸分解产生ATP,生物体应激条件下能通过上调AK的表达,来响应应急条件下的能量需求。关于AK对逆境胁迫的响应,在很多物种上都有报道。盐浓度对水产养殖有重要影响,通过改变养殖环境的盐浓度检测AK表达变化,发现日本沼虾(Macrobrachium nipponense)、斑节对虾(Penaeus monodon)和日本大眼蟹(M. japonicus)低盐胁迫均会使AK表达水平上升[16-18]。日本囊对虾(M. japonicus)经过4 h的缺氧处理,发现只有在肌肉中ATP水平略微下降,而其体内的磷酸精氨酸含量显著下降,这些数据表明ATP水平可以有效地缓冲磷酸精氨酸体系,AK可促使生成ATP以快速抵抗缺氧胁迫[19]。脊尾白虾(Exopalaemon carinicauda)研究中,用副溶血性弧菌或嗜水气单胞菌侵染脊尾白虾,检测到肌肉中AK表达水平上调,且均在24 h显著上调,120 h恢复对照组水平[20]。过氧化氢胁迫处理克氏锥虫(Trypanosoma cruzi),AK基因表达量显著上升,高水平表达的AK组较对照组有更强的生存能力[21]。以上研究均表明AK在逆境胁迫下,能够提高表达水平维持应激需能,增强对不良生存环境的适应能力,从而延长生命活动。
蚊虫的生命活动受气候因素的影响较大,温度和湿度是影响蚊虫发育和繁殖的主要气象因素[22]。蚊虫对温度和湿度耐受力的高低是蚊虫种群生存和发展的重要前提。近年来研究发现在冬季气温和湿度相对较低时,蚊虫依然能够正常活动[14]。AK作为ATP缓冲系统中的重要成员,在能量代谢中起着关键作用[7]。本文在不同温度和湿度胁迫下检测淡色库蚊AK的表达,发现在38和4 ℃胁迫时CpAK1的mRNA和蛋白水平上调,而CpAK2的mRNA和蛋白水平均下调。在相对湿度100%胁迫下CpAK1的表达未发生显著变化,分析原因可能是淡色库蚊的正常饲养条件湿度达到75%,100%的相对湿度对蚊虫来说属于适宜的湿度,不造成胁迫。本研究结果表明在淡色库蚊应对温度和湿度的逆境时,CpAK1的响应为表达上调,而CpAK2的响应为表达下调,推测两者均参与了逆境胁迫响应,但功能不同,具体的功能要进行进一步的研究。
利益冲突 无
| [1] |
Andrews LD, Graham J, Snider MJ, et al. Characterization of a novel bacterial arginine kinase from Desulfotalea psychrophila[J]. Comp Biochem Physiol B Biochem Mol Biol, 2008, 150(3): 312-319. DOI:10.1016/j.cbpb.2008.03.017 |
| [2] |
Conejo M, Bertin M, Pomponi SA, et al. The early evolution of the phosphagen kinases-insights from choanoflagellate and poriferan arginine kinases[J]. J Mol Evol, 2008, 66(1): 11-20. DOI:10.1007/s00239-007-9058-0 |
| [3] |
Pereira CA. Arginine kinase: A potential pharmacological target in trypanosomiasis[J]. Infect Disord Drug Targets, 2014, 14(1): 30-36. DOI:10.2174/1871526514666140713144103 |
| [4] |
Suzuki T, Soga S, Inoue M, et al. Characterization and origin of bacterial arginine kinases[J]. Int J Biol Macromol, 2013, 57: 273-277. DOI:10.1016/j.ijbiomac.2013.02.023 |
| [5] |
Suzuki T, Uda K, Adachi M, et al. Evolution of the diverse array of phosphagen systems present in annelids[J]. Comp Biochem Physiol B Biochem Mol Biol, 2009, 152(1): 60-66. DOI:10.1016/j.cbpb.2008.09.087 |
| [6] |
Uda K, Fujimoto N, Akiyama Y, et al. Evolution of the arginine kinase gene family[J]. Comp Biochem Physiol D Genomics Proteomics, 2006, 1(2): 209-218. DOI:10.1016/j.cbd.2005.10.007 |
| [7] |
Ellington WR. Evolution and physiological roles of phosphagen systems[J]. Annu Rev Physiol, 2001, 63: 289-325. DOI:10.1146/annurev.physiol.63.1.289 |
| [8] |
张楠, 徐贝贝, 王建军. 精氨酸激酶基因研究进展[J]. 环境昆虫学报, 2017, 39(3): 730-734. Zhang N, Xu BB, Wang JJ. Advances in arginine kinase gene[J]. J Environ Entomol, 2017, 39(3): 730-734. |
| [9] |
Ge LQ, Huang LJ, Yang GQ, et al. Molecular basis for insecticide-enhanced thermotolerance in the brown planthopper Nilaparvata lugens Stål (Hemiptera: Delphacidae)[J]. Mol Ecol, 2013, 22(22): 5624-5634. DOI:10.1111/mec.12502 |
| [10] |
王春燕, 吕子豪, 林同. 黄野螟精氨酸激酶基因的鉴定与表达分析[J]. 华中农业大学学报, 2019, 38(3): 39-46. Wang CY, Lyu ZH, Lin T. Identification and expression analysis of arginine kinase gene in Heortia vitessoides[J]. J Huazhong Agric Univ, 2019, 38(3): 39-46. DOI:10.13300/j.cnki.hnlkxb.2019.03.007 |
| [11] |
Chen XB, Yao PB, Chu XQ, et al. Isolation of arginine kinase from Apis cerana cerana and its possible involvement in response to adverse stress[J]. Cell Stress Chaperon, 2015, 20(1): 169-183. DOI:10.1007/s12192-014-0535-2 |
| [12] |
董帆. 二化螟和西花蓟马精氨酸激酶基因的表达分析与RNA干扰研究[D]. 扬州: 扬州大学, 2020. Dong F. Expression analysis and RNA interference of arginine kinase genes in Chilo suppressalis and Frankliniella occidentalis[D]. Yangzhou: Yangzhou University, 2020. (in Chinese) |
| [13] |
刘美德, 姜江, 佟颖, 等. 北京市居民区中蚊虫密度与气象因素关系的研究[J]. 寄生虫与医学昆虫学报, 2021, 28(2): 76-84. Liu MD, Jiang J, Tong Y, et al. Relationship of meteorological factors to mosquito density in residential areas of Beijing[J]. Acta Parasitol Med Entomol Sin, 2021, 28(2): 76-84. DOI:10.3969/j.issn.1005-0507.2021.02.003 |
| [14] |
吴治明, 褚宏亮. 江苏省城市环境中蚊虫越冬状况调查研究[J]. 中国媒介生物学及控制杂志, 2022, 33(1): 83-88. Wu ZM, Chu HL. An investigation of mosquito overwintering in urban environment of Jiangsu province, China[J]. Chin J Vector Biol Control, 2022, 33(1): 83-88. DOI:10.11853/j.issn.1003.8280.2022.01.015 |
| [15] |
李菊林, 朱国鼎, 周华云, 等. 淡色库蚊在不同温度下发育情况观察[J]. 中国媒介生物学及控制杂志, 2017, 28(1): 35-37. Li JL, Zhu GD, Zhou HY, et al. Effect of temperature on the development of Culex pipiens pallens[J]. Chin J Vector Biol Control, 2017, 28(1): 35-37. DOI:10.11853/j.issn.1003.8280.2017.01.010 |
| [16] |
Nikapitiya C, Kim WS, Park K, et al. Identification of potential markers and sensitive tissues for low or high salinity stress in an intertidal mud crab (Macrophthalmus japonicus)[J]. Fish Shellfish Immunol, 2014, 41(2): 407-416. DOI:10.1016/j.fsi.2014.09.018 |
| [17] |
Yang ZJ, Huang XT, Liao H, et al. Structure and functional analysis reveal an important regulated role of arginine kinase in Patinopecten yessoensis under low pH stress[J]. Aquat Toxicol, 2020, 222: 105452. DOI:10.1016/j.aquatox.2020 |
| [18] |
Shekhar MS, Kiruthika J, Ponniah AG. Identification and expression analysis of differentially expressed genes from shrimp (Penaeus monodon) in response to low salinity stress[J]. Fish Shellfish Immunol, 2013, 35(6): 1957-1968. DOI:10.1016/j.fsi.2013.09.038 |
| [19] |
Abe H, Hirai S, Okada S. Metabolic responses and arginine kinase expression under hypoxic stress of the kuruma prawn Marsupenaeus japonicus[J]. Comp Biochem Physiol A Mol Integr Physiol, 2007, 146(1): 40-46. DOI:10.1016/j.cbpa.2006.08.027 |
| [20] |
Wu ZX, Liu YJ, Zheng JQ, et al. Genomic structure, expression and functional characterization of arginine kinase (EcAK) from Exopalaemon carinicauda[J]. Fish Shellfish Immunol, 2021, 109: 82-86. DOI:10.1016/j.fsi.2020.12.009 |
| [21] |
Miranda MR, Canepa GE, Bouvier LA, et al. Trypanosoma cruzi: Oxidative stress induces arginine kinase expression[J]. Exp Parasitol, 2006, 114(4): 341-344. DOI:10.1016/j.exppara.2006.04.004 |
| [22] |
仲洁, 何隆华. 气象因素对蚊虫密度影响研究进展[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 95-99. Zhong J, He LH. Advances in research on impacts of meteorological factors on mosquito density[J]. Chin J Vector Biol Control, 2015, 26(1): 95-99. DOI:10.11853/j.issn.1003.4692.2015.01.028 |
 2022, Vol. 33
2022, Vol. 33



