扩展功能
文章信息
- 陈旭辉, 谭启龙, 舒纪为, 叶凌, 李世波, 王秋景
- CHEN Xu-hui, TAN Qi-long, SHU Ji-wei, YE Ling, LI Shi-bo, WANG Qiu-jing
- 浙江省岱山县一起肾综合征出血热疫情汉坦病毒分子流行病学分析
- Molecular epidemiological analysis of Hantavirus in an outbreak of hemorrhagic fever with renal syndrome in Daishan county, Zhejiang province, China
- 中国媒介生物学及控制杂志, 2022, 33(5): 706-709
- Chin J Vector Biol & Control, 2022, 33(5): 706-709
- 10.11853/j.issn.1003.8280.2022.05.017
-
文章历史
- 收稿日期: 2022-05-19
2 岱山县疾病预防控制中心传染病预防与控制科, 浙江 舟山 316200;
3 温州医科大学附属舟山医院感染科, 浙江 舟山 316000
2 Department of Infectious Disease Control and Prevention, Daishan Center for Disease Control and Prevention, Zhoushan, Zhejiang 316200, China;
3 Department of Infectious Disease, Zhoushan Hospital, Wenzhou Medical University, Zhoushan, Zhejiang 316000, China
肾综合征出血热(hemorrhagic fever with renalsyndrome,HFRS)主要流行于亚洲和欧洲,中国严重受其影响,占全世界HFRS报告病例总数的90%以上[1]。该病由汉坦病毒科正汉坦病毒属中多种血清型汉坦病毒(HV)引起[2],传染源是汉坦病毒的宿主动物,主要为鼠类啮齿动物,可通过多种途径传播[3-4]。我国流行的汉坦病毒主要有2型,即汉滩型(HTN)和首尔型(SEO)[5]。浙江省舟山市近20年无HFRS病例报告,2020年4-7月辖区内某海岛工业园中连续出现多例HFRS病例,为明确其基因亚型和进化特点,我们对病例和宿主动物标本开展了汉坦病毒病原学检测和分子进化研究。
1 材料与方法 1.1 标本来源病例急性期血清标本全部来自2020年4-7月该工业园发现的4例HFRS确诊病例,血液标本采集、标本的用途等事项均已告知并得到患者同意。宿主动物标本来自病例生活区附近所捕获的42只鼠,采集其鼠血清。
1.2 主要试剂汉坦病毒抗体检测试剂盒(胶体金法)购于厦门波生生物技术有限公司;HFRS汉坦病毒Ⅰ、Ⅱ分型核酸测定试剂盒(荧光PCR法)购于上海之江科技有限公司;一步法反转录聚合酶链式反应(RT-PCR)试剂盒(RR055A)、PCR试剂盒(RR902A)均购自宝生物工程(大连)有限公司。
1.3 引物的设计与合成根据中国疾病预防控制中心发布的《全国肾综合征出血热监测方案》中推荐的引物序列进行病毒基因扩增,引物序列见表 1。

|
病例血清标本使用汉坦病毒抗体检测试剂盒(胶体金法)进行汉坦病毒特异性IgM及IgG抗体检测,具体检测方法按照试剂盒说明书进行操作。
1.5 汉坦病毒荧光定量RT-PCR检测按照QIAGEN公司的RNA提取试剂盒对样本提取总RNA,采用HFRS汉坦病毒Ⅰ、Ⅱ分型核酸测定试剂盒(荧光PCR法)进行检测以确定基因型别,荧光定量RT-PCR反应体系及反应条件按试剂盒使用说明书进行,荧光定量PCR仪使用Applied Biosystems QuantStudio 5。
1.6 M片段部分区段的RT-PCR扩增及测序测序靶基因为汉坦病毒SEO M基因(MK360788.1)。采用巢式PCR进行两轮扩增,首轮外套扩增条件[用一步法RT-PCR试剂盒(RR055A)]:50 ℃ 30 min,95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环,第二轮内套扩增条件[用PCR试剂盒(R902A)]:95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30个循环。内套扩增产物经电泳50 min后在成像仪上确定特异性条带浓度达到测序要求后,递交上海迈浦生物科技有限公司进行测序。
1.7 部分M片段的测序及进化树构建序列整理和生物信息学分析将测序中的引物序列去除后,应用DNAStar软件进行序列的拼接、比对和分析。从美国国立生物技术信息中心(NCBI)的GenBank中下载国内外人源和鼠源M基因序列作为参比序列。采用MEGA Ⅹ软件(10.1.8)进行序列间的同源性比较,绘制M基因的遗传进化树。选用贝叶斯信息量(BIC)值最小的Tamura 3-parameter模型来构建,绘制方法采用neighbor-joining(NJ)法。
2 结果 2.1 病例基本情况该工业园位于舟山市岱山县渔山岛,占地20 km2,共有外来务工人员7.6万人,2020年4-7月共报告4例HFRS确诊病例;病例发病早期临床表现不典型,以发热(37.8~38.5 ℃)、乏力为主,急性发作,无明显临床分期;病例均为男性外来务工人员,年龄33~56岁,在工地居住时间超过半年,无HFRS疫苗接种史,分布在3个营地,相距1 km以内,均住简易板房,工作地点在建筑工地;宿舍和食堂无防鼠设施,食品、餐具等物品摆放随意,鼠迹明显。
2.2 血清学检测病例血清标本使用汉坦病毒抗体检测试剂盒同时检测IgM和IgG抗体,HFRS IgM和IgG均为阳性。在病例生活营地布放鼠笼150只,捕获鼠类42只,均为褐家鼠(Rattus norvegicus),鼠密度为28.00%。鼠标本未做抗汉坦病毒抗体检测。
2.3 核酸检测病例1和2血标本检测到汉坦病毒RNA,病例3和4血标本未检测到汉坦病毒RNA。42只鼠血标本中,有4份检测到汉坦病毒RNA。所有核酸提取阳性的标本,进一步分型为首尔型病毒(SEOV)汉坦病毒核酸阳性。
2.4 M基因的测序及进化树构建6份标本汉坦病毒RNA提取物成功扩增并经测序获得了汉坦病毒的M片段部分序列6条。序列已上传GenBank,登录号为MT822296~MT822301。系统进化树表明,本研究中6个M基因片段100%同源,属于汉坦病毒SEOV S3亚型,与汉滩型病毒(HTNV)在进化上为明显独立的2个进化支系。这6个病毒M基因在进化上同河北省分离株Rod/2012/QHD/4/Gc、浙江省瑞安分离株RuianRn180的亲缘关系最近,与国内外其他SEOV同源性为76.5%~98.3%。见图 1。
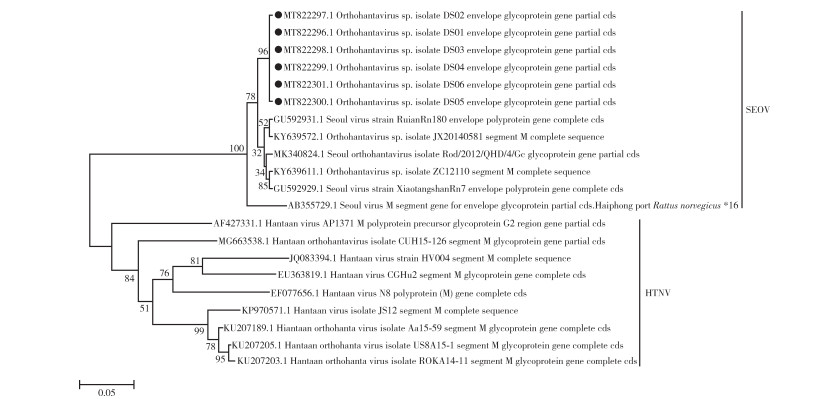
|
| 注:●为本次检测到的病毒序列;SEOV 首尔型病毒;HTNV 汉滩型病毒。 图 1 SEOV部分M基因核苷酸序列系统进化分析 Figure 1 Phylogenetic analysis of nucleotide sequence of M gene fragment of SEOV |
| |
本研究中的HFRS病例均为轻症,发病早期临床表现不典型,以发热、乏力为主,无明显临床分期。4例病例抗体均呈阳性,2例未检测到汉坦病毒RNA,可能由于病毒载量较低,这与湖北省的一起HFRS疫情病原学检测结果相似[6]。研究表明,由于HFRS的病毒血症期一般在病程的前5d,且汉坦病毒核酸在常温条件下极易降解,对储运条件要求较高,单纯采用核酸检测比较容易造成漏检,病例标本核酸检测结果为阴性,IgM抗体为阳性,亦可实验室确诊[7],因此有必要同时辅助于血清学检测。
汉坦病毒基因组L、M、S 3个基因片段分别编码RNA依赖的RNA聚合酶、糖蛋白(GP)Gn和Gc的前体糖蛋白及核衣壳蛋白(NP)。在汉坦病毒3个片段中M片段的重组率较高,可能与M基因编码的糖蛋白承受来自汉坦病毒宿主免疫压力最大有关[8];舟山市近20年无HFRS病例报告,此前汉坦病毒的检测一直停留在免疫检测水平,此次对病例标本开展测序分析,明确基因特征对舟山市该病的防制及临床诊治具有积极意义。因此,为了解目前基因特点和遗传变异情况,本研究利用巢式PCR分型技术及核苷酸测序技术,采用NJ法对6个标本M基因的核苷酸序列构建系统发生树进行病毒基因分型及进化分析,病毒基因序列高度同源,均为SEOV S3亚型,病例与宿主间具有明确的流行病学关联。
汉坦病毒感染存在宿主动物特异性和地区聚集现象,不同型别的病毒对宿主有选择性,HTNV和SEOV分别以黑线姬鼠(Apodemus agrarius)和褐家鼠为主要宿主动物[9],宿主动物的种群构成决定了疫源地的类型[10],此次捕获鼠种均为褐家鼠,这与捕鼠地点均在生活营地以及舟山市优势鼠种为褐家鼠有关[11-12],鼠标本汉坦病毒基因高度同源,显示同一地区相近鼠种携带同一亚型的汉坦病毒,同时表明褐家鼠为该园区HFRS的主要宿主动物,汉坦病毒具有明显的地理聚集现象及对宿主的相对选择性[13]。病例和鼠标本汉坦病毒M基因序列同源性为100%的样本是否为同一病毒株,则需要进行全基因序列的测定才可确定。
作为一种自然疫源性疾病,HFRS的流行与其自然宿主动物密切相关,工业园内鼠密度为28.00%,远高于以往舟山市的鼠密度(2.26%)[11],且褐家鼠十分活跃,工人的活动增加了人与鼠类接触的概率,感染风险也相应增加。当前,岱山县虽已不是HFRS的主要疫区,但是渔山岛鼠密度和汉坦病毒携带率均较高,加之工业园尚在建设中,工人生活环境差,鼠类繁殖栖息条件好,HFRS疫情存在发生风险。因此,建议当地有关部门改善工人居住条件,及时清理生活垃圾改善环境卫生,减少鼠类孳生环境,加大灭鼠力度降低鼠密度,同时做好工人HFRS疫苗的接种工作,预防和控制HFRS的再次发生。
利益冲突 无
| [1] |
梁小洁, 严延生, 张智芳, 等. 肾综合征出血热[J]. 中国人兽共患病学报, 2020, 36(10): 858-863. Liang XJ, Yan YS, Zhang ZF, et al. Hemorrhagic fever with renal syndrome[J]. Chin J Zoonoses, 2020, 36(10): 858-863. DOI:10.3969/j.issn.1002-2694.2020.00.133 |
| [2] |
宋干. 肾综合征出血热流行病学研究与防治[J]. 中国公共卫生, 2004, 20(6): 766-768. Song G. Epidemiology research and prevention and treatment of hemorrhagic fever with renal syndrome[J]. China J Public Health, 2004, 20(6): 766-768. DOI:10.3321/j.issn:1001-0580.2004.06.078 |
| [3] |
Jiang H, Zheng XY, Wang LM, et al. Hantavirus infection: A global zoonotic challenge[J]. Virol Sin, 2017, 32(1): 32-43. DOI:10.1007/s12250-016-3899-x |
| [4] |
Avšič-Županc T, Saksida A, Korva M. Hantavirus infections[J]. Clin Microbiol Infect, 2019, 21: e6-e16. DOI:10.1111/1469-0691.12291 |
| [5] |
中华预防医学会感染性疾病防控分会, 中华医学会感染病学分会. 肾综合征出血热防治专家共识[J]. 中国实用内科杂志, 2021, 41(10): 845-854. Infectious Disease Branch of Chinese Preventive Medicine Association, Society of Infectious Diseases of Chinese Medical Association. Expert consensus on prevention and treatment of hemorrhagic fever with renal syndrome[J]. Chin J Pract Internal Med, 2021, 41(10): 845-854. DOI:10.19538/j.nk2021100106 |
| [6] |
戴莹, 刘力, 胡兵. 一起流行性出血热疫情的病原学检测与分析[J]. 国际检验医学杂志, 2018, 39(14): 1775-1779. Dai Y, Liu L, Hu B. Etiological detection and analysis of an outbreak of epidemic hemorrhagic fever[J]. Int J Lab Med, 2018, 39(14): 1775-1779. DOI:10.3969/j.issn.1673-4130.2018.14.033 |
| [7] |
吴守丽, 严延生, 颜苹苹, 等. 肾综合征出血热抗体快速诊断试剂盒的应用研究[J]. 海峡预防医学杂志, 2009, 15(3): 1-4. Wu SL, Yan YS, Yan PP, et al. Application research on a rapid antibody diagnostic kit for hemorrhagic fever with renal syndrome[J]. Strait J Prev Med, 2009, 15(3): 1-4. |
| [8] |
姚苹苹, 朱函坪, 徐芳, 等. 浙江省丽水地区2株汉坦病毒分离株的型别鉴定和基因差异研究[J]. 中华流行病学杂志, 2009, 30(2): 175-178. Yao PP, Zhu HP, Xu F, et al. Study on the difference of genes and the type identification of hantavirus from Lishui, Zhejiang province[J]. Chin J Epidemiol, 2009, 30(2): 175-178. DOI:10.3760/cma.j.issn.0254-6450.2009.02.019 |
| [9] |
刘菁, 陈阳, 林代华, 等. 福建省2016-2018年肾综合征出血热流行特征和宿主动物监测分析[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 329-333. Liu J, Chen Y, Lin DH, et al. Epidemiological characteristics and host animal monitoring of hemorrhagic fever with renal syndrome in Fujian province, China, 2016-2018[J]. Chin J Vector Biol Control, 2021, 32(3): 329-333. DOI:10.11853/j.issn.1003.8280.2021.03.014 |
| [10] |
罗学辉, 黄邵军, 陈立锋, 等. 余姚市鼠形动物携带汉坦病毒及M基因分析[J]. 预防医学, 2016, 28(8): 789-791, 795. Luo XH, Huang SJ, Chen LF, et al. An investigation on the infection status and genotype of Hantavirus carried by rodents in Yuyao city of Zhejiang province[J]. Prev Med, 2016, 28(8): 789-791, 795. DOI:10.19485/j.cnki.issn1007-0931.2016.08.008 |
| [11] |
陈胜林, 王建跃. 舟山市1985-2000年肾综合征出血热监测资料分析[J]. 预防医学文献信息, 2002, 8(1): 102-103. Chen SL, Wang JY. Analysis of surveillance data of hemorrhagic fever with renal syndrome in Zhoushan from 1985 to 2000[J]. Lit Inf Prev Med, 2002, 8(1): 102-103. DOI:10.3969/j.issn.1672-9153.2002.01.101 |
| [12] |
张连根, 王忠发, 蒋文雅. 舟山港鼠类携带HFV与人群感染情况的调查[J]. 旅行医学科学, 1997, 3(1): 19. Zhang LG, Wang ZF, Jiang WY. The investigation of situation of rats carried HFV and infected population at Zhoushan port area[J]. Sci Travel Med, 1997, 3(1): 19. |
| [13] |
李茂中, 刘家森, 郭东春, 等. 汉坦病毒L基因的分段克隆及原核表达[J]. 中国预防兽医学报, 2012, 34(2): 143-145. Li MZ, Liu JS, Guo DC, et al. Cloning and prokaryotic expression of Hantavirus L gene[J]. Chin J Prev Vet Med, 2012, 34(2): 143-145. |
 2022, Vol. 33
2022, Vol. 33


