扩展功能
文章信息
- 朱剑, 陈光明, 吴鹰花, 廖国栋, 徐汉虹
- ZHU Jian, CHEN Guang-ming, WU Ying-hua, LIAO Guo-dong, XU Han-hong
- 鱼藤酮对德国小蠊肠道微生物的影响
- Effect of rotenone on the gut microbiota of Blattella germanica
- 中国媒介生物学及控制杂志, 2022, 33(5): 677-683
- Chin J Vector Biol & Control, 2022, 33(5): 677-683
- 10.11853/j.issn.1003.8280.2022.05.012
-
文章历史
- 收稿日期: 2022-03-10
2 中山榄菊日化实业有限公司, 广东 中山 528434
2 Zhongshan Lanju Daily Chemical Industry Co., Ltd., Zhongshan, Guangdong 528434, China
德国小蠊(Blattella germanica)是全球范围内广泛分布的重要卫生害虫,同时也是多种有害寄生虫、病毒和细菌的载体[1],其体表分泌物可引起人类严重的过敏反应[2]。化学杀虫剂长期大量应用已经使该虫对多种杀虫剂产生了严重抗性[3],亟需开发更为有效环保的药剂。
植物源杀虫剂具有资源丰富、成本低、易降解、毒副作用小、对人兽安全等优点,具有巨大发展潜力。在卫生害虫防治中,其开发和研究显得尤为重要[4]。其中鱼藤酮、印楝素和精油等已经被证实在德国小蠊防治中具有一定应用前景[5]。
鱼藤酮对许多害虫有较好的防治效果,与化学农药相比,其在环境中更易降解,是一种优异的广谱植物源杀虫剂[6]。有报道显示鱼藤酮对德国小蠊兼具胃毒和触杀活性[7],但其胃毒活性较低[8]。研究表明,昆虫肠道微生物介导了宿主对植物毒素的解毒功能[9]。Adams等[10]从山松大小蠹(Dendroctonus ponderosae)肠道中分离的细菌表现出萜烯降解活性,与其他食草动物相比,在山松大小蠹肠道宏基因组中编码萜烯降解酶的细菌基因丰度更高。甘蓝根蝇(Delia radicum)的肠道微生物表现出降解异硫氰酸酯的活性,并且对应的降解酶已经被鉴定[11]。上述研究都表明昆虫肠道微生物在增强宿主抵御植物毒素方面发挥着重要作用。虽然有研究表明鱼藤酮会干扰动物肠道中的微生物稳态[12-13],但关于鱼藤酮与昆虫肠道微生物之间相互作用的报道很少。
为探明肠道微生物在抵御植物源农药中发挥的作用,本研究首先检测了清除肠道微生物后鱼藤酮对德国小蠊的杀虫活性。在此基础上通过16S rRNA测序分析了鱼藤酮处理德国小蠊后其肠道微生物群落结构的变化情况,明确鱼藤酮对德国小蠊肠道微生物群落结构的影响,以期为植物源农药的应用提供新的策略。
1 材料与方法 1.1 供试昆虫本研究试虫为在实验室长期饲养的室内种群。德国小蠊在40 cm×30 cm×30 cm的玻璃缸中饲养,在玻璃缸的上沿涂抹一层5 cm宽的凡士林与石蜡油等质量混合的防护带,防止其逃离。德国小蠊整个生育周期用小鼠饲料饲喂,及时补充双蒸水。饲养条件为温度(26±1)℃、相对湿度(70±10)%。
1.2 德国小蠊肠道微生物的清除及生物活性测定参考施万里等[14]的方法用500 mg/L的庆大霉素(分析纯,辰欣药业股份有限公司)对德国小蠊的肠道微生物进行清除,利用涂布法和实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)法评价清除效果,其中用于RT-qPCR检测的正、反向引物分别为16SF(ACTCCTACGGGAGGCAGCAG)和16SR(ATTACCGCGGCTGCTGG)[15]。
将鱼藤酮原药(97%,由天然农药与化学生物学教育部重点实验室提供)用丙酮配制成母液,人工饲料加热融化后用10 ml移液器将2 g饲料转移到ϕ3 cm塑料培养皿中,趁人工饲料尚未凝固将200 µl配制好的鱼藤酮溶液加入人工饲料中,用移液器枪头充分搅拌均匀,饲料中鱼藤酮终浓度为1 000 mg/L,对照为添加等体积丙酮的人工饲料。将装有人工饲料的培养皿放在通风橱中2~3 h,待丙酮充分挥发后分别放入做好标记的一次性饭盒中。分别选取同一时期正常德国小蠊和抗生素处理7 d后的德国小蠊进行生物学测定,每个处理组3个重复,每个重复10只(雌雄各半)。每24 h观察记录小蠊的死亡情况。
1.3 昆虫肠道解剖及DNA提取取羽化1~2 d的健康德国小蠊成虫饲喂人工饲料1周后,再用含有鱼藤酮的人工饲料进行饲喂,相同条件下饲喂未添加鱼藤酮人工饲料的成虫作为对照。饲喂4 d后,将对照组和处理组成虫均饥饿处理24 h,再分别从两组中各取6只成虫(雌雄各半)。将所取虫体在75%乙醇溶液中洗涤3 min,然后用无菌水冲洗3遍。在无菌条件下仔细解剖整个肠道,防止污染和肠道破裂。将处理组和对照组6只试虫的肠道分别汇集在200 µl无菌水中并用匀浆器进行匀浆,然后1 500×g离心5 min,除去上清液并使用细菌基因组DNA提取试剂盒[DP302,天根生化科技(北京)有限公司]提取基因组DNA,具体步骤参考试剂盒说明书。最后用Nanodrop-1000(NanoDrop Technologies)测量DNA的浓度和质量,每个处理3次重复。DNA样本储存在-20 ℃下,以备后续进行16S rRNA测序。
1.4 细菌16S rRNA基因扩增及测序以1.3节中提取的总基因组为模板,分别以通用引物341F(CCTACGGGNGGCWGCAG)和805R(GACTACHVGGGTATCTAATCC)扩增细菌16S rRNA V3-V4可变区域(464 bp)[16],PCR(ProFlex PCR扩增仪,ABI,USA)扩增体系总体积为50 µl,基因组DNA模板2 µl、dNTP(2.5 mmol/L)8 µl、5 × FastPfu缓冲液10 µl、FastPfu聚合酶0.5 µl、正反向引物各1 µl(0.5 µmol/L)及dd H2O 27.5 µl。PCR程序为98 ℃预变性1 min;98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s(1 kb/min),共35个循环;最后72 ℃延伸10 min。PCR产物用1%琼脂糖凝胶电泳检测,然后胶回收纯化。利用Illumina HiSeq测序平台对16S rRNA基因扩增子进行测序(测序及分析由北京擎科生物技术有限公司完成)。
1.5 肠道微生物多样性分析对原始数据进行拼接(FLASH,version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33),并去除嵌合体(UCHIME,version 8.1),得到高质量的Tags序列。在相似性97%的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤分类操作单元(operational taxonomic unit,OTU)。使用核糖体数据库项目(ribosomal database project,RDP)分类器(置信阈值为70%)对所有有代表性的有效读长进行注释,并对Silva 132数据库进行比对。利用Mothor软件计算基于菌群丰度的Alpha多样性指数,包括反映群落丰富性的Chao1指数,反映菌群多样性的Shannon指数、Simpson指数,以及覆盖率指数。在门、科和属水平分析单样本的细菌菌群组成和丰度、多样本的细菌菌群相对丰度,并进行差异性分析。利用R语言vegan包、vegdist和hclust进行距离计算和聚类分析,距离算法采用BrayCurtis,聚类方法选用complete,并绘制热图。此外,应用主成分分析(PCA)来解释样本之间观察到的分类变异模式。
1.6 数据分析使用SPSS 22.0(SPSS Inc.,Chicago,Illinois,USA)软件进行数据分析。所有数据在分析前先由Shapiro-Wilk测试,以评估数据是否符合正态分布。如果数据符合正态分布,则使用独立样本t检验;如果数据不符合正态分布,则采用Kruskal-Wallis检验,然后进行多重比较分析。P < 0.05为差异有统计学意义。
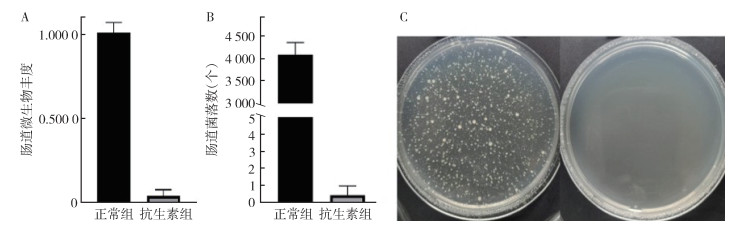
2 结果 2.1 抗生素对德国小蠊肠道微生物的清除抗生素处理7 d后,德国小蠊肠道微生物菌群相对丰度为0.045 4,与正常德国小蠊相比,肠道微生物总量被抑制95.46%(t=42.221,P < 0.001,图 1A),平板涂布结果显示抗生素处理后,德国小蠊肠道微生物可培养菌基本被清除(t=33.386,P < 0.001,图1B、1C)。
|
| 注:A 抗生素处理7 d后德国小蠊肠道微生物丰度;B 抗生素处理7 d后德国小蠊肠道菌落数;C 平板涂布后菌落生长情况(左为正常组,右 为抗生素组)。 图 1 抗生素对德国小蠊肠道微生物的影响 Figure 1 Effect of antibiotics on the gut microbiota of Blattella germanica |
| |
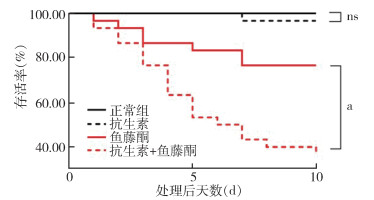
单独抗生素处理德国小蠊与正常饲喂德国小蠊相比较,存活率未见差异(t=-1.000,P=0.432)。然而,与单独鱼藤酮处理的德国小蠊相比,抗生素与鱼藤酮联合处理的德国小蠊存活率降低(t=8.485,P < 0.001)。见图 2。
|
| 注:数据来自 3 个平行的独立实验(每个处理组 n=15);ns 差异无统计学意义;a P<0.001。 图 2 抗生素处理后鱼藤酮对德国小蠊杀虫活性的变化 Figure 2 Change in the insecticidal activity of rotenone on Blattella germanica after antibiotic treatment |
| |
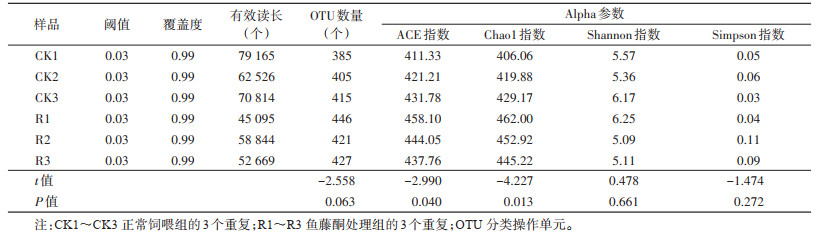
从6个样本中共获得2 499个OTUs和369 113个有效读长。每个样本OTU数量不同,但2组间差异无统计学意义(t=-2.558,P=0.063)。样本测序菌群覆盖率超过了99%。鱼藤酮处理后肠道微生物ACE指数和Chao1指数相较于对照组有所升高(t=-2.990,P=0.040;t=-4.227,P=0.013)。然而,Shannon指数和Simpson指数的差异无统计学意义(t=0.478,P=0.661;t=-1.474,P=0.272)。见表 1。
|
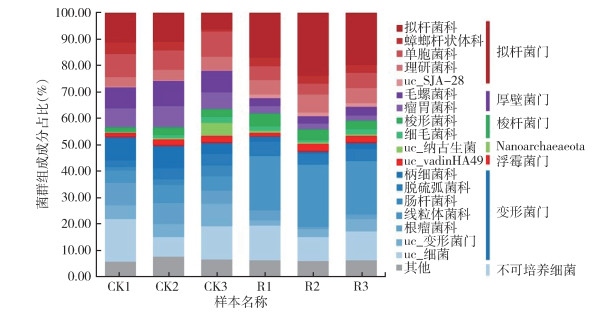
在不同的分类水平上鉴定了肠道微生物群,共检测到19门78科128属。拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、梭杆菌门(Fusobacteria)、Nanoarchaeaeota、浮霉菌门(Planctomycetes)和变形菌门(Proteobacteria)是所有样品中的优势门(均 > 1.00%),其中拟杆菌门(24.38%~38.78%)、厚壁菌门(6.62%~19.63%)和变形菌门(31.86%~36.01%)是所有肠道样品中最丰富的门。拟杆菌门在对照组中的相对丰度为(26.85±1.44)%,在鱼藤酮处理组中的相对丰度为(36.00±1.67)%,差异有统计学意义(t=-4.154,P=0.015)。而厚壁菌门正好相反,对照组中的相对丰度[(17.33±1.27)%]高于鱼藤酮处理组中的相对丰度[(6.83±0.21)%],差异有统计学意义(t=8.133,P=0.001)。见图 3。
|
| 注:其他 指相对丰度 <1.00%的分类群;uc表示不可培养;CK1~CK3 对照组的3个重复;R1~R3 鱼藤酮处理组的3个重复。 图 3 鱼藤酮处理后德国小蠊肠道菌群相对丰度分布 Figure 3 Relative abundance of the gut microbiota of Blattella germanica after rotenone treatment |
| |
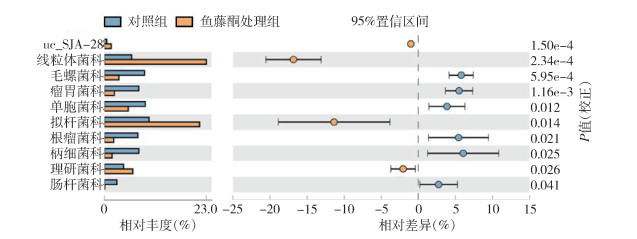
从图 4可以看出,与对照组相比较,鱼藤酮处理4 d后,德国小蠊肠道中毛螺菌科(Lachnospiraceae)、瘤胃菌科(Ruminococcaceae)、单胞菌科(Dysgonomonadace-ae)、柄细菌科(Caulobacteraceae)及肠杆菌科(Enterobacteriaceae)的相对丰度均降低,差异有统计学意义(t=10.662,P < 0.001;t=8.242,P=0.001;t=4.394,P=0.012;t=3.421,P=0.025;t=3.038,P=0.041);而线粒体菌科(Mitochondria)、拟杆菌科(Bacteroidaceae)和理研菌科(Rikenellaceae)的相对丰度均高于对照组,差异有统计学意义(t=-12.178,P < 0.001;t=-4.087,P=0.014;t=-3.570,P=0.026)。
|
| 注:uc 表示不可培养。 图 4 基于科水平的德国小蠊肠道菌群相对丰度的样本组间比较 Figure 4 Comparison of relative abundance between groups of the gut microbiota of Blattella germanica at the family level |
| |
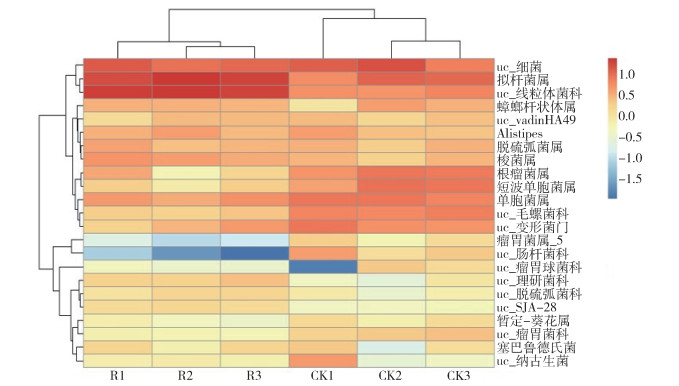
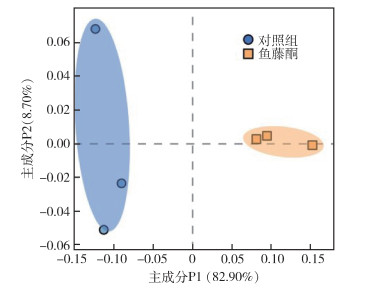
选择了相对丰度最高的23个属进行分析,使用Bray-Curtis指数制作聚类分析热图以比较组间细菌群落的相似性,结果显示:①不同处理的3个重复聚集在一起;②鱼藤酮处理组和对照组处于不同的分支(图 5)。通过主成分分析比较样品之间微生物群落组成的相似性,图 6显示鱼藤酮处理后肠道菌群分布模式,不同处理组内聚在一起,而组间较为离散。
|
| 注:列代表样本,行代表分配到属水平的细菌操作分类单元;聚类分析获得的细菌属和组别的树状图分别显示在左侧和顶部;色标表示相对丰度以底数为10的对数归一化处理后的大小;uc 表示不可培养;R1~R3 鱼藤酮处理组的3个重复;CK1~CK3 对照组的3个重复。 图 5 德国小蠊肠道菌群属水平上平均相对丰度较高的23个细菌属的聚类分析热图 Figure 5 Heatmap of the 23 bacterial genera with high relative abundances of the gut microbiota of Blattella germanica at the genus level |
| |
|
| 图 6 鱼藤酮处理后德国小蠊肠道菌群的主成分分析 Figure 6 Principal components analysis of Blattella germanica gut microbiota after rotenone treatment |
| |
本研究中德国小蠊肠道微生物被清除后,鱼藤酮对德国小蠊的杀虫活性显著增强,表明肠道微生物可能参与了抵御鱼藤酮的毒性作用。在此基础上我们通过高通量测序检测了鱼藤酮处理对德国小蠊肠道微生物群落的影响。多样性分析结果表明鱼藤酮处理后德国小蠊肠道微生物丰富度显著高于对照组。对照组和处理组中拟杆菌门、厚壁菌门、变形菌门、放线菌门和梭杆菌门都属于优势菌门,这与之前对德国小蠊肠道微生物群组成的报道一致[17]。德国小蠊肠道微生物群中厚壁菌门和拟杆菌门的优势存在是杂食性哺乳动物的共同特征[18],而梭杆菌门和变形菌门的存在也是其他蜚蠊和食木白蚁的共同特征[19]。但两组间相比较,属优势种群的拟杆菌门和厚壁菌门相对丰度都发生了显著变化。另外,聚类热图分析及主成分分析的结果表明,鱼藤酮处理组和对照组肠道微生物在组内水平上相似,但在组间对比上有所不同,这些结果都表明鱼藤酮处理对德国小蠊肠道微生物群落的结构分布有较大影响。
本研究共发现了9个科的相对丰度在2组间存在显著差异。与对照组相比,处理组单胞菌科和肠杆菌科的相对丰度显著降低。据报道,来自这2个科的细菌能够降解复杂的多糖并促进宿主的营养吸收[20-21]。当宿主摄入有害物质后,肠道细菌需要通过对其组成和丰度进行适应性改变,以帮助宿主提高耐受性并保持稳定的寄生关系[22]。对β-高效氯氰菊酯有抗性的德国小蠊种群与敏感种群相比较,体内与营养相关的肠道微生物群的丰度降低[3]。而处理组中观察到明显高丰度的拟杆菌科、理研菌科及线粒体菌科,拟杆菌科和理研菌科都属于拟杆菌门。据报道,拟杆菌可以通过刺激宿主的免疫系统来保护宿主昆虫免受肠道中增殖的病原体的侵害[23]。理研菌科在多种昆虫中比较常见,与肠道健康有关,并在保护宿主免受外源侵害方面起着重要作用[24]。与对照组相比,肠道中线粒体菌科(α变形菌门)的丰度显著增加。根据内共生理论,线粒体的祖先是α变形菌门的成员,该门与真核祖先细胞建立了共生关系[25]。研究表明,鱼藤酮会阻碍线粒体电子传递链,导致三磷酸腺苷(ATP)和能量供应不足。通过破坏线粒体膜电位释放细胞色素C和凋亡诱导因子被认为是鱼藤酮诱导细胞凋亡的重要方式[26]。因此,我们推测,当鱼藤酮进入肠道时,会刺激大量线粒体菌的产生。由于线粒体菌与线粒体高度同源,鱼藤酮可能直接靶向线粒体菌从而减少宿主线粒体的损伤,导致毒性的降低。
大量研究表明昆虫肠道微生物在降解植物毒素及杀虫剂、提高宿主抗药性等方面发挥着重要作用。本研究表明德国小蠊肠道微生物参与了宿主抵御鱼藤酮的毒性作用,相应的,鱼藤酮的摄入会影响德国小蠊肠道微生物菌落结构,但具体分子机制尚不清楚,后续可以通过比较转录组学及代谢组学进一步进行解析。在德国小蠊防治中利用硼酸与绿僵菌(Metarhizium anisopliae)的复配,氟蚁腙与绿僵菌的复配都是基于破坏肠道微生物菌落结构从而提升杀虫活性的研究思路[27-28]。本研究的结果也显示肠道微生物被清除后,鱼藤酮对德国小蠊的杀虫活性显著提高。相较于农业害虫防治,植物源杀虫剂在卫生害虫防治领域有着明显的发展优势和广阔的应用前景,进一步了解植物源杀虫剂与昆虫肠道微生物之间的关系将能够更好地为其在害虫防治上的应用提供理论依据。
利益冲突 无
| [1] |
都二霞, 李胜. 蟑螂为"小强"的分子奥秘[J]. 中国媒介生物学及控制杂志, 2021, 32(4): 385-389. Du EX, Li S. Molecular mystery of the "Little Mighty" cockroach[J]. Chin J Vector Biol Control, 2021, 32(4): 385-389. DOI:10.11853/j.issn.1003.8280.2021.04.001 |
| [2] |
Nasirian H. Infestation of cockroaches (Insecta: Blattaria) in the human dwelling environments: A systematic review and meta-analysis[J]. Acta Trop, 2017, 167: 86-98. DOI:10.1016/j.actatropica.2016.12.019 |
| [3] |
Zhang F, Yang RA. Life history and functional capacity of the microbiome are altered in beta-cypermethrin-resistant cockroaches[J]. Int J Parasitol, 2019, 49(9): 715-723. DOI:10.1016/j.ijpara.2019.04.006 |
| [4] |
辛正, 王东, 张晓, 等. 植物源卫生杀虫剂开发利用与前景展望[J]. 首都公共卫生, 2018, 12(1): 13-17. Xin Z, Wang D, Zhang X, et al. Review on current development and prospect of botanical hygienic insecticides[J]. Cap J Public Health, 2018, 12(1): 13-17. DOI:10.16760/j.cnki.sdggws.2018.01.005 |
| [5] |
Pan XY, Zhang F. Advances in biological control of the German cockroach, Blattella germanica (L.)[J]. Biol Control, 2020, 142: 104104. DOI:10.1016/j.biocontrol.2019.104104 |
| [6] |
Isman MB. Botanical insecticides, deterrents, and repellents in modern agriculture and an increasingly regulated world[J]. Annu Rev Entomol, 2006, 51(1): 45-66. DOI:10.1146/annurev.ento.51.110104.151146 |
| [7] |
倪玲, 肖蕾, 蔡祥海, 等. 植物成分防治蜚蠊研究进展[J]. 中国媒介生物学及控制杂志, 2017, 28(1): 90-92, 95. Ni L, Xiao L, Cai XH, et al. Progress on botanical constituents against cockroaches[J]. Chin J Vector Biol Control, 2017, 28(1): 90-92, 95. DOI:10.11853/j.issn.1003.8280.2017.01.027 |
| [8] |
刘春华. 一种生物源杀蟑胶饵的研制[D]. 广州: 中山大学, 2012. Liu CH. Research and development of a bio-insecticide gel against Blattella germanica[D]. Guangzhou: Sun Yat-sen University, 2012. (in Chinese) |
| [9] |
Chakraborty A, Roy A. Microbial influence on plant-insect interaction[M]//Singh IK, Singh A. Plant-pest interactions: From molecular mechanisms to chemical ecology. Singapore: Springer, 2021: 337-363.
|
| [10] |
Adams AS, Aylward FO, Adams SM, et al. Mountain pine beetles colonizing historical and naive host trees are associated with a bacterial community highly enriched in genes contributing to terpene metabolism[J]. Appl Environ Microbiol, 2013, 79(11): 3468-3475. DOI:10.1128/AEM.00068-13 |
| [11] |
Welte CU, De Graaf RM, Van Den Bosch TJM, et al. Plasmids from the gut microbiome of cabbage root fly larvae encode SaxA that catalyses the conversion of the plant toxin 2-phenylethyl isothiocyanate[J]. Environ Microbiol, 2016, 18(5): 1379-1390. DOI:10.1111/1462-2920.12997 |
| [12] |
Dodiya HB, Forsyth CB, Voigt RM, et al. Chronic stress-induced gut dysfunction exacerbates Parkinson's disease phenotype and pathology in a rotenone-induced mouse model of Parkinson's disease[J]. Neurobiol Dis, 2020, 135: 104352. DOI:10.1016/j.nbd.2018.12.012 |
| [13] |
Ünal İ, Üstündağ ÜV, Ateş PS, et al. Rotenone impairs oxidant/antioxidant balance both in brain and intestines in zebrafish[J]. Int J Neurosci, 2019, 129(4): 363-368. DOI:10.1080/00207454.2018.1538141 |
| [14] |
施万里, 杨繁, 孙晓霞, 等. 多种抗生素对抗药性德国小蠊肠道菌去除效果的研究[J]. 内蒙古大学学报(自然科学版), 2017, 48(3): 291-296. Shi WL, Yang F, Sun XX, et al. Study on removal of intestinal flora in pesticide-resistant Blattella germanica using various antibiotics[J]. Acta Sci Nat Univ Neimongol, 2017, 48(3): 291-296. DOI:10.13484/j.nmgdxxbzk.20170311 |
| [15] |
Cai ZH, Yao ZC, Li YS, et al. Intestinal probiotics restore the ecological fitness decline of Bactrocera dorsalis by irradiation[J]. Evol Appl, 2018, 11(10): 1946-1963. DOI:10.1111/eva.12698 |
| [16] |
Liu JL, Chang RR, Zhang XB, et al. Non-isoflavones diet incurred metabolic modifications induced by constipation in rats via targeting gut microbiota[J]. Front Microbiol, 2018, 9: 3002. DOI:10.3389/fmicb.2018.03002 |
| [17] |
Carrasco P, Pérez-Cobas AE, Van De Pol C, et al. Succession of the gut microbiota in the cockroach Blattella germanica[J]. Int Microbiol, 2014, 17(2): 99-109. DOI:10.2436/20.1501.01.212 |
| [18] |
Tinker KA, Ottesen EA. The core gut microbiome of the American cockroach, Periplaneta americana, is stable and resilient to dietary shifts[J]. Appl Environ Microbiol, 2016, 82(22): 6603-6610. DOI:10.1128/AEM.01837-16 |
| [19] |
Schauer C, Thompson CL, Brune A. The bacterial community in the gut of the cockroach Shelfordella lateralis reflects the close evolutionary relatedness of cockroaches and termites[J]. Appl Environ Microbiol, 2012, 78(8): 2758-2767. DOI:10.1128/AEM.07788-11 |
| [20] |
Khamis FM, Ombura FLO, Akutse KS, et al. Insights in the global genetics and gut microbiome of black soldier fly, Hermetia illucens: Implications for animal feed safety control[J]. Front Microbiol, 2020, 11: 1538. DOI:10.3389/fmicb.2020.01538 |
| [21] |
Cui LX, Guo QY, Wang XX, et al. Midgut bacterial diversity of a leaf-mining beetle, Dactylispa xanthospila (Gestro) (Coleoptera: Chrysomelidae: Cassidinae)[J]. Biodivers Data J, 2021, 9: e62843. DOI:10.3897/BDJ.9.e62843 |
| [22] |
Cator LJ, Johnson LR, Mordecai EA, et al. The role of vector trait variation in vector-borne disease dynamics[J]. Front Ecol Evol, 2020, 8: 189. DOI:10.3389/fevo.2020.00189 |
| [23] |
Backhed F, Ley RE, Sonnenburg JL, et al. Host-bacterial mutualism in the human intestine[J]. Science, 2005, 307(5717): 1915-1920. DOI:10.1126/science.1104816 |
| [24] |
Kakumanu ML, Maritz JM, Carlton JM, et al. Overlapping community compositions of gut and fecal microbiomes in lab-reared and field-collected German cockroaches[J]. Appl Environ Microbiol, 2018, 84(17): e01037-18. DOI:10.1128/AEM.01037-18 |
| [25] |
Degli Esposti M. Bioenergetic evolution in proteobacteria and mitochondria[J]. Genome Biol Evol, 2014, 6(12): 3238-3251. DOI:10.1093/gbe/evu257 |
| [26] |
Akhtar Y, Yeoung YR, Isman MB. Comparative bioactivity of selected extracts from Meliaceae and some commercial botanical insecticides against two noctuid caterpillars, Trichoplusia ni and Pseudaletia unipuncta[J]. Phytochem Rev, 2008, 7(1): 77-88. DOI:10.1007/s11101-006-9048-7 |
| [27] |
Chao Y, Wang MY, Dai W, et al. Synergism between hydramethylnon and Metarhizium anisopliae and their influence on the gut microbiome of Blattella germanica (L.)[J]. Insects, 2020, 11(8): 538. DOI:10.3390/insects11080538 |
| [28] |
Yang RA, Zhang MJ, Schal C, et al. Boric acid enhances Metarhizium anisopliae virulence in Blattella germanica (L.) by disrupting the gut and altering its microbial community[J]. Biol Control, 2021, 152: 104430. DOI:10.1016/j.biocontrol.2020.104430 |
 2022, Vol. 33
2022, Vol. 33


