扩展功能
文章信息
- 董红猛, 武亚雪, 胡永红
- DONG Hong-meng, WU Ya-xue, HU Yong-hong
- 抗蜱亚单位疫苗作用途径解析
- Analysis of action pathway of anti-tick subunit vaccine
- 中国媒介生物学及控制杂志, 2022, 33(5): 655-660
- Chin J Vector Biol & Control, 2022, 33(5): 655-660
- 10.11853/j.issn.1003.8280.2022.05.008
-
文章历史
- 收稿日期: 2022-06-08
蜱是专性吸血的体外寄生虫,除对宿主造成直接伤害,还传播多种病原体包括细菌、螺旋体、立克次体和病毒等,给人类健康和畜牧业发展带来极大危害[1-2]。目前主要通过化学杀螨剂进行蜱类防治,但长期使用化学杀虫剂容易造成蜱的抗药性及环境污染。因此,接种疫苗已成为有效的蜱类防治手段之一[3-4]。基于Bm86研发的抗蜱疫苗已实现商业化,但其对扇头蜱属(Rhipicephalus)以外物种作用不明显[5]。为实现蜱的有效防治,筛选高效、广谱的蜱类保护性抗原研究成为热点。由于各类抗原保护效率参差不齐,作用机制报道甚少[6]。本文对抗蜱亚单位疫苗在宿主和蜱体内的作用途径进行探讨,旨在阐明抗蜱疫苗作用机制,为研发高效抗蜱疫苗提供理论依据。
1 疫苗诱导宿主免疫应答抗蜱疫苗来源于蜱体内的保护性抗原。当含保护性抗原的疫苗注射到宿主体内后,不仅会激发宿主的体液免疫,产生抗体;还会诱导细胞免疫,刺激细胞因子生成等[7]。
1.1 体液免疫将微小扇头蜱(Rh. microplus)Subolesin抗原与热灭活牛分枝杆菌联合口服接种牛,之后进行蜱叮咬实验。与对照组相比,联合疫苗可使雌蜱数量减少51%、生殖力下降30%,疫苗免疫保护力为65%。抗蜱疫苗相关性分析结果显示,叮咬雌蜱数量与Subolesin IgG抗体滴度呈负相关。此外,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)信使RNA(messenger RNA,mRNA)水平与抗Subolesin的IgG抗体滴度之间存在正相关,且TNF-α mRNA水平与蜱的繁殖率呈负相关,表明口服Subolesin+热灭活牛分枝杆菌(heat inactivated Mycobacterium bovis)疫苗的效果与疫苗对蜱发育的影响之间存在相关性,揭示了口服疫苗后宿主适应性免疫应答在降低蜱繁殖能力中起作用。当疫苗到达口腔黏膜相关淋巴组织后,抗原的摄取、处理和递呈通过抗原递呈细胞(antigen presenting cells,APCs)发生,进而激活T细胞、辅助性T细胞和B细胞,启动抗原特异性细胞应答,有助于B细胞产生抗体[8]。
通过超声破碎,将长角血蜱(Haemaphysalis longicornis)唾液腺裂解蛋白免疫家兔,酶联免疫吸附试验(ELISA)结果显示,随着免疫次数的增加,家兔体内抗体滴度持续增加[9]。同样,将边缘革蜱(Dermacantor marginatus)谷胱甘肽S-转移酶(glutathione S-transferases,GSTs)重组蛋白rDmGST免疫家兔,ELISA检测rDmGST免疫组和磷酸缓冲盐溶液(phosphate buffer saline,PBS)对照组兔的抗体滴度,结果显示,rDmGST免疫组兔血清抗体滴度高,上述结果提示接种疫苗可引起宿主产生强烈的体液免疫反应[10]。
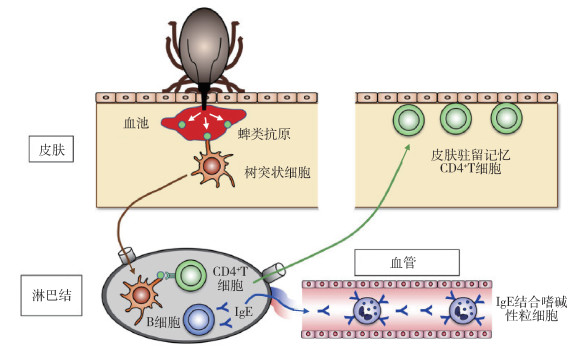
1.2 细胞免疫蜱叮咬宿主时可把唾液中抗原注射到皮肤中,并被树突状细胞吸收,输送到淋巴结。此时特异性B细胞和分化抗原决定簇4阳性(CD4+)T细胞被激活,引起蜱抗原特异性抗体IgE产生,且IgE通过免疫球蛋白E受体(Fc epsilon RI,FcεRI)结合到嗜碱性粒细胞表面。一些蜱抗原特异性CD4+T细胞分布于全身皮肤,并作为皮肤驻留记忆性T细胞保留下来(图 1)。当蜱第2次叮咬宿主时,记忆性T细胞在蜱唾液抗原刺激下被激活并分泌白细胞介素-3(interleukin-3,IL-3),促进携带IgE的嗜碱性粒细胞募集到蜱的叮咬部位。皮肤浸润的嗜碱性粒细胞被蜱抗原刺激释放组胺,组胺作用于角质细胞,导致表皮增生,干扰蜱附着或血液供给[11]。当长角血蜱先后2次叮咬家兔,通过ELISA检测宿主血液中TNF-α、IL-1β含量的动态变化,结果显示,初次侵染24~48 h内细胞因子明显上升,再次侵染后细胞因子浓度持续上升,并在72 h达到峰值。表明初次侵染后宿主先天免疫发挥作用,产生细胞因子参与免疫反应,再次侵染后宿主的获得性免疫发挥主要作用,阻碍长角血蜱的叮咬和吸血[12]。此外,通过原位杂交法检测发现,蓖子硬蜱(Ixodes ricinus)叮咬BALB/c小鼠可引起皮肤、淋巴结中干扰素-γ(interferon-γ,IFN-γ)、白细胞介素-2(IL-2)和IL-4 mRNA的表达上升,表明宿主细胞免疫发挥了重要作用[13-14]。
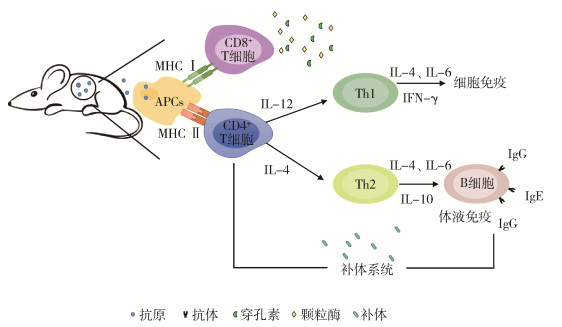
研究发现,获得性细胞免疫应答由CD4+和CD8+T细胞介导[15]。蜱类叮咬宿主时,蜱抗原被宿主摄入,经提呈细胞处理后以抗原肽-MHC Ⅱ复合物形式提呈给CD4+T细胞[16]。CD4+T细胞识别APCs(表达MHC Ⅱ类分子)处理的抗原后被激活,分化为T辅助细胞1型(T helper cell 1,Th1)和T辅助细胞2型(T helper cell 2,Th2)的功能亚群。Th1细胞通过产生IFN-γ介导对多种细胞内感染的生物体进行杀灭。IL-12由APCs(如巨噬细胞或树突状细胞)免疫开始时产生。因此,对于许多细胞内感染,IL-12是Th1细胞的诱导细胞因子,IFN-γ是介导保护的效应细胞因子。Th2细胞在产生体液免疫反应方面提供帮助,其特性是分泌IL-4、IL-6和IL-10。CD8+T细胞识别APCs(表达MHC Ⅰ类分子)处理呈现的抗原,通过IFN-γ、TNF-α等细胞因子或直接细胞溶解机制介导其效应器功能。CD8+T细胞释放穿孔素、颗粒酶等颗粒物可介导细胞杀伤机制[15]。
1.3 补体系统补体系统构成先天免疫系统的一部分,主要通过3种途径激活:经典途径、凝集素途径和替代途径[17]。所有途径都经过C3补体蛋白,从而激活产物C3a、C3b、C5a和膜攻击复合物(membrane attack complex,MAC)[18]。它不仅有助于清除和杀死病原体,而且有助于形成适应性免疫反应[19]。将Subolesin抗原与热灭活牛分枝杆菌联合口服接种牛,之后进行蜱叮咬实验,发现C3 mRNA水平有增加的趋势,其mRNA水平和雌蜱的数量之间呈负相关[8],表明接种疫苗可引起宿主补体系统变化。研究发现,蜱侵染可引起宿主C3a水平升高,且特异性IgG在吸血位点与唾液腺抗原形成复合物,而补体会加强对蜱的损伤[20]。C3a、C5a可引起肥大细胞和嗜碱性粒细胞脱粒,同时伴随着嗜酸性粒细胞趋化因子和血管活性物质的释放[20],且血管活性物质增加血管的通透性,促使抗体及免疫细胞聚集至蜱叮咬处,参与宿主的免疫应答[21]。
此外,C3补体参与调节抗原特异性免疫反应。补体介导的B细胞反应调节机制涉及补体激活产物(C3b、C3d)与细胞表面补体受体(CR1/CD35、CR2/CD21)的相互作用,刺激B细胞的增殖和分化[22-23]。除调节B细胞应答外,补体还参与T细胞的免疫调节[24-25],如补体调节蛋白CD46、CD55和CD59参与T细胞活化[26]。因此,抗蜱疫苗能有效引起宿主体内的免疫应答。见图 2。
|
| 注:APCs抗原递呈细胞;MHC主要组织相容性复合体;IL白细胞介素;IFN-γ干扰素-γ;Th T辅助细胞;Ig免疫球蛋白;CD分化抗原决定簇。 图 2 抗蜱疫苗诱导的宿主免疫应答 Figure 2 Host immune responses induced by anti-tick vaccine |
| |
蜱类疫苗引起的保护作用是通过抗体介导的。哺乳动物表达的抗体主要有5种:IgM、IgA、IgD、IgG和IgE,其中IgG含量最多[27-28]。当蜱叮咬接种疫苗的宿主时,宿主体内抗体随血液摄取进入蜱体内,引起抗体-抗原相互作用,从而减少蜱类数量、体质量和产卵[29]。蜱是吸血性寄生虫,不能自身合成血红素,需要宿主血液中血红蛋白作为外源性血红素来源,保障胚胎发育和幼蜱孵化。虽然蜱缺乏降解血红素的血红素加氧酶,但依赖于三磷酸腺苷结合盒式(adenosine triphosphate-binding cassette,ABC)转运蛋白,其可运输过量血红素来维持蜱体内血红素稳态。水通道蛋白(aquaporins,AQPs)是进化上保守的蛋白质,在细胞膜上形成孔,水和小中性溶质可以通过孔进行运输。蜱类AQPs存在于唾液腺、消化道和马氏管中,参与多种生理过程,包括唾液分泌、摄食和血液摄入后的渗透调节等。蜱吸血会产生毒性的活性氧物质(reactive oxygen species,ROS),硒蛋白(selenoprotein,SEL)可在清除活性氧、维持蜱的生存和微生物菌群方面发挥关键作用,甚至在蜱被病原微生物定植期间也发挥关键作用。将游走钝缘蜱(Ornithodoros erraticus)ABC转运蛋白、AQPs、SEL免疫兔子,之后进行蜱叮咬实验。结果显示,免疫组雌蜱饱血体质量、产卵量显著下降。推测在抗ABC转运蛋白的免疫反应中,抗体介导的ABC转运蛋白功能丧失导致血红素内环境不平衡,引起胚胎发育受损,进而降低雌蜱的繁殖能力。在抗AQPs免疫反应中,抗体介导的蜱摄食过程中AQPs浓缩血液成分功能丧失,从而减少了水分的排出,增加蜱的体质量,但会减少血液成分的摄入,进而减少蜱繁殖所需营养的供应。在抗SEL的免疫应答中,抗体介导的SEL功能丧失将导致ROS水平升高(毒性),对蜱的适应和繁殖不利[30]。研究发现,蜱粘合蛋白(cement protein,64P)具有免疫原性[31]。将具尾扇头蜱(Rh. appendiculatus)64P的2个N末端片段64TRP2、64TRP3及全长64TRP5免疫豚鼠,之后进行蜱叮咬实验,结果显示,各组死亡率分别为56%、70%和60%。将免疫64TRP2、64TRP3和64TRP5的豚鼠血清分别孵育雌蜱中肠,免疫印迹实验结果显示,其与中肠蛋白表现出不同程度的特异性反应,表明宿主抗体与这些表位发生反应,引起中肠损伤,导致蜱类死亡,提示这是一种抗体介导的效应[32]。
将长角血蜱成蜱中肠可溶性抗原免疫小鼠,筛选出IgG1、IgG2a、IgG2b单克隆抗体。通过免疫印迹实验分析,3种单克隆抗体均与成蜱中肠76 kDa蛋白反应。免疫金染色结果显示,单抗识别的抗原分布于细胞表面和细胞周围,表明76 kDa蛋白是细胞膜的组成部分。中肠免疫染色组化切片显示,消化细胞的膜和内部区域被单克隆抗体特异性染色,且中肠消化细胞遭到破坏,表明特异性抗体的结合引起蜱中肠损伤,并导致血餐向其他组织渗漏,从而抑制蜱发育[33]。通过超声破碎制备中华硬蜱(I. sinensis)中肠蛋白,并免疫新西兰大白兔,经中华硬蜱叮咬后,分析蜱中肠组织切片,发现中肠上皮严重损伤,消化细胞脱落,肠壁变薄等现象[34]。推测中肠抗原诱导宿主产生大量抗体,而中肠在抗体、补体和杀伤性T细胞的联合作用下严重受损[35]。
研究发现,针对蜱内部抗原的抗体在没有被消化的情况下通过蜱中肠进入血淋巴[36]。固相酶免疫测定分析显示,血淋巴中宿主抗体仍保持活性[37]。对不同来源的免疫球蛋白和其他蛋白用放射性标记物标记,通过毛细管饲喂蜱来检测单个化合物进入血淋巴的速率。结果证明免疫球蛋白包括IgG和IgM,进入血淋巴的速度比其他蛋白快。这表明蜱中肠细胞存在一种特定的机制选择性地摄取IgG[38]。
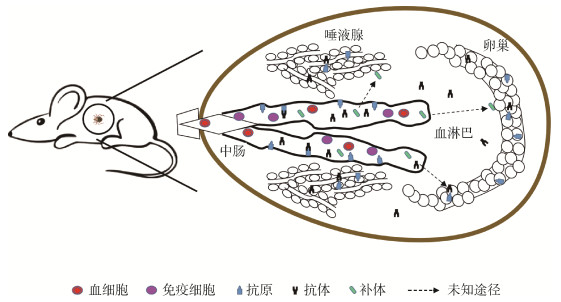
2.2 免疫细胞与其他吸血昆虫不同,蜱类血餐消化不是通过消化系统分泌蛋白酶进行,而是通过中肠消化细胞进行原始的细胞内吞方式消化[39]。研究发现,饱血雌蜱中肠腔内未消化的血液中有完整的宿主免疫细胞(嗜酸性粒细胞、嗜碱性粒细胞),其分泌活性物质,损伤中肠细胞膜,影响蜱的消化[16]。研究发现,被蜱反复叮咬的豚鼠可以获得抗蜱能力,称为致敏豚鼠。将抗嗜碱性粒细胞血清注射致敏豚鼠,可抑制血液、骨髓和皮肤部位的嗜碱性粒细胞,同时用正常兔血清注射致敏豚鼠作对照,之后进行美洲花蜱(Amblyomma americanum)叮咬实验。结果显示,抗嗜碱性粒细胞血清注射组雌蜱叮咬数量、平均体质量与未致敏豚鼠组饲养蜱无明显差异,雌蜱正常饱血,表明抗嗜碱性粒细胞血清消除了致敏豚鼠对美洲花蜱的抗性,说明嗜碱性粒细胞有助于豚鼠获得抗蜱性,推测其对蜱有抑制作用[40]。嗜碱性粒细胞通过提供IL-4,甚至在某些条件下作为抗原提呈细胞,在Th2型免疫反应中发挥重要作用。嗜碱性粒细胞也通过促进B细胞活化和分化来增强体液记忆反应[41]。
2.3 补体补体系统是脊椎动物先天性免疫和适应性免疫的重要组成部分,对病原体产生重要的进化压力。早期研究表明蜱唾液可抑制补体,对蜱完成血餐吸收具有重要意义,由此推测,补体系统的激活能够抑制蜱类进食[42]。当蜱摄入Bm86抗原免疫牛的血液时,蜱肠细胞会溶解,这可能是通过补体介导的宿主防御机制[43]。用吸血6 h的游走钝缘蜱成蜱中肠膜提取物(midgut membrane extract,GME)(aGME6h)+弗氏佐剂免疫小鼠,间接ELISA法检测发现其IgG2a表达水平升高。但小鼠经蜱侵染后用眼镜蛇毒抗补体蛋白(cobra venom anticomplementary protein,CVF)处理,减弱了疫苗对宿主的保护作用,证实补体在免疫效应器机制中起作用[44]。补体的这些生理功能是由激活过程中产生的大量产物、片段和复合物介导的。补体蛋白C3和C4的较大片段覆盖病原体表面,具有标记吞噬清除功能,而这些C3、C4补体蛋白的较小片段则将吞噬细胞招募到损伤部位,激活其杀灭病原体。补体末端通路的激活启动了多组分MAC在靶点上的组装,形成一个跨膜孔,导致细胞溶胀并最终溶解[45]。因此,接种疫苗后的宿主抗体、免疫细胞和补体会抑制蜱生长发育。见图 3。
|
| 图 3 宿主抗体、免疫细胞和补体对蜱的作用途径 Figure 3 Action pathways of host antibodies, immune cells, and complement on ticks |
| |
蜱及蜱传疾病对人类和畜牧业的危害极大,抗蜱疫苗对蜱类防治起到了至关重要的作用,与传统的化学防治相比,疫苗能够有效节约成本,并具有生物安全性,可预防蜱抗药性产生。目前抗蜱疫苗研究大多停留在功能性抗原筛选阶段,对其如何影响蜱类发育和生殖的机制报道甚少。
接种疫苗可有效引起宿主体内抗体、补体、免疫细胞及细胞因子的变化。这些变化的蛋白会随着蜱吸血进入蜱体内,影响蜱的正常发育。抗体由抗原结合片段(antigen-binding fragment,Fab)和可结晶片段(crystallizable fragment,Fc)构成[46],Fc可与免疫受体分子(Fc受体或补体)结合调节效应器功能,包括抗体依赖性细胞介导细胞毒性作用(antibody dependent cellular cytotoxicity,ADCC)、抗体依赖性细胞介导吞噬作用(antibody dependent cellular phagocytosis,ADCP)和补体依赖性细胞毒性作用(complement dependent cytotoxicity,CDC)[47]。因此,通过放射自显影、ELISA、流式细胞术分别检测蜱体内宿主抗体、补体水平及免疫细胞类型,经ADCC、ADCP和CDC分析明确各成分作用,为深入揭示抗蜱疫苗机制提供科学依据。
利益冲突 无
| [1] |
Mateos-Hernández L, Villar M, Moral A, et al. Tick-host conflict: Immunoglobulin E antibodies to tick proteins in patients with anaphylaxis to tick bite[J]. Oncotarget, 2017, 8(13): 20630-20644. DOI:10.18632/oncotarget.15243 |
| [2] |
Madison-Antenucci S, Kramer LD, Gebhardt LL, et al. Emerging tick-borne diseases[J]. Clin Microbiol Rev, 2020, 33(2): e00083-18. DOI:10.1128/CMR.00083-18 |
| [3] |
Villar M, Marina A, De La Fuente J. Applying proteomics to tick vaccine development: Where are we?[J]. Expert Rev Proteomics, 2017, 14(3): 211-221. DOI:10.1080/14789450.2017.1284590 |
| [4] |
Parthasarathi BC, Kumar B, Ghosh S. Current status and future prospects of multi-antigen tick vaccine[J]. J Vector Borne Dis, 2021, 58(3): 183-192. DOI:10.4103/0972-9062.321739 |
| [5] |
Blecha IMZ, Csordas BG, Aguirre ADAR, et al. Analysis of Bm86 conserved epitopes: Is a global vaccine against cattle tick Rhipicephalus microplus possible?[J]. Rev Bras Parasitol Vet, 2018, 27(3): 267-279. DOI:10.1590/S1984-296120180056 |
| [6] |
Ndawula C, Xavier MA, Villavicencio B, et al. Prediction, mapping and validation of tick glutathione S-transferase B-cell epitopes[J]. Ticks Tick Borne Dis, 2020, 11(4): 101445. DOI:10.1016/j.ttbdis.2020.101445 |
| [7] |
Jonsson NN, Matschoss AL, Pepper P, et al. Evaluation of TickGARDPLUS, a novel vaccine against Boophilus microplus, in lactating Holstein-Friesian cows[J]. Vet Parasitol, 2000, 88(3/4): 275-285. DOI:10.1016/s0304-4017(99)00213-7 |
| [8] |
Contreras M, Kasaija PD, Merino O, et al. Oral vaccination with a formulation combining Rhipicephalus microplus Subolesin with heat inactivated Mycobacterium bovis reduces tick infestations in cattle[J]. Front Cell Infect Microbiol, 2019, 9: 45. DOI:10.3389/fcimb.2019.00045 |
| [9] |
谢俊仁, 刘光远, 田占成, 等. 家兔抗长角血蜱免疫模型的建立及对长角血蜱成蜱生长发育的影响[J]. 畜牧兽医学报, 2008, 39(1): 79-84. Xie JR, Liu GY, Tian ZC, et al. Construction of rabbit immunity model against Haemaphysalis longicornis and its effects on H. longicornis adult growth[J]. Acta Vet Zootech Sin, 2008, 39(1): 79-84. DOI:10.3321/j.issn:0366-6964.2008.01.014 |
| [10] |
Huercha N, Song RQ, Li M, et al. Caracterization of glutathione S-transferase of Dermacantor marginatus and effect of the recombinant antigen as a potential anti-tick vaccine[J]. Vet Parasitol, 2020, 279: 109043. DOI:10.1016/j.vetpar.2020.109043 |
| [11] |
Karasuyama H, Miyake K, Yoshikawa S. Immunobiology of acquired resistance to ticks[J]. Front Immunol, 2020, 11: 601504. DOI:10.3389/fimmu.2020.601504 |
| [12] |
朱恬仪. 宿主对长角血蜱侵染的免疫应答[D]. 石家庄: 河北师范大学, 2018. DOI: 10.7666/d.D01417789. Zhu TY. The immune response of host to the infection of Haemaphysalis longicornis[D]. Shijiazhuang: Hebei Normal University, 2018. DOI: 10.7666/d.D01417789.(in Chinese) |
| [13] |
Ganapamo F, Rutti B, Brossard M. In vitro production of interleukin-4 and interferon-gamma by lymph node cells from BALB/c mice infested with nymphal Ixodes ricinus ticks[J]. Immunology, 1995, 85(1): 120-124. |
| [14] |
Mbow ML, Rutti B, Brossard M. IFN-γ IL-2, and IL-4 mRNA expression in the skin and draining lymph nodes of BALB/c mice repeatedly infested with nymphal Ixodes ricinus ticks[J]. Cell Immunol, 1994, 156(1): 254-261. DOI:10.1006/cimm.1994.1170 |
| [15] |
Seder RA, Hill AVS. Vaccines against intracellular infections requiring cellular immunity[J]. Nature, 2000, 406(6797): 793-798. DOI:10.1038/35021239 |
| [16] |
Wikel SK. Host immunity to ticks[J]. Annu Rev Entomol, 1996, 41: 1-22. DOI:10.1146/annurev.en.41.010196.000245 |
| [17] |
Morozova OV, Panov VV, Bakhvalova VN. Innate and adaptive immunity in wild rodents spontaneously and experimentally infected with the tick-borne encephalitis virus[J]. Infect Genet Evol, 2020, 80: 104187. DOI:10.1016/j.meegid.2020.104187 |
| [18] |
Veje M, Studahl M, Bergström T. Intrathecal complement activation by the classical pathway in tick-borne encephalitis[J]. J Neurovirol, 2019, 25(3): 397-404. DOI:10.1007/s13365-019-00734-1 |
| [19] |
Dalakas MC, Alexopoulos H, Spaeth PJ. Complement in neurological disorders and emerging complement-targeted therapeutics[J]. Nat Rev Neurol, 2020, 16(11): 601-617. DOI:10.1038/s41582-020-0400-0 |
| [20] |
薄新文, 汪明. 宿主对蜱免疫的研究进展[J]. 中国兽医杂志, 1998, 24(10): 45-47. Bo XW, Wang M. Research progress of host immunity to ticks[J]. Chin J Vet Med, 1998, 24(10): 45-47. DOI:10.3969/j.issn.0529-6005.1998.10.040 |
| [21] |
赵忠芳, 孔繁瑶. 蜱诱导宿主的免疫研究概况[J]. 寄生虫与医学昆虫学报, 2000, 7(2): 115-120. Zhao ZF, Kong FY. A survey of tick-induced host immune response[J]. Acta Parasitol Med Entomol Sin, 2000, 7(2): 115-120. DOI:10.3969/j.issn.1005-0507.2000.02.011 |
| [22] |
Lubbers R, Van Essen MF, Van Kooten C, et al. Production of complement components by cells of the immune system[J]. Clin Exp Immunol, 2017, 188(2): 183-194. DOI:10.1111/cei.12952 |
| [23] |
Peng Q, Li K, Patel H, et al. Dendritic cell synthesis of C3 is required for full T cell activation and development of a Th1 phenotype[J]. J Immunol, 2006, 176(6): 3330-3341. DOI:10.4049/jimmunol.176.6.3330 |
| [24] |
Rutemark C, Alicot E, Bergman A, et al. Requirement for complement in antibody responses is not explained by the classic pathway activator IgM[J]. Proc Natl Acad Sci USA, 2011, 108(43): E934-E942. DOI:10.1073/pnas.1109831108 |
| [25] |
Dunkelberger JR, Song WC. Complement and its role in innate and adaptive immune responses[J]. Cell Res, 2010, 20(1): 34-50. DOI:10.1038/cr.2009.139 |
| [26] |
Carroll MC. The complement system in regulation of adaptive immunity[J]. Nat Immunol, 2004, 5(10): 981-986. DOI:10.1038/ni1113 |
| [27] |
Geller A, Yan J. The role of membrane bound complement regulatory proteins in tumor development and cancer immunotherapy[J]. Front Immunol, 2019, 10: 1074. DOI:10.3389/fimmu.2019.01074 |
| [28] |
Pettinello R, Dooley H. The immunoglobulins of cold-blooded vertebrates[J]. Biomolecules, 2014, 4(4): 1045-1069. DOI:10.3390/biom4041045 |
| [29] |
Hsu E, Pulham N, Rumfelt LL, et al. The plasticity of immunoglobulin gene systems in evolution[J]. Immunol Rev, 2006, 210(1): 8-26. DOI:10.1111/j.0105-2896.2006.00366.x |
| [30] |
Contreras M, Moreno-Cid JA, Domingos A, et al. Bacterial membranes enhance the immunogenicity and protective capacity of the surface exposed tick Subolesin-Anaplasma marginale MSP1a chimeric antigen[J]. Ticks Tick Borne Dis, 2015, 6(6): 820-828. DOI:10.1016/j.ttbdis.2015.07.010 |
| [31] |
Pérez-Sánchez R, Manzano-Román R, Obolo-Mvoulouga P, et al. Function-guided selection of midgut antigens from Ornithodoros erraticus ticks and an evaluation of their protective efficacy in rabbits[J]. Vet Parasitol, 2019, 272: 1-12. DOI:10.1016/j.vetpar.2019.06.016 |
| [32] |
Nuttall PA, Trimnell AR, Kazimirova M, et al. Exposed and concealed antigens as vaccine targets for controlling ticks and tick‐ borne diseases[J]. Parasite Immunol, 2006, 28(4): 155-163. DOI:10.1111/j.1365-3024.2006.00806.x |
| [33] |
Trimnell AR, Hails RS, Nuttall PA. Dual action ectoparasite vaccine targeting 'exposed' and 'concealed' antigens[J]. Vaccine, 2002, 20(29-30): 3560-3568. DOI:10.1016/s0264-410x(02)00334-1 |
| [34] |
朱清仙, 刘志刚, 叶炳辉, 等. 中华硬蜱叮咬免疫兔后中肠消化细胞形态测量分析[J]. 中国体视学与图像分析, 1998, 3(3): 18-23. Zhu QX, Liu ZG, Ye BH, et al. Morphometrical analysis of the digestive cells of Ixodes sinensis after infesting immunized rabbits[J]. Chin J Stereol Image Anal, 1998, 3(3): 18-23. DOI:10.13505/j.1007-1482.1998.03.005 |
| [35] |
刘志刚, 叶炳辉, 朱清仙, 等. 中华硬蜱叮咬蜱抗原免疫接种宿主后中肠组织化学的动态观察[J]. 畜牧兽医学报, 2004, 35(4): 463-467. Liu ZG, Ye BH, Zhu QX, et al. Dynamic histochemistry changes in midgut of Ixodes sinensis after infesting on hosts immunized by tick antigen[J]. Acta Vet Zootech Sin, 2004, 35(4): 463-467. DOI:10.3321/j.issn:0366-6964.2004.04.022 |
| [36] |
Nakajima M, Kodama M, Yanase H, et al. Production and characterization of monoclonal antibodies against midgut of ixodid tick, Haemaphysalis longicornis[J]. Vet Parasitol, 2003, 115(4): 355-363. DOI:10.1016/s0304-4017(03)00187-0 |
| [37] |
Ackerman S, Clare FB, Mcgill TW, et al. Passage of host serum components, including antibody, across the digestive tract of Dermacentor variabilis (Say)[J]. J Parasitol, 1981, 67(5): 737-740. DOI:10.2307/3280459 |
| [38] |
Minoura H, Chinzei Y, Kitamura S. Ornithodoros moubata: Host immunoglobulin G in tick hemolymph[J]. Exp Parasitol, 1985, 60(3): 355-363. DOI:10.1016/0014-4894(85)90042-6 |
| [39] |
Wang H, Nuttall PA. Immunoglobulin-binding proteins in ticks: New target for vaccine development against a blood-feeding parasite[J]. Cell Mol Life Sci, 1999, 56(3/4): 286-295. DOI:10.1007/s000180050430 |
| [40] |
Wang F, Wang D, Jiang CZ, et al. Morphology and ultrastructure changes of Haemaphysalis longicornis Neumann (Acari: Ixodidae) female adult ticks at different developmental stages[J]. Int J Acarol, 2017, 43(4): 308-313. DOI:10.1080/01647954.2017.1298668 |
| [41] |
Brown SJ, Galli SJ, Gleich GJ, et al. Ablation of immunity to Amblyomma americanum by anti-basophil serum: Cooperation between basophils and eosinophils in expression of immunity to ectoparasites (ticks) in guinea pigs[J]. J Immunol, 1982, 129(2): 790-796. |
| [42] |
Karasuyama H, Wada T, Yoshikawa S, et al. Emerging roles of basophils in protective immunity against parasites[J]. Trends Immunol, 2011, 32(3): 125-130. DOI:10.1016/j.it.2010.11.006 |
| [43] |
Schroeder H, Skelly PJ, Zipfel PF, et al. Subversion of complement by hematophagous parasites[J]. Dev Comp Immunol, 2009, 33(1): 5-13. DOI:10.1016/j.dci.2008.07.010 |
| [44] |
Manzano-Román R, Encinas-Grandes A, Pérez-Sánchez R. Antigens from the midgut membranes of Ornithodoros erraticus induce lethal anti-tick immune responses in pigs and mice[J]. Vet Parasitol, 2006, 135(1): 65-79. DOI:10.1016/j.vetpar.2005.08.004 |
| [45] |
Morgan BP, Boyd C, Bubeck D. Molecular cell biology of complement membrane attack[J]. Semin Cell Dev Biol, 2017, 72: 124-132. DOI:10.1016/j.semcdb.2017.06.009 |
| [46] |
Lu LL, Suscovich TJ, Fortune SM, et al. Beyond binding: Antibody effector functions in infectious diseases[J]. Nat Rev Immunol, 2018, 18(1): 46-61. DOI:10.1038/nri.2017.106 |
| [47] |
Jennewein MF, Alter G. The immunoregulatory roles of antibody glycosylation[J]. Trends Immunol, 2017, 38(5): 358-372. DOI:10.1016/j.it.2017.02.004 |
 2022, Vol. 33
2022, Vol. 33