扩展功能
文章信息
- 赵聪, 张文举, 宁晓冬, 黄斌斌, 菅忆晨, 岳治光, 菅复春, 张龙现, 张素梅, 宁长申
- ZHAO Cong, ZHANG Wen-ju, NING Xiao-dong, HUANG Bin-bin, JIAN Yi-chen, YUE Zhi-guang, JIAN Fu-chun, ZHANG Long-xian, ZHANG Su-mei, NING Chang-shen
- 不同浓度大蒜素长效驱避剂对长角血蜱幼蜱的驱避效果研究
- Repellent efficacy of allicin long-acting repellents at different concentrations against larvae of Haemaphysalis longicornis
- 中国媒介生物学及控制杂志, 2022, 33(5): 648-654
- Chin J Vector Biol & Control, 2022, 33(5): 648-654
- 10.11853/j.issn.1003.8280.2022.05.007
-
文章历史
- 收稿日期: 2022-06-27
2 河南安进生物技术股份有限公司, 河南 郑州 450003;
3 河南应用技术职业学院, 河南 郑州 450042
2 Henan Anjin Biotechnology Co., Ltd., Zhengzhou, Henan 450003, China;
3 Henan Vocational College of Applied Technology, Zhengzhou, Henan 450042, China
蜱类不仅叮咬人和家畜,更是多种疾病的传播媒介,近一个世纪以来,利用化学合成的杀虫剂来治理蜱害取得了一定成果,但其造成的环境污染、药物残留及蜱耐药性等问题,越发受到人们的关注。化学合成的驱避剂避蚊胺被广泛用来驱避蜱类,但避蚊胺能够透皮吸收,对人体有潜在的危害;另外有不良气味、油腻感强,对塑料制品、皮革等具有腐蚀作用等[1],限制了其应用。而植物次生代谢物质具有低毒、低残留、易降解、与环境兼容性好的优点,一般被认为是潜在的化学杀虫剂及驱避剂的替代品[2]。因此研究开发绿色、安全、高效的天然驱避剂尤为重要。本试验研究了大蒜素对长角血蜱(Haemaphysalis longicornis)幼蜱的驱避效果,以期为筛选用于兽医临床的天然驱避剂提供参考。
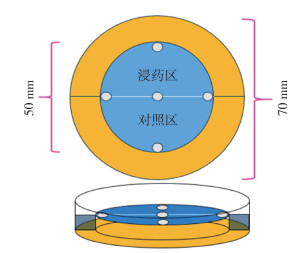
1 材料与方法 1.1 材料 1.1.1 蜱样品来源蜱样品于2020年8月4日采自河南省焦作市许湾村太行山,用布旗法采集草丛中成蜱56只,经形态学和分子生物学鉴定为长角血蜱。采获的蜱放于兔体饲养,收集饱血雌蜱置50 ml离心管含有湿棉花的试管内,室温(25~28 ℃)下保存。产卵、孵化,取幼蜱供试。本研究所用蜱均为同一雌蜱产卵孵化所得到的20日龄长角血蜱幼蜱,数量200只。见图1、2。

|
| 图 1 供试长角血蜱幼蜱(×5) Figure 1 Larvae of Haemaphysalis longicornis for testing (×5) |
| |

|
| 注:A孵化的幼蜱;B分装的活体幼蜱样品。 图 2 供试长角血蜱幼蜱 Figure 2 Larvae of Haemaphysalis longicornis for testing |
| |
大蒜素标准品(98%),购自世纪奥科生物技术有限公司;大蒜素水乳液(0.5%、1.0%、3.0%),大蒜素长效驱避剂(0.5%、1.0%、3.0%)、1%驱蚊酯长效驱避剂均为与河南安进生物有限公司合作研制,规格均为100 ml,批次均为20200524。OFF驱蚊液,上海庄臣有限公司,批号20200818AWPB,每瓶100 ml含避蚊胺7 g。六神驱蚊花露水,上海家化联合股份有限公司,批号20240216EODJS,每瓶195 ml,含薄荷醇、麝香。
1.1.3 其他材料101滤纸,18 cm×18 cm,杭州富阳木浆纸有限公司。
1.2 方法 1.2.1 不同浓度大蒜素对长角血蜱幼蜱的驱避活性分别称取大蒜素标准品(98%)5.10、10.20、15.31、20.41、40.82 mg于10 ml容量瓶中,加无水乙醇定容到刻度,配制成大蒜素浓度为0.5、1.0、1.5、2.0、3.0、4.0 mg/ml的系列溶液。采用Greive和Barnes[3]中的驱避试验装置,分别以0.5、1.0、1.5、2.0、3.0、4.0 mg/ml的大蒜素溶液为用药组,将101滤纸裁剪成ϕ50 mm的2个半圆,2个半圆滤纸片分别在相应浓度的大蒜素溶液及蒸馏水中浸泡10 min后取出,室温(23±2)℃自然风干5 min后,将浸泡过大蒜素及蒸馏水的2个半圆滤纸片重新组合成整圆放入幼蜱驱避试验装置中(图 3),并在水槽中注入蒸馏水防止幼蜱逃出试验区域,每次试验选取20只蜱放置于圆心处的铁块上,使其在场地中可以自由移动,并在装置上覆盖吸光布以隔绝外界光线的干扰,5 min后移去吸光布,观察蜱在滤纸片上的分布情况(每个试验重复3次,每次使用不同的幼蜱),统计驱避率,并绘制不同浓度大蒜素溶液对长角血蜱幼蜱的驱避活性曲线,计算半数驱避浓度(RC50)和全数驱避浓度(RC100)。驱避率计算公式如下:
|
| 图 3 蜱驱避试验装置模式图 Figure 3 Model diagram of tick repellent test device |
| |

|
将101滤纸裁剪成ϕ50 mm的2个半圆,2个半圆滤纸片一个在相应驱避剂中浸泡,另一个在蒸馏水中浸泡(每个处理组3个重复,对照组2个半圆均用蒸馏水浸泡)10 min后均取出,将该滤纸片在室温(23±2)℃下自然风干5 min后将半圆滤纸片组合放入幼蜱驱避装置中,驱避试验方法同1.2.1,计算实时驱避率。每次试验后将浸泡过相应的滤纸片取出,取出的滤纸片做好时间、用药情况标记,在25~28 ℃的室温下暴露在空气中放置,每48 h取该滤纸片继续上述驱避试验,直至第20天结束,测定不同浓度大蒜素长效驱避剂驱避长角血蜱幼蜱持续时间及其效果。
1.3 数据处理使用Excel 2016软件绘制不同药物不同时间对蜱的驱避率变化曲线,并用SPSS 18.0软件Kruskal-Wallis H检验对不同药物同一时间点的驱避活性的差异性进行分析,当处理组的驱避率首次下降至与对照组无统计学意义时,此时间点为最大作用时间,借此来比较不同处理组在不同时间的驱避效果,其中施药后驱避率≥90%的最大时间段为相应处理组的有效保护期。以P < 0.05为差异有统计学意义。
2 结果 2.1 大蒜素对长角血蜱幼蜱的驱避活性由图 4可见,大蒜素浓度在0.5~4.0 mg/ml内,随着浓度的增加其对长角血蜱幼蜱的驱避率逐渐上升,在4.0 mg/ml时达到95%以上,二者呈现一定的线性关系(y=28.818x-1.535,R2=0.892),RC50及RC100分别为1.79和3.52 mg/ml。

|
| 图 4 大蒜素对长角血蜱幼蜱驱避活性 Figure 4 Repellent activity of allicin against larvae of Haemaphysalis longicornis |
| |
由图 5可见,除对照组外,6个大蒜素处理组对蜱的驱避率在0 d时最高,均在95%以上,均大于对照组且差异有统计学意义(F=137.286、112.500、137.286、137.286、137.286、137.286,均P < 0.001)。但随着时间的增加,其驱避率均有不同程度的降低,16 d以后所有处理组的驱避率均下降到15%以下。其中0.5%、1.0%大蒜素水乳液的驱避活性在4 d内快速下降,分别由初始时的100%、96.7%下降到第4天的16.7%和23.3%,而3.0%大蒜素水乳液在2~6 d对蜱的驱避活性均大于0.5%、1.0%大蒜素水乳液,且差异有统计学意义(P < 0.05),但在8 d后其驱避活性均降至10%以下,与对照组接近(图 5)。另外,0.5%大蒜素长效驱避剂在2~10 d内的驱避活性均大于3.0%大蒜素水乳液,其中第4、6天时其驱避率为76.7%和43.3%,差异有统计学意义(4 d时,F=18.000,P=0.013;6 d时,F=12.500,P=0.024),而在2~12 d内其驱避活性小于同时间点的1.0%、3.0%大蒜素长效驱避剂,3.0%大蒜素长效驱避剂的驱避率在2~18 d内均大于1.0%大蒜素长效驱避剂,但二者之间差异无统计学意义(P > 0.05)(表 1)。分别对比相同浓度下不同剂型的大蒜素处理组,可以看到0.5%、1.0%、3.0%大蒜素长效驱避剂分别在2~10、2~12、2~12 d内的驱避活性不同程度地高于各自同浓度的大蒜素水乳液处理组。

|
| 注:相同天数对应数据点处字母相同表示差异无统计学意义(P > 0.05),字母不同表示差异有统计学意义(P < 0.05)。 图 5 不同浓度和剂型大蒜素处理组在不同时间的驱避活性变化 Figure 5 Change in repellent activity of different concentrations and dosage forms of allicin groups at different time |
| |

|
如表 1、图 6所示,除对照组(蒸馏水处理组)外,其他几个处理组在第5 min时对蜱的驱避活性均在90%以上,随着时间延长驱避活性不断下降,16 d后,所有处理组驱避活性均降至15%以下。在2~6 d内,六神驱蚊花露水和OFF驱蚊液的驱避活性相较于其他处理组变化较大,驱避活性分别由初始的96.7%、100%下降至第6天时的-6.7%和0,其中在第4天和第6天时,二者驱避活性均下降至10%以下,与对照组比较差异无统计学差意义(六神驱蚊花露水,F=1.000,P=0.374;OFF驱蚊液,F=0.100,P=0.768)。0.5%、1.0%、3.0%大蒜素长效驱避剂和驱蚊酯长效驱避剂在2~8 d内的驱避活性均大于相同时间点下的六神驱蚊花露水和OFF驱蚊液处理组。在12 d时,0.5%大蒜素长效驱避剂和驱蚊酯长效驱避剂的驱避活性差异无统计学差意义(F=0.040,P=0.851)。另外,驱蚊酯长效驱避剂的驱避活性在8 d内均大于对照组,其在2~12 d内的驱避率分别为86.7%、76.7%、63.3%、43.3%、16.7%和-3.3%,均小于1.0%、3.0%大蒜素长效驱避剂,而与0.5%大蒜素长效驱避剂较为接近,除第6天驱蚊酯长效驱避剂驱避活性大于0.5%大蒜素长效驱避剂,差异有统计学意义(F=18.000,P=0.013)外,二者在其他时间驱避率相近。

|
| 注:相同天数对应数据点处字母相同表示差异无统计学意义(P > 0.05),字母不同表示差异有统计学意义(P < 0.05)。 图 6 不同浓度大蒜素长效驱避剂与市售驱避剂在不同时间的驱避活性 Figure 6 Repellent activity of different concentrations of allicin long-acting repellents and commercially available repellents at different time after treating |
| |
处理5 min时,0.5%、1.0%、3.0%浓度下的大蒜素长效驱避剂处理组浸药区域的幼蜱数量为0,所对应的驱避率均为100%,但随着使用浓度的升高,幼蜱距离浸药区域的距离也越来越远,在3.0%浓度下幼蜱主要集中于滤纸片边缘。见图 7。

|
| 注:A 0.5%大蒜素长效驱避剂;B 1.0%大蒜素长效驱避剂;C 3.0%大蒜素长效驱避剂。 图 7 不同浓度大蒜素长效驱避剂5 min时对长角血蜱幼蜱的驱避效果 Figure 7 Repellent effect of different concentrations of allicin long-acting repellents on larvae of Haemaphysalis longicornis at 5 min after treating |
| |
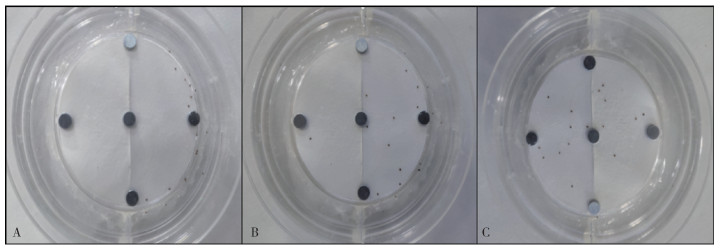
3.0%大蒜素长效驱避剂对长角血蜱幼蜱的驱避效果随着时间的延长而下降,5 min时,没有幼蜱停留在浸药区域;8 d时,浸药区域已经出现零星幼蜱,而到16 d时,浸药区域与对照区域的幼蜱分布已逐渐均匀。见图 8。
|
| 注:A 5 min;B 8 d;C 16 d。 图 8 不同时间3.0%大蒜素长效驱避剂对长角血蜱幼蜱的驱避效果 Figure 8 Repellent effect of 3% allicin long-acting repellent on larvae of Haemaphysalis longicornis at different time after treating |
| |
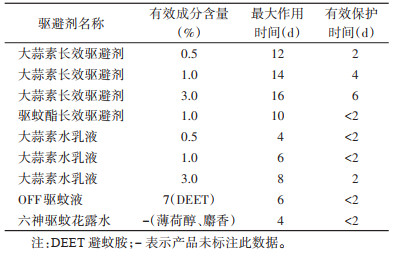
由表 2可见,0.5%、1.0%、3.0%的大蒜素长效驱避剂的有效保护期分别为2、4、6 d,最大作用时间分别为12、14和16 d,均优于对应浓度的大蒜素水乳液处理组及3个市售驱避剂处理组。
|
蜱类驱避剂发挥驱避作用的生理机制尚缺乏研究,关于蜱类是如何对驱避剂作出反应的研究还相对较少。大多数蜱类的驱避试验无法区分驱避剂的驱避作用是借助蜱的触觉还是嗅觉产生的。在本试验中,可以很明显观察到随着大蒜素使用浓度的升高,幼蜱距离浸药区域的距离也越来越远,在3.0%浓度下幼蜱主要集中于远离浸药区域的边缘,这一定程度上说明,幼蜱可以在不接触驱避物质的情况下对驱避剂作出反应,因此推测这可能是依靠其嗅觉产生。有研究表明硬蜱的哈氏器能够探测到空气中的驱避剂分子,嗅觉至少在一定程度上发挥了驱避作用[4]。例如,Dautel等[5]在“Y”形管驱避试验中发现,蓖籽硬蜱(Ixodes ricinus)若虫不会接近浸泡过避蚊胺(DEET)的滤纸片,而总是与其保持一定距离。McMahon等[6]发现,气流中混入驱虫剂邻苯二甲酸二甲酯会导致成年彩饰花蜱(Amblyomma variegatum)朝着与气流源相反的方向移动。Carroll等[7]在生物测试中,将驱虫剂处理过的手指包裹在有机纤维布中,以防止硬蜱直接接触驱虫剂。结果供试硬蜱在本试验中依旧被DEET和驱避剂SS220排斥,表明驱避作用可仅通过嗅觉获得。吡虫啉+氯菊酯混合溶液(IPSS)在兽医上被确定为是一种触杀药物,但Dautel和Cranna[8]在试验中发现硬蜱在爬行时触碰了IPSS处理的滤纸片后,出现明显的折返现象,说明硬蜱触觉感受在驱避作用中也起到了作用,即使IPSS不能像挥发油那样在空气中扩散。硬蜱的嗅觉和触觉化学感受在驱避作用中的相对重要性目前还没有得到充分的认识。除非在这方面进行更多的研究,否则很难理解这2种机制在未来新型驱避剂研发中的重要性。
3.2 大蒜素长效驱避剂的缓释效果在驱避剂的研制中,除了发掘更有效安全的驱避成分之外,另一重要的研究方向就是如何延缓驱避成分在使用后的流失以及透皮吸收现象。目前驱避剂的主要缓释手段有高分子聚合物、微胶囊、包结化合物、脂质体、水凝胶,并可以将其加工成油膏、乳剂、霜膏、喷雾剂、酊剂、气雾剂、摩丝、粉剂等剂型[9-11]。在本试验中,0.5%、1.0%、3.0%三个浓度的大蒜素水乳液的有效保护期均不超过2 d,而其长效剂型有效保护时间分别为2、4、6 d,同浓度下长效剂型的作用时间均优于普通水乳液,说明驱避剂制成长效剂型可以较好地解决驱避成分过快的问题。董桂蕃等[12]开发了一种以水溶性高分子化合物为载体材料的透明状水凝胶剂型,与普通酊剂和霜剂比较,明显延长驱避时间,室内试验和现场驱蚊效果试验对埃及伊蚊(Aedes aegypti)和白纹伊蚊(Ae. albopictus)均表现出良好的驱避效果;Yim等[13]研究了茶树油(TTO)乳剂和2种环糊精包结复合物的缓释型(SR)和改性缓释型(FR)对扇头蜱属蜱种(Rhipicephalus australis)的驱避效果,结果显示,FR在3 d内提供几乎完全的驱避效果(99.5%),到第15天依然可以驱避49.0%蜱。另外,驱避剂的使用效果除了受缓释技术手段影响外,亦受较多其他因素影响,如驱避剂的使用浓度、吸血昆虫的种类、密度、宿主的生理状态、个体差异以及使用时环境情况等[14-16]。
随着相关技术的进步,驱避剂将会逐渐取代杀蜱剂作为蜱类防治的主要手段。同时,如何在防控蜱类过程中应用新技术来创制新剂型、新制剂、新产品,来达到降低药物毒副作用、减少药物挥发和损耗、延长药物持效时间的目的一直是业界所努力的方向,另外还必须考虑到与畜牧业发展相适应,研制简单可行的生产工艺,尽量降低生产成本,才能对产品进行大规模推广应用,收到良好的社会和经济效益。
利益冲突 无
| [1] |
Barradas TN, Lopes LMA, Ricci-Júnior E, et al. Development and characterization of micellar systems for application as insect repellents[J]. Int J Pharm, 2013, 454(2): 633-640. DOI:10.1016/j.ijpharm.2013.05.050 |
| [2] |
李慧, 刘辉, 张兴. 植物源蚊虫驱避剂的研究与应用[J]. 中华卫生杀虫药械, 2018, 24(2): 199-202. Li H, Liu H, Zhang X. Research and application of botanical mosquito repellents[J]. Chin J Hyg Insect Equip, 2018, 24(2): 199-202. DOI:10.19821/j.1671-2781.2018.02.026 |
| [3] |
Greive KA, Barnes TM. In vitro comparison of four treatments which discourage infestation by head lice[J]. Parasitol Res, 2012, 110(5): 1695-1699. DOI:10.1007/s00436-011-2687-7 |
| [4] |
Carr AL, Salgado VL. Ticks home in on body heat: A new understanding of Haller's organ and repellent action[J]. PLoS One, 2019, 14(8): 23-31. |
| [5] |
Dautel H, Kahl O, Siems K, et al. A novel test system for detection of tick repellents[J]. Entomol Exp Appl, 1999, 91(3): 431-441. DOI:10.1046/j.1570-7458.1999.00511.x |
| [6] |
McMahon C, Krober T, Guerin PM. In vitro assays for repellents and deterrents for ticks: Differing effects of products when tested with attractant or arrestment stimuli[J]. Med Vet Entomol, 2003, 17(4): 370-378. DOI:10.1111/j.1365-2915.2003.00453.x |
| [7] |
Carroll JF, Klun JA, Debboun M. Repellency of Deet and SS220 applied to skin involves olfactory sensing by two species of ticks[J]. Med Vet Entomol, 2005, 19(1): 101-106. DOI:10.1111/j.0269-283X.2005.00559.x |
| [8] |
Dautel H, Cranna R. Assessment of repellency and mortality of a imidacloprid + permethrin spot-on solution against Ixodes holocyclus using a moving object bioassay[J]. Aus Vet Pract, 2006, 36(4): 136-147. |
| [9] |
陶波, 张大伟. 蚊虫驱避剂的研究进展[J]. 东北农业大学学报, 2014, 45(2): 123-128. Tao B, Zhang DW. Research advance of mosquito repellents[J]. J Northeast Agric Univ, 2014, 45(2): 123-128. DOI:10.3969/j.issn.1005-9369.2014.02.020 |
| [10] |
向婧洁, 钟延强, 樊莉, 等. 蚊虫驱避剂新进展[J]. 中国媒介生物学及控制杂志, 2013, 24(1): 79-82. Xiang JJ, Zhong YQ, Fan L, et al. Advances in mosquito repellent[J]. Chin J Vector Biol Control, 2013, 24(1): 79-82. |
| [11] |
张咏梅, 孙雯雯, 李培羽, 等. 对驱避剂的剂型及成分的试验研究[J]. 医学动物防制, 1996, 12(1): 23-25. Zhang YM, Sun WW, Li PY, et al. Experimental study on dosage form and composition of repellent[J]. Chin J Pest Control, 1996, 12(1): 23-25. |
| [12] |
董桂蕃, 董言德, 董瑞武, 等. 驱避剂新剂型的研究[J]. 中国媒介生物学及控制杂志, 1998, 9(3): 198-201. Dong GF, Dong YD, Dong RW, et al. Studies on the new formulation of repellent[J]. Chin J Vector Biol Control, 1998, 9(3): 198-201. DOI:10.3969/j.issn.1003-4692.1998.03.014 |
| [13] |
Yim WT, Bhandari B, Jackson L, et al. Repellent effects of Melaleuca alternifolia (tea tree) oil against cattle tick larvae (Rhipicephalus australis) when formulated as emulsions and in β-cyclodextrin inclusion complexes[J]. Vet Parasitol, 2016, 225: 99-103. DOI:10.1016/j.vetpar.2016.06.007 |
| [14] |
Qiu H, Jun HW, McCall JW. Pharmacokinetics, formulation, and safety of insect repellent N, N-diethyl-3-methylbenzamide (deet): A review[J]. J Am Mosq Control Assoc, 1998, 14(1): 12-27. |
| [15] |
Abdel-Ghaffar F, Al-Quraishy S, Mehlhorn H. Length of tick repellency depends on formulation of the repellent compound (icaridin = Saltidin®): Tests on Ixodes persulcatus and I. ricinus placed on hands and clothes[J]. Parasitol Res, 2015, 114(8): 3041-3045. DOI:10.1007/s00436-015-4506-z |
| [16] |
Debboun M, Frances SP, Strickman S. Insect repellents: Principles, methods, and uses[M]. Boca Raton: CRC Press, 2007: 245-260.
|
 2022, Vol. 33
2022, Vol. 33


