扩展功能
文章信息
- 段立科, 侯学霞, 张琳, 包子豪, 刘泽梁, 施淇源, 周海健, 董爱英, 郝琴
- DUAN Li-ke, HOU Xue-xia, ZHANG Lin, BAO Zi-hao, LIU Ze-liang, SHI Qi-yuan, ZHOU Hai-jian, DONG Ai-ying, HAO Qin
- 内蒙古阿尔山地区游离蜱携带伯氏疏螺旋体的检测及基因分型研究
- Detection and genotyping of Borrelia burgdorferi carried by free-living ticks in Arxan, Inner Mongolia, China
- 中国媒介生物学及控制杂志, 2022, 33(5): 642-647
- Chin J Vector Biol & Control, 2022, 33(5): 642-647
- 10.11853/j.issn.1003.8280.2022.05.006
-
文章历史
- 收稿日期: 2022-05-19
2 中国疾病预防控制中心传染病预防控制所螺旋体病控制室,传染病预防控制国家重点实验室,北京 102206
2 State Key Laboratory of Infectious Disease Prevention and Control, Department of Spirochetosis Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
莱姆病(Lyme disease)是20世纪70年代发现的一种人兽共患病,由携带伯氏疏螺旋体(Borrelia burgdorferi)的蜱叮咬人、兽而传播,因首次发现于美国康涅狄克州莱姆镇而得名[1]。1982年首次从全沟硬蜱(Ixodes persulcatus)中分离到伯氏疏螺旋体[2],随后相继在患者皮肤组织和脑脊液中培养出伯氏疏螺旋体。该病可累及多个器官和系统,皮肤游走性红斑是早期的特异表现,部分患者可伴有流感样症状,中期和晚期可表现为关节炎、神经根炎、心肌炎或慢性萎缩性肢端皮炎等[3]。莱姆病是美国最常见的媒介传播疾病,据美国疾病预防控制中心估计,每年的新发病例数约为300 000例[4]。欧洲在2016年报告了约85 000例病例。目前在欧洲、北美、亚洲和俄罗斯报道的莱姆病病例比任何其他蜱传细菌性疾病都多[5],而且发病率每年都在增长,给全球公共卫生事业带来了巨大挑战[6]。
1986年,我国在黑龙江省林区发现首例莱姆病病例[7],此后多个省(自治区、直辖市)相继出现莱姆病病例报道,因其流行性和危害性日益引起人们的关注,截止目前人群血清学调查显示约有30个省(自治区、直辖市)存在该病病例[8-9]。近年来,随着微观和宏观气候改变,人类行为如商业贸易、动物迁徙等活动使各地蜱的种类发生变化,蜱的栖息地和活动区域不断扩大,莱姆病传播风险随之增加。阿尔山市位于内蒙古自治区(内蒙古)兴安盟西北部,针、阔叶林繁密,畜牧业发达,是蜱的理想栖息地,但该地区尚未开展过莱姆病相关研究。本研究对内蒙古阿尔山地区采集的游离蜱进行伯氏疏螺旋体的检测和分离培养,确定其感染率和携带的主要基因型,为评估当地莱姆病传播风险,建立防控体系提供科学依据。
1 材料与方法 1.1 试剂与仪器 1.1.1 主要试剂DNA提取试剂盒(DNeasy Blood & Tissue Kit)购自德国Qiagen公司,PCR相关试剂(Premix TapTM,RR901A)购自TaKaRa公司。
1.1.2 主要仪器PCR仪(德国SensoQuest),电泳仪(北京君意东方电泳设备有限公司),组织研磨器(北京天根生化科技有限公司),凝胶成像仪(美国Bio-rad)。
1.2 蜱采集与蜱种鉴定2020年5月和2021年5月,在内蒙古阿尔山地区的草地和灌木丛生境选择4~5个采样点,采用布旗法采获游离蜱295只,根据蜱的形态学特征,如假头基、基突、背突、口下板、盾板、生殖孔和气门板的性状和位置,初步鉴定蜱种[10]。随后将蜱用75%乙醇溶液充分洗涤,再用纯水洗涤3次以除去残余的乙醇。每只蜱充分研磨后按照说明书提取蜱基因组DNA,利用PCR方法扩增蜱16S rDNA片段[11],扩增产物经一代测序后上传到美国国立生物技术信息中心(NCBI)比对,结合形态学特征和比对结果综合鉴定蜱种。
1.3 伯氏疏螺旋体检测 1.3.1 巢式PCR随机选择100只全沟硬蜱和全部13只森林革蜱提取基因组DNA,利用巢式PCR方法扩增伯氏疏螺旋体5S(rrfA)~23S(rrlB)rRNA基因间隔区,引物序列见表 1。配置1.5%琼脂糖凝胶,待扩增循环结束后,产物经凝胶电泳,凝胶成像系统读取结果。将阳性产物一代测序后,上传到NCBI比对,确定基因型。

|
从NCBI下载不同基因型伯氏疏螺旋体菌株5S~23S rRNA基因间隔区序列[12]和我国主要致病基因型标准菌株PD91(B. garinii)和FP1(B. afzelii)的序列[9],利用MEGA 11软件,将测得序列与下载参考序列采用Clustal W方法比对,邻接法(neighbor-joining method,NJ法)进行系统发育分析(相同序列选择1个作为代表序列),Bootstrap设置为1 000,其他参数为软件默认值。
1.4 伯氏疏螺旋体分离培养随机选取102只全沟硬蜱,将每只蜱在纯水中冲洗数次以去除表面杂质。然后将蜱浸泡在75%乙醇溶液10~15 min,最后用无菌蒸馏水冲洗去除残留乙醇,放在无菌滤纸上。干燥后,将蜱分为7组(10~15只/组),每组蜱中加入500 μl BSKⅡ培养基,用组织研磨器充分研磨后,3 000×g离心10 min,取100 μl研磨上清液,在BSKⅡ培养基中培养(33 ℃)。每周通过暗视野显微镜判断是否有螺旋体生长。若有螺旋体生长,待培养到螺旋体浓度达到107~108细胞/ml时,吸取培养液到离心管中,12 000×g离心30 min,弃去上清液,沉淀溶于磷酸缓冲盐溶液(PBS)中,12 000×g离心15 min,重复3次,最终重悬于100 μl TE,保存于-20 ℃。如果培养2个月后未见螺旋体生长,则视为阴性。
1.5 多位点序列分析(MLSA) 1.5.1 DNA提取利用水煮法制备全基因组DNA,将离心重悬的细菌置于100 ℃金属浴10 min,3 000×g离心3 min,得到上清液DNA。
1.5.2 PCR检测和系统发育分析PCR扩增基因和引物见表 2,反应体系和条件参照文献[14]所述。待扩增循环结束后,产物经1.5%琼脂糖凝胶电泳,凝胶成像仪读取结果。阳性产物经测序后,使用DNAStar中SeqMan软件人工校正减去两端不可靠碱基,得到分离菌株7个位点序列。在NCBI下载伯氏疏螺旋体不同基因型标准菌株7个位点的序列[14],利用MEGA 11软件删除两端不对齐序列,使不同菌株每个位点片段长度一致,每株菌均以rrs、hbb、groEL、recA、fla、ospA、rrf-rrl spacer的顺序拼接序列,Clustal W法比对,NJ法聚类分析确定基因型,Bootstrap设置为1 000,其他参数为软件默认值。
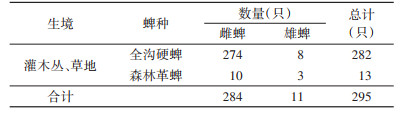
共采获295只游离蜱,蜱性别与蜱种分布如表 3所示,所有蜱均为成蜱。
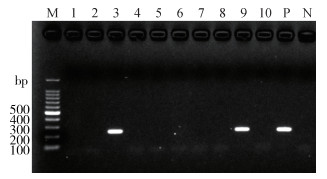
对113只蜱进行PCR检测,包括100只全沟硬蜱,13只森林革蜱。在全沟硬蜱中有24只检出伯氏疏螺旋体,检出率为24.00%;森林革蜱中未检出伯氏疏螺旋体。见图 1。
|
| 注:M marker;1~10不同蜱样本;P阳性对照;N阴性对照。 图 1 部分蜱样本巢式PCR检测伯氏疏螺旋体结果 Figure 1 Nested PCR analysis of Borrelia burgdorferi of some tick samples |
| |
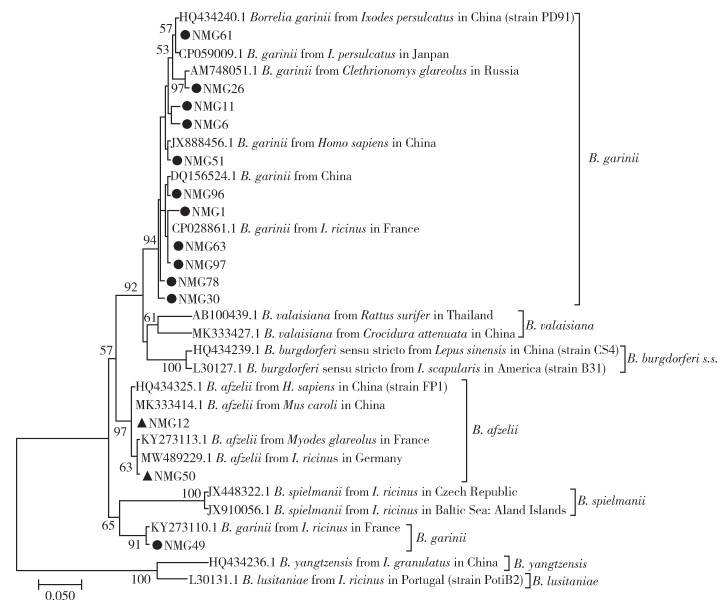
检出伯氏疏螺旋体的24只全沟硬蜱中,NMG1与NMG25序列相同,以NMG1为代表序列;NMG6、NMG55与NMG100序列相同,以NMG6为代表序列;NMG61、NMG85与NMG91序列相同,以NMG61为代表序列,将5条重复序列去除后,留下NMG1、NMG6和NMG61等12株不同序列与NCBI GenBank中B. garinii序列同源性较高(98%~100%),17只全沟硬蜱携带B. garinii基因型伯氏疏螺旋体。NMG12、NMG21、NMG74与NMG76序列相同,以NMG12为代表序列;NMG50、NMG70与NMG86序列相同,以NMG50为代表序列,NMG12、NMG50与B. afzelii同源性较高(98%~100%),7只全沟硬蜱携带B. afzelii基因型伯氏疏螺旋体(图 2)。内蒙古阿尔山地区全沟硬蜱携带B. garinii(17/24,70.83%)和B. afzelii(7/24,29.17%)2种基因型伯氏疏螺旋体。
|
| 注:●本研究中测得聚类分析为B. garinii的序列;▲本研究中测得聚类分析为B. afzelii的序列。 图 2 伯氏疏螺旋体5S~23S rRNA基因间隔区聚类分析 Figure 2 Cluster analysis based on 5S-23S rRNA intergenic spacer region of Borrelia burgdorferi |
| |
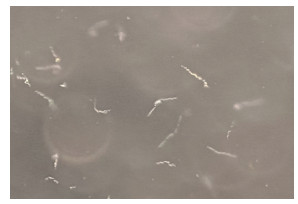
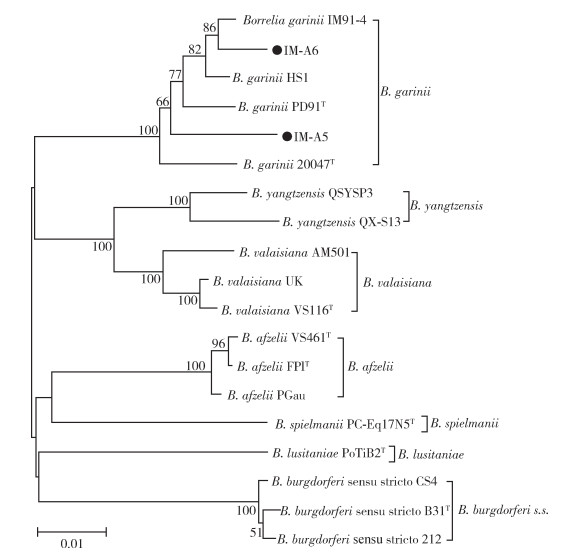
从102只全沟硬蜱中分离出2株菌,其形态如图 3所示。MLSA分析结果表明均为B. garinii菌株,命名为IM-A5和IM-A6。IM-A6与内蒙古全沟硬蜱中分离出的菌株IM91-4同源性较高,位于同一分支,IM-A5则单独位于一个分支。见图 4。
|
| 图 3 伯氏疏螺旋体镜下形态(×200,暗视野) Figure 3 Morphology of Borrelia burgdorferi under microscope (×200, dark field) |
| |
|
| 注:●本研究中分离的伯氏疏螺旋体菌株。 图 4 内蒙古阿尔山地区伯氏疏螺旋体分离菌株的多位点序列分析鉴定结果 Figure 4 Multilocus sequence analysis of isolates of Borrelia burgdorferi from Arxan, Inner Mongolia, China |
| |
莱姆病是一种新发的蜱媒传染病。1986年,我国从黑龙江省林区发现第1例莱姆病患者[7],截止2018年,共有2 786例病例报道[15],发病数逐年增长,对人民健康构成严重威胁。对媒介蜱伯氏疏螺旋体感染状况的研究,可评估人群感染风险,为当地开展莱姆病的防控工作提供理论依据。
内蒙古是我国蜱传疾病的重疫区之一,本次调查地为内蒙古阿尔山市,位于兴安盟西北部,绿色植被覆盖率高,野生动物资源丰富,畜牧业发达,属寒温带大陆性季风气候。5月在阿尔山市采获的游离蜱以全沟硬蜱居多,占比高达95.59%,为当地的优势蜱种,有文献曾对我国常见蜱种适宜栖息地做了预测,指出我国东北地区气温随季节变化明显,针阔混交林覆盖面积广,具备全沟硬蜱生存繁殖的适宜条件[15],这与本次调查的结果相对应。除全沟硬蜱外,也有少量森林革蜱检出,与刘丹等[16]的研究结果相似。
5S(rrfA)~23S(rrlB)rRNA基因间隔区是伯氏疏螺旋体基因上特异片段,巢式PCR方法扩增这一特异基因常被用作媒介蜱中伯氏疏螺旋体检测方法。本次实验结果显示,阿尔山地区全沟硬蜱中伯氏疏螺旋体携带率达24.00%。汤芳等[17]在内蒙古林区采获的全沟硬蜱携带疏螺旋体比例达29.01%,Gaowa等[18]在内蒙古采获的全沟硬蜱伯氏疏螺旋体感染率为43.80%,提示该地区林业工作者、林区居民以及旅游人群有感染莱姆病的风险,进入林区要做好自我防护。目前伯氏疏螺旋体可分为20多个基因型,我国发现的致病基因型主要为B. garinii和B. afzelii,此外,B. burgdorferi sensu stricto、B. bavariensis和B. spielmanii等相关的基因型也会导致人类感染。阿尔山地区17只全沟硬蜱中检出B. garinii基因型伯氏疏螺旋体,检出率为17.00%,系统发育分析显示分为12个分支,分布较为分散,与伯氏疏螺旋体不同菌株间存在较大的遗传异质性有关。B. garinii在我国最早于1986年从黑龙江省的莱姆病病例中检出,是我国伯氏疏螺旋体常见致病基因型之一。B. afzelii是在我国北方和南方都存在的致病基因型,于2000年首次从黑龙江省的莱姆病病例中分离[19]。本研究中检出B. afzelii的蜱有7只,检出率为7.00%。本次采获的森林革蜱中未检出伯氏疏螺旋体,可能是蜱数量有限,难以反映真实携带率,在后面的研究中将进一步加大媒介蜱的采集和检测,同时开展人群、宿主的莱姆病感染状况调查,为当地建立莱姆病的防控体系提供科学依据。
研究发现,莱姆病患者不同的临床表现与感染的基因型不同相关。美国流行的基因型为B. burgdorferi sensu stricto,患者通常表现关节炎症状;而欧洲和亚洲感染B. garinii和B. afzelii的患者较为多见,常出现神经系统病变和慢性萎缩性肢端皮炎。
MLSA分型方法基于伯氏疏螺旋体染色体和质粒上的7个保守基因位点,对于伯氏疏螺旋体菌株分型具有很好的应用性,侯学霞等[20]曾使用该方法对山西省吕梁地区分离菌株进行基因分型。本研究中分离培养出2株伯氏疏螺旋体(IM-A5和IM-A6),经MLSA分型鉴定均为B. garinii基因型,聚类分析显示IM-A6与内蒙古全沟硬蜱中分离出的菌株IM91-4位于同一分支,亲缘关系较近。
综上所述,内蒙古阿尔山地区的优势蜱种为全沟硬蜱,其伯氏疏螺旋体感染率较高,携带的基因型为我国主要致病基因型B. garinii和B. afzelii,提示当地居民、林区工作人员以及到该地旅游人群进入林区、牧场等地有感染莱姆病的风险,应注意自我防护,避免被蜱叮咬。内蒙古阿尔山市应针对莱姆病等蜱传疾病,建立相应的监测防控体系,加强灭蜱、灭鼠工作,同时对基层医护人员进行莱姆病相关知识培训,以便对疑似病例早诊断、早治疗。
利益冲突 无
| [1] |
Steere AC, Malawista SE, Snydman DR, et al. Lyme arthritis: An epidemic of oligoarticular arthritis in children and adults in three Connecticut communities[J]. Arthritis Rheum, 1977, 20(1): 7-17. DOI:10.1002/art.1780200102 |
| [2] |
Burgdorfer W, Barbour AG, Hayes SF, et al. Lyme disease-a tick-borne spirochetosis?[J]. Science, 1982, 216(4552): 1317-1319. DOI:10.1126/science.7043737 |
| [3] |
Maraspin V, Mrvič T, Ružić-Sabljić E, et al. Acrodermatitis chronica atrophicans in children: Report on two cases and review of the literature[J]. Ticks Tick Borne Dis, 2019, 10(1): 180-185. DOI:10.1016/j.ttbdis.2018.10.009 |
| [4] |
Steere AC, Strle F, Wormser GP, et al. Lyme borreliosis[J]. Nat Rev Dis Primers, 2016, 2: 16090. DOI:10.1038/nrdp.2016.90 |
| [5] |
Madison-Antenucci S, Kramer LD, Gebhardt LL, et al. Emerging tick-borne diseases[J]. Clin Microbiol Rev, 2020, 33(2): e00083-18. DOI:10.1128/CMR.00083-18 |
| [6] |
White J, Noonan-Toly C, Lukacik G, et al. Lyme disease surveillance in New York state: An assessment of case underreporting[J]. Zoonoses Public Health, 2018, 65(2): 238-246. DOI:10.1111/zph.12307 |
| [7] |
Ai CX, Wen YX, Zhang YG, et al. Clinical manifestations and epidemiological characteristics of Lyme disease in Hailin county, Heilongjiang province, China[J]. Ann N Y Acad Sci, 1988, 539: 302-313. DOI:10.1111/j.1749-6632.1988.tb31864.x |
| [8] |
张哲夫, 万康林, 张金声, 等. 我国莱姆病的流行病学和病原学研究[J]. 中华流行病学杂志, 1997, 18(1): 8-11. Zhang ZF, Wan KL, Zhang JS, et al. Studies on epidemiology and etiology of Lyme disease in China[J]. Chin J Epidemiol, 1997, 18(1): 8-11. |
| [9] |
Hao Q, Hou XX, Geng Z, et al. Distribution of Borrelia burgdorferi sensu lato in China[J]. J Clin Microbiol, 2011, 49(2): 647-650. DOI:10.1128/JCM.00725-10 |
| [10] |
刘敬泽, 杨晓军. 蜱类学[M]. 北京: 中国林业出版社, 2013: 31-36. Liu JZ, Yang XJ. Ixodesmology[M]. Beijing: China Forestry Publishing House, 2013: 31-36. |
| [11] |
Wang YZ, Mu LM, Zhang K, et al. A broad-range survey of ticks from livestock in northern Xinjiang: Changes in tick distribution and the isolation of Borrelia burgdorferi sensu stricto[J]. Parasit Vectors, 2015, 8: 449. DOI:10.1186/s13071-015-1021-0 |
| [12] |
Yang XN, Yang HJ, Zhang L, et al. Tick-borne pathogens in Shanxi province, China[J]. Biomed Environ Sci, 2021, 34(5): 410-415. DOI:10.3967/bes2021.055 |
| [13] |
张琳, 苗广青, 侯学霞, 等. 巢式PCR和实时荧光定量PCR在莱姆病宿主动物监测中的应用评价[J]. 中国媒介生物学及控制杂志, 2018, 29(5): 425-427. Zhang L, Miao GQ, Hou XX, et al. Evaluation of nested PCR and real-time PCR in host surveillance of Lyme disease[J]. Chin J Vector Biol Control, 2018, 29(5): 425-427. DOI:10.11853/j.issn.1003.8280.2018.05.001 |
| [14] |
Richter D, Postic D, Sertour N, et al. Delineation of Borrelia burgdorferi sensu lato species by multilocus sequence analysis and confirmation of the delineation of B. spielmanii sp. nov.[J]. Int J Syst Evol Microbiol, 2006, 56(Pt 4): 873-881. DOI:10.1099/ijs.0.64050-0 |
| [15] |
Zhao GP, Wang YX, Fan ZW, et al. Mapping ticks and tick-borne pathogens in China[J]. Nat Commun, 2021, 12(1): 1075. DOI:10.1038/s41467-021-21375-1 |
| [16] |
刘丹, 乌兰图雅, 殷旭红, 等. 内蒙古地区2015-2019年不同寄生蜱的种群分布及病原体多样性分析[J]. 现代预防医学, 2021, 48(8): 1345-1349, 1398. DOI:1003-8507(2021)08-1345-06. Liu D, Wulantuya, Yin XH, et al. Analysis on the spieces distribution and pathogen diversity of different parasitic ticks from 2015 to 2019 in Inner Mongolia, China[J]. Mod Prev Med, 2021, 48(8): 1345-1349, 1398. DOI:1003-8507(2021)08-1345-06.(in Chinese) |
| [17] |
汤芳, 周磊, 蒋兰芬, 等. 内蒙古奇乾地区媒介蜱携带伯氏疏螺旋体的调查研究[J]. 传染病信息, 2018, 31(1): 31-33. Tang F, Zhou L, Jiang LF, et al. Investigation on Borrelia burgdorferii in ticks collected in Qiqian region of Inner Mongolia[J]. Infect Dis Inf, 2018, 31(1): 31-33. DOI:10.3969/j.issn.1007-8134.2018.01.007 |
| [18] |
Gaowa, Wulantuya, Sato K, et al. Surveillance of Borrelia miyamotoi-carrying ticks and genomic analysis of isolates in Inner Mongolia, China[J]. Parasit Vectors, 2021, 14(1): 368. DOI:10.1186/s13071-021-04809-z |
| [19] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in mainland China: An increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/S1473-3099(15)00177-2 |
| [20] |
侯学霞, 张琳, 李国华, 等. 山西省吕梁地区莱姆病自然疫源地调查研究[J]. 中国媒介生物学及控制杂志, 2017, 28(6): 550-552. Hou XX, Zhang L, Li GH, et al. Investigation on natural foci of Lyme disease in Lyuliang area, Shanxi province[J]. Chin J Vector Biol Control, 2017, 28(6): 550-552. DOI:10.11853/j.issn.1003.8280.2017.06.008 |
 2022, Vol. 33
2022, Vol. 33