扩展功能
文章信息
- 李樊, 刘凤明, 冯盼盼, 王东强, 付士红, 聂凯, 殷启凯, 何英, 殷佳宇, 许松涛, 包名家, 王环宇
- LI Fan, LIU Feng-ming, FENG Pan-pan, WANG Dong-qiang, FU Shi-hong, NIE Kai, YIN Qi-kai, HE Ying, YIN Jia-yu, XU Song-tao, BAO Ming-jia, WANG Huan-yu
- 黑龙江省桦南县2020年蜱媒病毒调查
- Investigation of tick-borne viruses in Huanan county, Heilongjiang province, China, 2020
- 中国媒介生物学及控制杂志, 2022, 33(5): 637-641
- Chin J Vector Biol & Control, 2022, 33(5): 637-641
- 10.11853/j.issn.1003.8280.2022.05.005
-
文章历史
- 收稿日期: 2022-04-23
2 佳木斯市疾病预防控制中心,黑龙江 佳木斯 154000;
3 桦南县疾病预防控制中心,黑龙江 佳木斯 154400
2 Jiamusi Center for Disease Control and Prevention, Jiamusi, Heilongjiang 154000, China;
3 Hua'nan Center for Disease Control and Prevention, Jiamusi, Heilongjiang 154400, China
蜱媒病毒(Tick-borne viruses,TBV)是一类重要的虫媒病毒,其在蜱和脊椎动物宿主间感染、复制并传播,引起人兽共患疾病[1]。重要的蜱媒病毒包括:蜱传脑炎病毒(Tick-borne encephalitis virus,TBEV)、发热伴血小板减少综合征病毒(Severe fever with thrombocytopenia syndrome virus,SFTSV,现名大别班达病毒,Dabie bandavirus,DBV)、鄂木斯克出血热病毒(Omsk hemorrhagic fever virus,OHFV)、兰加特病毒(Langat virus,LGTV)、波瓦森病毒(Powassan virus,POWV)以及新发现的阿龙山病毒(Alongshan virus,ALSV)等[2]。蜱是一类专性吸血的节肢动物,可寄生于哺乳动物、鸟类、爬行类和两栖类等脊椎动物体表,吸血进食以促进发育,是蜱媒病毒的主要传播媒介。蜱在适宜的温湿度条件下出现活动高峰,在温带地区春夏季较为多见,在热带地区全年可见。硬蜱多分布在比较开阔的生境,如森林、草原、灌木丛等,不同蜱种生存的环境不尽相同,例如全沟硬蜱(Ixodes persulcatus)多见于高纬度针阔混交林带,草原革蜱(Dermacentor nuttalli)则分布在草原地带。
黑龙江省佳木斯市桦南县位于我国东北部,地处三江平原腹地,小兴安岭余脉,是蜱媒疾病的重要自然疫源地。在该地区开展蜱媒病毒监测和调查,对于该地区的蜱媒疾病预防控制具有重要意义。本研究在黑龙江省佳木斯市桦南县蜱活动高峰季开展了蜱标本采集,并对这些蜱携带的相关病毒开展核酸筛查和检测,研究结果将为当地制订针对性的防控措施提供重要的科学数据。
1 材料与方法 1.1 标本采集2020年5月在黑龙江省佳木斯市桦南县(东经130°50′,北纬46°23′)采集游离蜱样本。采集方式为人工布旗法,采集生境主要集中在林区、草地[3]。装有蜱的收集容器内放入润湿的棉花,密封容器口,做好编号和登记,常温运送至实验室。
1.2 形态学鉴定蜱种在体视显微镜下根据蜱假头基、基突、须肢、盾板、侧沟、气门、生殖孔、肛沟、尾突等形态学特征,对采获的蜱标本进行分类鉴定,鉴定过程在低温冰排上进行。
1.3 病毒核酸提取和筛查将采获的蜱按种类和性别,约10只混为1管(批次),共获得90批次。进行机械研磨后,吸取研磨液上清,并进行核酸提取。使用QIAamp Viral RNA Mini Kit(德国Qiagen公司)按说明书方法提取病毒RNA。使用实时荧光定量PCR方法检测样本中TBEV、SFTSV、OHFV、LGTV、POWV、ALSV核酸,引物和探针序列详见表 1和研究团队已发表论文[4]。反应体系为:2×RT-PCR buffer 12.5 µl和25×RT-PCR Enzyme Mix 1 µl(AgPath-ID One-Step RT-PCR Kit,美国ThermoFisher公司),10 nmol/L正、反向引物各1 µl,5 nmol/L探针0.5 µl,提取的RNA模板1 µl,无核酶水8 µl。迅速置于QuantStudio5荧光定量PCR仪(美国ThermoFisher公司)进行反应,反应条件为:45 ℃ 10 min;95 ℃ 10 min;95 ℃ 15 s和60 ℃ 1 min,45次循环。
以1.3中提取的病毒RNA样本为模板,使用Superscript Ⅳ反转录酶(美国ThermoFisher公司)和随机引物,按试剂盒说明书合成cDNA。获得的cDNA采用REPLI-g Mini Kit(德国Qiagen公司)进行全基因组扩增(whole genome amplification,WGA),之后使用0.8倍体积的AMPure XP Beads(德国Beckman公司)纯化扩增产物。利用Qubit4.0荧光计(美国ThermoFisher公司)对纯化产物进行定量后,使用NexteraXT DNA Library Preparation Kit(美国Illumina公司)按说明书提供的标准流程完成测序文库的构建。使用0.8倍体积的AMPure XP Beads(德国Beckman公司)纯化文库。通过Qubit定量后,应用Novoseq测序平台进行双端150 bp测序反应。Sanger测序由生工生物工程(上海)股份有限公司完成。
1.5 病毒基因组拼接对下机数据进行质控后,使用Bowtie2(v2.3.5)软件将下机数据与参考基因组(reference sequence:NC_001672.1)进行双端序列比对[5]。利用Samtools(v1.9)软件提取双端比对到病毒基因组的读序,并根据比对信息进行排序和去重处理。生成基于参考基因组NC_001672.1的一致性(consensus)序列,结合Sanger测序结果,补齐序列中存在的空缺(gap),使用SeqMan软件(DNAStar)进行核苷酸序列拼接,最终获得病毒基因组一致性序列。
1.6 分子遗传特征分析从美国国立生物技术信息中心(NCBI)GenBank中下载不同型别的TBEV全基因组序列,使用MAFFT(v7.471)进行多序列比对[6]。使用MEGA 7.0软件完成基于邻接法(neighbour-joining method,NJ法)的系统进化分析,Bootstrap值设定为1 000,构建和修饰系统进化树。
2 结果 2.1 蜱种构成2020年5月在佳木斯市桦南县林区和农场共采获游离蜱890只,包括全沟硬蜱475只,占比53.37%,其中雄蜱210只、雌蜱265只;森林革蜱(D. silvarum)360只,占40.45%,其中雄蜱260只、雌蜱100只;嗜群血蜱(Haemaphysalis concinna)55只,占6.18%,其中雄蜱5只、雌蜱50只。全沟硬蜱为采获的优势蜱种。
2.2 实时荧光定量PCR方法病毒核酸检测利用实时荧光定量PCR方法分别对TBEV、SFTSV、OHFV、LGTV、POWV、ALSV共6种病毒进行筛查,核酸检测结果发现其中1批标本(编号JMS20)TBEV核酸阳性,检测循环阈值(Ct)为28。而ALSV、SFTSV、OHFV、LGTV、POWV核酸检测结果均为阴性。此组TBEV核酸阳性标本为雌性全沟硬蜱。本次调查全沟硬蜱的最低带病毒率为0.21%。
2.3 TBEV基因组序列JMS20高通量测序下机文库获得165 652 768条读序,去除低质量和带接头的读序后,得到139 777 242条读序,占原始数据读序数的84.38%。以下载的TBEV参考株(NC_001672.1,11 141 bp)作为参照基因组进行比对获得的一致性序列,结合Sanger测序结果,最终获得TBEV序列覆盖参考基因组的73.61%(8 201/11 141)。
2.4 TBEV基因特征在GenBank中选择47株来自不同国家(地区)、采集时间、型别的TBEV序列,与本研究获得的TBEV基因序列组成基于E基因片段的数据集,构建基于NJ法的系统进化树。结果显示,本研究获得的TBEV序列位于远东亚型(Far Eastern subtype)分支,与西伯利亚型(Siberian subtype)、欧洲亚型(Europe subtype)、Baikalian亚型、Himalaya亚型等进化亲缘关系较远。见图 1。
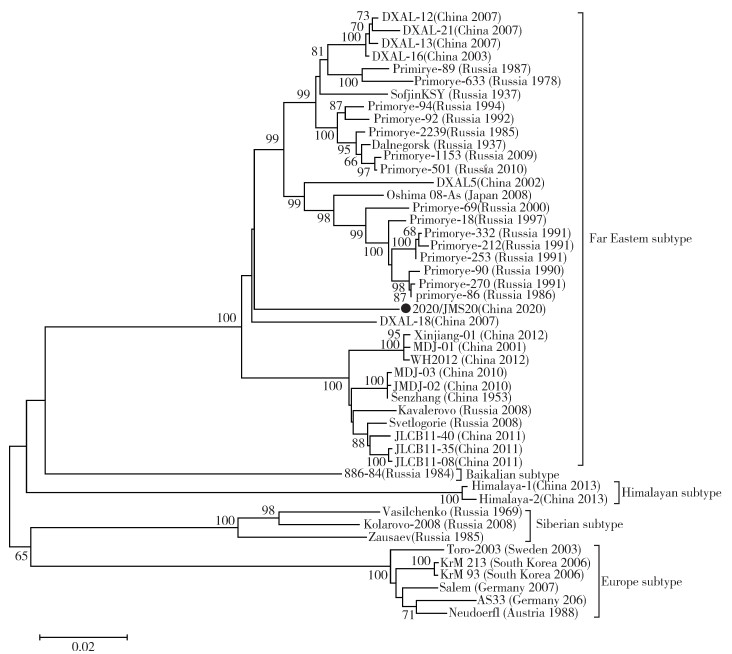
|
| 图 1 基于JMS20病毒株包膜区E核苷酸序列的系统进化分析 Figure 1 Phylogenetic analysis based on nucleotide sequences encoding envelope protein E of strain JMS20 |
| |
进一步分析发现,JMS20独立于远东亚型2个主要进化分支,又不同于DXAL-18(China 2007),进化地位较为特殊。包膜E蛋白氨基酸序列分析结果显示,JMS20与我国使用的蜱传脑炎(Tick-borne encephalitis,TBE)灭活疫苗株(森张株)存在6个氨基酸差异位点。见表 2。

|
本研究选择了桦南县蜱最活跃季节(春季)开展调查研究。在桦南县共采获1科3属3种蜱,均为我国东北地区的常见蜱种,也为佳木斯地区的常见蜱种[4]。此3种蜱是TBEV的最主要传播媒介,其中全沟硬蜱携带的病原体种类最多,森林革蜱中立克次体的丰度和占比很高[7]。本次调查发现1组全沟硬蜱呈现TBEV核酸阳性,全沟硬蜱TBEV的最低带病毒率为0.21%,该TBEV为远东型,进化地位特殊。
TBE在我国又称森林脑炎,是由携带TBEV的蜱叮咬所致的以中枢神经系统病变为主的自然疫源性传染病。感染者的临床症状主要以意识障碍、脑膜刺激征和瘫痪为主,半数以上病例有不同程度意识障碍、颅神经瘫痪,可导致长期或永久性神经后遗症甚至死亡[8]。TBE流行主要分布于北纬39°~65°的广大地区,包括大多数北欧国家、俄罗斯、中国、韩国以及日本等国家和地区。我国东北的大兴安岭、小兴安岭和长白山三大林区是TBEV的自然疫源地[9]。此外,西北地区新疆维吾尔自治区天山北麓及阿尔泰山南麓也是其自然疫源地[10]。在我国4-7月是蜱繁殖期,也是TBE高发期。
TBEV由前苏联科学家Tkachev于1936年在前苏联的远东地区首次分离[11]。TBEV属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),是具有包膜的单股正链RNA病毒,全基因组约为11 kb,仅包含有1个开放阅读框(ORF),依次编码3种结构蛋白(C、prM和E)和7种非结构蛋白(NS1、NS2A、NS2B、NS3、NS4A、NS4B和NS5)。根据病毒基因组序列多样性,TBEV主要分为3个型别:欧洲亚型、西伯利亚型和远东亚型。近年研究又陆续发现了Baikalian亚型、Himalaya亚型等。不同型别之间毒力差异较大,3个主要亚型毒株感染引起的病死率分别为0.5%~2.0%(欧洲亚型)、6.0%~8.0%(西伯利亚型)和5.0%~20.0%(远东亚型)[12]。我国东北地区流行的TBEV主要为远东亚型,致残致死率高,历史上曾给该地区造成严重的疾病负担[13]。我国于1952年从TBE死亡患者张某的脑组织中分离到该病毒,命名为“森张株”,该毒株被用于生产TBE灭活疫苗。
本研究针对TBEV远东亚型的进化分析结果显示,该型具有2个较大的谱系,近年来陆续发现了分离于两大谱系之外的DXAL-18和本研究鉴定的JMS20。依据现有数据分析,DXAL-18和JMS20株的进化地位极其特殊,但其进化地位的形成和流行特征目前尚未明晰。根据碱基替代模型估算,TBEV是一种较为“年轻”的病毒,其起源时间在1 000~10 000年[14]。学界对于TBEV基因组变异的认识仍然十分有限,迄今为止观察到的亚型多样性和型间基因距离的分离仍无法解释。如果病毒是随着时间的推移逐渐进化的,那么遗传距离会呈现梯度进化模式。基因距离双峰分布的一般解释为:①量子事件(亚型对新宿主或生态的快速适应);②长时间的进化过程中,一些谱系的灭绝和另一些谱系的广泛传播;③这2种机制的结合。因此,罕见的变异或谱系的发现有助于理解和深入研究TBEV的变异和进化[15]。对TBE主要自然疫源地开展调查,监测TBEV的遗传变异情况,发现其遗传多样性,深入理解TBEV进化传播规律和生物学特性,对该疾病的防控具有指导意义。
本次调查未发现SFTSV、OHFV、LGTV、POWV和ALSV等在该地区流行的证据。SFTSV,国际病毒分类委员会最新命名为Dabie bandavirus(大别班达病毒),属于布尼亚病毒目(Bunyavirales)班达病毒属(Bandavirus),于2010年首次从感染者血清中分离到,其引起的发热伴血小板减少综合征病例也在我国的河南、湖北、山东、安徽、辽宁和江苏省等多地被发现[16]。ALSV是2017年在我国内蒙古自治区呼伦贝尔市阿龙山镇发现的一种新的分节RNA病毒,属黄病毒科的荆门病毒群(Jingmen Group)[17]。随后芬兰学者在篦麻硬蜱(I. ricinus)中也检测到ALSV[18],俄罗斯学者在俄罗斯东部地区也分离到ALSV[19],目前的研究结果提示该病毒在欧亚大陆分布较为广泛。OHFV、LGTV、POWV均属黄病毒科黄病毒属,分别流行于俄罗斯鄂木斯克地区、北美洲、东南亚地区,流行区域具有较强的地理局限性[2],目前在我国的流行和传播风险较低。本研究结果对于了解佳木斯地区蜱媒病毒流行情况具有一定科学意义。
本研究对2020年采自黑龙江省佳木斯市的蜱标本开展了6种重要的蜱媒病毒调查,尚未发现SFTSV、OHFV、LGTV、POWV、ALSV在该地区流行的证据,而TBEV远东亚型仍然是佳木斯市最主要的蜱媒病毒,本次调查研究结果为该地区蜱媒病毒的防控提供了参考数据。
志谢 佳木斯市疾病预防控制中心(CDC)、桦南县CDC的同志在蜱标本采集过程中给予配合和帮助,一并志谢利益冲突 无
| [1] |
Boulanger N, Boyer P, Talagrand-Reboul E, et al. Ticks and tick-borne diseases[J]. Méd Mal Infect, 2019, 49(2): 87-97. DOI:10.1016/j.medmal.2019.01.007 |
| [2] |
Shi JM, Hu ZH, Deng F, et al. Tick-borne viruses[J]. Virol Sin, 2018, 33(1): 21-43. DOI:10.1007/s12250-018-0019-0 |
| [3] |
石华, 王玥, 韩华, 等. 蜱媒疾病风险评估中标本采集方法的探讨[J]. 中华卫生杀虫药械, 2013, 19(4): 308-310. Shi H, Wang Y, Han H, et al. Discussion of methods for specimen collection in the tick-borne risk evaluation[J]. Chin J Hyg Insect Equip, 2013, 19(4): 308-310. DOI:10.19821/j.1671-2781.2013.04.010 |
| [4] |
王倩莹, 刘凤明, 付士红, 等. 黑龙江边境地区蜱虫携带病原体调查[J]. 中华实验和临床病毒学杂志, 2019, 33(5): 504-508. Wang QY, Liu FM, Fu SH, et al. Investigation of tick-borne pathogens in Heilongjiang border area[J]. Chin J Exp Clin Viral, 2019, 33(5): 504-508. DOI:10.3760/cma.j.issn.1003-9279.2019.05.013 |
| [5] |
Langmead B, Salzberg SL. Fast gapped-read alignment with Bowtie 2[J]. Nat Methods, 2012, 9(4): 357-359. DOI:10.1038/nmeth.1923 |
| [6] |
Rozewicki J, Li SL, Amada KM, et al. MAFFT-DASH: Integrated protein sequence and structural alignment[J]. Nucleic Acids Res, 2019, 47(W1): W5-W10. DOI:10.1093/nar/gkz342 |
| [7] |
Jia N, Wang JF, Shi WQ, et al. Large-scale comparative analyses of tick genomes elucidate their genetic diversity and vector capacities[J]. Cell, 2020, 182(5): 1328-1340. e13. DOI:10.1016/j.cell.2020.07.023 |
| [8] |
Varlacher JF, Hägglund S, Juremalm M, et al. Tick-borne encephalitis[J]. Rev Sci Tech, 2015, 34(2): 453-466. DOI:10.20506/rst.34.2.2371 |
| [9] |
Chen XJ, Li F, Yin QK, et al. Epidemiology of tick-borne encephalitis in China, 2007-2018[J]. PLoS One, 2019, 14(12): e0226712. DOI:10.1371/journal.pone.0226712 |
| [10] |
吕志, 梁国栋. 中国蜱传脑炎研究进展[J]. 中华流行病学杂志, 2009, 30(6): 641-643. Lyu Z, Liang GD. Advances in research on tick-borne encephalitis in China[J]. Chin J Epidemiol, 2009, 30(6): 641-643. DOI:10.3760/cma.j.issn.0254-6450.2009.06.026 |
| [11] |
Dumpis U, Crook D, Oksi J. Tick-borne encephalitis[J]. Clin Infect Dis, 1999, 28(4): 882-890. DOI:10.1086/515195 |
| [12] |
Süss J. Tick-borne encephalitis 2010: Epidemiology, risk areas, and virus strains in Europe and Asia-an overview[J]. Ticks Tick Borne Dis, 2011, 2(1): 2-15. DOI:10.1016/j.ttbdis.2010.10.007 |
| [13] |
Xing Y, Schmitt HJ, Arguedas A, et al. Tick-borne encephalitis in China: A review of epidemiology and vaccines[J]. Vaccine, 2017, 35(9): 1227-1237. DOI:10.1016/j.vaccine.2017.01.015 |
| [14] |
Subbotina EL, Loktev VB. Molecular evolution of the tick-borne encephalitis and Powassan viruses[J]. Mol Biol, 2012, 46(1): 75-84. DOI:10.1134/S0026893311060148 |
| [15] |
Deviatkin AA, Karganova GG, Vakulenko YA, et al. TBEV subtyping in terms of genetic distance[J]. Viruses, 2020, 12(11): 1240. DOI:10.3390/v12111240 |
| [16] |
Zhan JB, Wang Q, Cheng J, et al. Current status of severe fever with thrombocytopenia syndrome in China[J]. Virol Sin, 2017, 32(1): 51-62. DOI:10.1007/s12250-016-3931-1 |
| [17] |
Wang ZD, Wang B, Wei F, et al. A new segmented virus associated with human febrile illness in China[J]. N Engl J Med, 2019, 380(22): 2116-2125. DOI:10.1056/NEJMoa1805068 |
| [18] |
Kuivanen S, Levanov L, Kareinen L, et al. Detection of novel tick-borne pathogen, Alongshan virus, in Ixodes ricinus ticks, south-eastern Finland, 2019[J]. Euro Surveill, 2019, 24(27): 1900394. DOI:10.2807/1560-7917.ES.2019.24.27.1900394 |
| [19] |
Kholodilov IS, Litov AG, Klimentov AS, et al. Isolation and characterisation of Alongshan virus in Russia[J]. Viruses, 2020, 12(4): 362. DOI:10.3390/v12040362 |
 2022, Vol. 33
2022, Vol. 33



