扩展功能
文章信息
- 高杨, 许士奇, 王丽娜, 郭文平, 刘铭
- GAO Yang, XU Shi-qi, WANG Li-na, GUO Wen-ping, LIU Ming
- 河北省塞罕坝国家级自然保护区蜱类调查研究
- An investigation of tick species in Saihanba National Nature Reserve of Hebei province, China
- 中国媒介生物学及控制杂志, 2022, 33(5): 632-636
- Chin J Vector Biol & Control, 2022, 33(5): 632-636
- 10.11853/j.issn.1003.8280.2022.05.004
-
文章历史
- 收稿日期: 2022-06-09
2 承德医学院生物医学工程系,河北 承德 067000;
3 承德医学院基础医学院病原生物学教研室,河北 承德 067000
2 Department of Biomedical Engineering, Chengde Medical University, Chengde, Hebei 067000, China;
3 Department of Pathogenic Biology, School of Basic Medical Science, Chengde Medical University, Chengde, Hebei 067000, China
蜱是仅次于蚊虫的第二大传染病媒介生物,宿主多样且分布广泛,可寄生于不同的脊椎动物[1]。作为专性吸血节肢动物,蜱在吸血的同时传播多种病原体(细菌、病毒、立克次体、螺旋体、原虫等),严重影响畜牧业发展及人类健康[1-2]。蜱媒病原体在世界范围内每年可导致1万多例临床病例,且呈逐年增加趋势,尤其近年来中国多地发生的蜱叮咬人致死事件,引起人们对蜱及蜱媒疾病进一步重视[2-4]。近些年随着研究不断深入,已证实中国蜱及蜱媒病原体的地理分布均有扩展,且愈发严重[5-6]。由于现阶段尚无单一、有效途径控制蜱类,因此需在充分了解蜱的宿主、生境和季节分布的基础上,采取多种方法对蜱及蜱媒疾病进行综合防治[1, 3]。
塞罕坝国家级自然保护区(塞罕坝保护区)位于河北省围场满族蒙古族自治县(围场县)北部,是典型森林-草原生态交错带[7],野生动、植物资源丰富,利于蜱类生存。该保护区地处冀蒙交界处,而内蒙古地区蜱类多样,由于环境变化、物种迁移以及地区间人、物流动频繁,大大增加了塞罕坝保护区内蜱媒疾病的传播风险,而保护区蜱类研究资料较为匮乏,缺乏对于该地区蜱及蜱媒疾病的系统研究。为掌握塞罕坝保护区内蜱类本底资料,明确该地区蜱类季节变化规律,丰富区内蜱类研究内容,2018年3-12月对该地区蜱类生境分布及季节消长情况进行了调查,以期为后续蜱及蜱媒疾病的综合防控提供理论依据。
1 材料与方法 1.1 地理概况塞罕坝保护区(东经116°89′78″~117°65′25″,北纬42°06′00″~42°60′43″)海拔1 010~1 939.6 m,属中寒温带大陆性季风气候,年平均气温-1.2 ℃[8]。夏季气候凉爽,最高气温一般不超过25 ℃,冬季漫长且寒冷干燥,极端最低气温可达-43.3 ℃[9]。
1.2 自由生活蜱的数量调查2018年3-12月,分别在针叶林、阔叶林、混合针叶林、草地和灌丛5种植被类型内选取1 000 m2的样方(图 1)。采用布旗法在样方内每2周采蜱1次,1 m2的粗糙白布,一端固定在金属杆上,手持另一端拖动布旗在植被上收集蜱,每25~30 m检查布旗。使用扫旗法在灌丛样方采蜱,将白布缠绕铝合金杆上,在灌丛内外反复摆动。每样方采样30 min,仔细检查布旗和防护服,用镊子夹取蜱放入50 ml离心管中,带回实验室,并记录种类、数量和发育阶段[10]。

|
| 图 1 塞罕坝国家级自然保护区蜱类调查点空间分布 Figure 1 Spatial distribution of tick investigation sites in Saihanba National Nature Reserve |
| |
2018年3-12月,每月随机选择5只羊收集寄生蜱,在羊圈内将羊固定好后,仔细检查其耳部、犄角根部、头面部和其他部位[11],用镊子夹住蜱假头逆叮咬方向快速将蜱拔出,随即将蜱放入50 ml的离心管内,同时记录寄生蜱的数量和发育阶段。2018年5-9月,采用笼日法调查鼠体表的寄生蜱,每日17:00左右放置捕鼠笼,翌日08:00检查捕鼠笼,用2%的戊巴比妥钠(pelltobarbitalum natricum)以0.2 ml/100 g的剂量将其麻醉[11],随后检查其体表蜱的寄生情况。每月调查1次宿主动物体表的寄生蜱,并将收集到的蜱带回实验室分类鉴定[10]。

|
使用Excel 2010软件进行数据录入分析,Origin 7.0软件做图,SPSS 21.0软件进行数据分析,采用χ2检验比较不同生境和不同宿主中蜱的数量与寄生强度差异。P < 0.05为差异有统计学意义。
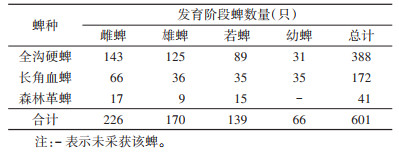
2 结果 2.1 蜱种类及其构成2018年3-12月,共采获硬蜱601只,隶属3属3种(表 1)。从自然植被上采获的游离蜱数量(458只)明显多于宿主动物体表的寄生蜱(143只)(表2、3)。在所采获蜱中,全沟硬蜱(Ixodes persulcatus)数量最多,占采获总数的64.56%(388/601);其次是长角血蜱(Haemaphysalis longicornis),占28.62%(172/601);森林革蜱(Dermacentor silvarum)数量最少,占6.82%(41/601)。调查期间,全沟硬蜱和长角血蜱3个发育阶段(成蜱、若蜱、幼蜱)均有采获,森林革蜱只采获成蜱和若蜱,无幼蜱。见表 1。
|

|

|
调查期间,仅全沟硬蜱在5种生境中都存在,长角血蜱存在于除针叶林外的4种生境,森林革蜱只存在于灌丛(表 2),不同蜱种的生境差异有统计学意义(χ2=96.506,P < 0.001)。在灌丛和草地存在的蜱较多(268只),占游离蜱总数的58.52%;在针叶林存在的蜱最少,占9.39%。
2.3 不同宿主寄生蜱的构成本研究共检查宿主动物87只,其中羊50只,鼠37只,其中阳性动物总数为36只,总感染率为41.38%,羊体及鼠体的感染率分别为46.00%和35.14%(表 3)。在动物体表共采获蜱143只,总寄生强度为3.97(143/36),且蜱在鼠体上的寄生强度(66/13,5.08)高于羊体上的寄生强度(77/23,3.35)(表 3)。不同宿主的寄生蜱差异有统计学意义(χ2=16.106,P < 0.001),羊体和鼠体体表均采获全沟硬蜱和长角血蜱,而森林革蜱仅在羊体上出现。另外,在鼠体上采获的均为全沟硬蜱和长角血蜱的幼蜱。见表 3。
2.4 蜱的季节消长2018年3-12月,蜱的数量变化趋势明显,且不同蜱种间的数量差异有统计学意义(χ2=31.437,P < 0.001)。塞罕坝保护区内蜱3月可见活动,而后数量迅速增加;5月中旬-8月,蜱的数量维持在较高水平;10-12月蜱大量减少直至消失(图 2)。在调查期间,全沟硬蜱数量最多,6月初其成蜱达到高峰(表 4、图 2);而后成蜱数量快速减少,幼蜱与若蜱数量随之增加,8月初若蜱和幼蜱数量达到高峰,之后各发育阶段的全沟硬蜱数量都迅速减少。长角血蜱与森林革蜱的变化趋势相似,3-6月间数量增加缓慢,8月达到高峰,而后数量也迅速减少(图 2)。高峰时期不同发育阶段的长角血蜱组成不同,7月该蜱的成蜱多于幼蜱和若蜱,而8月幼蜱和若蜱数量高于成蜱。见表 4。

|
| 图 2 塞罕坝国家级自然保护区内蜱类季节消长 Figure 2 Seasonal fluctuation of ticks in Saihanba National Nature Reserve |
| |
本次调查发现全沟硬蜱是该地区优势蜱种,占此次采获蜱总数的64.56%,长角血蜱次之,森林革蜱最少。长角血蜱在中国分布广泛,全沟硬蜱与森林革蜱主要分布于黑龙江、吉林、辽宁省及内蒙古自治区(内蒙古)等地[12]。塞罕坝保护区存在多个蜱种,可能是由于近年随着环境气候变化,蜱类适宜的生存环境不断增加[13],以及塞罕坝保护区与内蒙古接壤,且动植物资源丰富[7, 9],随着动物迁徙与人员流动频繁,加剧了该保护区及毗邻地区蜱类扩散,从而使得该区域出现蜱种多样性。全沟硬蜱是中国北方的优势蜱种,分布范围主要受到温度和湿度影响[12, 14]。该蜱最佳适生区的年温差 > 30 ℃,年降雨量在450~816 mm[14]。塞罕坝保护区冬季长且寒冷,最冷月平均温度可低至-21.9 ℃、最热月平均温度13.6 ℃,平均降水量452 mm[7],基本达到全沟硬蜱最佳适生区标准,因此该蜱适宜在塞罕坝保护区内生存,成为该区域的优势蜱种。
在所调查的5种生境类型中,灌丛和草地中的游离蜱较多,与已报道研究结果一致[11, 13, 15]。本调查中牲畜主要在灌丛与草地活动,而游离蜱种群数量一般与宿主的密度有密切关系[13],且游离蜱一般在植被尖部等待宿主动物靠近,一旦接触便在动物体表寄生[15]。因此在塞罕坝保护区内的灌丛和草地中采集的游离蜱较多。本研究中全沟硬蜱除了大量存在于灌丛和草地外,在针阔混交林中的数量明显多于阔叶林和针叶林(表 2),与草地中该蜱数量相似,与之前全沟硬蜱生境报道一致[12],表明针阔混交林也是该蜱的主要生境之一,应引起相关部门的重视。
本次调查中,蜱对宿主动物的感染率达41.38%,说明塞罕坝保护区内蜱对宿主的侵袭较为严重。其中羊体的感染率为46.00%,可能是灌丛与草丛是该地区蜱的主要生境,且羊群一般在灌丛与草丛内放养,导致蜱对羊体的侵袭较为严重。鼠体的感染率为35.14%,表明该地区鼠类存在作为宿主传播多种蜱媒病原体的可能性,因此相关部门应对鼠类做好监控,以预防蜱媒疾病的发生。本次调查所采获的3种蜱皆是三宿主蜱,幼蜱主要寄生于啮齿类等小型哺乳动物,因此在鼠体上发现了全沟硬蜱和长角血蜱的幼蜱,该结果与已往报道一致[11]。森林革蜱的采样量较少(41只),调查过程中未发现其幼蜱。
2018年3-12月,调查区域内全沟硬蜱成蜱的高峰出现在5-6月,若蜱的高峰出现在8月,均早于长角血蜱。不同区域生态因子(温度、湿度、宿主、光照等)的差异会导致同种蜱的生活史和季节消长发生改变,同一区域的不同蜱也会对相似的生态因子产生不同的生理反应,继而出现季节变化特征的差异[1, 11, 15]。全沟硬蜱对于低温和干燥有更强的耐受力[14, 16],因此塞罕坝保护区内的全沟硬蜱出现活动高峰早于长角血蜱的现象。已有报道表明河北省长角血蜱数量高峰出现在7月[11],而本研究中塞罕坝保护区内长角血蜱的活动高峰为8月,略晚于之前报道。这可能是一方面长角血蜱成蜱对于活动高峰的温度要求较高,气温需要达到18 ℃[11];另一方面塞罕坝保护区地处河北省最北部(图 1),年平均气温较低,因此导致该保护区内的长角血蜱出现较晚且活动周期较短。本次调查所采获到的森林革蜱数量较少,但其季节动态变化趋势与长角血蜱类似。
综上所述,塞罕坝保护区内蜱种多样,分布广泛且不同生境分布特征明显;蜱的活跃期集中于5-8月,与夏季旅游高峰期重合。因此建议景区相关部门加大蜱及蜱媒疾病防控宣传力度,提醒广大游客加强个人防护,注意自我保护,及时涂抹驱避剂,以减少或避免蜱叮咬[17],相关部门应建议养殖户在蜱高发季节较少放牧或者实行圈养。另外,本研究还提示相关部门应做好蜱媒疾病的监测工作,严控媒介传染病跨区域传播及流行,提高蜱及蜱媒疾病预测、预警能力。本研究获得了该区域蜱类的基本情况,但更准确的结论,特别是蜱季节动态变化仍需今后长期稳定的调查。
利益冲突 无
| [1] |
Dantas-Torres F. Climate change, biodiversity, ticks and tick-borne diseases: The butterfly effect[J]. Int J Parasitol: Parasit Wildl, 2015, 4(3): 452-461. DOI:10.1016/j.ijppaw.2015.07.001 |
| [2] |
Ramezani Z, Chavshin AR, Telmadarraiy Z, et al. Ticks (Acari: Ixodidae) of livestock and their seasonal activities, northwest of Iran[J]. Asian Pac J Trop Dis, 2014, 4(2): S754-757. DOI:10.1016/S2222-1808(14)60721-0 |
| [3] |
于志军, 刘书广, 董娜, 等. 蜱类基础生物学研究进展[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 205-208. Yu ZJ, Liu SG, Dong N, et al. Research progress on fundamental biology of ticks[J]. Chin J Vector Biol Control, 2018, 29(2): 205-208. DOI:10.11853/j.issn.1003.8280.2018.02.025 |
| [4] |
刘吉起, 赵奇, 许汴利. 蜱类研究进展[J]. 中国媒介生物学及控制杂志, 2013, 24(2): 186-188. Liu JQ, Zhao Q, Xu BL. Progress in research on ticks[J]. Chin J Vector Biol Control, 2013, 24(2): 186-188. |
| [5] |
周明浩, 陈红娜. 我国新发蜱媒病原体研究概述[J]. 中华卫生杀虫药械, 2019, 25(3): 193-198. Zhou MH, Chen HN. A review on emerging tick-borne pathogens in China[J]. Chin J Hyg Insect Equip, 2019, 25(3): 193-198. DOI:10.19821/j.1671-2781.2019.03.001 |
| [6] |
Yu ZJ, Wang H, Wang TH, et al. Tick-borne pathogens and the vector potential of ticks in China[J]. Parasit Vectors, 2015, 8(1): 24. DOI:10.1186/s13071-014-0628-x |
| [7] |
崔岩. 塞罕坝国家森林公园观赏性树木调查与分析[J]. 安徽农学通报, 2019, 25(10): 59, 73. Cui Y. Investigation and analysis of ornamental trees in Saihanba National Forest Park[J]. Anhui Agric Sci Bull, 2019, 25(10): 59, 73. DOI:10.16377/j.cnki.issn1007-7731.2019.10.026 |
| [8] |
周磊, 汤芳, 栾进, 等. 内蒙古奇乾地区蜱携带斑点热立克次体的调查[J]. 中国国境卫生检疫杂志, 2017, 40(2): 96-99. Zhou L, Tang F, Luan J, et al. Investigation on spotted fever group Rickettsiae in ticks collected from Qiqian areas of Inner Mongolia[J]. Chin J Front Health Quar, 2017, 40(2): 96-99. DOI:10.16408/j.1004-9770.2017.02.006 |
| [9] |
王利宏, 刘纪建. 塞罕坝森林公园发展条件分析[J]. 安徽农学通报, 2018, 24(20): 118-119. Wang LH, Liu JJ. Analysis on development conditions of Saihanba Forest Park[J]. Anhui Agric Sci Bull, 2018, 24(20): 118-119. DOI:10.16377/j.cnki.issn1007-7731.2018.20.046 |
| [10] |
陆宝麟, 吴厚永. 中国重要医学昆虫分类与鉴别[M]. 郑州: 河南科学技术出版社, 2003: 652-713. Lu BL, Wu HY. Classification and identification of important medical insects of China[M]. Zhengzhou: Henan Science and Technology Press, 2003: 652-713. |
| [11] |
Zheng HY, Yu ZJ, Zhou LF, et al. Seasonal abundance and activity of the hard tick Haemaphysalis longicornis (Acari: Ixodidae) in North China[J]. Exp Appl Acarol, 2012, 56(2): 133-141. DOI:10.1007/s10493-011-9505-x |
| [12] |
吴海霞, 刘小波, 岳玉娟, 等. 2019年全国蜱类监测报告[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 417-422. Wu HX, Liu XB, Yue YJ, et al. National surveillance report on ticks in China, 2019[J]. Chin J Vector Biol Control, 2020, 31(4): 417-422. DOI:10.11853/j.issn.1003.8280.2020.04.007 |
| [13] |
朱金国, 徐连贵, 陈美超, 等. 2015年额尔古纳口岸及毗邻林区蜱类调查[J]. 中国国境卫生检疫杂志, 2016, 39(5): 336-338. Zhu JG, Xu LG, Chen MC, et al. Surveillance on ticks in the Argun port and adjacent forest zones, 2015[J]. Chin J Front Health Quar, 2016, 39(5): 336-338. DOI:10.16408/j.1004-9770.2016.05.009 |
| [14] |
马奔, 马晓羽, 张仪, 等. 我国全沟硬蜱适生区预测[J]. 中国血吸虫病防治杂志, 2021, 33(2): 169-176. Ma B, Ma XY, Zhang Y, et al. Prediction of suitable habitats of Ixodes persulcatus in China[J]. Chin J Schisto Control, 2021, 33(2): 169-176. DOI:10.16250/j.32.1374.2020244 |
| [15] |
Meng H, Xu SQ, Yu ZJ, et al. Abundance and seasonal activity of Haemaphysalis concinna (Acari: Ixodidae) at the border between China and Russia in Northern Inner Mongolia, China[J]. Parasit Vectors, 2016, 9(1): 1. DOI:10.1186/s13071-015-1291-6 |
| [16] |
Di Luca M, Toma L, Bianchi R, et al. Seasonal dynamics of tick species in an urban park of Rome[J]. Ticks Tick-Borne Dis, 2013, 4(6): 513-517. DOI:10.1016/j.ttbdis.2013.06.008 |
| [17] |
师佳佳, 吕明洁, 袁中良. 郑州市蜱类地理分布、寄生宿主及季节消长调查[J]. 中国媒介生物学及控制杂志, 2021, 32(3): 361-364. Shi JJ, Lyu MJ, Yuan ZL. An investigation of geographical distribution, host, and seasonality of ticks in Zhengzhou, China[J]. Chin J Vector Biol Control, 2021, 32(3): 361-364. DOI:10.11853/j.issn.1003.8280.2021.03.020 |
 2022, Vol. 33
2022, Vol. 33



