扩展功能
文章信息
- 郑卫青, 付仁龙, 陶卉英, 刘仰青, 陈盛恩
- ZHENG Wei-qing, FU Ren-long, TAO Hui-ying, LIU Yang-qing, CHEN Sheng-en
- 实验室长角血蜱吸食小鼠血方法与评价
- Laboratory method and evaluation of Haemaphysalis longicornis feeding on mouse blood
- 中国媒介生物学及控制杂志, 2022, 33(5): 627-631
- Chin J Vector Biol & Control, 2022, 33(5): 627-631
- 10.11853/j.issn.1003.8280.2022.05.003
-
文章历史
- 收稿日期: 2022-05-20
蜱属于蛛形纲节肢动物,为体外寄生生物,依靠大量吸食宿主血液完成生长、发育和繁殖,其对人和牲畜能造成重大危害,包括贫血、蜱瘫痪(tick paralysis)、红肉过敏症(red meat allergies)[1-2]。此外,蜱在吸血过程中还能传播多种病原体,是仅次于蚊虫的病原体传播媒介,引发严重的蜱传病,如莱姆病、森林脑炎、发热伴血小板减少综合征[3-4]、无形体病以及泰勒虫和巴贝斯虫等寄生虫病[5-7]。
蜱实验室饲养能为研究蜱生物学特性、媒介效能、蜱、宿主与病原体相互作用提供标准、可比的生物材料,同时为研究防蜱抗病药物、疫苗提供可靠支撑。目前,蜱实验室饲养方法有体外人工和宿主体表 2个供血体系。常见的体外人工喂血有2种方法,即采用硅胶膜和动物皮膜的体外供血[8-9],该法血餐可定量,且免去宿主的免疫抵抗,但不能准确评价蜱类的媒介效能以及蜱类、病原体与宿主相互作用关系[10];宿主体表吸血是指蜱类通过切割活体宿主动物皮肤,刺破血管获取血液,供血的宿主动物一般为大白兔,该方法沿用多年,技术成熟,血源供给稳定[11-12],但血源单一,无法满足嗜特异宿主蜱的生长、发育和繁殖,亦有一些实验室尝试固定小白鼠供血,弊端是蜱类需在较大范围内搜索吸血靶标部位,吸血活力有限,对于需要交配的虫种,饱血率更低[13]。此外,固定实验鼠限制其活动的行为也违背了动物福利[9, 13]。本文研制并探讨了一种可用于蜱实验室饲养的吸血小室,该小室在一定范围内不限制宿主活动,且稳定供血,可用于蜱、病原体与宿主相互关系的研究。
1 材料与方法 1.1 试虫长角血蜱(Haemaphysalis longicornis)孤雌生殖种群(以下简称孤雌种群)采自四川省苍溪县,两性生殖种群(以下简称两性种群)采自河北省小五台山国家自然保护区,均由河北师范大学河北省动物生理生化与分子生物学重点实验室生态学团队赠送。饲养环境温度(25±1)℃,相对湿度85%~90%。
1.2 实验动物昆明小鼠,普通级,购自湖南史莱克景达实验动物有限公司,6周龄,用于蜱吸血。实验环境温度(25±1)℃。
1.3 蜱吸血小室制备取15 ml离心管,在离管口2 cm处切开,保留离心管上半部。沿切口处上方粘贴宽约为5 mm的双面胶(日本Nichiban),双面胶的另一面粘连具伸缩性且中间镂空的圆形布料,布料基部外侧用强力布基胶粘贴并固定在离心管壁,布料端部内侧涂布黏性强、贴合度高、对鼠皮刺激性低的780#非凡力布料胶水。根据布料端部的面积,用电动理发器在小鼠背部前半部剃出相当面积的鼠毛,并涂抹相应胶水,待布面和昆明小鼠体表胶水干燥至适宜程度,用力压合2个表面,并用吹风机微风吹粘连面,加速粘结过程。粘连小室的昆明小鼠正常饲养1 d,检查小室鼠咬情况以及粘连面的破损和脱胶情况,如完好,可用于蜱吸血。供血时,旋开管盖即可放入蜱。见图 1。

|
| 注:A瓶盖,钻小孔,便于空气流通;B切去管身和端部的15 ml离心管;C强力布基胶带,内侧粘贴布料,布料内层与双面胶粘连,双面胶另一面粘贴在离心管壁;D伸缩性良好的布料,布料表面涂抹胶水,与涂抹胶水的鼠皮肤紧密贴合。 图 1 蜱吸食小鼠血装置示意图和实物图 Figure 1 Schematic diagram and real picture of laboratory chamber for rearing Haemaphysalis longicornis by feeding on mouse blood |
| |
每个吸血小室均投入1组蜱。长角血蜱孤雌种群若虫4组,两性种群3组,每组30只。孤雌种群成虫2组,每组3只;两性种群3组,每组4只,其中3只雌蜱,1只雄蜱。
1.5 体质量测量与计算将清洗干净的蜱类,置于1/10 000 g天平称量。
1.6 蜱生长、发育和繁殖能力观察与评价 1.6.1 若蜱生长、发育观察观察指标包括叮咬成功率、叮咬时长、吸血期、饱血体质量、蜕皮前期和蜕皮率。叮咬成功率,将4 d内叮咬的蜱设定为叮咬成功,计算叮咬成功的蜱数与观察蜱总数的百分比即为叮咬成功率,未成功叮咬蜱移出实验;叮咬时长,指每组从第1只蜱叮咬至最后1只蜱叮咬的时间;吸血期,指从蜱叮咬成功至蜱饱血所需时间;饱血体质量,即5只饱血蜱的重量;蜕皮前期,指蜱饱血至蜕皮所需时间;蜕皮率,指蜕皮为成蜱的蜱数与饱血若蜱数的百分比。
1.6.2 成蜱生长、发育观察观察指标包括饱血率和吸血期,饱血率指饱血蜱占叮咬蜱的比例。
1.6.3 成蜱繁殖能力观察孤雌和两性饱血蜱,分别置于不同容器,于产卵的第1~4天每天收集卵并计数,之后在第6、7、9、14天收集卵并计数。记录每只蜱产卵前期、产卵数、孵化期和孵化率。产卵前期,指蜱饱血到产下第1粒虫卵所需时间;产卵数,指采集卵总数;孵化期,指开始采集卵到第1枚卵孵化所需时间;孵化率,指孵化卵数与采收总卵数之比值。
1.7 动物伦理本实验所涉及动物实验已获动物伦理审批通过,动物伦理审批批号:21010100/2015。
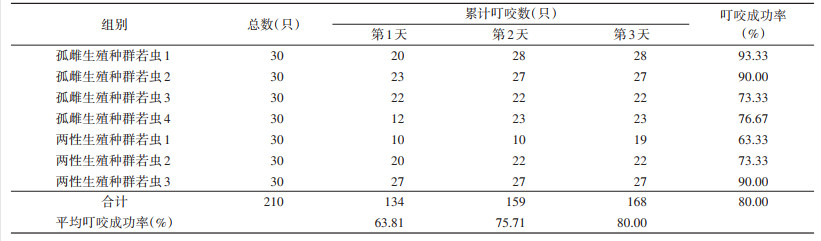
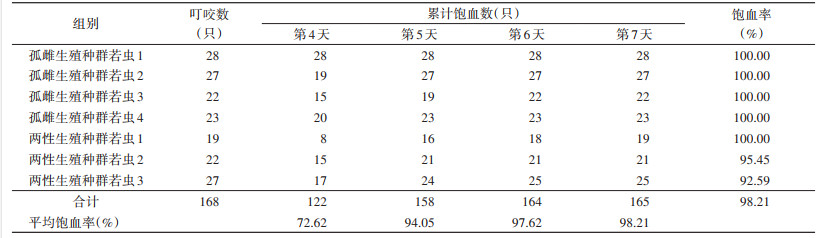
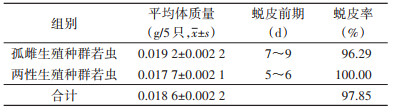
2 结果 2.1 若蜱若蜱第1、2、4天的平均叮咬成功率分别为63.81%、75.71%和80.00%,其中孤雌种群若虫叮咬成功率较高,为73.33%~93.33%,两性种群为63.33%~90.00%,较低。孤雌种群若虫叮咬时长为1~2 d,两性种群为1~4 d(表 1)。若蜱第4~7天的平均饱血率分别为72.62%、94.05%、97.62%和98.21%,其中孤雌种群若虫饱血率为100%,两性种群为92.59%~100%。孤雌种群若虫吸血期为4~6 d,两性种群为4~7 d(表 2)。5只孤雌种群重0.019 2 g,两性种群重0.017 7 g,平均为0.018 6 g;孤雌种群若虫蜕皮前期为7~9 d,两性种群为5~6 d;孤雌种群若虫蜕皮率为96.29%,两性种群为100%,平均蜕皮率为97.85%。见表 3。
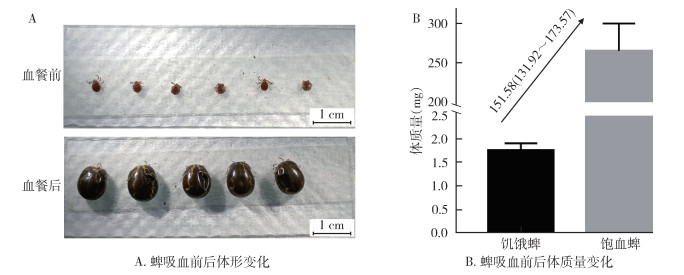
与饥饿雌蜱比,饱血雌蜱体形明显增大(图 2A)。吸血前,平均体质量为1.75 mg,最小为1.60 mg,最大为2.10 mg;吸血后,平均体质量为265.27 mg,最小为228.10 mg,最大为312.10 mg;吸血前、后体质量比为1∶151.58(131.92~173.57),饱血蜱体质量增加了150多倍(图 2B)。
|
| 图 2 血餐前、后蜱体形和体质量变化情况 Figure 2 Change in tick body size and weight before feeding and after engorgement |
| |
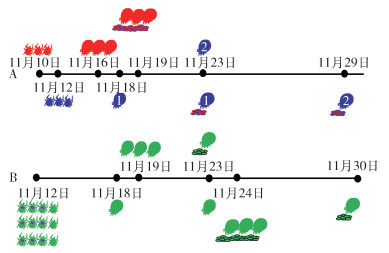
于小室中投放雌蜱共计15只,其中10只叮咬并饱血,饱血率为66.67%;吸血期为6~11 d,中位数为6.5 d。见图3、4。

|
| 注:A蜱快速吸血阶段,白色填充黑色边缘箭头示正在吸血的雄蜱,黑色箭头示雌蜱;B吸血中的蜱;C饱血蜱;D产卵蜱及其卵块。 图 3 小室中蜱吸血和产卵情况 Figure 3 Feeding blood and laying eggs of ticks in the chambers |
| |
|
| 注:A孤雌生殖种群长角血蜱,分2组,图中带有不同数字的蜱表示不同组蜱,在不同的日期投放,以红色(11月10日)、蓝色(11月12日)区别;B两性生殖种群长角血蜱,分3组,于同一天(11月12日)投放。 图 4 吸食小鼠血蜱的生长、发育情况 Figure 4 Growth and development of ticks feeding on mouse blood |
| |
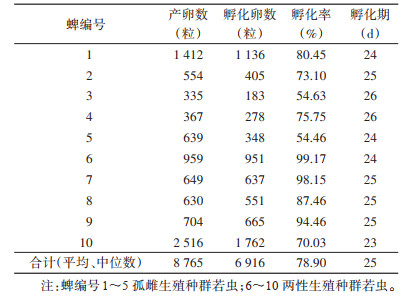
雌蜱总产卵量为8 765粒,平均每蜱产卵876粒,孵化卵数6 916粒,卵平均孵化率为78.90%。孵化期为23~26 d,中位数为25 d。见表 4、图 3。
本文描述了一种基于吸血小室的蜱吸血方法,该法为蜱类吸血制造了一个安全、稳定的环境,通过分析长角血蜱吸血、生长、发育和繁殖情况,评价小室用于蜱实验室饲养的可行性。
蜱实验室饲养存在2个问题,一是非寄生期的温、湿度控制,二是吸血时蜱不受干扰的持续吸血。在非寄生期,置有蜱类的人工气候箱能较准确地控制温度,但很难控制湿度,人工气候箱光照增强或环境温度升高,箱内湿度随之下降,因此在设置人工气候箱的湿度时,应综合考虑环境温度、箱体光照强度。蜱实验室吸血存在体外人工供血和宿主体表吸血2个体系[8-9, 12-13]。宿主体表吸血又分为束缚宿主和宿主自由活动下的蜱吸血。束缚宿主的蜱吸血,蜱类管理比较困难,常有蜱逃逸,而宿主自由活动时的蜱吸血需要制造一个蜱稳定吸血的环境[12-13]。本研究将小室与小鼠背部的皮肤粘连,结构稳定,并可较长时间固定在小鼠背部,投放蜱类到相对封闭小室稳定供血,该小室不影响小鼠正常活动,但在蜱吸血期间,应注意实验小鼠因蜱叮咬和小室的承重引起不安,破坏小室结构,从而影响蜱类吸血。此外,蜱吸食小鼠血时间不宜过长,一般不超过10 d。笔者还发现,与两性种群蜱相比,孤雌种群蜱能快速完成吸血过程,但孤雌种群蜱产卵量低,卵孵化期较长,孵化率较低,这与相关研究结果一致[14]。两性种群蜱需要更长时间完成吸血,可能原因是吸血时雌、雄蜱交配需要一定时间。
蜱吸血受到蜱种、虫态和供血宿主等因素影响,对于需转移宿主的多宿主蜱,在已有的大白兔供血情况下,增加其他宿主如啮齿动物供血,能更好地满足多宿主蜱吸血需求[15]。本研究制备的小室能为长角血蜱吸食小鼠血提供稳定场所,并丰富了其血餐来源,避免了目前大白兔单一供血情况。长角血蜱为三宿主蜱,存在孤雌和两性种群[14],在我国、日本、韩国和俄罗斯广泛分布,能传播多种病原体,例如发热伴血小板减少综合征病毒、无形体等,是一种重要的病原体传播媒介[16-17]。本研究采用自制小室供蜱吸食小鼠血,研究表明,该小室能稳定供血给长角血蜱孤雌和两性2个种群,吸血后蜱均可完成生长、发育和繁殖过程,但成蜱饱血率和雌蜱平均产卵数均低于以兔为饲血动物的种群[18],可能原因是成蜱由于空间受限或供血动物体内血液含量不足,难以维持成蜱饱血,导致饱血率与产卵量降低,我们的观察也证明3只雌蜱共同吸食小鼠至饱血状态时,小鼠活动能力明显减弱,体温急剧降低,也可能与长角血蜱成蜱本身的嗜血习性有关。而以小鼠为饲血动物的长角血蜱若虫吸血率、饱血率和蜕皮率均较高,提示本文的实验室长角血蜱吸食鼠血方法可能更适用于为幼蜱或若蜱喂血。
志谢 本实验使用的长角血蜱2个种群均由河北师范大学刘敬泽教授提供,河北师范大学王多博士提供了丰富的蜱饲养经验和方法。此外,河北师范大学刘敬泽和军事医学科学院孙毅教授在论文修改方面提供了许多宝贵意见,在此一并志谢利益冲突 无
| [1] |
Commins SP, Platts-Mills TAE. Tick bites and red meat allergy[J]. Curr Opin Allergy Clin Immunol, 2013, 13(4): 354-359. DOI:10.1097/ACI.0b013e3283624560 |
| [2] |
Hall-Mendelin S, Craig SB, Hall RA, et al. Tick paralysis in Australia caused by Ixodes holocyclus Neumann[J]. Ann Trop Med Parasitol, 2011, 105(2): 95-106. DOI:10.1179/136485911X12899838413628 |
| [3] |
Goodman JL, Dennis DT, Sonenshine DE. Tick-borne diseases of humans[M]. Washington, DC: ASM Press, 2005: 3-11.
|
| [4] |
Yu XJ, Liang MF, Zhang SY, et al. Fever with thrombocytopenia associated with a novel Bunyavirus in China[J]. N Engl J Med, 2011, 364(16): 1523-1532. DOI:10.1056/NEJMoa1010095 |
| [5] |
危芙蓉, 兰勤娴, 朱丹, 等. 中国部分地区警犬体表寄生蜱的巴贝虫感染情况调查[J]. 中国寄生虫学与寄生虫病杂志, 2012, 30(5): 390-392. Wei FR, Lan QX, Zhu D, et al. Investigation on Babesia in ticks infested on police dogs in selected areas of China[J]. Chin J Parasitol Parasit Dis, 2012, 30(5): 390-392. |
| [6] |
Zhang LJ, Liu H, Xu BL, et al. Anaplasma phagocytophilum infection in domestic animals in ten provinces/cities of China[J]. Am J Trop Med Hyg, 2012, 87(1): 185-189. DOI:10.4269/ajtmh.2012.12-0005 |
| [7] |
Chen Y, Chen YY, Liu G, et al. Prevalence of Theileria in cattle in China: A systematic review and meta-analysis[J]. Microb Pathog, 2022, 162: 105369. DOI:10.1016/j.micpath.2021.105369 |
| [8] |
Andrade JJ, Xu G, Rich SM. A silicone membrane for in vitro feeding of Ixodes scapularis (Ixodida: Ixodidae)[J]. J Med Entomol, 2014, 51(4): 878-879. DOI:10.1603/ME13180 |
| [9] |
Kröber T, Guerin PM. In vitro feeding assays for hard ticks[J]. Trends Parasitol, 2007, 23(9): 445-449. DOI:10.1016/j.pt.2007.07.010 |
| [10] |
Antunes S, Rosa C, Couto J, et al. Deciphering Babesia-vector interactions[J]. Front Cell Infect Microbiol, 2017, 7: 419. DOI:10.3389/fcimb.2017.00429 |
| [11] |
Liao M, Zhou JL, Gong HY, et al. Hemalin, a thrombin inhibitor isolated from a midgut cDNA library from the hard tick Haemaphysalis longicornis[J]. J Insect Physiol, 2009, 55(2): 165-174. DOI:10.1016/j.jinsphys.2008.11.004 |
| [12] |
Patrick CD, Hair JA. Laboratory rearing procedures and equipment for multi-host ticks (Acarina: Ixodidae)[J]. J Med Entomol, 1975, 12(3): 389-390. DOI:10.1093/jmedent/12.3.389 |
| [13] |
Nuss AB, Mathew MG, Gulia-Nuss M. Rearing Ixodes scapularis, the black-legged tick: Feeding immature stages on mice[J]. J Vis Exp, 2017(123): 55286. DOI:10.3791/55286 |
| [14] |
Chen Z, Yang XJ, Bu FJ, et al. Morphological, biological and molecular characteristics of bisexual and parthenogenetic Haemaphysalis longicornis[J]. Vet Parasitol, 2012, 189(2/4): 344-352. DOI:10.1016/j.vetpar.2012.04.021 |
| [15] |
Anderson JF, Magnarelli LA. Biology of ticks[J]. Infect Dis Clin North Am, 2008, 22(2): 195-215. DOI:10.1016/j.idc.2007.12.006 |
| [16] |
Zheng WQ, Umemiya-Shirafuji R, Chen SE, et al. Identification of Haemaphysalis longicornis genes differentially expressed in response to Babesia microti infection[J]. Pathogens, 2020, 9(5): 378. DOI:10.3390/pathogens9050378 |
| [17] |
Zheng WQ, Umemiya-Shirafuji R, Zhang Q, et al. Porin expression profiles in Haemaphysalis longicornis infected with Babesia microti[J]. Front Physiol, 2020, 11: 502. DOI:10.3389/fphys.2020.00502 |
| [18] |
刘敬泽, 姜在阶. 实验室条件下长角血蜱的生物学特性研究[J]. 昆虫学报, 1998, 41(3): 280-283. Liu JZ, Jiang ZJ. Studies on the bionomics of Haemaphysalis longicornis Neumann (Acari: Ixodidae) under laboratory conditions[J]. Acta Entomol Sin, 1998, 41(3): 280-283. DOI:10.3321/j.issn:0454-6296.1998.03.010 |
 2022, Vol. 33
2022, Vol. 33