扩展功能
文章信息
- 殷红敏, 付蒙, 孔逸尘, 杨字, 黄皓, 张云智
- YIN Hong-min, FU Meng, KONG Yi-chen, YANG Zi, HUANG Hao, ZHANG YUN-zhi
- 蝙蝠与蝙蝠携带的汉坦病毒
- Bat and bat-borne hantaviruses
- 中国媒介生物学及控制杂志, 2022, 33(4): 596-600
- Chin J Vector Biol & Control, 2022, 33(4): 596-600
- 10.11853/j.issn.1003.8280.2022.04.028
-
文章历史
- 收稿日期: 2022-02-21
2 昆明医科大学,云南 昆明 650000
2 Kunming Medical University, Kunming, Yunnan 650000, China
1951-1953年朝鲜战争期间,3 000多名士兵感染了一种急性发热伴肾功能衰竭,最终导致休克的出血热,病死率高达7%,当时命名为朝鲜出血热(Korean hemorrhagic fever,KHF),但一直没有证实KHF的病原体。直到1976年French等[1]在韩国汉坦河(Hantaan river)附近捕获的黑线姬鼠(Apodemus agrarius)中首次用间接免疫荧光试验证实KHF的病原体是一种新的病毒,根据该病毒的发现地,命名为汉坦病毒(Hantavirus,HV)。HV是一类重要的自然疫源性病毒。HV的宿主动物十分广泛,近几十年,发现越来越多的蝙蝠携带HV。从遗传进化上看,HV最早可能出现在食虫目动物或蝙蝠中,然后传播到啮齿目动物,再以啮齿类动物为主要的自然宿主感染人[2]。蝙蝠携带的许多病毒已经造成了严重的社会危害和公共卫生问题,威胁人类的生命和健康,引起我们的关注。
1 蝙蝠蝙蝠是哺乳纲(Mammalia)翼手目(Chiroptera)动物的统称,是哺乳动物中的第二大类群,仅次于啮齿目动物,目前已报道的蝙蝠有21科237属1 446种,约占全球哺乳动物的22%[3]。传统形态学将蝙蝠分为大蝙蝠亚目(Megachiroptera)和小蝙蝠亚目(Microchiroptera),最新的分子分类研究将其分为阳蝙蝠亚目(Yangochiroptera)和阴蝙蝠亚目(Yinpterochiroptera)[4-7]。阳蝙蝠亚目蝙蝠也称为小型蝙蝠(microbats),其种类丰富,体型较小,通常以昆虫为食,少数以动物的血液为食。阴蝙蝠亚目蝙蝠又称为大型蝙蝠(megabats),体型相对较大,通常以果实、花粉或花蜜为食[8]。蝙蝠广泛分布在世界上除南极洲以外的所有大陆。蝙蝠的进化可以追溯到大约5 000万年前,具有很强的飞行能力,是唯一能够飞行的哺乳动物[9-10]。
蝙蝠是许多自然疫源性疾病的宿主,是多种新发传染病病原体的宿主。迄今为止,已有超过200种病毒在蝙蝠中被检测到[11-12]。许多新发传染病如马尔堡病毒(Marburg virus)、亨德拉病毒(Hendra virus)和尼帕病毒(Nipah virus)等RNA病毒均被证实来源于蝙蝠,越来越多的证据表明,埃博拉病毒(Ebola virus)、严重急性呼吸综合征冠状病毒(Severe acute respiratory syndrome coronavirus,SARS-CoV)、中东呼吸综合征冠状病毒(Middle east respiratory syndrome coronavirus,MERS-CoV)和严重急性呼吸综合征冠状病毒-2(Severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)等烈性病毒也与蝙蝠有关[13-17]。蝙蝠的飞行能力、冬眠和社会行为有利于病毒的保存、进化和传播。蝙蝠携带的病毒在公共卫生安全上一度被忽视,随着研究的深入,越来越多的新病毒在蝙蝠上被发现,引起了科学界的重视。
2 汉坦病毒HV宿主主要为啮齿目(Rodentia)、翼手目(Chiroptera)和食虫目(Insectivora)动物,后来在爬行动物(reptile)、辐鳍鱼(Actinopterygii)和无颌动物(Agnatha)中也发现HV样病毒(Hantavirus-like),但只有啮齿目动物携带的HV能引起人类疾病[18-20]。HV引起人类的2种疾病:肾综合征出血热(hemorrhagic fever with renal syndrome,HFRS)和汉坦病毒肺综合征(Hantavirus pulmonary syndrome,HPS)。HFRS主要分布在亚洲和欧洲,我国也称流行性出血热(epidemic hemorrhagic fever,EHF)。HFRS的临床特征主要有出血性表现、肾功能衰竭,甚至多器官功能障碍,其病情较重,病死率为10%[21]。HPS主要分布在南美洲和北美洲,临床上以呼吸困难、呼吸窘迫综合征、心肺衰竭为特征,病死率高达30%~40%[22-24]。
2.1 HV基因组结构HV粒子呈球形或近球形,ϕ 80~120 nm,是一种有包膜分节段的单股负链RNA病毒,其基因组由大(L)、中(M)、小(S)3个片段组成。其中L片段长6.5~6.6 kb,编码RNA依赖的RNA聚合酶(RNA-dependent RNA polymerase,RdRp),即L蛋白,通过其转录、复制酶和内切酶活性,介导HV基因组的转录和复制。M片段长3.7~3.8 kb,编码病毒包膜糖蛋白Gc和Gn糖蛋白,Gc和Gn是HV表面刺突蛋白,与受体结合,介导病毒进入宿主细胞。S片段长度为1.8~2.1 kb,编码病毒核衣壳(Nucleocapsid,N)蛋白,N蛋白包裹病毒RNA,以保护病毒免受细胞核酸酶的降解,与RdRp一起,确保病毒基因组的有效复制。
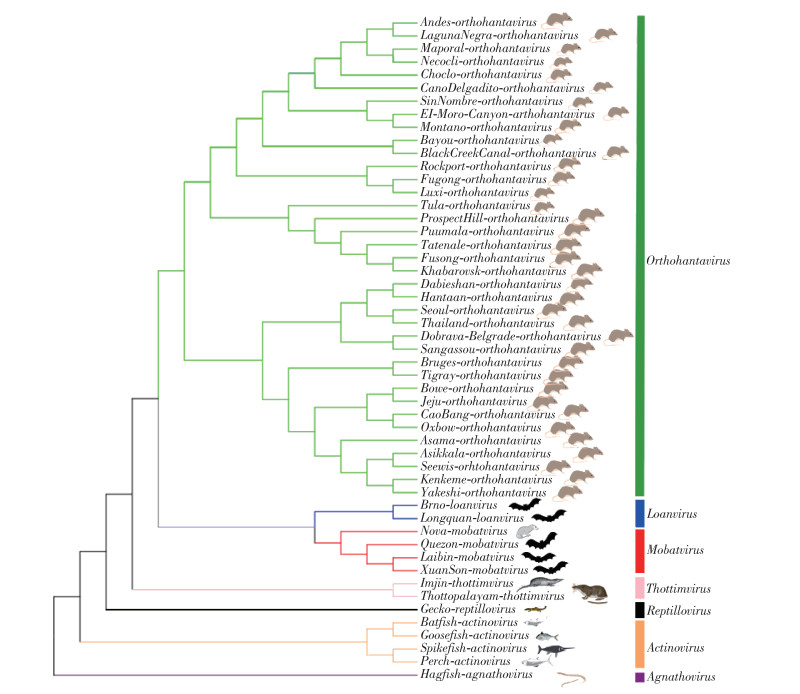
2.2 HV的分类根据国际病毒分类委员会(The International Committee on Taxonomy of Viruses,ICTV)最新的分类,将原来汉坦病毒属(Hantavirus)提升为汉坦病毒科(Hantaviridae),根据HV的宿主动物不同来分类,分为4亚科7属53种:(1)哺乳动物HV亚科(Mammantavirinae)4属47种:①正汉坦病毒属(Orthohantavirus)38种;②鼹鼠蝙蝠病毒属(Mobatvirus)5种;③龙泉病毒属(Loanvirus)2种;④索托帕拉雅病毒属(Thottimvirus)2种。(2)辐鳍鱼HV亚科(Actantavirinae)1属4种:辐鳍鱼病毒属(Actinovirus)4种。(3)爬行动物HV亚科(Repantavirinae)1属1种:爬行动物病毒属(Reptillovirus)。(4)无颌动物HV亚科(Agantavirinae)1属1种:无颌动物病毒属(Agnathovirus)。我们从美国国立生物技术信息中心(NCBI)下载51种HV[未包含勒拿河病毒(Lena mobatvirus)和罗宾纳正HV(Robina orthohantavirus)2种]基因组序列,用Clustal Ⅹ软件进行比对,用MEGA Ⅹ软件选最大似然法(Construct/Test maximum likelihood,ML),基于S片段氨基酸水平建立了系统发育树。见图 1。
|
| 图 1 基于51种汉坦病毒S片段氨基酸水平的系统进化发育树 Figure 1 Phylogenetic tree based on the amino acid levels in S fragments of 51 species of hantavirus |
| |
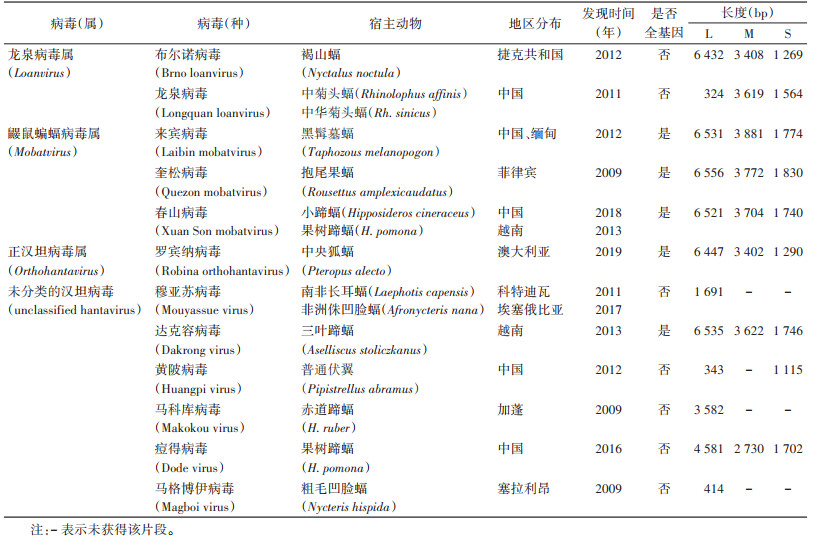
见表 1。蝙蝠携带的HV包括在哺乳动物HV亚科(Mammantavirinae)中,分为4类:(1)龙泉病毒属(Loanvirus)2种:①龙泉病毒(Longquan loanvirus,LQUV),2011年在我国浙江省龙泉市的中华菊头蝠(Rhinolophus sinicus)和中菊头蝠(Rh. affinis)的肺组织中检测到[25],获得了S、M全长和部分L片段;②布尔诺病毒(Brno loanvirus,BRNV),2012年在捷克共和国的褐山蝠(Nyctalus noctula)肝组织中发现[26],获得L、M、S的近全长。(2)鼹鼠蝙蝠病毒属(Mobatvirus)3种:①来宾病毒(Laibin mobatvirus,LAIV),2012年在中国广西壮族自治区(广西)黑髯墓蝠(Taphozous melanopogon)肺组织中检测到[27],2015年在缅甸的黑髯墓蝠肺组织中也检测到[28];②春山病毒(Xuân Sơn virus,XSV),2013年在越南果树蹄蝠(Hipposideros pomona)肺组织中发现[29],2018年在我国广西的小蹄蝠(H. cineraceus)肺组织检测到;③奎松病毒(Quezon mobatvirus,QZNV),2016年在菲律宾抱尾果蝠(Rousettus amplexicaudatus)的肺组织中发现[30],这3种HV均获得了全基因组。(3)正HV属(Orthohantavirus)1种:罗宾纳正HV(Robina orthohantavirus,ROBV),2019年在澳大利亚中央狐蝠(Pteropus alecto)的脑组织中发现,获得了全基因组。(4)未分类的HV(Unclassified hantavirus)6种:①达克容病毒(Dakrong virus,DKGV),在越南三叶蹄蝠(Aselliscus stoliczkanus)中发现;②穆亚苏病毒(Mouyassue virus,MOYV),在科特迪瓦、埃塞俄比亚的东非长耳蝠(Laephotis capensis)、非洲侏凹脸蝠(Afronycteris nana)中检测到;③黄陂病毒(Huangpi virus,HUPV),在中国的普通伏翼(Pipistrellus abramus)肺组织中发现;④马格博伊病毒(Magboi virus,MGBV),在塞拉利昂的粗毛凹脸蝠(Nycteris hispida)中发现;⑤马科库病毒(Makokou virus,MAKV),在加蓬赤道蹄蝠(H. ruber)脾脏中发现;⑥痘得病毒(Dode virus,DODV),在中国的果树蹄蝠(H. pomona)中发现。目前只有DKGV获得了L、M、S片段的全序列,其余5种只获得部分序列(以上信息来自于NCBI Virus)。
|
2012年de Araujo等[31]在巴西捕获的蝙蝠样本中检测到引起HPS的安第斯正HV(Andes orthohantavirus,ANDV),基于部分S片段的核苷酸序列分析,获得的序列与ANDV的基因型阿拉拉夸拉正HV(Araraquara orthohantavirus,ARQV)核苷酸的同源性达93%~95%。2012-2014年Sabino-Santos等[32]在巴西捕获的蝙蝠中证实存在ANDV抗体。2018年Sabino-Santos等[33]又在之前检测的蝙蝠HV阳性吸血蝠(Desmodus rotundus)和昭短尾叶鼻蝠(Carollia perspicillata)样本中扩增出HV的部分S片段,与ANDV的基因型ARQV同源性分别达到94%和99%。多种证据表明,具有高致病性的ANDV的基因型ARQV在蝙蝠中存在,但还未有蝙蝠携带HV感染人的病例报道。
4 展望随着多种蝙蝠携带HV的发现,尤其在蝙蝠中检测到高致病性的ARQV,应引起我们的高度警惕。HV与宿主动物的多样性,应加强HV与宿主的调查研究,分析病毒与宿主动物共进化关系。目前为止,正HV属的HV中,ROBV是唯一被发现的蝙蝠携带的HV,对人的致病性尚不清楚。蝙蝠携带HV感染率低,还未分离到病毒,许多蝙蝠携带HV也未获得全基因组,需要进一步改进检测方法[18, 25, 28, 34-36],来揭开它们神秘的面纱。
利益冲突 无
| [1] |
French GR, Foulke RS, Brand OA, et al. Korean hemorrhagic fever: Propagation of the etiologic agent in a cell line of human origin[J]. Science, 1981, 211(4486): 1046-1048. DOI:10.1126/science.6110243 |
| [2] |
Zhang YZ. Discovery of hantaviruses in bats and insectivores and the evolution of the genus Hantavirus[J]. Virus Res, 2014, 187: 15-21. DOI:10.1016/j.virusres.2013.12.035 |
| [3] |
ASM Mammal Diversity Database [EB/OL]. (2021-10-09) [2021-12-01]. http://www.mammaldiversity.org/.
|
| [4] |
Baker RJ, Longmire JL, Maltbie M, et al. DNA synapomorphies for a variety of taxonomic levels from a cosmid library from the New World BAT Macrotus waterhousii[J]. Syst Biol, 1997, 46(4): 579-589. DOI:10.1093/sysbio/46.4.579 |
| [5] |
Hutcheon JM, Kirsch JAW, Pettigrew JD. Base-compositional biases and the bat problem. Ⅲ. The question of microchiropteran monophyly[J]. Philos Trans R Soc Lond B Biol Sci, 1998, 353(1368): 607-617. DOI:10.1098/rstb.1998.0229 |
| [6] |
Teeling EC, Scally M, Kao DJ, et al. Molecular evidence regarding the origin of echolocation and flight in bats[J]. Nature, 2000, 403(6766): 188-192. DOI:10.1038/35003188 |
| [7] |
Teeling EC, Madsen O, Murphy WJ, et al. Nuclear gene sequences confirm an ancient link between New Zealand's short-tailed bat and South American noctilionoid bats[J]. Mol Phylogenet Evol, 2003, 28(2): 308-319. DOI:10.1016/s1055-7903(03)00117-9 |
| [8] |
Calisher CH, Childs JE, Field HE, et al. Bats: Important reservoir hosts of emerging viruses[J]. Clin Microbiol Rev, 2006, 19(3): 531-545. DOI:10.1128/CMR.00017-06 |
| [9] |
Schönrich G, Rang A, Lütteke N, et al. Hantavirus-induced immunity in rodent reservoirs and humans[J]. Immunol Rev, 2008, 225(1): 163-189. DOI:10.1111/j.1600-065X.2008.00694.x |
| [10] |
Baker ML, Schountz T, Wang LF. Antiviral immune responses of bats: A review[J]. Zoonoses Public Health, 2013, 60(1): 104-116. DOI:10.1111/j.1863-2378.2012.01528.x |
| [11] |
Moratelli R, Calisher CH. Bats and zoonotic viruses: Can we confidently link bats with emerging deadly viruses?[J]. Mem Inst Oswaldo Cruz, 2015, 110(1): 1-22. DOI:10.1590/0074-02760150048 |
| [12] |
Wu ZQ, Yang L, Ren XW, et al. Deciphering the bat virome catalog to better understand the ecological diversity of bat viruses and the bat origin of emerging infectious diseases[J]. ISME J, 2016, 10(3): 609-620. DOI:10.1038/ismej.2015.138 |
| [13] |
Letko M, Seifert SN, Olival KJ, et al. Bat-borne virus diversity, spillover and emergence[J]. Nat Rev Microbiol, 2020, 18(8): 461-471. DOI:10.1038/s41579-020-0394-z |
| [14] |
Olival KJ, Hayman DTS. Filoviruses in bats: Current knowledge and future directions[J]. Viruses, 2014, 6(4): 1759-1788. DOI:10.3390/v6041759 |
| [15] |
Memish ZA, Mishra N, Olival KJ, et al. Middle east respiratory syndrome coronavirus in bats, Saudi Arabia[J]. Emerg Infect Dis, 2013, 19(11): 1819-1823. DOI:10.3201/eid1911.131172 |
| [16] |
Leroy EM, Kumulungui B, Pourrut X, et al. Fruit bats as reservoirs of Ebola virus[J]. Nature, 2005, 438(7068): 575-576. DOI:10.1038/438575a |
| [17] |
Amman BR, Albariño CG, Bird BH, et al. A recently discovered pathogenic paramyxovirus, sosuga virus, is present in Rousettus aegyptiacus fruit bats at multiple locations in Uganda[J]. J Wildl Dis, 2015, 51(3): 774-779. DOI:10.7589/2015-02-044 |
| [18] |
Arai S, Yanagihara R. Genetic diversity and geographic distribution of bat-borne hantaviruses[J]. Curr Issues Mol Biol, 2020, 39: 1-28. DOI:10.21775/cimb.039.001 |
| [19] |
Holmes EC, Zhang YZ. The evolution and emergence of hantaviruses[J]. Curr Opin Virol, 2015, 10: 27-33. DOI:10.1016/j.coviro.2014.12.007 |
| [20] |
Brook CE, Dobson AP. Bats as 'special' reservoirs for emerging zoonotic pathogens[J]. Trends Microbiol, 2015, 23(3): 172-180. DOI:10.1016/j.tim.2014.12.004 |
| [21] |
Tadin A, Turk N, Korva M, et al. Multiple co-infections of rodents with hantaviruses, Leptospira, and Babesia in Croatia[J]. Vector Borne Zoonotic Dis, 2012, 12(5): 388-392. DOI:10.1089/vbz.2011.0632 |
| [22] |
Vapalahti O, Mustonen J, Lundkvist A, et al. Hantavirus infections in Europe[J]. Lancet Infect Dis, 2003, 3(10): 653-661. DOI:10.1016/s1473-3099(03)00774-6 |
| [23] |
Heyman P, Vaheri A, Lundkvist A, et al. Hantavirus infections in Europe: From virus carriers to a major public-health problem[J]. Expert Rev Anti-Infect Ther, 2009, 7(2): 205-217. DOI:10.1586/14787210.7.2.205 |
| [24] |
MacNeil A, Nichol ST, Spiropoulou CF. Hantavirus pulmonary syndrome[J]. Virus Res, 2011, 162(1/2): 138-147. DOI:10.1016/j.virusres.2011.09.017 |
| [25] |
Guo WP, Lin XD, Wang W, et al. Phylogeny and origins of hantaviruses harbored by bats, insectivores, and rodents[J]. PLoS Pathog, 2013, 9(2): e1003159. DOI:10.1371/journal.ppat.1003159 |
| [26] |
Straková P, Dufkova L, Širmarová J, et al. Novel hantavirus identified in European bat species Nyctalus noctula[J]. Infect Genet Evol, 2017, 48: 127-130. DOI:10.1016/j.meegid.2016.12.025 |
| [27] |
Xu L, Wu JM, He B, et al. Novel hantavirus identified in black-bearded tomb bats, China[J]. Infect Genet Evol, 2015, 31: 158-160. DOI:10.1016/j.meegid.2015.01.018 |
| [28] |
Arai S, Kikuchi F, Bawm S, et al. Molecular phylogeny of mobatviruses (Hantaviridae) in Myanmar and Vietnam[J]. Viruses, 2019, 11(3): 228. DOI:10.3390/v11030228 |
| [29] |
Arai S, Nguyen ST, Boldgiv B, et al. Novel bat-borne hantavirus, Vietnam[J]. Emerg Infect Dis, 2013, 19(7): 1159-1161. DOI:10.3201/eid1907.121549 |
| [30] |
Arai S, Taniguchi S, Aoki K, et al. Molecular phylogeny of a genetically divergent hantavirus harbored by the Geoffroy's rousette (Rousettus amplexicaudatus), a frugivorous bat species in the Philippines[J]. Infect Genet Evol, 2016, 45: 26-32. DOI:10.1016/j.meegid.2016.08.008 |
| [31] |
de Araujo J, Thomazelli LM, Henriques DA, et al. Detection of hantavirus in bats from remaining rain forest in São Paulo, Brazil[J]. BMC Res Notes, 2012, 5: 690. DOI:10.1186/1756-0500-5-690 |
| [32] |
Sabino-Santos G Jr, Maia FGM, Vieira TM, et al. Evidence of hantavirus infection among bats in Brazil[J]. Am J Trop Med Hyg, 2015, 93(2): 404-406. DOI:10.4269/ajtmh.15-0032 |
| [33] |
Sabino-Santos G Jr, Maia FGM, Martins RB, et al. Natural infection of Neotropical bats with hantavirus in Brazil[J]. Sci Rep, 2018, 8(1): 9018. DOI:10.1038/s41598-018-27442-w |
| [34] |
Yanagihara R, Gu SH, Arai S, et al. Hantaviruses: Rediscovery and new beginnings[J]. Virus Res, 2014, 187: 6-14. DOI:10.1016/j.virusres.2013.12.038 |
| [35] |
Bennett SN, Gu SH, Kang HJ, et al. Reconstructing the evolutionary origins and phylogeography of hantaviruses[J]. Trends Microbiol, 2014, 22(8): 473-482. DOI:10.1016/j.tim.2014.04.008 |
| [36] |
Witkowski PT, Drexler JF, Kallies R, et al. Phylogenetic analysis of a newfound bat-borne hantavirus supports a laurasiatherian host association for ancestral mammalian hantaviruses[J]. Infect Genet Evol, 2016, 41: 113-119. DOI:10.1016/j.meegid.2016.03.036 |
 2022, Vol. 33
2022, Vol. 33


