扩展功能
文章信息
- 赵聪, 岳治光, 宁晓冬, 菅忆晨, 黄斌斌, 卢晨阳, 张文举, 张凯慧, 菅复春, 宁长申
- ZHAO Cong, YUE Zhi-guang, NING Xiao-dong, JIAN Yi-chen, HUANG Bin-bin, LU Chen-yang, ZHANG Wen-ju, ZHANG Kai-hui, JIAN Fu-chun, NING Chang-shen
- 一种节肢动物体外驱避试验装置的研制及初步应用
- Development and preliminary application of a device for arthropod in vitro repellent test
- 中国媒介生物学及控制杂志, 2022, 33(4): 573-579
- Chin J Vector Biol & Control, 2022, 33(4): 573-579
- 10.11853/j.issn.1003.8280.2022.04.024
-
文章历史
- 收稿日期: 2022-02-28
2 河南安进生物技术股份有限公司, 河南 郑州 450105;
3 河南应用技术职业学院, 河南 郑州 450042;
4 广西大学, 广西 南宁 530004
2 Henan Anjin Biotechnology Co., Ltd., Zhengzhou, Henan 450105, China;
3 Henan Vocational College of Applied Technology, Zhengzhou, Henan 450042, China;
4 Guangxi University, Nanning, Guangxi 530004, China
随着全球气温变暖、人类活动范围扩大和交通运输业的快速发展,蜱的分布区域发生变化,新发和再发蜱媒病对人类健康和畜牧业发展的威胁愈发严重,控制蜱是控制蜱媒传染病的重要手段之一。在生活水平不断提高的今天,人们更加注重自身健康和居住环境的安全,而化学防治病媒生物面临越来越多的挑战,亟需研发安全、环保、高效、经济的蜱防控方法。因此驱避剂日益受到人们的青睐,安全高效驱避剂的筛选也就尤为重要。目前常用的筛选方法主要有体外试验和人体试验2种[1-9],人体试验是将驱避剂直接施用到人体皮肤或衣服上,可以较为真实地反映蜱的活动状态和驱避剂的驱避效果,但人体试验中实验人员直接接触驱避剂和硬蜱也伴随着一些风险,如驱避剂的毒性、对驱避剂过敏、可能被蜱叮咬感染蜱媒疾病等[10-11]。而体外试验方法操作方便、耗时短、费用低,是大多数研究者优先采用的方法。本研究旨在制备一种制作简单、使用方便、结果准确的体外硬蜱驱避试验装置,以期为硬蜱驱避剂的研发提供技术支持。
1 材料与方法 1.1 材料 1.1.1 硬蜱样品来源成蜱于2020年8月4日采自河南省焦作市许湾村(太行山区),用布旗法采集草丛中硬蜱成蜱56只,经形态学和PCR法鉴定为长角血蜱(Haemaphysalis longicornis)。幼蜱:上述成蜱放兔体饲养,收集交配后的饱血雌蜱置含有湿棉球的50 ml离心管内,室温(25~28 ℃)下保存。产卵、孵化,取幼蜱(20日龄)供试,数量200只。
1.1.2 试剂0.5%大蒜素水乳液,安进生物技术股份有限公司;蒸馏水,实验室自制。
1.1.3 试验用品101滤纸,180 mm×180 mm,杭州富阳木浆纸有限公司;聚氯乙烯(PVC)塑料片,0.25 mm×210 mm×297 mm,苏州奥凯高分子材料股份有限公司;热熔胶枪DL390020,罗维特(天津)金属制品贸易有限公司;其他材料见表 1。
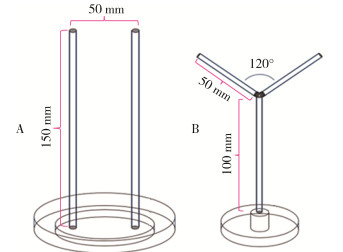
根据文献[12]装置制备:取1根1号圆木条从中间将其截为2根ϕ5 mm、长150 mm的圆木条,2根木条分别使用热熔胶将其垂直固定在1个4号平皿上(木条间距50 mm),最后把该装置放入1个装有蒸馏水的5号平皿中。见图 1A。
自制驱避试验装置(自制装置):使用1号圆木条分别截成ϕ5 mm、长100 mm的长木条及ϕ5 mm、长50 mm的短木条,以长木条为主干,其顶端与2根短木条(臂)连接在一起,夹角120°,并且处于同一平面,每条臂与主干连接处都设有1对1.0 mm×0.5 mm×0.5 mm铷磁铁,方便拆卸。使用热熔胶将主干底端与1个ϕ15 mm、高20 mm的木桩(用于放置硬蜱)连接,并且木桩下外接1个3号平皿,作为水槽。见图 1B。
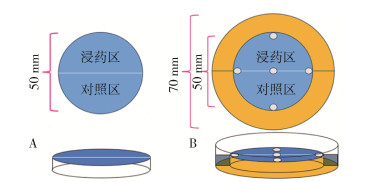
1.2.1.2 圆形滤纸法驱避试验装置的制备根据文献[13]装置制备:使用101滤纸裁剪出2个ϕ50 mm的半圆,其中1个半圆滤纸为药物处理区域,另1个为蒸馏水处理区域,二者可拼接成1个整圆并放入3号平皿的底部,构成整个试验装置,圆心处放置虫体。见图 2A。
|
| 图 2 改进前(A)与改进后(B)幼蜱的驱避试验装置模式图 Figure 2 Model diagrams of the larval tick repellent test device before and after improvement |
| |
自制装置制备:将3号平皿倒置,平皿外底面用于放置圆形滤纸,使用8号铁片将其内底面覆盖并固定;使用101滤纸裁剪出2个ϕ50 mm的半圆,其中1个半圆滤纸为药物处理区域,另1个为蒸馏水处理区域,拼接成整圆后放入3号平皿的底部,并使用5个7号铷磁铁在5个位置进行吸附(图 2B),以保持滤纸片与外底面的平整贴合;后将整个装置移入并使用热熔胶固定于4号平皿上,外环作为水槽,防止虫体逃离驱避装置;将PVC塑料板裁切成15 mm×10 mm大小插入水槽中线处,对浸药半区与对照半区的水槽进行阻隔。见图 2B。
1.2.2 硬蜱驱避试验 1.2.2.1 木条攀爬法驱避试验自制设备:试验前将2根支臂取下,1根浸泡于0.5%大蒜素水乳液,另1根同时浸泡蒸馏水(对照组均浸泡蒸馏水),10 min后各取出干燥,干燥后的2根臂重新吸附在主干上,水槽注20 ml蒸馏水后,选取长角血蜱成蜱15只,将其放入驱避装置的木桩上,15 min后观察硬蜱在木条上的分布情况,计算驱避率。试验重复3次。
文献[12]装置试验方法:试验前将2根木条取下,其中1根浸泡于0.5%大蒜素水乳液,另1根同时浸泡蒸馏水(对照组均浸泡蒸馏水),10 min后同时取出干燥,将2根干燥后的木条用热熔胶枪重新固定在原位置,水槽注10 ml蒸馏水后选取长角血蜱成蜱15只,将其放入驱避装置的4号平皿中,15 min后观察硬蜱在木条上的分布情况,计算驱避率。试验重复3次。
1.2.2.2 圆形滤纸法驱避试验自制设备试验方法:将101滤纸裁剪成ϕ50 mm的2个半圆,2个半圆滤纸片在0.5%大蒜素水乳液及蒸馏水中各浸泡10 min后取出(每个处理组3套圆形滤纸片作为重复组,其中对照组2个半圆滤纸片均浸泡蒸馏水),干燥后将处理组及对照组的2个半圆滤纸片重新组合成整圆并放入幼蜱驱避装置中,向水槽中注入10 ml蒸馏水。每次试验选取20只硬蜱放置于圆心处的磁铁上,使其在场地中可以自由移动,并在装置上覆盖吸光布以隔绝外界光线的干扰,5 min后移去吸光布,观察硬蜱在滤纸片上的分布情况,计算驱避率。
文献[13]装置试验方法:将101滤纸裁剪成ϕ50 mm的2个半圆,2个半圆滤纸片在0.5%大蒜素水乳液及蒸馏水中各浸泡10 min后取出(每个处理组3套圆形滤纸片作为重复组,其中对照组2个半圆滤纸片均浸泡蒸馏水),干燥后将处理组及对照组的2个半圆滤纸片重新组合成整圆并放入3号平皿,每次试验选取20只硬蜱放置于滤纸片圆心处,使其在场地中可以自由移动,并在装置上覆盖吸光布以隔绝外界光线的干扰,5 min后移去吸光布,观察硬蜱在滤纸片上的分布情况,统计驱避率。
1.2.3 硬蜱驱避效果评价观察实验过程中硬蜱的位置,记录运动到浸药区与蒸馏水对照区硬蜱数量,计算驱避率。计算公式如下:

|
使用SPSS 18.0软件Kruskal-Wallis H检验将不同驱避装置对硬蜱的驱避率及处于无效区域硬蜱数量占比进行差异性分析,进而比较2种驱避装置的使用效果。P < 0.05为差异有统计学意义。
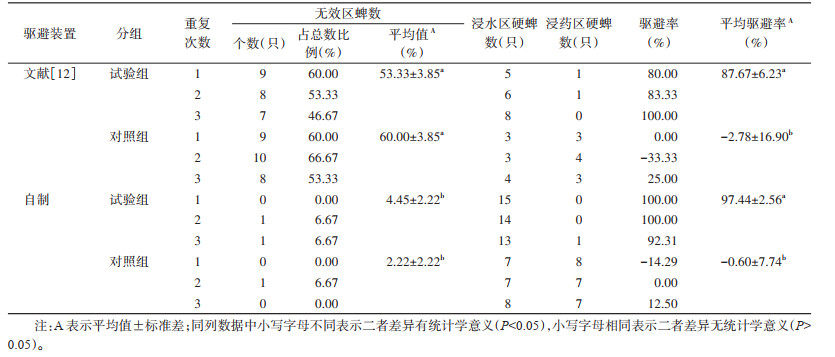
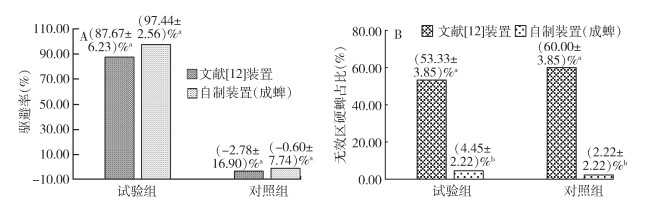
2 结果 2.1 木条攀爬法硬蜱驱避试验效果成蜱驱避装置改进前后驱避试验结果见表 2、图 3,文献[12]装置在3次重复试验中,试验组有(53.33±3.85)%的硬蜱未爬上木条,无法判断其是否被驱避,对照组有(60.00±3.85)%的硬蜱未爬上木条,2组处于无效区的硬蜱占总数的50.00%以上;在自制装置中,几乎所有硬蜱在试验结束时均处于有效区域内,试验组及对照组处于无效区内的硬蜱分别占总数的(4.45±2.22)%和(2.22±2.22)%,均少于文献[12]装置中处于无效区域的硬蜱占比,且差异有统计学意义(试验组F=121.004,P < 0.001;对照组F=168.825,P=0.001);另外,自制装置试验组的平均驱避率为(97.44±2.56)%,较文献[12]装置试验组的(87.67±6.23)%驱避率出现了一定程度的增加,但二者之间差异无统计学意义(F=2.105,P=0.220)。2种驱避装置的对照组平均驱避率接近,二者之间差异亦无统计学意义(F=0.014,P=0.912)。
|
|
| 注:A 2种驱避装置试验组和对照组驱避率比较;B 2种驱避装置试验组和对照组无效区蜱数占比比较;小写字母不同表示二者差异有统计学意义(P < 0.05),小写字母相同表示二者差异无统计学意义(P > 0.05)。 图 3 木条攀爬法2种驱避试验装置的驱避率及无效区蜱数 Figure 3 Repellent rates and number of ticks in ineffective areas of two repellent test devices for tick climbing rod bioassay |
| |
文献[12]装置驱避试验中有较多硬蜱处于平皿底部未爬上木条,而自制装置绝大部分硬蜱都爬到木条上。见图 4。
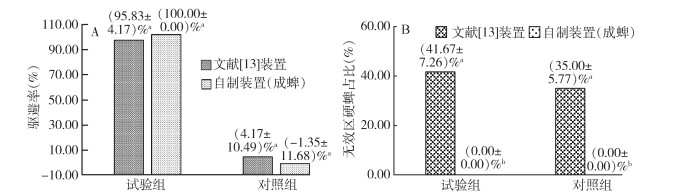
幼蜱驱避装置改进前后驱避试验结果如表 3、图 5所示。在试验组中,2种驱避装置的驱避率分别为(95.83±4.17)%和(100±0.00)%,二者之间差异无统计学意义(F=1.000,P=0.374),在对照组中,2种驱避装置的驱避率分别为(4.17±10.49)%和(-1.35±11.68)%,二者之间差异亦无统计学意义(F=0.123,P=0.743)。其中文献[13]装置的试验组及对照组的3次重复试验中,分别有(41.67±7.26)%和(35.00±5.77)%的供试幼蜱爬出试验区域,对于这一部分幼蜱无法确定其是否被驱避。而自制装置驱避试验中,试验组及对照组处于无效区的幼蜱数均为(0.00±0.00)%,显著小于文献[13]装置中的平均值,且差异有统计学意义(试验组F=32.895,P=0.005;对照组F=36.750,P=0.004)。
|
|
| 注:A 2种驱避装置试验组和对照组驱避率比较;B 2种驱避装置试验组和对照组无效区蜱数占比比较;小写字母不同表示二者差异有统计学意义(P < 0.05),小写字母相同表示二者差异无统计学意义(P > 0.05)。 图 5 圆形滤纸法2种驱避装置的驱避率及无效区域蜱数占比 Figure 5 Repellent rates and proportion of ticks in ineffective areas of two fillter paper repellent devices |
| |
文献[13]驱避装置试验中出现硬蜱爬出试验区的情况,而自制滤纸片驱避装置由于水槽的限制,所有硬蜱都处于试验区内。见图 6。
本研究制备了硬蜱体外驱避装置,并与文献报道的驱避装置的应用效果进行了试验比较,自制装置与文献中的装置使用时在驱避率上差异无统计学意义,可能是因为驱避成分本身作用较强,几乎没有硬蜱出现在药物处理过的区域,当驱避成分效果减弱时,不同驱避装置的差异性是否会得以体现,需要进一步研究。
在木条攀爬法中,文献[12]装置在试验过程中有(53.33±3.85)%和(60.00±3.85)%的硬蜱未爬上木条,处于无效区,分析导致这种问题的原因有以下2个方面:(1)硬蜱在初始放置位置(ϕ70 mm平皿内)上活动范围过大,而木条在平皿上占据的空间过小,导致硬蜱无法很好地接触到供其攀爬的木条。(2)缺乏引诱物,硬蜱的宿主可以散发出CO2、乳酸、热量、氨类物质来吸引硬蜱的主动靠近[14-15]。因此在自制装置中,使用ϕ15 mm,高2 mm的圆木桩来代替平皿,限制了硬蜱的活动范围,同时将供硬蜱攀爬的2根独立木条改为“Y”型结构,使得在硬蜱攀爬的过程中可以对相应的驱避剂作出反应。而自制装置试验中处于无效区的硬蜱占比分别为(4.45±2.22)%和(2.22±2.22)%,显著小于文献[12]装置,处于无效区的硬蜱数越少意味着更多的硬蜱参与了试验,因此试验结果就越准确、可信。
在滤纸片法驱避装置中,文献[13]装置所提供的方法在试验中有(41.67±7.26)%和(35.00±5.77)%幼蜱爬出了滤纸片,这部分幼蜱是否被驱避也无法计算,因此样本量减少,试验准确度下降,另外逃出的幼蜱可能对试验人员产生危害;而自制装置在文献[13]装置的基础上增加了1个水槽来防止幼蜱逃出滤纸片,试验中处于无效区的硬蜱数均为(0.00±0.00)%,使得试验结果准确度得以提升,其次考虑到试验过程中可能存在部分幼蜱落入水槽,并通过水槽爬到另一个半区,影响试验结果的准确性,所以在水槽中设置了挡板来避免这种情况的出现。
Sukkanon等[16]提供了一种硬蜱驱避试验的方法,该方法将硬蜱放入1个开口试管中,并在试管口蒙上一层浸泡过驱避成分的纱布,试验者用手悬浮在试管口上方50 mm处,采用诱使硬蜱靠近的方法测试驱避剂的效果,该方法属于体外试验的改进型,虽然这种方法保护了试验人员不被硬蜱叮咬且更接近真实情况,但是需要人员全程参与,试验效率相对较低,不便于大批量进行试验。Mawela等[17]同样使用了垂直木条法进行硬蜱驱避试验,相较于本试验的木条攀爬法,它采用了单根木条,且木条底部同样连接着小木桩,限制了底部硬蜱的活动范围,使硬蜱能更多地爬上木条,但不同之处在于该驱避装置是单一木条没有“Y”型结构,其木条上段1/2浸泡驱避剂,其下段1/2浸泡水,通过硬蜱在木条上不同区域的分布来确定驱避率,该方法的优点是结构更加简单,但其浸药区与浸水区共用1根木条,并不是相互独立的部分,随着驱避剂有效成分的挥发,驱避活性较弱时,其驱避效果可能会被硬蜱向上攀爬的特性一定程度抵消,造成试验结果不准确。
本试验制备的木条驱避装置及滤纸片驱避装置具有良好的准确性,可以用于硬蜱以及螨、虱、蚜虫等依靠爬行的昆虫或节肢动物的驱避试验,本试验制备的体外硬蜱驱避装置为驱避剂的开发提供了一种技术手段。
利益冲突 无
| [1] |
王萍, 赵树超, 黄振东, 等. 蜱虫驱避剂筛选的常用方法[J]. 中华卫生杀虫药械, 2018, 24(5): 505-508, 511. Wang P, Zhao SC, Huang ZD, et al. A review on methods for screening tick repellents[J]. Chin J Hyg Insectic Equip, 2018, 24(5): 505-508, 511. DOI:10.19821/j.1671-2781.2018.05.028 |
| [2] |
Benelli G, Pavela R, Canale A, et al. Tick repellents and acaricides of botanical origin: A green roadmap to control tick-borne diseases?[J]. Parasitol Res, 2016, 115(7): 2545-2560. DOI:10.1007/s00436-016-5095-1 |
| [3] |
Ferreira LL, de Oliveira Filho JG, Mascarin GM, et al. In vitro repellency of DEET and β-citronellol against the ticks Rhipicephalus sanguineus sensu lato and Amblyomma sculptum[J]. Vet Parasitol, 2017, 239: 42-45. DOI:10.1016/j.vetpar.2017.04.021 |
| [4] |
Jordan RA, Schulze TL, Dolan MC. Efficacy of plant-derived and synthetic compounds on clothing as repellents against Ixodes scapularis and Amblyomma americanum (Acari: Ixodidae)[J]. J Med Entomol, 2012, 49(1): 101-106. DOI:10.1603/me10241 |
| [5] |
Semmler M, Abdel-Ghaffar F, Al-Rasheid KAS, et al. Comparison of the tick repellent efficacy of chemical and biological products originating from Europe and the USA[J]. Parasitol Res, 2011, 108(4): 899-904. DOI:10.1007/s00436-010-2131-4 |
| [6] |
Bissinger BW, Roe RM. Tick repellents: Past, present, and future[J]. Pestic Biochem Physiol, 2010, 96(2): 63-79. DOI:10.1016/j.pestbp.2009.09.010 |
| [7] |
Mwangi EN, Hassanali A, Essuman S, et al. Repellent and acaricidal properties of Ocimum suave against Rhipicephalus appendiculatus ticks[J]. Exp Appl Acarol, 1995, 19(1): 11-18. DOI:10.1007/BF00051933 |
| [8] |
Ndungu M, Lwande W, Hassanali A, et al. Cleome monophylla essential oil and its constituents as tick (Rhipicephalus appendiculatus) and maize weevil (Sitophilus zeamais) repellents[J]. Entomol Exp Appl, 1995, 76(3): 217-222. DOI:10.1111/j.1570-7458.1995.tb01965.x |
| [9] |
Lwande W, Ndakala AJ, Hassanali A, et al. Gynandropsis gynandra essential oil and its constituents as tick (Rhipicephalus appendiculatus) repellents[J]. Phytochemistry, 1999, 50(3): 401-405. DOI:10.1016/S0031-9422(98)00507-X |
| [10] |
郭莉, 毛光琼, 吴宣, 等. 蜱及蜱媒疾病的危害及防治[J]. 四川畜牧兽医, 2010, 37(12): 49-50. Guo L, Mao GQ, Wu X, et al. Harm and control of ticks and tick borne diseases[J]. Sichuan Anim Vet Sci, 2010, 37(12): 49-50. DOI:10.3969/j.issn.1001-8964.2010.12.027 |
| [11] |
郑卫青, 柳小青, 陈海婴. 蜱虫危害及其媒介效能[J]. 中华卫生杀虫药械, 2014, 20(5): 493-496, 500. Zheng WQ, Liu XQ, Chen HY. Research on ticks infestation and their vector capacity[J]. Chin J Hyg Insectic Equip, 2014, 20(5): 493-496, 500. DOI:10.19821/j.1671-2781.2014.05.033 |
| [12] |
Wanzala W, Sika NFK, Gule S, et al. Attractive and repellent host odours guide ticks to their respective feeding sites[J]. Chemoecology, 2004, 14(3/4): 229-232. DOI:10.1007/s00049-004-0280-6 |
| [13] |
Greive KA, Barnes TM. In vitro comparison of four treatments which discourage infestation by head lice[J]. Parasitol Res, 2012, 110(5): 1695-1699. DOI:10.1007/s00436-011-2687-Proceedingsofthe |
| [14] |
邓国藩, 姜在阶. 中国经济昆虫志. 第三十九册. 蜱螨亚纲. 硬蜱科[M]. 北京: 科学出版社, 1991: 89-93. Deng GF, Jiang ZJ. Economic insects of China. Fasc. 39 (Acari: Ixodidae)[M]. Beijing: Science Press, 1991: 89-93. |
| [15] |
Carr AL, Salgado VL. Ticks home in on body heat: A new understanding of Haller's organ and repellent action[J]. PLoS One, 2019, 14(8): e0221659. DOI:10.1371/journal.pone.0221659 |
| [16] |
Sukkanon C, Chareonviriyaphap T, Doggett SL. Topical and spatial repellent bioassays against the Australian paralysis tick, Ixodes holocyclus (Acari: Ixodidae)[J]. Aust Entomol, 2019, 58(4): 866-874. DOI:10.1111/aen.12420 |
| [17] |
Mawela KG, Luseba D, Magano S, et al. Repellent properties of Rotheca glabrum plant extracts against adults of Rhipicephalus appendiculatus[J]. BMC Vet Res, 2019, 15(1): 122. DOI:10.1186/s12917-019-1853-5 |
 2022, Vol. 33
2022, Vol. 33