扩展功能
文章信息
- 范苏云, 石向辉, 陈建, 陈建忠, 顾金保
- FAN Su-yun, SHI Xiang-hui, CHEN Jian, CHEN Jian-zhong, GU Jin-bao
- 蚊浓核病毒亚致死剂量感染对白纹伊蚊溴氰菊酯抗药性的影响研究
- Effect of sublethal dose of Mosquito densovirus infection on deltamethrin resistance of Aedes albopictus
- 中国媒介生物学及控制杂志, 2022, 33(4): 499-502
- Chin J Vector Biol & Control, 2022, 33(4): 499-502
- 10.11853/j.issn.1003.8280.2022.04.011
-
文章历史
- 收稿日期: 2021-11-12
2 南方医科大学公共卫生学院, 广东 广州 510515
2 School of Public Health, Southern Medical University, Guangzhou, Guangdong 510515, China
白纹伊蚊(Aedes albopictus)是我国重要的媒介蚊种,也是广东省登革热传播的主要媒介[1-3]。蚊虫化学防治依然是蚊媒传染病防治的常规手段。拟除虫菊酯类杀虫剂因其低毒、高效、低滞留等优点被广泛应用于蚊虫的防制,但也因其长期大规模的使用,蚊虫对拟除虫菊酯类杀虫剂的抗性发展日趋广泛与严重[4]。因此,蚊虫抗药性已经成为蚊虫综合治理(integrated mosquito management,IMM)所面临的主要问题之一。蚊浓核病毒(Mosquito densovirus,MDV)是一种蚊虫特有的单链DNA病毒,对蚊虫具有一定的致病性,高浓度感染可导致蚊虫死亡,具有发展为生物农药的潜在价值。亚致死剂量病毒感染可以影响蚊虫发育,但感染后是否可以对蚊虫抗药性产生影响,目前未有相关报道。本研究使用亚致死剂量的白纹伊蚊浓核病毒-7(Aedes albopictus densovirus-7,AalDV-7)感染白纹伊蚊溴氰菊酯抗性品系后,通过抗药性测定,明确抗性品系的抗药性变化,为进一步利用MDV与拟除虫菊酯类杀虫剂配伍使用抑制蚊虫对常规杀虫剂抗药性增强提供理论基础,为登革热防控工作提供新的策略。
1 材料与方法 1.1 实验蚊虫白纹伊蚊(上海株)由南方医科大学保种,敏感品系长期饲养于蚊虫专用饲养室,温度(27±1)℃,湿度70%~80%,日光照循环为12 h∶12 h,且未暴露于任何杀虫剂。幼蚊饲养于脱氯水中,给予龟粮。成蚊给予10%葡萄糖溶液,雌蚊通过Hemotek蚊虫喂血仪(Hemotek公司,英国)吸食脱脂棉羊血用于产卵。白纹伊蚊3~4龄幼虫用于幼蚊抗药性测试和筛选,羽化后3~5 d未吸血的雌蚊用于成蚊抗药性测试。
1.2 白纹伊蚊浓核病毒本实验使用的AalDV-7(GenBank:MK182384)为南方医科大学首次在广州市野生白纹伊蚊中分离、鉴定并保种[5],病毒原液浓度为2.00×1010 geq/ml,置于-70 ℃保存待用。
1.3 主要试剂溴氰菊酯(94.62%)杀虫剂标准品购自上海西格玛奥德里奇公司,成蚊抗药性测试所用的溴氰菊酯药膜(0.05%)和对照药膜由世界卫生组织(WHO)指定的马来西亚理科大学提供。葡萄糖粉(分析纯)、丙酮溶液(分析纯)购自广州化学试剂厂。组织DNA提取试剂盒(天根生化科技有限公司,北京),2×Dream Taq Hot Start Green PCR Master Mix[赛默飞世尔科技(中国)有限公司,上海]。
1.4 白纹伊蚊抗性品系的筛选以敏感品系产卵孵化出的幼虫为第1代,根据每代测定的幼虫半数致死浓度(LC50),配制1 L相应浓度的溴氰菊酯液进行筛选,先将准确称量好的溴氰菊酯粉末以丙酮稀释溶解,再混入去氯自来水。在筛选盆中放入1 000只3龄幼虫,添加已配制好的溴氰菊酯药液,24 h后挑选出存活幼蚊继续饲养至成蚊,即为筛选后的下一代抗性种群[6]。雌蚊吸血产卵后孵化出的幼蚊一部分继续用于扩种或施加溴氰菊酯筛选下一代,另一部分正常饲养用于本代次幼蚊和成蚊抗药性测试。
1.5 蚊虫的病毒感染病毒浓度以每毫升中的基因组当量(genome equivalents per ml,geq/ml)表示。将1~2龄白纹伊蚊幼虫每组200只置于内含有200 ml无菌水的塑料碗中,加入AalDV-7病毒原液,感染终浓度为108 geq/ml(感染浓度选择基于前期研究结果,白纹伊蚊幼虫感染108 geq/ml病毒后死亡率与对照组相比差异无统计学意义,但幼虫期延长、化蛹率降低,即亚致死剂量)[5],28 ℃下孵育24 h,将幼虫用无菌水洗涤3遍后移至塑料碗常规饲养。
1.6 蚊虫的病毒阳性检测对于实验室抗性株,随机选择10只成蚊为1组,共3组,通过PCR检测蚊虫是否有浓核病毒感染。幼蚊感染病毒后24 h,随机选择10只幼蚊,蒸馏水洗涤3次后提取基因组DNA,进行单只PCR检测以明确感染率。使用组织DNA提取试剂盒提取样品基因组,使用MDV基因组保守区特异性引物,以提取的基因组为模板,进行常规PCR检测,白纹伊蚊rpS7基因(GenBank:JN132168)为内参照,引物序列与循环参数见参考文献[5]。引物由生工生物工程(上海)股份有限公司合成。反应体系:2×Master Mix 25 μl,正、反向引物各1 μl,模板gDNA 2 μl,ddH2O 21 μl。反应条件:95 ℃预变性3 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸1 min,共35个循环;72 ℃再延伸5 min。PCR产物用1%的琼脂糖凝胶电泳检测。
1.7 幼蚊抗药性测定采用WHO推荐的幼虫浸渍法测定抗药性[7]。准确称量溴氰菊酯标准品粉末,以丙酮为溶剂制成1 ml母液,并以丙酮稀释成7个连续梯度浓度,每种浓度1 ml药液与99 ml脱氯自来水混合入纸杯中,取25只3~4龄幼虫放入纸杯,24 h后观察并记录幼虫死亡数。每个浓度设3个重复,同时设立对照组,对照组中加入99 ml去氯自来水和1 ml的丙酮。
1.8 成蚊抗药性测定采用WHO推荐的成蚊接触筒法测定成蚊抗药性[8],组装接触筒后分别装入0.05%溴氰菊酯药膜和对照药膜,每次实验设置5个实验组和2个对照组。每组分别取25只羽化后3~5 d未吸血雌蚊转移到恢复筒中(不含药膜)恢复1 h,并观察记录成蚊死亡或受到损伤的数量。1 h后转移至接触筒中(内含药膜),与药膜接触1 h,期间每隔10 min记录1次击倒的成蚊数量,1 h后将接触筒中的雌蚊再转移至恢复筒中恢复24 h,期间饲喂10%的葡萄糖水。24 h后记录死亡成蚊数。
1.9 统计学分析采用SPSS 19.0统计软件分析,幼蚊LC50和成蚊半数击倒时间(KT50)使用Probit法计算,回归方程建立后采用拟合优度χ2检验方程是否成立。抗性比(RR50)为筛选株与敏感株的LC50比值,RR50 < 5为敏感种群,RR50 > 10为高度抗性种群,5≤RR50≤10为中等抗性种群[7]。成蚊死亡率(MR) > 98%为敏感种群,90%≤MR≤98%为疑似抗性种群,MR < 90%为抗性种群[8]。感染前后幼蚊LC50变化采用t检验进行比较,感染前后成蚊死亡率变化采用χ2检验进行比较。P < 0.05为差异有统计学意义。
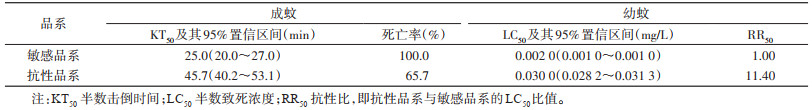
2 结果 2.1 抗性品系幼蚊和成蚊的抗性水平敏感品系白纹伊蚊连续施加溴氰菊酯筛选至第15代。幼蚊LC50由第1代0.002 0 mg/L升至第15代0.030 0 mg/L,RR50值为11.40,为高度抗性种群。成蚊生物测定死亡率由第1代100%降低至65.7%,为抗性种群。本实验室成功建立了敏感品系来源的溴氰菊酯抗性品系,以第15代抗性品系与敏感品系作为研究对象。见表 1。
|
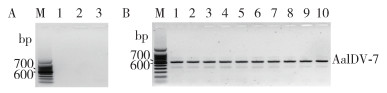
各组样品内参照基因rpS7 PCR结果均为阳性,基因提取质量可靠。3组未感染的实验室抗性株(每组n=10)以MDV保守区基因特异性引物进行常规PCR后凝胶电泳检测,结果如图 1A所示,3组测试的实验室抗性株均未见阳性片段。根据文献[5]采用低于LC50(109.48 geq/ml)的病毒浓度108 geq/ml感染1~2龄幼虫,24 h后随机选择10只幼虫提取基因组DNA进行PCR检测,重复1次。结果如图 1B,3次重复实验白纹伊蚊幼蚊的病毒感染率为100%。
|
| 注:M表示DNA ladder;A中1~3表示1~3组(每组10只)未感染的实验室抗性株白纹伊蚊AalDV-7基因的PCR检测结果;B中1~10表示实验室抗性株白纹伊蚊幼虫感染AalDV-7后,随机挑选的1~10只幼虫PCR的检测结果;AalDV-7表示白纹伊蚊浓核病毒-7。 图 1 白纹伊蚊浓核病毒-7(AalDV-7)感染白纹伊蚊前后PCR检测结果 Figure 1 PCR results of Aedes albopictus before and after infection with Ae. albopictus densovirus-7 |
| |
亚致死剂量AalDV-7感染溴氰菊酯抗性品系1龄幼虫24 h后恢复常规饲养,待其发育至3~4龄进行抗性水平检测。结果显示,幼蚊对溴氰菊酯LC50由0.030 0 mg/L降低至0.018 5 mg/L,差异有统计学意义(t=12.521,P < 0.001),与敏感株相比RR50值为9.25,为中等抗性种群。见表 2。

|
亚致死剂量AalDV-7感染溴氰菊酯抗性品系幼蚊发育至成蚊后,进行成蚊溴氰菊酯抗性分析。结果显示,感染后抗性株成蚊对溴氰菊酯死亡率由65.7%升至78.1%,感染前后差异有统计学意义(χ2=5.079,P=0.015)。MR < 90%,成蚊为抗性种群。见表 3。

|
白纹伊蚊是我国登革热等蚊媒传染病的主要传播媒介[9],目前由于缺乏可广泛使用的疫苗与特效治疗手段,蚊媒控制是防治蚊媒传染病的主要手段[10]。化学防治以其快速高效、使用方法简单等特点而成为蚊媒控制的重要手段。近年来,由于化学杀虫剂的长期、大规模、不规范使用,使得我国蚊虫杀虫剂抗性不断上升,同时污染环境,威胁人畜健康[11-12]。在不同类型的卫生害虫杀虫剂中,拟除虫菊酯使用最为广泛,在已公布的调查区域例如广州市、河南省、西安市等其使用量均超过了50%,其中溴氰菊酯尤以高效、广谱、强触杀作用等特点成为灭蚊最常用的杀虫剂之一[13-15]。因此,各地蚊虫溴氰菊酯抗性上升尤为突出,寻求新的方法控制蚊虫抗药性成为目前媒介防制中面临的主要问题之一。AalDV-7作为特异性感染蚊类的病毒,在自然界蚊虫中发现其无法感染除蚊虫外的其他昆虫、鱼类、鸟类和哺乳动物,具有较好的生物安全性,在高浓度时对蚊虫有着较好的杀伤效果,且可以通过水平传播和垂直传播在蚊虫种群内扩散,这些特征使其具有发展为生物杀蚊剂的潜在价值[16]。此外,在亚致死剂量条件下感染,对蚊虫生长发育有一定的影响[5]。本研究结果显示亚致死剂量的AalDV-7感染虽然不能直接杀死白纹伊蚊,但是会降低成蚊和幼蚊对溴氰菊酯的抗药性,在一定程度上起到了增效剂的作用。AalDV-7的特点展示出其不但可以单独作为生物杀虫剂使用,还可以与化学杀虫剂联合使用,提高作用效果,研究结果将为今后解决蚊虫杀虫剂抗性产生问题提供新的策略和方法。
利益冲突 无
| [1] |
Martynova EU, Schal C, Mukha DV. Effects of recombination on densovirus phylogeny[J]. Arch Virol, 2016, 161(1): 63-75. DOI:10.1007/s00705-015-2642-5 |
| [2] |
Gu JB, Dong YQ, Peng HJ, et al. A recombinant AeDNA containing the insect-specific toxin, BmK IT1, displayed an increasing pathogenicity on Aedes albopictus[J]. Am J Trop Med Hyg, 2010, 83(3): 614-623. DOI:10.4269/ajtmh.2010.10-0074 |
| [3] |
石向辉, 顾金保. 亚致死量白纹伊蚊浓核病毒-3感染对白纹伊蚊吸血与生殖的影响[J]. 热带医学杂志, 2017, 17(7): 889-891. Shi XH, Gu JB. Effect of sublethal dose of Aedes albopictus densovirus-3 (AalDV-3) on blood-sucking and oviposition habit of Ae.albopictus[J]. J Trop Med, 2017, 17(7): 889-891. DOI:10.3969/j.issn.1672-3619.2017.07.012 |
| [4] |
陈建, 范苏云, 石向辉, 等. 2016年深圳市福田区白纹伊蚊抗药性现状研究[J]. 预防医学论坛, 2018, 24(4): 248-250. Chen J, Fan SY, Shi XH, et al. Study on insecticide resistance in Aedes albopictus, Futian district, Shenzhen city, 2016[J]. Prev Med Trib, 2018, 24(4): 248-250. DOI:10.16406/j.pmt.issn.1672-9153.2018.04.004 |
| [5] |
Li J, Dong YQ, Sun Y, et al. A novel densovirus isolated from the Asian tiger mosquito displays varied pathogenicity depending on its host species[J]. Front Microbiol, 2019, 10: 1549. DOI:10.3389/fmicb.2019.01549 |
| [6] |
Kumar S, Thomas A, Sahgal A, et al. Effect of the synergist, piperonyl butoxide, on the development of deltamethrin resistance in yellow fever mosquito, Aedes aegypti L.(Diptera: Culicidae)[J]. Arch Insect Biochem Physiol, 2002, 50(1): 1-8. DOI:10.1002/arch.10021 |
| [7] |
World Health Organization. Guidelines for laboratory and field testing of mosquito larvicides[R]. Geneva: World Health Organization, 2005: 8-12.
|
| [8] |
World Health Organization. Test procedures for insecticide resistance monitoring in malaria vector mosquitoes[M]. 2nd ed. Geneva: World Health Organization, 2016: 12-29.
|
| [9] |
龚道方, 周红宁. 中国登革热重要媒介白纹伊蚊的研究进展[J]. 中国媒介生物学及控制杂志, 2009, 20(6): 607-610. Gong DF, Zhou HN. Progress in dengue fever important vector Aedes albopictus in China[J]. Chin J Vector Biol Control, 2009, 20(6): 607-610. |
| [10] |
Benelli G, Lo Iacono A, Canale A, et al. Mosquito vectors and the spread of cancer: An overlooked connection?[J]. Parasitol Res, 2016, 115(6): 2131-2137. DOI:10.1007/s00436-016-5037-y |
| [11] |
李成玲, 胡志刚, 江毅民, 等. 广州地区白纹伊蚊对常用杀虫剂抗药性的初步研究[J]. 热带医学杂志, 2010, 10(4): 429-430, 447. Li CL, Hu ZG, Jiang YM, et al. Preliminary investigation of Aedes albopictus resistant to commonly used insecticides in Guangzhou[J]. J Trop Med, 2010, 10(4): 429-430, 447. |
| [12] |
赵春春. 我国白纹伊蚊抗药性及kdr基因分布研究[D]. 北京: 中国疾病预防控制中心, 2019. Zhao CC. Study on insectcides resistance and kdr gene distribution of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2019. (in Chinese) |
| [13] |
梁雪莹, 江毅民, 刘杰, 等. 2018年广州市卫生杀虫剂使用情况调查[J]. 中华卫生杀虫药械, 2020, 26(3): 197-199. Liang XY, Jiang YM, Liu J, et al. Investigation on the application of insecticides in Guangzhou in 2018[J]. Chin J Hyg Insect Equip, 2020, 26(3): 197-199. DOI:10.19821/j.1671-2781.2020.03.002 |
| [14] |
赵奇, 高丽君, 钱丹, 等. 河南省卫生杀虫剂使用现状调查[J]. 中华卫生杀虫药械, 2015, 21(1): 26-28. Zhao Q, Gao LJ, Qian D, et al. Investigation on the application of public health insecticides in Henan[J]. Chin J Hyg Insect Equip, 2015, 21(1): 26-28. DOI:10.19821/j.1671-2781.2015.01.009 |
| [15] |
王欣, 庞松涛, 雷晓岗, 等. 西安市卫生杀虫剂使用现状调查分析[J]. 中华卫生杀虫药械, 2014, 20(6): 580-582. Wang X, Pang ST, Lei XG, et al. Investigation on the use of insecticides in Xi'an city[J]. Chin J Hyg Insect Equip, 2014, 20(6): 580-582. DOI:10.19821/j.1671-2781.2014.06.024 |
| [16] |
Carlson J, Suchman E, Buchatsky L. Densoviruses for control and genetic manipulation of mosquitoes[J]. Adv Virus Res, 2006, 68: 361-392. DOI:10.1016/S0065-3527(06)68010-X |
 2022, Vol. 33
2022, Vol. 33

