扩展功能
文章信息
- 高杨, 许士奇, 王丽娜, 郭文平, 刘铭
- GAO Yang, XU Shi-qi, WANG Li-na, GUO Wen-ping, LIU Ming
- 塞罕坝自然保护区蜱媒斑点热群立克次体检测及遗传进化分析
- Detection and phylogenetic analysis of spotted fever group rickettsiae in ticks in Saihanba National Nature Reserve, China
- 中国媒介生物学及控制杂志, 2022, 33(2): 252-257
- Chin J Vector Biol & Control, 2022, 33(2): 252-257
- 10.11853/j.issn.1003.8280.2022.02.016
-
文章历史
- 收稿日期: 2021-10-19
立克次体(Rickettsia)广泛分布于世界各地,呈短棒状或球形,是一类专性细胞内寄生、革兰阴性的原核细胞微生物。依据种间进化关系立克次体被分为四大群类,包括:贝氏立克次体群(Rickettsia belli group)、加拿大立克次体群(R. canadensis group)、斑点热群(spotted fever group,SFG)和斑疹伤寒群(typhus group,TG),优势类群为SFG[1-2]。斑点热群立克次体(spotted fever group rickettsia,SFGR)主要由蜱传播,可引起具有自然疫源性特征的人兽共患疾病[3]。近年来,随着世界范围内新发及再发蜱媒立克次体病逐年增多,以及培养技术与分子诊断技术的发展,现已证实存在至少28种SFGR,并且不断报道从蜱中分离出新种或新基因型[2, 4]。我国已报道存在埃氏立克次体(R. aeschlimannii)、康氏立克次体(R. conorii)、猫氏立克次体(R. felis)、黑龙江立克次体(R. heilongjiangensis)、马赛立克次体(R. massiliae)、劳氏立克次体(R. raoultii)、立氏立克次体(R. rickettsia)、西伯利亚立克次体(R. sibirica)和斯洛伐克立克次体(R. slovaca)等10余种SFGR,其中黑龙江立克次体、劳氏立克次体、西伯利亚立克次体、新塔拉塞维奇立克次体(Candidatus R. tarasevichiae)和Rickettsia sp. XY99已有确诊病例报道[5-7]。随着更多蜱媒病原体新发与再发,蜱媒疾病正严重威胁我国的公共卫生安全[8-9]。
塞罕坝自然保护区(保护区)位于河北省承德市围场满族蒙古族自治县境内,属温带半湿润季风气候区。保护区内自然资源丰富,生态物种多样,适宜蜱类栖息,而对于该地区SFGR研究却相当匮乏。保护区地处内蒙古高原与河北省北部山地的交接处,内蒙古地区是重要的蜱媒疾病自然疫源地[10],加大了该保护区内蜱媒立克次体病传播风险。为了掌握保护区内蜱的SFGR感染率及基因型,同时为蜱媒斑点热科学有效防治提供科学依据,我们于2019年4-11月对保护区内游离蜱SFGR进行了调查研究。现将结果报告如下。
1 材料与方法 1.1 主要试剂与设备DNA提取试剂盒(KG203)、DNA产物纯化试剂盒(DP204)购于天根生化科技有限公司;Trans2K® DNA marker、2×Taq PCR Mastermix均购于北京全式金生物技术有限公司。Heraguard™ ECO超净工作台(美国Thermo Fisher Scientific公司),T-100 PCR基因扩增仪(美国Bio-Rad公司),核酸电泳仪(DY9Y-6C型,北京六一生物科技有限公司),Alpha凝胶成像系统(美国Protein Simple公司),4 ℃离心机(美国Thermo Fisher Scientific公司)。
1.2 蜱的采集2019年4-11月,在保护区内采用布旗法收集游离蜱,手持布旗在自然生境中拖拽布旗,每50 m左右检查旗布表面,用镊子夹取蜱,放入有透气孔的塑料瓶中。记录采样地点、时间后送回实验室。经形态学鉴定后,进行病原学检测。
1.3 蜱DNA提取将采集到的蜱置于75%乙醇溶液中浸泡10 min,用双蒸水冲洗3次后,放置到滤纸上吸干蜱表面水分。以单只蜱为一组,置于1.5 ml离心管中,加入液氮,用研磨杵将蜱研碎。应用DNA提取检测试剂盒进行DNA提取,DNA产物置于-20 ℃冰箱保存备用。
1.4 目的片段扩增以提取DNA为模板,将无菌水作为阴性对照样本,以Rr190.70f和Rr190.701r为引物扩增SFGR外膜蛋白A基因(ompA)片段,以Rsfg877和Rsfg1258为引物扩增SFGR柠檬酸合成酶A基因(gltA)片段,引物序列见表 1,引物由北京天一辉远生物公司合成。PCR反应体系(50 μl):Taq PCR Mastermix 26 μl,dd H2O 16 μl,模板DNA 4 μl,正、反向引物各2 μl。ompA基因片段反应条件为:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃延伸5 min;gltA基因片段反应条件为:95 ℃ 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min。
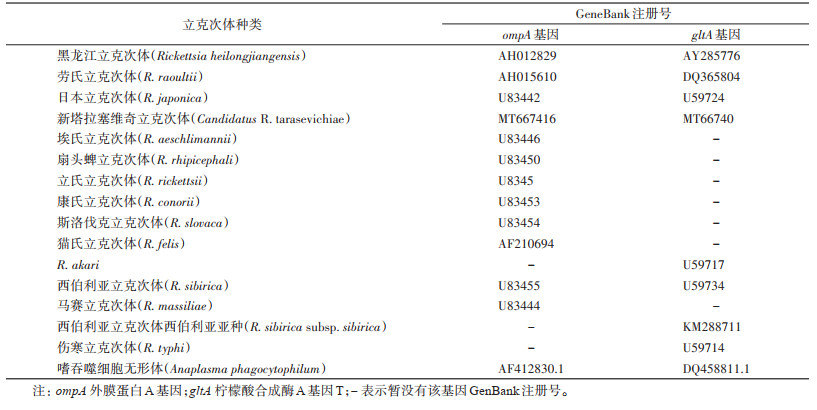
使用DNA产物纯化试剂盒将PCR阳性产物进行纯化,将纯化产物送北京天一辉远生物公司进行测序。登录美国国立生物技术信息中心(NCBI),将测序结果与GenBank中已注册的相应基因进行比对,采用DNAman 6.0软件和MEGA 7.0软件进行同源性和遗传距离分析,利用MEGA 7.0和Mrbayes 3.2.6系统发育分析软件基于邻接法(neighbour-joining method,NJ法)(bootstrap replicates 1 000次)、BI法(Bayesian inference),以嗜吞噬细胞无形体(Anaplasma phagocytophilum)为外群,构建分子系统发育树。
1.6 统计学分析使用Excel 2010软件进行数据处理,不同蜱种所检出的SFGR阳性率以百分率(%)表示。采用SPSS 22.0软件进行统计学分析,不同蜱种间SFGR的阳性率差异采用χ²检验,P < 0.05为差异有统计学意义。
2 结果 2.1 采集蜱的种类及SFGR感染情况2019年4-11月,在保护区共采获游离蜱919只,经鉴定分别为血蜱属的嗜群血蜱(Haemaphysalis concinna,242只)、硬蜱属的全沟硬蜱(Ixodes persalcatus,546只)和革蜱属的森林革蜱(Dermacentor silvarum,131只),全沟硬蜱为该地区优势蜱种(表 2)。对保护区内采集蜱进行SFGR检测,SFGR阳性蜱共有72只,总阳性率为7.8%,共获得2种SFGR基因型:劳氏立克次体和新塔拉塞维奇立克次体,其中检测到森林革蜱只携带劳氏立克次体,阳性率为11.5%(15/131),嗜群血蜱和全沟硬蜱都只携带新塔拉塞维奇立克次体,阳性率分别为9.5%(23/242)和6.2%(34/546)(表 2)。经统计学检验,3种蜱SFGR阳性率差异无统计学意义(χ²=1.261,P=0.263)。
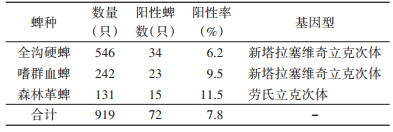
|
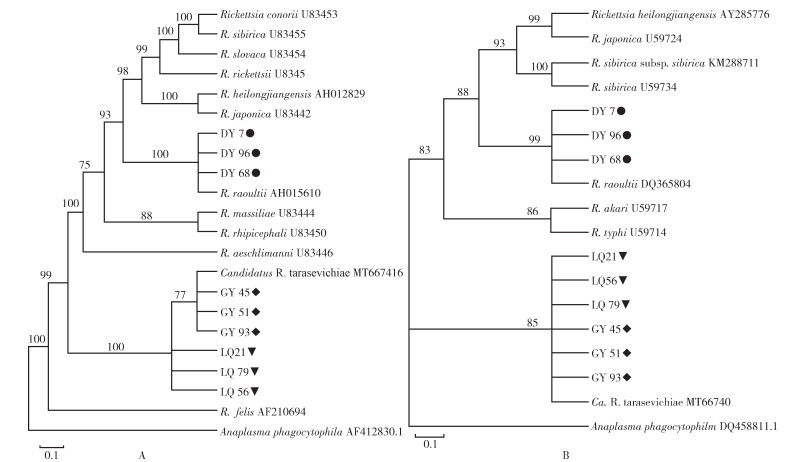
对所获得的72份阳性样本进行测序,共测序成功44份,其中SFGR ompA序列25份,gltA序列19份。通过DNAman 6.0软件比对,ompA序列(25份)和gltA序列(19份)的基因相似性分别为99.97%和99.95%。从2种序列中随机选取9份序列,其中DY7、DY68、DY96为森林革蜱,LQ21、LQ56、LQ79为嗜群血蜱,GY45、GY51、GY93为全沟硬蜱。将所选序列与NCBI中注册的序列进行同源性比较,并与GenBank中已登录序列(表 3)构建系统进化树(图 1、2)。结果表明,该地区SFRG阳性蜱携带劳氏立克次体和新塔拉塞维奇立克次体,森林革蜱携带的SFGR(DY7、DY68、DY96)与GenBank中劳氏立克次体(AH015610、DQ365804)处于同一分支,亲缘关系最近(图 1、2),基因相似性为99.84%(ompA)和99.63%(gltA);嗜群血蜱(LQ21、LQ56、LQ79)和全沟硬蜱携带(GY45、GY51、GY93)的SFGR与新塔拉塞维奇立克次体(MT667416、MT66740)聚为一支(图 1、2),相似度分别为99.54%(ompA)和99.62%(gltA),且2种建树方法中,目标序列的聚类趋势一致。
|

|
| 注:A基于ompA基因的斑点热群立克次体同源比对;B基于gltA基因的斑点热群立克次体同源比对;●森林革蜱;▼嗜群血蜱;♦全沟硬蜱 图 1 斑点热群立克次体ompA/gltA基因基于邻接法系统发育树 Figure 1 Neighbor-joining-based phylogenetic trees of ompA/gltA genes of spotted fever group rickettsiae |
| |
|
| 注:A基于ompA基因的斑点热群立克次体同源比对;B基于gltA基因的斑点热群立克次体同源比对;●森林革蜱;▼嗜群血蜱;♦全沟硬蜱 图 2 斑点热群立克次体ompA/gltA基因基于贝叶斯系统发育树 Figure 2 Bayesian phylogenetic trees of ompA/gltA genes of spotted fever group rickettsiae |
| |
蜱作为一种重要的媒介生物,在吸血的同时将多种病原体传播给人类和动物,导致人兽共患病的发生,给人类健康和畜牧业发展带来巨大危害[11-13]。在我国可传播病原体的蜱类达60多种,且38种可传播2种以上病原体[13]。因此对于蜱及蜱媒疾病调查研究十分重要。本实验中,保护区内存在硬蜱3属3种,分别为全沟硬蜱、嗜群血蜱和森林革蜱,其中全沟硬蜱数量最多,是保护区内优势蜱种,这可能因为该蜱是河北省北部优势蜱种[14],且该结果与之前研究结果一致[15]。本次调查中,保护区内蜱都可携带SFGR,但不同蜱种间SFGR的阳性率有所不同。以上结果表明,保护区内存在多种蜱,且不同蜱种均可感染SFRG,提示该地区蜱类均能够成为SFGR的潜在宿主或传播媒介。
在过去几十年中,有关蜱媒立克次体的报道不断增多,使其成为一个日益重要的公共卫生问题[13, 16]。在我国至少存在10种SFGR,涉及16个蜱种,其中黑龙江立克次体、劳氏立克次体、西伯利亚立克次体以及新塔拉塞维奇立克次体广泛分布于我国北方地区,且主要集中在内蒙古自治区(内蒙古)和东北地区[10, 13, 17]。本研究发现保护区内存在2种SFGR(劳氏立克次体和新塔拉塞维奇立克次体),而该地区此前未见SFGR报道。上述2种SFGR出现的地方增多,这可能由于保护区与内蒙古、东北地区相接,SFGR由此侵入。劳氏立克次体于1990年在草原革蜱(D. nuttalli)和短小扇头蜱(Rhipicephalus pumilio)中被发现,在2008年被命名为一个新种[8, 18]。在我国劳氏立克次体主要存在于森林革蜱、草原革蜱、边缘革蜱(D. marginatus)、短垫血蜱(H. erinacei)和长角血蜱(H. longicornis),且在黑龙江省已有确诊病例报道[8, 16]。本研究中,森林革蜱携带劳氏立克次体,而在嗜群血蜱和全沟硬蜱中均未检测到该立克次体,该结果与之前内蒙古地区立克次体的报道一致[10],可能因为劳氏立克次体更易感染革蜱属蜱种[19]。另外,本研究中森林革蜱的劳氏立克次体阳性率低于其他地区森林革蜱该立克次体阳性率[10, 18-19],这应该与SFGR流行情况、采集区域和样本量有关[19]。新塔拉塞维奇立克次体于2001年首次发现[10, 18],在我国该立克次体主要存在于嗜群血蜱、全沟硬蜱和森林革蜱,并且于2013年在黑龙江省发现了5起确诊病例[18]。本研究中嗜群血蜱和全沟硬蜱中均携带新塔拉塞维奇立克次体,而森林革蜱未检测到携带该立克次体,究其原因可能有:(1)新塔拉塞维奇立克次体在全沟硬蜱内可高效经卵垂直传播,但在森林革蜱中经卵传播效率较低[13, 16]。(2)本次实验采集的森林革蜱数量较少(131只),且均为游离蜱。
随着分子生物学技术的发展,越来越多的SFGR新种被发现,并且基因分类结果也更趋于准确。目前广泛用于立克次体种属鉴定的基因包括:ompA、ompB、16S rRNA、gltA[20]。ompA基因5'端具有高度特异性,广泛应用于SFGR基因型或亚型的鉴定和分类研究,gltA基因同样具有种属特异性,主要应用于进化距离较远的立克次体[19-20]。当前主要的建树方法有邻接法、最大简约法(maximum parsimony method,MP法)、最大似然法(maximum likelihood method,ML法)和贝叶斯法,每种构建方法所使用的原理不同,且所适用的情况也不同。贝叶斯法保留了ML的基本原理,引进了蒙特卡洛方法,使计算时间大大缩短,其可以分析很大的数据集,一般可以获得比ML更好的结果[21]。本实验采用2种方法对ompA和gltA基因构建的系统发育树均存在差别(图 1、2),可能是不同地理环境、生存压力和基因进化速率不同等因素所导致[19]。因此仅根据1种基因对SFGR进行种属分类并不准确,应利用多基因对其进行研究。本研究采用了2种建树方法(NJ、BI),虽然同一基因的目标序列聚类趋势一致,但不同方法系统发育树的拓扑结构差别较大(图 1A和图 2A;图 2A和图 2B),因此为了获得更加准确的系统发育结果,应根据情况采用多种分类方法共同分析。
通过对保护区的蜱媒SFGR调查,明确了保护区游离蜱类组成及优势蜱种,SFGR在游离蜱中的感染程度以及该地区SFGR种类,证实该地区存在SFGR,且具有基因多样性,填补了该地区SFGR流行情况空白,丰富了该地区蜱媒立克次体的理论基础,为防控蜱媒疾病提供了理论依据。但对于该地区寄生蜱、宿主动物与SFGR的关系,还需进一步研究,以期更好地预防及控制该地区蜱与蜱媒疾病。
利益冲突 无
| [1] |
Merhej V, Angelakis E, Socolovschi C, et al. Genotyping, evolution and epidemiological findings of Rickettsia species[J]. Infect Genet Evol, 2014, 25: 122-137. DOI:10.1016/j.meegid.2014.03.014 |
| [2] |
Vanegas A, Keller C, Krüger A, et al. Molecular detection of spotted fever group rickettsiae in ticks from Cameroon[J]. Ticks Tick-Borne Dis, 2018, 9(4): 1049-1056. DOI:10.1016/j.ttbdis.2018.03.022 |
| [3] |
Fang LQ, Liu K, Li XL, et al. Emerging tick-borne infections in mainland China: An increasing public health threat[J]. Lancet Infect Dis, 2015, 15(12): 1467-1479. DOI:10.1016/S1473-3099(15)00177-2 |
| [4] |
Parola P, Paddock CD, Socolovschi C, et al. Update on tick-borne rickettsioses around the world: A geographic approach[J]. Clin Microbiol Rev, 2014, 27(1): 657-702. DOI:10.1128/CMR.00104-13 |
| [5] |
Wei QQ, Guo LP, Wang AD, et al. The first detection of Rickettsia aeschlimannii and R. massiliae in Rhipicephalus turanicus ticks, in northwest China[J]. Parasit Vectors, 2015, 8(1): 631. DOI:10.1186/s13071-015-1242-2 |
| [6] |
Yang JF, Tian ZC, Liu ZJ, et al. Novel spotted fever group rickettsiae in Haemaphysalis qinghaiensis ticks from Gansu, Northwest China[J]. Parasit Vectors, 2016, 9(1): 146. DOI:10.1186/s13071-016-1423-7 |
| [7] |
Li H, Cui XM, Cui N, et al. Human infection with novel spotted fever group Rickettsia genotype, China, 2015[J]. Emerg Infect Dis, 2016, 22(12): 2153-2156. DOI:10.3201/eid2212.160962 |
| [8] |
王卓, 王建伟, 于淼, 等. 东北地区蜱传斑点热群立克次体的分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2018, 29(4): 344-347. Wang Z, Wang JW, Yu M, et al. Molecular epidemiological studies on spotted fever group Rickettsia in ticks from Northeastern China[J]. Chin J Vector Biol Control, 2018, 29(4): 344-347. DOI:10.11853/j.issn.1003.8280.2018.04.005 |
| [9] |
张艳凯, 刘敬泽. 蜱类病原体和共生菌多样性及其作用[J]. 应用昆虫学报, 2019, 56(1): 1-11. Zhang YK, Liu JZ. Diversity, and roles, of pathogens and symbionts in ticks[J]. Chin J Appl Entomol, 2019, 56(1): 1-11. DOI:10.7679/j.issn.2095-1353.2019.001 |
| [10] |
周磊, 汤芳, 栾进, 等. 内蒙古奇乾地区蜱携带斑点热立克次体的调查[J]. 中国国境卫生检疫杂志, 2017, 40(2): 96-99. Zhou L, Tang F, Luan J, et al. Investigation on spotted fever group rickettsiae in ticks collected from Qiqian areas of Inner Mongolia[J]. Chin J Front Health Quarant, 2017, 40(2): 96-99. DOI:10.16408/j.1004-9770.2017.02.006 |
| [11] |
冯立, 王卓, 杨军, 等. 黑龙江逊克地区森林革蜱斑点热立克次体DNA的检测[J]. 中国人兽共患病学报, 2014, 30(10): 1020-1023. Feng L, Wang Z, Yang J, et al. Molecular detection of spotted fever group Rickettsia in Dermacentor silvarum from the Xunke area, China[J]. Chin J Zoonoses, 2014, 30(10): 1020-1023. DOI:10.3969/cjz.j.issn.1002-2694.2014.10.007 |
| [12] |
Parola P, Paddock CD, Raoult D. Tick-borne rickettsioses around the world: Emerging diseases challenging old concepts[J]. Clin Microbiol Rev, 2005, 18(4): 719-756. DOI:10.1128/CMR.18.4.719-756.2005 |
| [13] |
于志军, 刘敬泽. 蜱传疾病及其媒介蜱类研究进展[J]. 应用昆虫学报, 2015, 52(5): 1072-1087. Yu ZJ, Liu JZ. Progress in research on tick-borne diseases and vector ticks[J]. Chin J Appl Entomol, 2015, 52(5): 1072-1087. DOI:10.7679/j.issn.2095-1353.2015.128 |
| [14] |
李思思, 张晓雨, 张艳凯, 等. 内蒙古地区全沟硬蜱细菌群落结构及多样性分析[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 607-612. Li SS, Zhang XY, Zhang YK, et al. An analysis of bacterial community composition and diversity in Ixodes persulcatus in Inner Mongolia, China[J]. Chin J Vector Biol Control, 2019, 30(6): 607-612. DOI:10.11853/j.issn.1003.8280.2019.06.003 |
| [15] |
高杨, 许士奇, 李丽静, 等. 塞罕坝自然保护区硬蜱调查及分子鉴定[J]. 中国病原生物学杂志, 2019, 14(9): 1054-1057, 1075. Gao Y, Xu SQ, Li LJ, et al. Molecular identification of ixodid ticks collected from Saihanba in Hebei province[J]. J Parasit Biol, 2019, 14(9): 1054-1057, 1075. DOI:10.13350/j.cjpb.190914 |
| [16] |
周明浩, 陈红娜. 我国新发蜱媒病原体研究概述[J]. 中华卫生杀虫药械, 2019, 25(3): 193-198. Zhou MH, Chen HN. A review on emerging tick-borne pathogens in China[J]. Chin J Hyg Insect Equip, 2019, 25(3): 193-198. DOI:10.19821/j.1671-2781.2019.03.001 |
| [17] |
乌兰图雅, 殷旭红, 崔云虹, 等. 内蒙古中西部草原蜱媒病原体多样性及基因型分析[J]. 中国寄生虫学与寄生虫病杂志, 2021, 39(1): 27-34, 42. Wulantuya, Yin XH, Cui YH, et al. Diversity and genotype analysis of tick-borne pathogens in grasslands in the central and western part of Inner Mongolia[J]. Chin J Parasitol Parasit Dis, 2021, 39(1): 27-34, 42. DOI:10.12140/j.issn.1000-7423.2021.01.004 |
| [18] |
闻静, 焦丹, 鞠文东, 等. 新发蜱传病原体: 劳氏立克次体的研究现状[J]. 中国人兽共患病学报, 2015, 31(4): 361-364. Wen J, Jiao D, Ju WD, et al. Emerging tick-borne pathogen: The research status on Rickettsia raoultii[J]. Chin J Zoonoses, 2015, 31(4): 361-364. DOI:10.3969/cjz.j.issn.1002-2694.2015.04.015 |
| [19] |
桂峥, 于晶峰, 木兰. 内蒙古部分地区草原革蜱携带斑点热群立克次体DNA检测及其基因型分布[J]. 吉林大学学报(医学版), 2021, 47(1): 210-215. Gui Z, Yu JF, Mu L. Detection of DNA in spotted fever group Rickettsia carried by Dermacentor nuttalli in partial areas of Inner Mongolia and its distribution of genotypes[J]. J Jilin Univ(Med Ed), 2021, 47(1): 210-215. DOI:10.13481/j.1671-587Ⅹ.20210129 |
| [20] |
姜理平, 孟真, 崔清荣, 等. 浙江省蜱标本中斑点热群立克次体rOmpA和gltA基因检测[J]. 中国媒介生物学及控制杂志, 2010, 21(4): 350-352. Jiang LP, Meng Z, Cui QR, et al. Detection of rOmpA and gltA genes of spotted fever group rickettsiae from tick specimens in Zhejiang province[J]. Chin J Vector Biol Control, 2010, 21(4): 350-352. |
| [21] |
徐广, 方庆权, Keirans JE, et al. 分子系统进化关系分析的一种新方法: 贝叶斯法在硬蜱属中的应用[J]. 动物学报, 2003, 49(3): 380-388. Xu G, Fang QQ, Keirans JE, et al. Application of Bayesian method for inferring phylogenetic relationships of ticks within the genus Ixodes[J]. Acta Zool Sin, 2003, 49(3): 380-388. DOI:10.3969/j.issn.1674-5507.2003.03.013 |
 2022, Vol. 33
2022, Vol. 33



