扩展功能
文章信息
- 李伊娜, 陈宇飞, 云托娅, 白潇, 刘丽飞, 郝艳阳, 吕楠男, 张胜, 李宏, 李彬, 靳木子
- LI Yi-na, CHEN Yu-fei, YUN Tuo-ya, BAI Xiao, LIU Li-fei, HAO Yan-yang, LYU Nan-nan, ZHANG Sheng, LI Hong, LI Bin, JIN Mu-zi
- 内蒙古自治区中西部口岸地区2020年蜱类优势种及其病原携带情况的调查研究
- Dominant species of ticks and tick-borne pathogens in the central and western ports areas of the Inner Mongolia Autonomous Region, China, 2020
- 中国媒介生物学及控制杂志, 2022, 33(2): 216-220
- Chin J Vector Biol & Control, 2022, 33(2): 216-220
- 10.11853/j.issn.1003.8280.2022.02.009
-
文章历史
- 收稿日期: 2021-11-24
2 二连海关, 内蒙古 二连浩特 011100;
3 呼和浩特海关, 内蒙古 呼和浩特 010020
2 Erenhot Customs House, Erenhot, Inner Mongolia 011100, China;
3 Huhhot Customs District, Huhhot, Inner Mongolia 010020, China
蜱属于蛛形纲(Arachnida)蜱目(Ixodida),由假头和躯体两部分组成。主要吸附于哺乳动物体表,通过吸食血液获取营养物质。温度、湿度、土壤、植被、宿主等都可影响蜱类生命活动,内蒙古自治区(内蒙古)的天然气候条件适合于蜱类的生长,牧区遍布的牛、羊等均是蜱的优质宿主[1]。蜱是仅次于蚊虫的病媒生物[2],可以携带多种病原体,如原虫、病毒、细菌、立克次体、螺旋体、衣原体和支原体等[3],可导致疫病在动物间进行传播,威胁人类和其他动物的生命健康,严重影响地区经济繁荣发展。本研究于内蒙古策克、甘其毛都、满都拉及珠恩嘎达布其口岸地区采集标本,开展蜱传病原监测研究,为口岸地区传染病防控工作提供基础研究依据,明确中蒙边境口岸地区传染病的监测工作方向,对我国传染病跨境传播防控工作具有重要意义。
1 材料与方法 1.1 蜱标本采集时间及地点2020年4-7月在内蒙古口岸地区,包括策克、甘其毛都、满都拉和珠恩嘎达布其口岸4个地区采集蜱。
1.2 试剂及仪器RR001A试剂盒250份/盒、批号AJE0880A,RR019A试剂盒100份/盒、批号AK61622A,RR064A试剂盒250份/盒、批号AJG1447A,均由TaKaRa(大连)公司生产;K1082试剂盒1000/盒、批号00810404,由赛默飞(美国)公司生产,核酸提取试剂盒96×5份/盒购自Qiagen(德国)公司。
SpeedMill Plus组织破碎仪购自Analytik Jena AG(德国)公司,全自动核酸提取工作站购自Qiagen(德国)公司,7500、PE9700和QuantStudio7FlexPCR仪均购自ABI(美国)公司,凝胶成像仪购自Azure(美国)公司,SteREO Discovery.V20体视显微镜购自Zeiss(德国)公司。
1.3 实验方法 1.3.1 蜱类采集方法对游离蜱采用布旗法进行采集。晴天条件下,在干燥灌木或草丛布旗拖行进行采集。对寄生蜱采用体表检视法采集,使用乙醚、镊子采集口岸附近牧区牛、羊、马匹等体表附着蜱。
1.3.2 蜱类鉴定在显微镜下观察蜱虫背部的盾板、假头基,腹部的肛沟、生殖孔、气门板,腿部的外距、内距、盾板等,再参照《中国国境口岸医学媒介生物鉴定图谱》和《中国境外重要病媒生物》[4-5]对蜱进行形态学鉴别。
1.3.3 核酸提取挑选大小适中、身体完整的非吸血蜱,使用75%乙醇溶液浸泡清洗后,放入离心管加300 µl生理盐水进行研磨,研磨后取200 µl组织液,按照核酸提取试剂盒说明书提取DNA和RNA。
1.3.4 PCR扩增检测贝氏柯克斯体(Coxiella burnetii)、伯氏疏螺旋体(Borrelia burgdorferi)、嗜吞噬细胞无形体(Anaplasma phagocytophilum)和斑点热群立克次体(spotted fever group Rickettsiae,SFGR)进行巢氏PCR,埃立克体(Ehrlichia)进行普通PCR,森林脑炎病毒(tick borne encephalitis virus)采用反转录PCR(reverse transcription polymerase chain reaction,RT-PCR)法,反应条件见表 1。PCR体系包括PCR Master Mix(2×)、ddH2O以及正、反向引物和待测核酸样本。巢氏PCR先用第1轮引物、反应条件及待测核酸样本进行普通PCR,然后使用第2轮引物、反应条件及第1轮的PCR产物再进行普通PCR。森林脑炎病毒先进行第1轮反转录,再以全部产物为模板进行普通PCR。反应结束后,取产物5 µl用1.0%琼脂糖凝胶电泳进行鉴定,观察有无扩增目的条带,将出现目标条带的PCR产物送测序公司(华大基因)进行测序。将测序结果在美国国立生物技术信息中心(NCBI)网站的GenBank上进行分析,对比BLAST搜索结果得出蜱携带病原体的种类。新型布尼亚病毒(Severe fever with thrombocytopenia syndrome virus,SFTSV)采用实时荧光RT-PCR法,反转录和PCR扩增一步完成,在循环的最后一步收集荧光,设置阴性对照,结束后在PCR仪上直接读取扩增曲线是否起峰,起峰且荧光达到阈值经历的循环数 < 40为阳性,对结果进行分析并得出蜱携带病原体的种类。
使用Excel 2016软件建立数据库,应用软件SPSS 23.0进行χ2检验,比较4个口岸地区蜱携带病原体的情况。P < 0.05为差异有统计学意义。
2 结果 2.1 蜱采集情况共采集数千只蜱,按照地区随机挑选586只进行检测,其中满都拉、珠恩嘎达布其、策克和甘其毛都口岸分别为47、49、360和130只。蜱经鉴定共1科3属4种,分别为硬蜱属(Ixodes)的草原硬蜱(I. crenulatus),革蜱属(Dermacentor)的草原革蜱(D. nuttalli),璃眼蜱属(Hyalomma)的亚洲璃眼蜱(H. asiaticum)和残缘璃眼蜱(H. dctritum)。经χ2检验,4个口岸间蜱种构成差异有统计学意义(χ2=607.011,P < 0.001)。草原革蜱是满都拉和珠恩嘎达布其口岸地区的优势蜱种,分别占93.62%(44/47)和100%(49/49),亚洲璃眼蜱是策克和甘其毛都口岸地区的优势蜱种,分别占99.17%(357/360)和100%(130/130)。
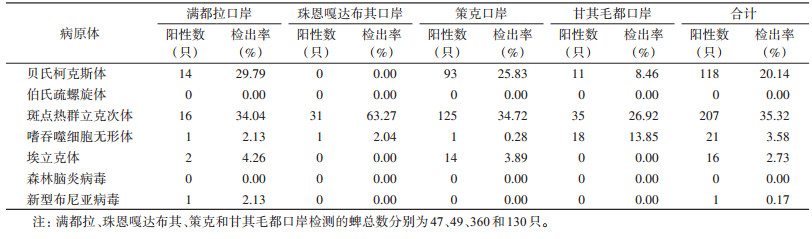
2.2 病原体检出情况对586只蜱标本通过RT-PCR和PCR扩增检测,发现携带贝氏柯克斯体118只,斑点热群立克次体207只,嗜吞噬细胞无形体21只,埃立克体16只,SFTSV 1只,伯氏疏螺旋体和森林脑炎病毒检测结果均为阴性(表 2)。4个口岸共80只蜱同时携带2种及2种以上病原体,多重感染的阳性率为13.65%(80/586)。满都拉、甘其毛都、策克和珠恩嘎达布其口岸发现多重感染的蜱分别有10、14、56和0只,阳性率为21.28%、10.77%、15.56%和0。见表 3。
|

|
4个口岸每种病原体的检出情况存在差异。伯氏疏螺旋体和森林脑炎病毒在4个口岸的蜱中均未检出,斑点热群立克次体和嗜吞噬细胞无形体在4个口岸的蜱中均有检出,此外,甘其毛都口岸蜱检出携带贝氏柯克斯体,策克和满都拉口岸蜱检出携带贝氏柯克斯体和埃立克体,满都拉口岸1只蜱检出携带新布尼亚病毒(表 2)。4个口岸贝氏柯克斯体、斑点热群立克次体、嗜吞噬细胞无形体和SFTSV 4种病原体阳性率差异有统计学意义(χ2=33.360,P < 0.001;χ2=20.851,P < 0.001;χ2=51.638,P < 0.001;χ2=11.488,P < 0.001),而埃立克体差异均无统计学意义(均P > 0.05)。
3 讨论内蒙古地区幅员辽阔,生态环境复杂多样,是多种蜱传疾病的自然疫源地。本研究显示,内蒙古西部中蒙边境口岸地区分布多种蜱类,其中草原革蜱是满都拉和珠恩嘎达布其口岸及周边地区的优势蜱种,亚洲璃眼蜱是策克和甘其毛都口岸及周边地区的优势蜱种[12]。
本次研究发现,各口岸地区因环境不同,不仅分布蜱种存在差异,蜱类携带病原体种类、数量等也存在较大差异。在珠恩嘎达布其口岸仅发现斑点热群立克次体和嗜吞噬细胞无形体2种病原体,且在此地区未发现2种病原体同时感染同1只草原革蜱的情况,该地区蜱普遍携带斑点热群立克次体,也存在感染嗜吞噬细胞无形体的风险,甘其毛都口岸发现大量蜱携带斑点热群立克次体和嗜吞噬细胞无形体,少量蜱携带贝氏柯克斯体,有近半的蜱均携带病原体,传染风险极高;策克口岸存在大量蜱携带贝氏柯克斯体和斑点热群立克次体,另外发现2只蜱中1只感染贝氏柯克斯体、埃立克体和斑点热群立克次体3种病原体,另1只感染贝氏柯克斯体、埃立克体、斑点热群立克次体和SFTSV 4种病原体。4个地区蜱携带病原体种类、数量存在差异,但均检出斑点热群立克次体和嗜吞噬细胞无形体,这2种病原体在口岸地区分布极为广泛,且蜱类极易感染。
不同地区有不同的生存环境,导致不同蜱类携带种类复杂的病原体。研究表明,蜱传疾病的流行范围呈现越来越广的趋势,目前我国有60种蜱被证实能够传播疾病,其中38种可同时携带多种病原体[13],由于环境和人口的变化,蜱传疾病发病率在世界范围内呈增长趋势,目前蜱传疾病已被认定能够影响社会公共卫生安全[14]。近年来,国内多次报道蜱叮咬导致动物或人感染贝氏柯克斯体[15-16]、伯氏疏螺旋体、斑点热群立克次体[17-18]和SFTSV[19-20]等情况,蜱传疾病应该受到重视。本研究数据显示,4个口岸地区采集的586只蜱中,蜱携带斑点热群立克次体和贝氏柯克斯体的检出率分别为35.32%和20.14%。其次,有一定数量的蜱携带嗜吞噬细胞无形体和埃立克体,个别检出SFTSV。同时,4个口岸地区共检出80只携带混合病原体的蜱,阳性率达到13.65%,说明蜱类能同时传播多种疾病[21],且该现象在除珠恩嘎达布其口岸外的3个口岸地区大量存在。由此可见,口岸地区蜱传疾病形势严峻,情况复杂,大量携带病原体的蜱可能导致严重疾病传播,为边境地区生活的人们带来巨大风险。同时中蒙边境地区环境更具多样性和复杂性,极有可能出现新发蜱媒疾病,该地区关于媒介蜱及其携带病原体的研究仍需进一步加强。
利益冲突 无
| [1] |
吴海霞, 刘小波, 岳玉娟, 等. 2019年全国蜱类监测报告[J]. 中国媒介生物学及控制杂志, 2020, 31(4): 417-422. Wu HX, Liu XB, Yue YJ, et al. National surveillance report on ticks in China, 2019[J]. Chin J Vector Biol Control, 2020, 31(4): 417-422. DOI:10.11853/j.issn.1003.8280.2020.04.007 |
| [2] |
Sonenshine DE, Mather TN. Ecological dynamics of tick-borne zoonoses[M]. Oxford: Oxford University Press, 1994: 447.
|
| [3] |
郑卫青, 柳小青, 陈海婴. 蜱虫危害及其媒介效能[J]. 中华卫生杀虫药械, 2014, 20(5): 493-496, 500. Zheng WQ, Liu XQ, Chen HY. Research on ticks infestation and their vector capacity[J]. Chin J Hyg Insect Equip, 2014, 20(5): 493-496, 500. DOI:10.19821/j.1671-2781.2014.05.033 |
| [4] |
张际文. 中国国境口岸医学媒介生物鉴定图谱[M]. 天津: 天津科学技术出版社, 2015: 432-469. Zhang JW. The identification atlas of medical vectors in Chinese points of entry[M]. Tianjin: Tianjin Science and Technology Press, 2015: 432-469. |
| [5] |
郭天宇, 许荣满. 中国境外重要病媒生物[M]. 天津: 天津科学技术出版社, 2017: 140-205. Guo TY, Xu RM. Important vectors outside China[M]. Tianjin: Tianjin Science and Technology Press, 2017: 140-205. |
| [6] |
中华人民共和国国家质量监督检验检疫总局. SN/T 3395-2012蜱类携带森林脑炎病毒、伯氏疏螺旋体、贝氏柯克斯体PCR检测方法[S]. 北京: 中国标准出版社, 2013. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 3395-2012 PCR detection methods for tick borne encephalitis virus, Borrelia burgdorferi, Coxiella burneti[S]. Beijing: Standards Press of China, 2013. (in Chinese) |
| [7] |
崔晓鸣. 嗜吞噬细胞无形体及其复合感染的调查与实验研究[D]. 北京: 中国人民解放军军事医学科学院, 2016. Cui XM. Anaplasma phagocytophilum and its coinfection with other tick-borne pathogens: Experimental study and epidemiological investigation[D]. Beijing: Academy of Military Medical Sciences, 2016. (in Chinese) |
| [8] |
褚宸一. 媒介和宿主中伯氏疏螺旋体感染调查及基因分型研究[D]. 北京: 中国人民解放军军事医学科学院, 2009. Chu CY. Survey on the prevalence and genotyping of Borrelia burgdorferi sensu lato in vectors and hosts[D]. Beijing: Academy of Military Medical Sciences, 2009. (in Chinese) |
| [9] |
周磊, 汤芳, 栾进, 等. 内蒙古奇乾地区蜱携带斑点热立克次体的调查[J]. 中国国境卫生检疫杂志, 2017, 40(2): 96-99. Zhou L, Tang F, Luan J, et al. Investigation on spotted fever group Rickettsiae in ticks collected from Qiqian areas of Inner Mongolia[J]. Chin J Front Health Quarant, 2017, 40(2): 96-99. DOI:10.16408/j.1004-9770.2017.02.006 |
| [10] |
赵秋敏, 吴晓明, 张泮河, 等. 3种蜱媒传染病在媒介蜱和鼠类中复合感染的研究[J]. 中华流行病学杂志, 2005, 26(1): 9-13. Zhao QM, Wu XM, Zhang PH, et al. Study on the coinfection of three tick-borne infectious diseases in China using polymerase chain reaction method[J]. Chin J Epidemiol, 2005, 26(1): 9-13. DOI:10.3760/j.issn:0254-6450.2005.01.003 |
| [11] |
胡建功. 发热伴血小板减少综合征病例的病毒载量与抗体动态变化规律研究[D]. 北京: 中国人民解放军军事医学科学院, 2016. Hu JG. Dynamic changes of viral loads and antibodys in patients with severe fever with thrombocytopenia syndrome[D]. Beijing: Academy of Military Medical Sciences, 2016. (in Chinese) |
| [12] |
王云冲. 内蒙古阿拉善地区双峰驼体表蜱种的鉴定及蜱体内病原的分离[D]. 呼和浩特: 内蒙古农业大学, 2020. DOI: 10.27229/d.cnki.gnmnu.2020.000726. Wang YC. Identification of tick species on the surface of Bactrian camel and isolation of tick pathogens in Alxa, Inner Mongolia[D]. Hohhot: Inner Mongolia Agricultural University, 2020. DOI: 10.27229/d.cnki.gnmnu.2020.000726.(inChinese) |
| [13] |
陈锐, 寇增强, 温红玲. 我国常见蜱传疾病的流行病学研究进展[J]. 中华实验和临床病毒学杂志, 2020, 34(1): 102-106. Chen R, Kou ZQ, Wen HL. Epidemiological studies of common tick-borne diseases in China[J]. Chin J Exp Clin Virol, 2020, 34(1): 102-106. DOI:10.3760/cma.j.issn.1003-9279.2020.01.021 |
| [14] |
Brinkmann A, Dinçer E, Polat C, et al. A metagenomic survey identifies Tamdy orthonairovirus as well as divergent phlebo-, rhabdo-, chu- and flavi-like viruses in Anatolia, Turkey[J]. Ticks Tick-Borne Dis, 2018, 9(5): 1173-1183. DOI:10.1016/j.ttbdis.2018.04.017 |
| [15] |
冯淑萍, 张培培, 李春英, 等. 广西四个地市2020年牛、羊Q热流行病学调查与分析[J]. 上海畜牧兽医通讯, 2021(3): 42-44. Feng SP, Zhang PP, Li CY, et al. Epidemiological investigation and analysis of Q fever in cattle and sheep in four prefectures and cities of Guangxi in 2020[J]. Shanghai J Anim Husband Vet Med, 2021(3): 42-44. DOI:10.14170/j.cnki.cn31-1278/s.2021.03.014 |
| [16] |
赵锐, 许德荣, 张伟. mNGS诊断1例Q热病例报告[J]. 实验与检验医学, 2021, 39(3): 745-747. Zhao R, Xu DR, Zhang W. A case of Q fever diagnosed by mNGS[J]. Exp Lab Med, 2021, 39(3): 745-747. DOI:10.3969/j.issn.1674-1129.2021.03.072 |
| [17] |
吴雪, 顾时平, 黄艺, 等. 安吉县5例斑点热病例报告[J]. 预防医学, 2017, 29(1): 88-90. Wu X, Gu SP, Huang Y, et al. Report of 5 cases of spotted fever in Anji county[J]. Prev Med, 2017, 29(1): 88-90. DOI:10.19485/j.cnki.issn1007-0931.2017.01.024 |
| [18] |
孟艳, 张昕, 王丹凤, 等. 北京市首例莱姆病合并斑点热混合感染确诊病例的流行病学调查分析[J]. 中国人兽共患病学报, 2019, 35(1): 81-84. Meng Y, Zhang X, Wang DF, et al. Epidemiological analysis of the first confirmed case of Lyme disease combined with spotted fever in Beijing[J]. Chin J Zoonoses, 2019, 35(1): 81-84. DOI:10.3969/j.issn.1002-2694.2018.00.228 |
| [19] |
王娟, 蔡亮, 杨浩, 等. 一起家庭聚集性发热伴血小板减少综合征疫情的流行病学及病原学分析[J]. 疾病监测, 2021, 36(7): 729-733. Wang J, Cai L, Yang H, et al. Epidemiological investigation and etiological analysis on a cluster of severe fever with thrombocytopenia syndrome in a family[J]. Dis Surveill, 2021, 36(7): 729-733. DOI:10.3784/jbjc.202011100380 |
| [20] |
冯亚玲, 胡兰琴, 姜锡能, 等. 兰溪市首例发热伴血小板减少综合征病例调查[J]. 预防医学, 2021, 33(3): 284-285. Feng YL, Hu LQ, Jiang XN, et al. Investigation on the first case of fever with thrombocytopenia syndrome in Lanxi city[J]. Prev Med, 2021, 33(3): 284-285. DOI:10.19485/j.cnki.issn2096-5087.2021.03.017 |
| [21] |
杨宇, 高艳菲, 曹旸, 等. 内蒙古满洲里口岸地区2012-2014年蜱携带病原体调查[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 147-150, 156. Yang Y, Gao YF, Cao Y, et al. Investigation on tick-borne pathogens in Inner Mongolia Manchuria port area during 2012-2014[J]. Chin J Vector Biol Control, 2018, 29(2): 147-150, 156. DOI:10.11853/j.issn.1003.8280.2018.02.008 |
 2022, Vol. 33
2022, Vol. 33



