扩展功能
文章信息
- 覃晓宁, 任欣悦, 谢雪颜, 陈彦桦, 夏乾峰, 康迅
- QIN Xiao-ning, REN Xin-yue, XIE Xue-yan, CHEN Yan-hua, XIA Qian-feng, KANG Xun
- 海口市及周边地区白纹伊蚊幼蚊肠道微生物分离与鉴定
- Isolation and identification of gut microbiota of Aedes albopictus larvae from Haikou and surrounding areas, China
- 中国媒介生物学及控制杂志, 2022, 33(2): 201-206
- Chin J Vector Biol & Control, 2022, 33(2): 201-206
- 10.11853/j.issn.1003.8280.2022.02.006
-
文章历史
- 收稿日期: 2021-11-22
2 海南医学院热带转化医学教育部重点实验室,海南 海口 571199;
3 海南医学院热带生物医学技术实验室,海南 海口 571199;
3 海南医学院热带生物医学技术实验室, 海南 海口 571199
2 Key Laboratory of Tropical Translational Medicine of Ministry of Education, Hainan Medical College, Haikou, Hainan 571199, China;
3 Tropical Biomedical Technology Laboratory, Hainan Medical College, Haikou, Hainan 571199, China
蚊虫不仅骚扰吸血,而且是多种疾病的传播媒介。在美国虫媒病毒委员会登记的虫媒病毒已超过5 000种,可由多种媒介传播,其中超过一半是由蚊虫传播[1]。蚊肠道微生物与蚊相互作用的研究为控制蚊媒传染病提供了新的思路,迄今为止,蚊虫肠道细菌组成是研究最广泛的。巴西、孟加拉国和意大利对实验室内培养的埃及伊蚊(Aedes aegypti)、白纹伊蚊(Ae. albopictus)和野外采集的幼蚊、蛹和成蚊(肠道和性腺)的肠道菌进行培养,鉴定出近平滑念珠菌(Candida parapsilosis)和吉列蒙氏念珠菌(Meyerozyma guilliermondii),除通过形态学和生化鉴定细菌外,研究者们还提取了肠道菌DNA进行测序鉴定,鉴定出芽孢杆菌属(Bacillus sp.)和枯草芽孢杆菌(B. subtilis)[2]。有研究显示,在印度阿鲁纳恰尔邦巴鲁克蓬地区收集的伊蚊幼蚊和蛹、白纹伊蚊的中肠中共鉴定出16种不同的细菌,其中变形细菌门(62.50%)细菌最为突出,第二大门是厚壁菌门(31.25%)[3]。蚊虫共生微生物群对于蚊虫的生长、发育、繁殖、进化以及对病原体的媒介效能都有很大影响[4-9]。海南省地理位置适合蚊虫孳生,目前海南省对蚊虫的研究主要是蚊种的鉴定,对幼蚊肠道微生物的研究相对较少。为此,我们对海口市及周边地区的白纹伊蚊幼蚊肠道微生物进行分离与鉴定,为后续研究其功能奠定基础。
1 材料与方法 1.1 样品采集针对海南省疟疾发病呈现明显的西南部高发、东北部低发的地区分布规律[10],我们于2019年5-9月选择海南省东北部人口数量最多的海口市及其周边的文昌市抱罗镇高堆村、临高县昌拱村,海口市的大顶村、溪宜下村和星辉村采集白纹伊蚊幼蚊。
1.2 主要仪器与试剂LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,琼脂18 g/L,pH值7.2。LB液体培养基(100 ml):1.0 g胰蛋白胨,1.0 g NaCl,0.5 g酵母抽提物,100 ml蒸馏水;PDA培养基:马铃薯葡萄糖琼脂37 g,1 L蒸馏水。细菌基因组DNA提取试剂盒(DP302),天根生化科技(北京)有限公司;真菌DNA小量提取试剂盒D3390-01,北京杰辉博高生物技术有限公司;血液/组织基因组DNA提取试剂盒,速徕生物科技有限公司;dNTP、LA Taq聚合酶和DNA分子质量标准(DL 2000、1 000 bp Ladder)均购自宝日医生物技术(北京)有限公司;PCR扩增仪(Biometra)、Mini-Protean Tetra Cell电泳仪(Bio-Rad)和微量移液器(Eppendorf),凝胶成像系统(BIO-RAD)及自动电热压力蒸汽灭菌锅(LDZX-40AI)等实验室常规仪器。
1.3 基因组DNA提取及扩增按照速徕生物科技有限公司的Dneasy Blood & Tissue Kit试剂盒说明书提取幼蚊DNA,从白纹伊蚊线粒体细胞色素C氧化酶亚基Ⅰ(COⅠ)基因中选用合适的引物进行基因扩增,扩增mtDNA-COⅠ的引物由宝日医生物技术(北京)有限公司合成。预期的PCR扩增片段大小约为650 bp,正向引物5'-GGTCAACAAATCATAAAGATATTGG-3',反向引物5'-TAAACTTCAGGG-TGACCAAAAAATCA-3'。以提取蚊虫DNA为模板,用上述引物进行PCR扩增,扩增反应条件:预变性95 ℃ 5 min;变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 41 s,共35个循环;终延伸72 ℃ 12 min。利用1%琼脂糖凝胶电泳鉴定PCR扩增产物。取扩增产物5 μl进行1%琼脂糖凝胶电泳,凝胶成像系统观察拍照记录结果。扩增产物送华大基因有限公司进行双向测序,将序列进行BLAST比对。幼蚊基因测序得到的序列上传到美国国立生物技术信息中心(NCBI)数据库中,获取登录号。从国际基因库(GenBank)下载蚊虫基因序列与采集的幼蚊基因序列用MEGA 7.0.26软件构建系统发育树,此次进化Bootstrap取值为1 000,树的分支可信。
5个地点各取30只白纹伊蚊幼蚊肠道接种于LB培养基,37 ℃孵育24~48 h,将长出的菌落挑取真菌接种于PDA培养基,细菌接种于LB培养基,进行重复传代培养。所有步骤均在无菌环境中进行,严格遵循无菌操作。取上述纯化好的单菌落,提取DNA。细菌引物为27F(5'-AGAGTITGATCCTGGCTCAG-3')和1492R(5'-TACGGATACCACGACTT-3'),真菌通用引物ITS4(5'-TCCTCCGCTTATTGATATGC-3')和ITS1(5'-TCCGTAGGTGAACCTGCGG-3')。细菌的扩增体系(25 μl):Mix 10 μl;DNA 1 μl;27F+1492R 1 μl;ddH2O 12 μl。细菌PCR扩增反应程序:95 ℃ 5 min;94 ℃ 30 s,52 ℃ 45 s,72 ℃ 1 min,共30个循环;72 ℃ 12 min。真菌的扩增体系(25 μl):Mix 10 μl,DNA 1 μl,ITS1、ITS4各1 μl;ddH2O 12 μl,真菌PCR扩增反应程序:94 ℃ 5 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃12 min。利用1%琼脂糖凝胶电泳鉴定扩增产物。扩增产物经1%琼脂糖凝胶电泳后用凝胶成像系统观察并保存,样品送华大基因有限公司测序。将序列在NCBI数据库中进行BLAST比对,并进行分析。
2 结果 2.1 幼蚊基因组DNA产物条带鉴定及BLAST分析结果5个地点采集的幼蚊基因扩增产物电泳结果如图 1所示,条带大小在500~750 bp,靠近750 bp,符合预期结果(650 bp左右)。
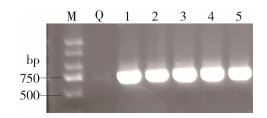
|
| 注:M表示marker(DL 2000);Q阴性对照;1文昌市抱罗镇高堆村;2临高县昌拱村;3海口市星辉村;4海口市大顶村;5海口市溪宜下村。 图 1 海口市及周边5个地点白纹伊蚊幼蚊线粒体细胞色素C氧化酶亚基Ⅰ基因PCR产物电泳结果 Figure 1 Electrophoresis results of PCR products of mitochondrial cytochrome c oxidase subunit Ⅰ gene of Aedes albopictus larvae in Haikou and five surrounding sites |
| |
幼蚊COⅠ基因BLAST的分析结果:在BLAST结果的描述区域共有5个值,可看到E值均为0,这5个地点的幼蚊基因编码氨基酸序列与国际基因库中的白纹伊蚊同源性达到了100%。见表 1。
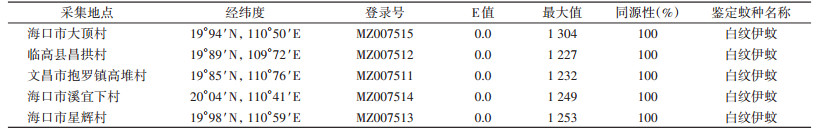
|
采用遗传距离建树法的邻接法(neighbor-joining method,NJ法)构建系统进化树,结果见图 2。文昌市抱罗镇高堆村、临高县昌拱村、海口市星辉村、溪宜下村、大顶村5个地点的蚊虫登录号依次为MZ007511、MZ007512、MZ007513、MZ007514和MZ007515。这5个地点的幼蚊又与国际基因库(GenBank)下载的白纹伊蚊(MT434292.1)遗传距离最近,具有一定的同源性,可以确定这5个地点的幼虫属于库蚊亚科,伊蚊属。

|
| 图 2 邻接法构建的基于细胞色素C氧化酶亚基Ⅰ基因序列的系统进化树 Figure 2 Phylogenetic tree based on cytochrome C oxidase subunit Ⅰ gene sequence constructed by the neighbor-joining method |
| |
电泳结果显示(图 3、4),产物条带均处在1 000~2 000 bp,与细菌16S rDNA的预期条带大小(1 386 bp)相符;真菌PCR产物电泳均靠近在1 000 bp,与预期内部转录间隔区(ITS)分子质量大小(839 bp)相符。5个地点白纹伊蚊幼蚊肠道微生物共分离出11个细菌单菌落(8种不同细菌),2种真菌。文昌抱罗镇高堆村和海口溪宜下村分离出菌落类型较多,分别为3和4种,而海口大顶村和临高昌拱村均只分离出1种细菌,仅在临高昌拱村采集的幼蚊中分离出真菌。

|
| 注:M表示marker(DL 2000);Q阴性对照;1临高县昌拱村蚊虫肠道细菌;2~4文昌市抱罗镇高堆村蚊虫肠道细菌;5海口市大顶村蚊虫肠道细菌;6~9海口市溪宜下村蚊虫肠道细菌;10、11海口市星辉村蚊虫肠道细菌。 图 3 海口市白纹伊蚊幼蚊肠道细菌DNA扩增产物电泳结果 Figure 3 Electrophoresis results of DNA amplification products of gut bacteria of Aedes albopictus larvae in Haikou |
| |
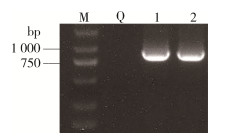
|
| 注:M表示marker(DL 2000);Q阴性对照;1米曲霉(Aspergillus oryzae);2分枝横梗霉(Lichtheimia ramosa)。 图 4 海口市白纹伊蚊幼蚊肠道真菌DNA扩增产物电泳结果 Figure 4 Electrophoresis results of DNA amplification products of gut fungi of Aedes albopictus larvae in Haikou |
| |
所获细菌均接种于LB固体培养基上生长18~24 h,真菌在PDA培养基上培养3~7 d,海口市溪宜下村蚊虫肠道共分离出4个单菌落、文昌市抱罗镇高堆村蚊虫肠道分离得到3个单菌落、海口市星辉村蚊虫肠道分离出2个单菌落,海口市大顶村和临高县昌拱村蚊虫肠道均只分离得到1个单菌落,只有临高县昌拱村蚊虫肠道分离出2种真菌(表 3);分离鉴定得到的肠道菌形态见图 5,菌落颜色及菌落特征描述见表 2。
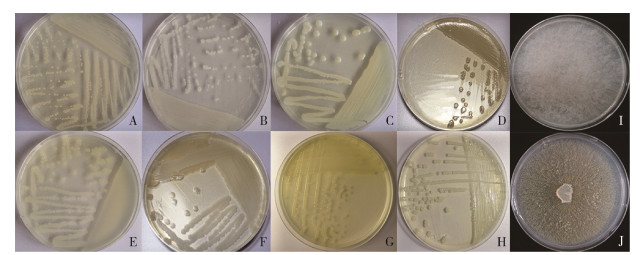
|
| 注:A鲍曼不动杆菌;B贝莱斯芽孢杆菌;C蛋白水解芽孢杆菌;D纺锤形赖氨酸芽孢杆菌;E巨大芽孢杆菌;F蜡状芽孢杆菌;G沙雷菌;H水生拉恩菌;I分枝横梗霉;J米曲霉。 图 5 海口市白纹伊蚊幼蚊肠道菌形态图(×300) Figure 5 Morphology of gut bacteria of Aedes albopictus larvae in Haikou (×300) |
| |

|
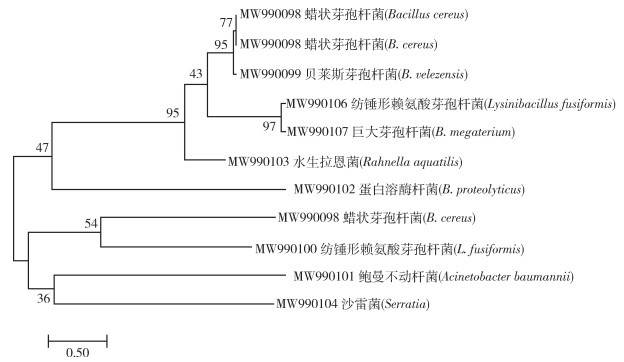
将细菌基因测序结果和NCBI数据库中进行序列比对,同源性均 > 98.00%,所获得的比对结果见表 3。从幼蚊肠道中分离鉴定出沙雷菌、蜡状芽孢杆菌属、纺锤形赖氨酸芽孢杆菌、巨大芽孢杆菌、贝莱斯芽孢杆菌、鲍曼不动杆菌、蛋白水解芽孢杆菌和水生拉恩菌。其中主要的优势菌属为芽孢杆菌属(图 6)。5个地点所分离出的11个单菌落中,优势菌为厚壁菌门细菌。见表 3。

|
|
| 图 6 邻接法构建的基于细菌16S rDNA基因序列的系统进化树 Figure 6 Phylogenetic tree based on bacterial 16S rDNA gene sequence constructed by the neighbor-joining method |
| |
只有临高县昌拱村蚊虫培养出2种真菌,其他地点未分离到真菌。从BLAST结果中可以看到2种真菌与国际基因库中的米曲霉和分枝横梗霉同源性分别达100%。
3 讨论本次研究的幼蚊采自文昌市抱罗镇高堆村、临高县昌拱村以及海口市的3个不同村庄,采集的幼蚊基因编码氨基酸序列与国际基因库中的白纹伊蚊同源性达到了100%,从而可以确定所鉴定的幼蚊为白纹伊蚊。在采样过程中发现,白纹伊蚊通常喜欢在竹子、树桩、树洞、树木和废旧轮胎中繁殖。有研究证实,在水生生物阶段的幼蚊通过栖息地获得相当一部分细菌。繁殖地点的微生物组成和环境特征可以解释部分未成熟和成年蚊虫阶段细菌不同定植模式[11]。
本研究分析了白纹伊蚊幼蚊的中肠微生物,采集的幼蚊具有不同的栖息地,从进化树可以看出,本次研究中文昌市抱罗镇与其他4个地点(海口市星辉村、溪宜下村、大顶村及临高县昌拱村)的白纹伊蚊虽然基因交流较少,但是对于肠道微生物的种类,文昌市采集的幼蚊分离出蜡状芽孢杆菌和纺锤形赖氨酸芽孢杆菌,海口市溪宜下村也同样分离出这2种菌。在海口市的星辉村、大顶村、溪宜下村和临高县昌拱村中,仅大顶村和溪宜下村采集的幼蚊分离培养出蜡状芽孢杆菌,以及仅从临高县昌拱村采集的幼蚊中分离培养出真菌。综上所述,白纹伊蚊基因同源性程度的高低可能对蚊虫体内肠道微生物的种类多样性不存在影响,这2个方面因素的相关性还需要进一步积累数据解释和分析。通过基因序列分析鉴定出白纹伊蚊幼蚊中肠微生物共有8种不同细菌,2种真菌,并且大多数细菌属已从伊蚊的中肠以及其他蚊种中得到报道,例如肠杆菌、芽孢杆菌、假单胞菌、克雷伯菌、不动杆菌和沙雷菌的细菌属[12-17]。还有报道称一些细菌种类与蚊虫肠道环境、寄生菌以及按蚊、库蚊等其他蚊虫种类密切相关,从印度阿鲁纳恰尔邦巴鲁克蓬生物多样性地点采集白纹伊蚊肠道分离得到的菌,变形细菌门最为突出,第二大门是厚壁菌门[18]。而本次研究中,白纹伊蚊肠道中厚壁菌门占优势,导致这种结果的差异可能是由于地理环境不同造成的,但是存在的共同点为即使地理环境的不同,白纹伊蚊肠道主要菌门依旧是变形菌门和厚壁菌门。因此我们认为即使生活栖息环境存在地理等差异,白纹伊蚊的肠道优势菌门大体上还是相似的,从而认为白纹伊蚊的肠道环境会更适合于变形菌门和厚壁菌门生存。
从我们的研究中发现,白纹伊蚊幼蚊中肠中分离出了沙雷菌。在之前有报道称沙雷菌产生的红色色素苦苣苔,称为Prodigiosin,具有抗菌作用,会改变小鼠盲肠微生物群的丰富度和多样性[3]。本次研究中临高县昌拱村的白纹伊蚊肠道微生物菌落的丰富度最低,仅分离出1种细菌,而其他4个地点均分离出2种及2种以上的细菌菌株,是否是因为临高县昌拱村白纹伊蚊幼蚊体内存在沙雷菌而改变了其肠道内微生物群的丰富度有待进一步研究。
近年来蚊虫肠道菌群的生物学功能等方面的研究取得了一些进展,某些中肠栖息细菌在疾病传播、宿主与寄生虫的相互作用中起着重要作用,并且还影响了蚊虫的媒介能力。中肠是寄生虫和上皮表面之间的第1个接触点,其中大量的寄生虫数量减少[19]。阻止疟原虫发育的微生物群可用于调节蚊虫的媒介能力[20]。目前蚊虫肠道菌在中肠定植的机制知之甚少,对蚊虫以及它们肠道微生物群的进一步探索,可用于研究并开发新颖、环保、高效的防御蚊虫传播病毒的机制,以降低蚊虫的媒介能力,从而控制疾病的传播。
利益冲突 无
| [1] |
贾德胜, 谭伟龙, 王长军, 等. 伊蚊传播疾病及其防治[J]. 中华卫生杀虫药械, 2017, 23(1): 1-7. Jia DS, Tan WL, Wang CJ, et al. Aedes-borne diseases prevention and control[J]. Chin J Hyg Insect Equip, 2017, 23(1): 1-7. DOI:10.19821/j.1671-2781.2017.01.001 |
| [2] |
Scolari F, Casiraghi M, Bonizzoni M. Aedes spp. and their microbiota: A review[J]. Front Microbiol, 2019, 10: 2036. DOI:10.3389/fmicb.2019.02036 |
| [3] |
Yadav KK, Bora A, Datta S, et al. Molecular characterization of midgut microbiota of Aedes albopictus and Ae. aegypti from Arunachal Pradesh, India[J]. Parasit Vectors, 2015, 8: 641. DOI:10.1186/s13071-015-1252-0 |
| [4] |
Dong YM, Manfredini F, Dimopoulos G. Implication of the mosquito midgut microbiota in the defense against malaria parasites[J]. PLoS Pathog, 2009, 5(5): e1000423. DOI:10.1371/journal.ppat.1000423 |
| [5] |
Ricci I, Damiani C, Capone A, et al. Mosquito/microbiota interactions: From complex relationships to biotechnological perspectives[J]. Curr Opin Microbiol, 2012, 15(3): 278-284. DOI:10.1016/j.mib.2012.03.004 |
| [6] |
Minard G, Mavingui P, Moro CV. Diversity and function of bacterial microbiota in the mosquito holobiont[J]. Parasit Vectors, 2013, 6(1): 146. DOI:10.1186/1756-3305-6-146 |
| [7] |
Dennison NJ, Jupatanakul N, Dimopoulos G. The mosquito microbiota influences vector competence for human pathogens[J]. Curr Opin Insect Sci, 2014, 3: 6-13. DOI:10.1016/j.cois.2014.07.004 |
| [8] |
Coon KL, Vogel KJ, Brown MR, et al. Mosquitoes rely on their gut microbiota for development[J]. Mol Ecol, 2014, 23(11): 2727-2739. DOI:10.1111/mec.12771 |
| [9] |
Kim CH, Lampman RL, Muturi EJ. Bacterial communities and midgut microbiota associated with mosquito populations from waste tires in East-Central Illinois[J]. J Med Entomol, 2015, 52(1): 63-75. DOI:10.1093/jme/tju011 |
| [10] |
曾晓露. 海南地区疟疾疫情分布特征及环境影响因素研究[D]. 重庆: 第三军医大学, 2015. Zeng XL. Study on the distribution characteristics of malaria epidemic situation and its environmental factors in Hainan province[D]. Chongqing: Third Military Medical University, 2015. (in Chinese) |
| [11] |
Li X, Tan XF, Chen QS, et al. Prodigiosin of Serratia marcescens ZPG19 alters the gut microbiota composition of Kunming mice[J]. Molecules, 2021, 26(8): 2156. DOI:10.3390/molecules26082156 |
| [12] |
Guégan M, Zouache K, Démichel C, et al. The mosquito holobiont: Fresh insight into mosquito-microbiota interactions[J]. Microbiome, 2018, 6(1): 49. DOI:10.1186/s40168-018-0435-2 |
| [13] |
Chao J, Wistreich GA. Microbial isolations from the midgut of Culex tarsalis Coquillett[J]. J Insect Pathol, 1959, 1: 311-318. |
| [14] |
Demaio J, Pumpuni CB, Kent M, et al. The midgut bacterial flora of wild Aedes triseriatus, Culex pipiens, and Psorophora columbiae mosquitoes[J]. Am J Trop Med Hyg, 1996, 54(2): 219-223. DOI:10.4269/ajtmh.1996.54.219 |
| [15] |
Pidiyar VJ, Jangid K, Patole MS, et al. Studies on cultured and uncultured microbiota of wild Culex quinquefasciatus mosquito midgut based on 16S ribosomal RNA gene analysis[J]. Am J Trop Med Hyg, 2004, 70(6): 597-603. DOI:10.1016/S0008-6215(97)00005-0 |
| [16] |
Rani A, Sharma A, Rajagopal R, et al. Bacterial diversity analysis of larvae and adult midgut microflora using culture-dependent and culture-independent methods in lab-reared and field-collected Anopheles stephensi-an Asian malarial vector[J]. BMC Microbiol, 2009, 9(1): 96. DOI:10.1186/1471-2180-9-96 |
| [17] |
Boissière A, Tchioffo MT, Bachar D, et al. Midgut microbiota of the Malaria mosquito vector Anopheles gambiae and interactions with Plasmodium falciparum infection[J]. PLoS Pathog, 2012, 8(5): e1002742. DOI:10.1371/journal.ppat.1002742 |
| [18] |
Chandel K, Mendki MJ, Parikh RY, et al. Midgut microbial community of Culex quinquefasciatus mosquito populations from India[J]. PLoS One, 2013, 8(11): e80453. DOI:10.1371/journal.pone.0080453 |
| [19] |
Wu P, Sun P, Nie KX, et al. A gut commensal bacterium promotes mosquito permissiveness to arboviruses[J]. Cell Host Microbe, 2019, 25(1): 101-112.e5. DOI:10.1016/j.chom.2018.11.004 |
| [20] |
Campbell CL, Mummey DL, Schmidtmann ET, et al. Culture-independent analysis of midgut microbiota in the arbovirus vector Culicoides sonorensis (Diptera: Ceratopogonidae)[J]. J Med Entomol, 2004, 41(3): 340-348. DOI:10.1603/0022-2585-41.3.340 |
 2022, Vol. 33
2022, Vol. 33


