扩展功能
文章信息
- 伍思翰, 周欣欣, 柯雪梅, 李玉伟, 陈斌, 黄婧雯, 陈华芳, 林敏珍, 雷蕾, 郭志南, 孟凤霞
- WU Si-han, ZHOU Xin-xin, KE Xue-mei, LI Yu-wei, CHEN Bin, HUANG Jing-wen, CHEN Hua-fang, LIN Min-zhen, LEI Lei, GUO Zhi-nan, MENG Feng-xia
- 福建省厦门市2020年白纹伊蚊对拟除虫菊酯类杀虫剂敏感性及击倒抗性基因研究
- Study on sensitivity and knockdown resistance genes of Aedes albopictus to pyrethroid insecticides in Xiamen, Fujian province, China, 2020
- 中国媒介生物学及控制杂志, 2022, 33(2): 177-182
- Chin J Vector Biol & Control, 2022, 33(2): 177-182
- 10.11853/j.issn.1003.8280.2022.02.003
-
文章历史
- 收稿日期: 2021-11-10
2 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 传染病预防控制国家重点实验室, 北京 102206;
3 福建省疾病预防控制中心, 福建 福州 350001
2 Key Laboratory of Infectious Disease Prevention and Control, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China;
3 Fujian Center for Disease Control and Prevention, Fuzhou, Fujian 350001, China
白纹伊蚊(Aedes albopictus)是登革热、黄热病和基孔肯雅热等多种虫媒传染病的重要传播媒介,对人类健康和经济发展具有严重威胁[1]。环境治理是防治白纹伊蚊的根本措施,但当出现突发登革热疫情时,须使用卫生杀虫剂来迅速降低白纹伊蚊密度,从而控制登革热的发展流行。近年来,由于登革热疫情、大型会议保障、卫生城镇创建等工作需要,卫生杀虫剂在各地频繁使用,导致蚊虫抗药性产生并且日渐严重[2]。拟除虫菊酯类杀虫剂是蚊虫防治的主要杀虫剂,各地蚊虫均已对其产生较为严重的抗药性[3]。
厦门市地处中国东南沿海,为南亚热带海洋性季风气候,年平均气温20.9 ℃,温和多雨,非常适合伊蚊生长繁殖,白纹伊蚊是厦门市的优势蚊种。厦门市是东南沿海重要的中心城市,闽南金三角中心,经济贸易发达,与东南亚国家人员及经贸交往频繁,为登革热的传入和流行提供了条件。1873年现厦门市报告了福建省首例登革热病例[4]。本世纪以来,福建省每年都有输入性登革热病例报告[5],并发生了多起由输入病例引起的本地暴发疫情,2018年以前,厦门市均有散发输入登革热病例的报告,2011-2016年共报告33例[6],2017和2018年分别报告7和17例。2019年登革热疫情在全国蔓延[7],福建省福州、莆田、泉州和宁德市等多地暴发登革热本地疫情,厦门市与国内疫情形势一样[7],登革热病例剧增,病例数达到138例,并首次在湖里、思明和集美区出现了本地病例,其中湖里区出现本地病例数最多,防控形势日趋严峻。由于登革热至今仍无疫苗上市,对其防控的主要措施就是阻止蚊虫叮咬和降低蚊虫密度。近年来,为了做好国际贸易投洽会、金砖国家等大型会议保障,卫生城镇的创建以及登革热疫情防控等需要,厦门市各区每年均定期开展爱国卫生运动,组织群众做好环境卫生、采取“翻盆倒罐”消除白纹伊蚊幼蚊,使用6.8%氯氰菊酯水乳剂为主的拟除虫菊酯类杀虫剂杀灭成蚊等化学防控措施。我们于2020年7月采集2019年出现登革热本地病例最多的湖里区和未出现登革热本地病例的翔安区的白纹伊蚊,检测其对拟除虫菊酯类杀虫剂的抗药性和击倒抗性(knockdown resistance,kdr)基因突变,分析两地白纹伊蚊对拟除虫菊酯类杀虫剂的抗药性差异,为制定科学性、针对性的防控技术方案提供依据。
1 材料与方法 1.1 试虫来源2020年7月7-13日,分别在厦门市湖里和翔安区采集野外白纹伊蚊幼蚊和蛹,采样点分布在各区东、南、西、北4个方位,采集生境为居民区、医院和公园。湖里区共采集幼蚊约1 900条、蛹320只,翔安区共采集幼蚊约2 600条、蛹130只。具体采样点见图 1。
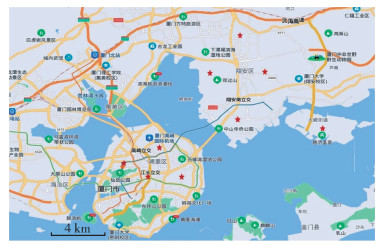
|
| 注:红色星号标记为采样点。 图 1 福建省厦门市湖里和翔安区白纹伊蚊采样点分布图 Figure 1 Distribution of sampling sites of Aedes albopictus in Huli district and Xiang'an district of Xiamen |
| |
0.03%溴氰菊酯、0.4%氯菊酯、0.08%高效氯氰菊酯、0.4%高效氯氰菊酯和0.07%高效氯氟氰菊酯及对照药膜均由中国疾病预防控制中心传染病预防控制所媒介生物控制室提供。DNA提取试剂盒购自无锡百泰克生物技术有限公司,Taq PCR预混液[2×EasyTaqTMPCR SuperMix(+dye)]购自北京全式金生物技术有限公司,引物由北京擎科生物科技有限公司合成。
1.3 成蚊抗药性生物学测定采用世界卫生组织(WHO)推荐的成蚊接触法。测定试虫为F1代羽化后3~5 d未吸血健康雌蚊,每种杀虫剂设置5个重复,每个重复包括约25只试虫。试虫在测试筒内与药膜接触1 h后,记录接触1 h的击倒数,并计算击倒率。之后将试虫转移到恢复筒中,饲以10%糖水,于人工生化培养箱中饲养,饲养条件:温度(25±1)℃,相对湿度(70±5)%,光照周期(L∶D)=14 h∶10 h。24 h后观察并记录各组试虫的死亡情况。若对照组死亡率在5%~20%时,用Abbott公式校正处理死亡率;若对照死亡率 > 20%,实验视为无效。
试虫死亡判断标准:试虫完全不动或仅足、翅、躯体等轻微震颤,无法爬动或飞行,视为死亡。
抗性级别判定标准:试虫死亡率≥98%为敏感种群(S),死亡率在80%~98%(不含)为可疑抗性种群(M),死亡率 < 80%为抗性群体(R)。
1.4 kdr基因扩增和测序按照DNA提取试剂盒说明书提取单只白纹伊蚊成蚊基因组DNA。根据Kasai等[8]设计的引物扩增kdr基因第Ⅱ、Ⅲ结构域部分片段,PCR反应体系和反应条件参照文献[9]。扩增的第Ⅱ结构域部分片段包含S989、I1011、L1014和V1016位点,第Ⅲ结构域部分片段包含I1532和F1534位点,以此检测各位点突变情况。
1.5 数据处理与分析使用Excel 2016软件计算死亡率和校正死亡率。利用DNAStar 7.1Seqman、MEGA X软件对测得的kdr基因部分序列进行比对和分析,确定各位点等位基因型和基因型,计算各样本kdr基因突变频率。采用t检验计算不同种群间击倒率和死亡率的差异,P < 0.05表示差异有统计学意义。
2 结果 2.1 白纹伊蚊成蚊对4种拟除虫菊酯类杀虫剂的抗药性湖里和翔安区白纹伊蚊分别暴露于0.03%溴氰菊酯、0.4%氯菊酯、0.08%高效氯氰菊酯、0.4%高效氯氰菊酯和0.07%高效氯氟氰菊酯杀虫剂后,湖里区的击倒率在63.82%~100%,最高为0.4%高效氯氰菊酯[(96.00±4.00)%],最低为0.08%高效氯氰菊酯[(66.71±2.89)%];翔安区的击倒率在29.56%~100%,最高为0.4%高效氯氰菊酯[(95.13±4.87)%],最低为0.4%氯菊酯[(33.99±4.43)%];对2个区的击倒率进行t检验,0.4%氯菊酯和0.08%高效氯氰菊酯的击倒率差异均有统计学意义(t=11.000,P < 0.001;t=4.870,P=0.001),其中0.4%氯菊酯的击倒率湖里区高于翔安区,0.08%高效氯氰菊酯的击倒率翔安区高于湖里区,其他杀虫剂差异均无统计学意义(t=1.317,P=0.224;t=0.293,P=0.777;t=0.900,P=0.394)。湖里区的校正死亡率在18.71%~97.60%,对溴氰菊酯为可疑抗性群体,对氯菊酯、高效氯氰菊酯和高效氯氟氰菊酯为抗性群体;翔安区的死亡率在18.71%~89.90%,对溴氰菊酯、氯菊酯、高效氯氰菊酯和高效氯氟氰菊酯均为抗性群体。对2个区的试虫死亡率进行t检验,0.03%溴氰菊酯的死亡率差异有统计学意义(t=5.628,P < 0.001),湖里区高于翔安区,对其余杀虫剂的死亡率差异均无统计学意义(t=1.543,P=0.161;t=0.636,P=0.543;t=1.739,P=0.120;t=0.179,P=0.862)。见表 1。
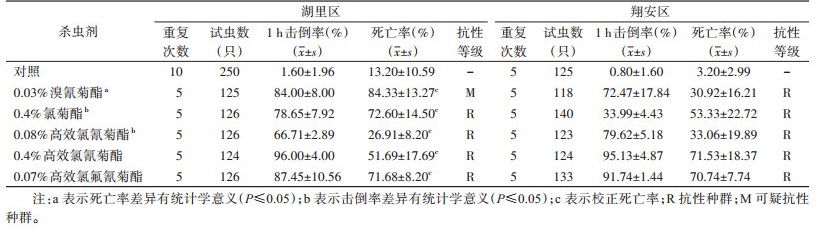
|
厦门市湖里和翔安区共检测了171只白纹伊蚊kdr基因第Ⅱ结构域和第Ⅲ结构域部分序列,序列对比分析结果表明:S989、I1011和L1014未发现有义突变。湖里区白纹伊蚊第Ⅱ结构域V1016和第Ⅲ结构域F1534位点存在突变,未发现第Ⅲ结构域I1532位点突变,翔安区白纹伊蚊第Ⅱ结构域V1016位点和第Ⅲ结构域I1532和F1534位点均存在突变。F1534位点共有4种等位基因,即编码苯丙氨酸的野生型TTC/F(试虫只数181/所占比例52.92%),编码丝氨酸的突变型TCC/S(112/32.75%),编码半胱氨酸的突变型TGC/C(47/13.74%),编码亮氨酸的突变型TTG/L(2/0.58%);7种基因型分别为野生型纯合子F/F(58/33.92%),野生/突变型杂合子F/S(45/26.32%)、F/C(18/10.53%)和F/L(2/1.17%),突变型纯合子S/S(25/14.62%)、C/C(6/3.51%)和突变型杂合子S/C(17/9.94%)。I1532位点共有2种等位基因,即编码异亮氨酸的野生型ATC/I(340/99.42%),编码苏氨酸的突变型ACC/T(2/0.58%);2种基因型分别为野生型纯合子I/I(169/98.83%),野生/突变型杂合子I/T(2/1.75%)。V1016位点共有3种等位基因,即编码缬氨酸的野生型GTA/V(300/87.72%),编码甘氨酸的突变型GGA/G(42/12.28%);3种基因型分别为野生型V/V(133/77.78%),野生/突变型杂合子V/G(35/20.47%),突变型纯合子G/G(3/1.75%)。见表 2、3。
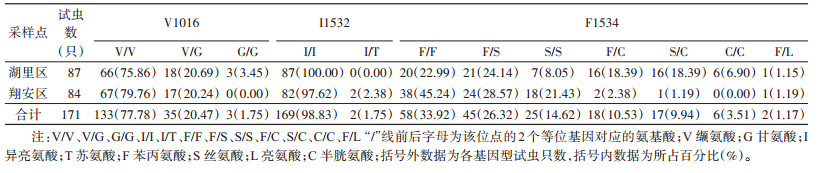
|
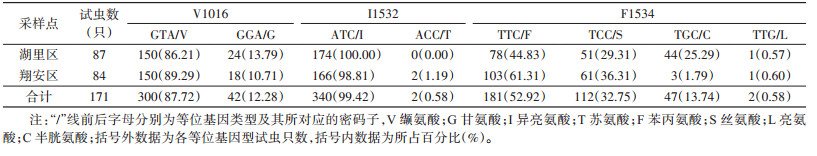
|
湖里和翔安区均以F1534位点突变为主,其次是V1016位点,I1532位点突变率最低。翔安区V1016位点突变等位基因只有1种类型GGA/G,占比10.71%,I1532位点突变等位基因为ACC/T,占比1.19%,仅有2个样本检测到该等位基因型。F1534位点有3种突变等位基因型,主要是TCC/S,占36.31%,TGC/C占1.79%,TTG/L占0.60%。湖里区V1016位点GGA/G突变等位基因频率(13.79%)高于翔安区(10.71%),I1532位点未发现突变型等位基因。F1534位点突变等位基因共有3种类型,且突变频率总体高于翔安区,也是以TCC/S型为主,TGC/C型频率为25.29%,仅发现1个样本含有TTG/L型。见表 3。
3 讨论拟除虫菊酯是从除虫菊酯中提取的一类有机合成杀虫剂,毒性相对低,持续效果时间长,应用范围日趋广泛,但其具有价格高,易产生抗性的缺点,国内外相关研究均有提及[10-11]。溴氰菊酯、氯菊酯、高效氯氰菊酯和高效氯氟氰菊酯是拟除虫菊酯类杀虫剂中的代表,厦门市近年来也较常用,是首选的灭蚊杀虫剂,开展其抗药性水平检测有着非常重要的意义。厦门市在2018年之前从未开展过白纹伊蚊成蚊对杀虫剂抗药性的研究,2018和2019年连续2年开展了相关研究。本次研究发现,2个区白纹伊蚊成蚊对氯菊酯、高效氯氟氰菊酯和高效氯氰菊酯均为抗性群体,湖里区成蚊对溴氰菊酯表现为可疑抗性群体,而翔安区成蚊对溴氰菊酯表现为抗性群体,与厦门市2018和2019年的研究结果类似[2],与刘鹃等[12]、陈斌等[13]对四川省内江市和福州地区白纹伊蚊的抗药性监测结果也相似,但与徐建敏等[14]研究发现广州市部分地区白纹伊蚊成蚊对氯菊酯敏感的结果不同。2个区白纹伊蚊成蚊对拟除虫菊酯类杀虫剂抗药性差异不大与近几年厦门市在爱国卫生运动、农业、园林和卫生虫害控制中均大量使用该类杀虫剂有关,说明厦门市白纹伊蚊成蚊对该类杀虫剂均已产生抗性,提示今后对蚊虫进行消杀时应减少或不使用此类杀虫剂,而应交替使用残杀威和马拉硫磷等敏感杀虫剂来控制蚊虫[2]。今后应积极开展环境改造与治理,建设卫生、健康、舒适的生产、生活环境,定期开展抗药性监测,指导科学杀虫灭蚊。
本研究发现湖里和翔安区的白纹伊蚊kdr基因F1534位点均存在突变,以F1534S为主,其次为F1534C。我国相关研究发现F1534S与白纹伊蚊对菊酯类杀虫剂的抗性表型密切相关[15-17]。Chen等[18]发现F1534S与白纹伊蚊对菊酯类杀虫剂的抗性呈正相关。本研究中,F1534位点还出现了1534S、1534C、S1534C和F1534L型突变,这几种突变型与抗药性的关系国内外相关研究较少,Li等[19]研究发现广东种群中F1534L与白纹伊蚊的抗性具有相关性,其意义有待进一步研究。本研究发现翔安区的白纹伊蚊kdr基因I1532位点存在突变,为I1532T,该位点突变首次在意大利罗马种群中发现[20],I1532位点未检测到突变型纯合子,只发现一定比例的野生/突变型杂合子,且总体突变等位基因频率较低(0.58%),与朱彩英[9]研究结论一致。相关研究发现[21],I1532T与白纹伊蚊对溴氰菊酯的抗性呈负相关。但是也有研究[17]认为,高频率使用各种类型的拟除虫菊酯类杀虫产品,是导致蚊虫种群多个位点同时突变的原因。本研究发现湖里区的白纹伊蚊kdr基因V1016位点存在突变,检测到野生/突变型杂合子和突变纯合子,与Zhou等[22]的研究结果一致;Kasai等[23]对意大利和越南白纹伊蚊进行研究认为,V1016G与F1534C和F1534S突变类型相比较具有更高程度的抗性。因为相关研究发现[24],白纹伊蚊敏感种群kdr基因相关位点均未发生kdr突变,所以从分子层面说明厦门市白纹伊蚊成蚊对拟除虫菊酯类杀虫剂产生了抗性。
抗药性监测方法分为生物测定法、生物化学测定法以及分子生物学测定法。生物测定法是最经典的监测方法,本研究中的成蚊接触法就属于该方法。但生物测定法具有操作比较复杂、耗时长的特点,不利于抗性的早期监测。生物化学测定法是从酶化学水平对蚊虫抗药性进行评价的方法,与传统生物测定法相比,测定更加准确、快速。分子生物学测定法是利用分子生物学方法对杀虫剂作用靶标的基因位点进行检测的方法,更精细也更有说服力,且可用于蚊虫抗药性的早期监测。本研究是厦门市首次对白纹伊蚊进行分子层面的抗药性研究,弥补了厦门市相关研究的空白。本研究生物测定数据和分子生物学测定其检测结果较一致,说明kdr机制是厦门市白纹伊蚊对拟除虫菊酯类杀虫剂产生抗性的机制之一,证实厦门市的白纹伊蚊种群已对拟除虫菊酯类杀虫剂产生了广泛的抗药性。研究结果提示应科学合理地使用杀虫剂,特别是已产生抗性的杀虫剂。加强抗性监测,及时评估蚊虫对杀虫剂的抗性水平,轮换使用对蚊虫敏感的杀虫剂,制定科学合理的蚊虫消杀策略,不仅能有效延缓蚊虫抗性的产生,还能提高控制效果。
利益冲突 无
| [1] |
Ishak IH, Riveron JM, Ibrahim SS, et al. The cytochrome P450 gene CYP6P12 confers pyrethroid resistance in kdr-free Malaysian populations of the dengue vector Aedes albopictus[J]. Sci Rep, 2016, 6: 24707. DOI:10.1038/srep24707 |
| [2] |
伍思翰, 柯雪梅, 陈国伟, 等. 厦门市白纹伊蚊成蚊对常用杀虫剂的抗药性观察[J]. 中华地方病学杂志, 2020, 39(6): 402-405. Wu SH, Ke XM, Chen GW, et al. Observation on resistance of adult Aedes albopictus to commonly used insecticides in Xiamen city[J]. Chin J Endemiol, 2020, 39(6): 402-405. DOI:10.3760/cma.j.cn231583-20191107-00313 |
| [3] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [4] |
陈韵冬. 登革热在全球主要流行区的流行近况[J]. 中华流行病学杂志, 1990, 11(1): 51-54. Chen YD. The prevalence of dengue fever in major endemic regions of the world[J]. Chin J Epidemiol, 1990, 11(1): 51-54. |
| [5] |
陈武, 吴生根, 洪荣涛, 等. 福建省2004-2013年登革热流行特征分析[J]. 中国公共卫生, 2015, 31(1): 1-4. Chen W, Wu SG, Hong RT, et al. Prevalent characteristics dengue fever in Fujian province, 2004-2013[J]. Chin J Public Health, 2015, 31(1): 1-4. DOI:10.11847/zgggws2015-31-01-01 |
| [6] |
黄健康, 柯雪梅, 郭志南, 等. 2011-2016年厦门市蚊媒传染病登革热和疟疾疫情分析[J]. 中华卫生杀虫药械, 2020, 26(4): 376-378. Huang JK, Ke XM, Guo ZN, et al. Epidemiological analysis of mosquito-borne diseases dengue fever and malaria in Xiamen from 2011 to 2016[J]. Chin J Hyg Insect Equip, 2020, 26(4): 376-378. DOI:10.19821/j.1671-2781.2020.04.023 |
| [7] |
杨瑞军, 黄世腾, 吕磊, 等. 浙江省衢州市2019年本地登革热暴发疫情的分子流行病学研究[J]. 中国媒介生物学及控制杂志, 2020, 31(5): 521-525. Yang RJ, Huang ST, Lyu L, et al. Molecular epidemiological study of local dengue outbreak in Quzhou, Zhejiang province, China, 2019[J]. Chin J Vector Biol Control, 2020, 31(5): 521-525. DOI:10.11853/j.issn.1003.8280.2020.05.004 |
| [8] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. DOI:10.7883/yoken.64.217 |
| [9] |
朱彩英. 中国白纹伊蚊击倒抗性基因突变及检测技术研究[D]. 北京: 中国疾病预防控制中心, 2020. DOI: 10.27511/d.cnki.gzyyy.2020.000116. Zhu CY. Study on knockdown resistance gene mutation and detection technology of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2020. DOI: 10.27511/d.cnki.gzyyy.2020.000116. (inChinese) |
| [10] |
寇景轩, 刘宏美, 公茂庆, 等. 山东省白纹伊蚊对常用化学杀虫剂的抗性调查[J]. 寄生虫病与感染性疾病, 2015, 13(3): 115-117. Kou JX, Liu HM, Gong MQ, et al. Preliminary investigation of Aedes albopictus resistant to commonly used insecticides in Shandong province[J]. Paras Infect Dis, 2015, 13(3): 115-117. |
| [11] |
张晓, 王东, 王永明, 等. 济南市白纹伊蚊和淡色库蚊对9种杀虫剂的抗性测定[J]. 中华卫生杀虫药械, 2016, 22(2): 121-123. Zhang X, Wang D, Wang YM, et al. Resistance monitoring of Culex pipiens pallens and Aedes albopictus to nine insecticides in Ji'nan city[J]. Chin J Hyg Insect Equip, 2016, 22(2): 121-123. DOI:10.19821/j.1671-2781.2016.02.005 |
| [12] |
刘鹃, 徐勇, 于雪岚, 等. 内江市白纹伊蚊的抗药性调查[J]. 中华卫生杀虫药械, 2017, 23(1): 43-45. Liu J, Xu Y, Yu XL, et al. Resistance of Aedes albopictus to insecticides in Neijiang[J]. Chin J Hyg Insect Equip, 2017, 23(1): 43-45. DOI:10.19821/j.1671-2781.2017.01.012 |
| [13] |
陈斌, 李玉伟, 林立旺, 等. 福州市白纹伊蚊2016年常用杀虫剂抗药性调查[J]. 海峡预防医学杂志, 2018, 24(5): 66-68. Chen B, Li YW, Lin LW, et al. Insecticide resistance of Aedes albopictus in Fuzhou, in 2016[J]. Strait J Prev Med, 2018, 24(5): 66-68. |
| [14] |
徐建敏, 梁雪莹, 严子锵, 等. 白纹伊蚊对3种拟除虫菊酯类杀虫剂的抗药性调查[J]. 中华卫生杀虫药械, 2014, 20(5): 439-440, 443. Xu JM, Liang XY, Yan ZQ, et al. Resistance of Aedes albopictus to three pyrethroids insecticides[J]. Chin J Hyg Insect Equip, 2014, 20(5): 439-440, 443. DOI:10.19821/j.1671-2781.2014.05.014 |
| [15] |
赵春春, 朱彩英, 开文龙, 等. 海口市2018年白纹伊蚊击倒抗性基因型分布研究[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 7-11. Zhao CC, Zhu CY, Kai WL, et al. Genotypes of knockdown resistance gene and their distribution in Aedes albopictus in Haikou, China, in 2018[J]. Chin J Vector Biol Control, 2019, 30(1): 7-11. DOI:10.11853/j.issn.1003.8280.2019.01.002 |
| [16] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. Wang XH, Chen HY, Yang XY, et al. Resistance to pyrethroid insecticides and analysis of knockdown resistance (kdr) gene mutations in Aedes albopictus from Haikou city[J]. Acad J Sec Mil Med Univ, 2015, 36(8): 832-838. DOI:10.3724/SP.J.1008.2015.00832 |
| [17] |
陈翰明, 高景鹏, 姜进勇, 等. 我国白纹伊蚊现场群体击倒抗性基因I1532和F1534突变检测及I1532T突变等位基因报告[J]. 中国媒介生物学及控制杂志, 2018, 29(2): 120-125. Chen HM, Gao JP, Jiang JY, et al. Detection of the I1532 and F1534 kdr mutations and a novel mutant allele I1532T in VGSC gene in the field populations of Aedes albopictus from China[J]. Chin J Vector Biol Control, 2018, 29(2): 120-125. DOI:10.11853/j.issn.1003.8280.2018.02.002 |
| [18] |
Chen HY, Li KL, Wang XH, et al. First identification of kdr allele F1534S in VGSC gene and its association with resistance to pyrethroid insecticides in Aedes albopictus populations from Haikou city, Hainan Island, China[J]. Infect Dis Poverty, 2016, 5: 31. DOI:10.1186/s40249-016-0125-x |
| [19] |
Li YJ, Xu JB, Zhong DB, et al. Evidence for multiple-insecticide resistance in urban Aedes albopictus populations in Southern China[J]. Parasit Vectors, 2018, 11(1): 4. DOI:10.1186/s13071-017-2581-y |
| [20] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel (VGSC) gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
| [21] |
高景鹏. 我国白纹伊蚊对拟除虫菊酯类杀虫剂的敏感性检测与抗性机制研究[D]. 上海: 中国人民解放军海军军医大学, 2018. Gao JP. Susceptibility detection and resistance mechanism of Aedes albopictus(Diptera: Culicidae) to pyrethroid insecticides in China[D]. Shanghai: Naval Medical University, 2018. (in Chinese) |
| [22] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing China: First report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
| [23] |
Kasai S, Caputo B, Tsunoda T, et al. First detection of a Vssc allele V1016G conferring a high level of insecticide resistance in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016: A new emerging threat to controlling arboviral diseases[J]. Euro Surveill, 2019, 24(5): 1700847. DOI:10.2807/1560-7917.ES.2019.24.5.1700847 |
| [24] |
兰学梅, 徐家宝, 姜进勇. 云南省瑞丽市白纹伊蚊对拟除虫菊酯类杀虫剂抗性种群的电压门控钠离子通道基因突变分析[J]. 中国媒介生物学及控制杂志, 2019, 30(2): 158-162. Lan XM, Xu JB, Jiang JY. An analysis of voltage-gated sodium channel gene mutation in Aedes albopictus resistant populations against pyrethroid insecticides in Ruili, Yunnan province, China[J]. Chin J Vector Biol Control, 2019, 30(2): 158-162. DOI:10.11853/j.issn.1003.8280.2019.02.010 |
 2022, Vol. 33
2022, Vol. 33


