扩展功能
文章信息
- 李文玉, 周欣欣, 伦辛畅, 马德龙, 林凌鸿, 宋秀平, 鲁亮, 刘起勇, 王君, 王春兰, 孟凤霞
- LI Wen-yu, ZHOU Xin-xin, LUN Xin-chang, MA De-long, LIN Ling-hong, SONG Xiu-ping, LU Liang, LIU Qi-yong, WANG Jun, WANG Chun-lan, MENG Feng-xia
- 淡色库蚊成蚊对拟除虫菊酯类杀虫剂敏感性的影响因素研究
- A study of factors affecting the sensitivity of adult Culex pipiens pallens to pyrethroid insecticides
- 中国媒介生物学及控制杂志, 2022, 33(2): 171-176
- Chin J Vector Biol & Control, 2022, 33(2): 171-176
- 10.11853/j.issn.1003.8280.2022.02.002
-
文章历史
- 收稿日期: 2021-11-22
2 福州市疾病预防控制中心, 福建 福州 350004
2 Fuzhou Center for Disease Control and Prevention, Fuzhou, Fujian 350004, China
淡色库蚊(Culex pipiens pallens)是我国北方入室吸血的主要蚊种,班氏丝虫病的传播媒介,西尼罗热的潜在媒介,流行性乙型脑炎的可能传播媒介[1]。淡色库蚊不仅传播疾病,且通过刺叮吸血来骚扰人类的日常工作和生活。淡色库蚊的幼虫主要孳生于污水沟、水塘等脏乱且不易清理积水的地方,并且这些地方控制蚊虫主要以杀虫剂为主。但长期、大量、大面积地使用杀虫剂,使得淡色库蚊的抗药性发展迅速。从20世纪60年代开始监测淡色库蚊的抗药性,至今为止多地均已检测出淡色库蚊野外种群存在抗性[2],在鲁西南、苏中、东北等地区的淡色库蚊均产生不同程度抗性[3-6]。拟除虫菊酯类杀虫剂是病媒生物防治中使用最广泛的杀虫剂,其中使用较多的为氯菊酯、溴氰菊酯等[7]。
为了更科学、高效地防治病媒生物,需要了解其对杀虫剂的抗药性,从而制定更科学有效的杀虫剂使用方案。在抗药性监测中,一般以测定成蚊在诊断剂量下的死亡率表示抗性程度。但是在生物测定敏感性实验中,蚊虫的性别、日龄不同均会对杀虫剂敏感性产生差异,同时由于诊断剂量法仅能获得1个杀虫剂浓度下成蚊的死亡率,无法了解其他浓度时性别对成蚊杀虫剂敏感性的影响。本文通过测定成蚊的半数致死浓度(LC50)制定毒力回归线,研究淡色库蚊成蚊对拟除虫菊酯类杀虫剂敏感性的影响因素,为淡色库蚊成蚊抗性监测及防控提供依据。
1 材料与方法 1.1 试虫 1.1.1 试虫来源(1)北京品系(BJ):淡色库蚊实验室品系,由20世纪70年代引入实验室的北京种群,进入实验室后未接触杀虫剂饲养至今。(2)北京敏感品系(BJS):淡色库蚊实验室选育的敏感品系,由70年代引入实验室的北京种群经敏感性反选育获得。2009-2011年,用溴氰菊酯(F1~F11)、氯菊酯(F12~F16)和高效氯氰菊酯(F17~F22)反选育,获得BJS。(3)天津品系(TJ):淡色库蚊实验室品系,引自天津种群。
试虫均在温度(25±1)℃、相对湿度(75±5)%、光照周期(L∶D)=14 h∶10 h环境中饲养。其中幼蚊供以猪肝粉和酵母粉,成蚊以10%糖水饲养,用小白鼠供血后产卵。
1.1.2 试虫判定标准活虫判定标准:可以正常站立和飞行。
试虫击倒判定标准:停落时不能站立或背面着地时,翅膀和腿有活动能力但不能飞行。
试虫死亡判定标准:没有生命迹象、不能飞行、停落时不能站立和移动。
1.2 杀虫剂及主要试剂96.22%氯菊酯,由江苏优嘉植物保护有限公司生产;98.6%溴氰菊酯,由印度TAGROS公司生产。乙醚(分析纯)为天津化学试剂二厂生产,丙酮(分析纯)为北京化工厂生产,液体石蜡(化学纯)为国药集团化学试剂有限公司生产,白糖。DNA提取试剂盒为无锡百泰克生物技术有限公司生产,Taq PCR预混液[2×EasyTaqTMPCR SuperMix(+dye)]为北京全式金生物技术有限公司生产,引物由北京擎科生物科技有限公司合成。
1.3 主要器材及用品药膜纸、接触筒、电动吸蚊器、移液器、奥克斯E11140型ExplorerTM分析天平(感量为0.1 mg)、SANYO MLR-350型植物光照培养箱、加湿器、电暖器、纱布、棉球等。
1.4 方法 1.4.1 淡色库蚊成蚊对杀虫剂敏感性测定采用接触法[8],根据世界卫生组织标准方法制做药膜[9],每个处理及对照均做3组重复。每次吸取20~25只成蚊,雌蚊与雄蚊分开实验。水平放置接触筒接触1 h,1 h后记录击倒试虫数,并将接触筒中蚊虫转移至恢复筒中,放入培养箱饲养,24 h后计算死亡试虫数。分别计算击倒率和死亡率。
1.4.2 不同日龄淡色库蚊成蚊24 h自然死亡率的研究方法使用BJS品系的2、3~5、6日龄雌、雄成蚊,按1.4.1的方法分别进行测定,以了解不同日龄淡色库蚊成蚊24 h自然死亡率。
1.4.3 不同性别淡色库蚊成蚊对杀虫剂敏感性的研究方法使用TJ品系的3~5日龄雌雄成蚊,按1.4.1的方法分别测定成蚊对氯菊酯的敏感性,以分析性别对成蚊敏感性的影响。
1.4.4 淡色库蚊成蚊基因组DNA提取及电压门控钠离子通道(voltage-gated sodium channel,VGSC)基因的扩增和测序取单只淡色库蚊成蚊,提取基因组DNA。用正向引物CD1:5'-GAC CTG CCA CGG TGG AAC T-3',和反向引物CD2:5'-TTG GAC AAA AGC AAG GCT AAG-3'[10],扩增VGSC基因结构域S6节段。PCR反应体系为25 μl,包含基因组DNA2 μl,2×Taq PCR预混液12.5 μl,正、反向引物(10 μmol/L)各1 μl,ddH2O8.5 μl。PCR反应条件为94 ℃预变性2 min;35个循环94 ℃变性30 s,60 ℃复性30 s,72 ℃延伸30 s;最后72 ℃延伸8 min,4 ℃保存。将PCR扩增产物测序。
1.5 统计学分析用SPSS 25软件中的Probit回归,获得LC50及其95%置信区间(95%CI)、毒力回归线的斜率b值、χ2值、自由度等。并用SPSS 25软件进行χ2检验,判断不同处理间死亡率的差异,P < 0.05为差异有统计学意义。应用Seqman、MEGA Ⅹ软件对测得的VGSC基因部分序列进行峰图比对和分析,计算击倒抗性基因(kdr)突变频率(kdr频率)。对照组死亡率 < 5%时无需校正,在5%~20%时则需进行校正,> 20%则实验失败。

|
日龄对淡色库蚊雄成蚊24 h自然死亡率的影响大于雌成蚊(表 1)。在实验室控制条件下,雄蚊2、3~5、6日龄的24 h自然死亡率分别为2.08%、1.39%和89.25%;雌蚊2、3~5、6日龄的24 h自然死亡率均为0。雄成蚊24 h自然死亡率均随着日龄的增加而增加,雄蚊日龄超过5日后,日龄越高,雄蚊越脆弱,差异有统计学意义(χ2=148.415,P < 0.001)。当日龄 > 5日时,其对雄成蚊比雌成蚊24 h自然死亡率的影响更为明显,差异有统计学意义(χ2=110.463,P < 0.001)。而日龄≤5日时,雌成蚊与雄成蚊的差异无统计学意义(χ2=2.100,P=0.147)。

|
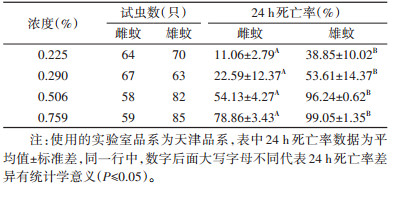
不同性别成蚊在相同药物、相同浓度和实验条件下,对杀虫剂雄蚊比雌蚊敏感(表 2)。0.225%氯菊酯时的雌、雄蚊24 h死亡率分别为11.06%和38.85%,差异有统计学意义(χ2=13.483,P < 0.001);0.506%氯菊酯时的雌、雄蚊死亡率分别为54.13%和96.24%,雄成蚊24 h死亡率大于雌成蚊,差异有统计学意义(χ2=37.122,P < 0.001)。
|
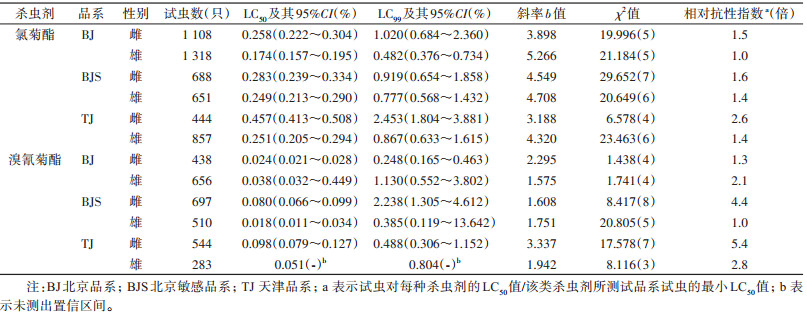
3个实验室品系中,对氯菊酯的敏感性雌成蚊为BJ≈BJS > TJ、雄成蚊为BJ > BJS≈TJ(≈表示2个品系对杀虫剂的敏感性差异无统计学意义)。雌成蚊对氯菊酯的LC50均大于雄成蚊(表 3)。由毒力回归线的斜率b值来看,BJ雄蚊的b值最大。各品系的相对抗性倍数均 < 3.0。
|
BJ、BJS的雌成蚊对氯菊酯的敏感性LC50及其95%CI分别为0.258%(0.222%~0.304%)和0.283%(0.239%~0.334%),置信区间有交集,差异无统计学意义;BJS、TJ的雌成蚊对氯菊酯的敏感性LC50及其95%CI分别为0.283%(0.239%~0.334%)和0.457%(0.413%~0.508%),置信区间无交集,差异有统计学意义。
2.4 淡色库蚊成蚊对溴氰菊酯的敏感性3个实验室品系中,对溴氰菊酯的敏感性雌成蚊为BJ > BJS≈TJ、雄成蚊BJ≈BJS。并且除了BJ的雌成蚊对溴氰菊酯的LC50小于雄成蚊,其余为雌成蚊对溴氰菊酯的LC50均大于雄成蚊(表 3)。由毒力回归线的斜率b值来看,TJ雌蚊的b值最大。BJS和TJ的雌蚊相对抗性倍数均 > 3.0倍,分别为4.4和5.4倍。
BJS、TJ的雌成蚊对溴氰菊酯的敏感性LC50及其95%CI分别为0.080%(0.066%~0.099%)和0.098%(0.079%~0.127%),置信区间有交集,差异无统计学意义。
2.5 氯菊酯、溴氰菊酯对淡色库蚊成蚊毒力的影响溴氰菊酯对淡色库蚊成蚊的毒力强于氯菊酯,但不同品系的相对毒力倍数不同(表 3)。溴氰菊酯对BJ、BJS、TJ雌蚊的毒力是氯菊酯毒力的10.8、3.5和4.7倍,3个品系均显示溴氰菊酯的毒力强于氯菊酯。
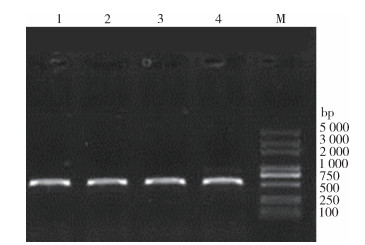
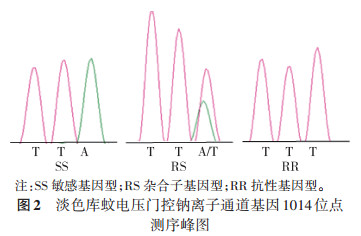
2.6 淡色库蚊北京敏感品系VGSC等位基因频率BJ kdr频率高于BJS和TJ。PCR扩增得到大小为513~525 bp片段(图 1)。其中BJ的1014位点存在苯丙氨酸突变成亮氨酸,即由TTA置换为TTT,L1014F型突变(图 2)。BJ成蚊kdr频率为15.96%(表 4),BJS和TJ未检测到突变。
|
| 注:M表示marker;1~2北京品系;3北京敏感品系;4天津品系。 图 1 淡色库蚊第Ⅱ结构域S6节段扩增电泳结果 Figure 1 Electrophoretogram of amplification of S6 segment of domain Ⅱ in Culex pipiens pallens |
| |
|
| 注:SS敏感基因型;RS杂合子基因型;RR抗性基因型。 图 2 淡色库蚊电压门控钠离子通道基因1014位点测序峰图 Figure 2 Sequencing chromatogram of the 1014 locus of the voltage-gated sodium channel gene in Culex pipiens pallens |
| |

|
BJ成蚊与BJS成蚊相对比,对氯菊酯敏感性没有差异。尽管其kdr基因突变频率存在差异,但是这2个品系的成蚊对氯菊酯的敏感性并无差异。其可能原因是:(1)钠离子通道基因不是显性遗传(多为不完全显性,少数为完全隐形)[11-13],kdr为第3染色体上的隐形遗传因子[14],所以影响生物测定结果主要是抗性纯合子RR。表 4可以看出抗性纯合子的频率很低,因此,2.13%的kdr纯合子突变对BJ的抗性表型贡献很小,尚不能通过生物测定检测出其抗性的表现型。(2)幼蚊抗性与成蚊抗性可能存在差异。BJS在长期的饲养过程中,幼蚊经过了不同世代的溴氰菊酯(F1~F11)、氯菊酯(F12~F16)和高效氯氰菊酯(F17~F22)敏感反选育,2014年检测到BJS幼蚊对3种杀虫剂的敏感性均有所升高,较BJ分别增加了13.88、2.03和4.51倍[15]。而本文测定的为成蚊敏感性,淡色库蚊的幼蚊阶段和成蚊阶段对拟除虫菊酯的抗性机制可能不同。
3.2 实验室饲养室长期封闭饲养的淡色库蚊kdr频率变化通过不同时期对BJ与BJS的VGSC基因检测可见,在淡色库蚊实验室封闭饲养的品系中,淡色库蚊kdr频率是稳定的。本研究所测BJS的kdr频率和2014年张晓越[15]所测BJS的kdr频率一致。2009年Liu等[16]所测BJ的kdr频率为17.20%,与本研究中kdr频率(15.96%)接近。2个研究BJ的kdr频率虽相差不大,但是本研究所测RR(%)为2.13%,而Liu等[16]所测为0,同时本研究RS(%)相对降低,SS(%)相对增大。这可能是因为Liu等所测样本量为47只,而本研究所测样本为94只,可能抗性基因频率较低,47只样本不足以检测到突变纯合子。
3.3 其他影响成蚊杀虫剂敏感性的可能因素除成蚊性别、日龄不同会引起杀虫剂敏感性产生差异外,饲养及实验操作也可能会对实验结果有一定影响:(1)饲料配方会导致代谢酶系发生一定程度的变化。(2)试虫饲养密度高,个体偏小,对杀虫剂的敏感性就会提高。(3)实验操作过程,转移试虫不当,会对蚊虫造成一定程度的机械损伤,也会影响蚊虫的敏感性。(4)饲养温度影响淡色库蚊成蚊的发育周期、体质量、脂肪含量等,进一步影响试虫对杀虫剂的敏感性。
利益冲突 无
| [1] |
杨培培. 蚊媒拟除虫菊酯类杀虫剂抗性检测及乙脑病毒携带情况研究[D]. 济南: 济南大学, 2016. Yang PP. Study on the detection of pyrethroid insecticide resistance of the vector mosquito and JE virus infection of mosquito[D]. Ji'nan: University of Jinan, 2016. (in Chinese) |
| [2] |
孟凤霞, 靳建超, 陈云, 等. 我国淡色库蚊/致倦库蚊对常用化学杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2011, 22(6): 517-520, 528. Meng FX, Jin JC, Chen Y, et al. Resistance of Culex pipiens pallens/Cx. pipiens quinquefasciatus to commonly used insecticides in China[J]. Chin J Vector Biol Control, 2011, 22(6): 517-520, 528. |
| [3] |
宋晓, 程鹏, 王海防, 等. 鲁西南地区淡色库蚊抗药性评价[J]. 中国血吸虫病防治杂志, 2020, 32(1): 69-72. Song X, Cheng P, Wang HF, et al. Study on insecticide resistance of Culex pipiens pallens in southwest region of Shandong province[J]. Chin J Schisto Control, 2020, 32(1): 69-72. DOI:10.16250/j.32.1374.2018261 |
| [4] |
李菊林, 唐建霞, 吴竞瑶. 等. 2018-2019年江苏省库蚊监测结果分析[J]. 中国血吸虫病防治杂志, 2021, 33(5): 510-512, 522. Li JL, Tang JX, Wu JY, et al. Surveillance of Culex mosquitoes in Jiangsu province from 2018 to 2019[J]. Chin J Schisto Control, 2021, 33(5): 510-512, 522. DOI:10.16250/j.32.1374.2020308 |
| [5] |
高丹, 吴旭, 周博. 沈阳市淡色库蚊幼虫对5种常用杀虫剂的抗性调查[J]. 中华卫生杀虫药械, 2021, 27(4): 384-385. Gao D, Wu X, Zhou B. Investigation on the resistance of Culex pipiens pallens larvae to five commonly used insecticides in Shenyang[J]. Chin J Hyg Insect Equip, 2021, 27(4): 384-385. DOI:10.19821/j.1671-2781.2021.04.025 |
| [6] |
刘维, 赵岩, 郭建华, 等. 2020年吉林省淡色库蚊幼虫对常用杀虫剂的抗性调查[J]. 中华卫生杀虫药械, 2021, 27(6): 496-498. Liu W, Zhao Y, Guo JH, et al. Survey on the resistance of Culex pipiens pallens larvae to commonly used insecticides in Jilin province in 2020[J]. Chin J Hyg Insect Equip, 2021, 27(6): 496-498. DOI:10.19821/j.1671-2781.2021.06.004 |
| [7] |
姜志宽, 张桂林. 拟除虫菊酯在卫生害虫防治中的应用[J]. 中华卫生杀虫药械, 2007, 13(5): 307-311. Jiang ZK, Zhang GL. Application of pyrethrin for controlling insects[J]. Chin J Hyg Insect Equip, 2007, 13(5): 307-311. DOI:10.3969/j.issn.1671-2781.2007.05.001 |
| [8] |
World Health Organization (WHO). Test procedures for insecticide resistance monitoring in malaria vector mosquitoes[M]. 2nd ed. Geneva: WHO, 2018: 17-20.
|
| [9] |
刘维德. 蚊类抗药性及其测定[M]. 北京: 科学出版社, 1979: 53-63. Liu WD. Insecticide resistance of mosquitoes and its determination[M]. Beijing: Science Press, 1979: 53-63. |
| [10] |
宋锋林. 淡色库蚊对拟除虫菊酯击倒抗性(kdr)的分子生态学特征的研究[D]. 北京: 中国人民解放军军事医学科学院, 2004. Song FL. The study on molecular ecology characteristics of knockdown resistance (kdr) to pyrethroid of Culex pipiens pallens[D]. Beijing: Academy of Military Medical Sciences, 2004. (in Chinese) |
| [11] |
朱昌亮, 李玉兰, 孙立新, 等. 淡色库蚊对溴氰菊酯抗性的遗传分析[J]. 中国寄生虫学与寄生虫病杂志, 1998, 16(1): 21-24. Zhu CL, Li YL, Sun LX, et al. Genetic analysis of deltamethrin resistance in Culex pipiens pallens[J]. Chin J Parasitol Parasit Dis, 1998, 16(1): 21-24. |
| [12] |
李菊林, 高琪, 周华云, 等. 嗜人按蚊对溴氰菊酯抗性的遗传分析[J]. 中国血吸虫病防治杂志, 2003, 15(5): 367-369. Li JL, Gao Q, Zhou HY, et al. Genetic analysis of deltamethrin resistance in Anopheles anthropophagus[J]. Chin J Schisto Control, 2003, 15(5): 367-369. DOI:10.3969/j.issn.1005-6661.2003.05.014 |
| [13] |
张小磊, 袁志明, 胡晓敏. 致倦库蚊对杀虫剂的抗性现状及治理[J]. 中国媒介生物学及控制杂志, 2019, 30(6): 719-724. Zhang XL, Yuan ZM, Hu XM. Current status of insecticide resistance in Culex pipiens quinquefasciatus and management of resistance[J]. Chin J Vector Biol Control, 2019, 30(6): 719-724. DOI:10.11853/j.issn.1003.8280.2019.06.031 |
| [14] |
Farnham AW. Genetics of resistance of houseflies (Musca domestica L.) to pyrethroids. Ⅰ. Knock-down resistance[J]. Pestic Sci, 1977, 8(6): 631-636. DOI:10.1002/ps.2780080607 |
| [15] |
张晓越. 我国淡色库蚊/致倦库蚊对常用杀虫剂抗性时空分布的研究[D]. 北京: 中国疾病预防控制中心, 2014. Zhang XY. Study on space-time distribution of Culex pipens pallens/quinquefasciatus resistance to common-used insecticides in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2014. (in Chinese) |
| [16] |
Liu H, Lu YJ, Liu QY, et al. Comparison of pyrethroid resistance in adults and larvae of Culex pipiens pallens (Diptera: Culicidae) from four field populations in China[J]. J Econ Entomol, 2013, 106(1): 360-365. DOI:10.1603/EC11439 |
 2022, Vol. 33
2022, Vol. 33


