扩展功能
文章信息
- 吴海, 钟赛凤, 赵秋宇, 权云帆
- WU Hai, ZHONG Sai-feng, ZHAO Qiu-yu, QUAN Yun-fan
- 人体蠕形螨标本制作方法探讨
- A specimen preparation method for human Demodex
- 中国媒介生物学及控制杂志, 2022, 33(1): 143-147
- Chin J Vector Biol & Control, 2022, 33(1): 143-147
- 10.11853/j.issn.1003.8280.2022.01.026
-
文章历史
- 收稿日期: 2021-06-04
2 海南医学院基础医学与生命科学学院, 海南 海口 571199
2 School of Basic Medicine and Life Science, Hainan Medical University, Haikou, Hainan 571199, China
蠕形螨(demodicid mite)是一类寄生于多种哺乳动物的毛囊、皮脂腺的永久性寄生螨类。迄今为止,已知蠕形螨134种,均寄生在各种哺乳动物皮肤内,如猫、犬、牛、马、兔、人等。为了区分各种蠕形螨,常以其宿主动物名称为其冠名,如猫蠕形螨、犬蠕形螨等。寄生于人体的蠕形螨有2种,分别为毛囊蠕形螨(Demodex folliculorum)和皮脂蠕形螨(D. brevis)。蠕形螨可引起皮炎、痤疮、眼睑缘炎等[1-2]。人体蠕形螨世界性广布,国外报告人群感染率为27%~100%,国内人群感染率一般在20%以上,最高可达97.86%。人感染毛囊蠕形螨多见,皮脂蠕形螨次之,部分患者存在双重感染。感染者上至90多岁老年人,下至几月龄的婴儿[3-5]。观察识别蠕形螨是诊断蠕形螨病的依据,玻片标本制作是观察的基础,人体寄生虫教学需要为学生提供大量蠕形螨玻片标本,但目前市面上未有此类标本出售。本研究探索、比较几种不同的人体蠕形螨玻片标本制作方法,以期寻找一种安全、快速且对蠕形螨形态影响较小的长久保存标本的制作方法,满足人体寄生虫学实验教学需求,也为蠕形螨相关研究的标本制作提供借鉴。
1 材料与方法 1.1 标本来源蠕形螨标本于2020年采集自海南医学院2018级和2019级学生面部,透明胶纸粘贴法收集到人体蠕形螨有效标本(虫体完整无变形、破损)95份,其中成虫标本92份,幼虫标本3份;挤刮涂片法收集到人体蠕形螨有效标本(虫体完整无变形、破损)3份,均为成虫。标本收集后5 d内制作完成。
1.2 主要试剂中性树胶购自中国上海标本模型厂,主要成分为天然树脂和二甲苯;无味型封片剂购自无锡市江原实业技贸总公司,该试剂仅标称为不含二甲苯的绿色环保型封片剂,未公开其主要成分;甘油明胶购自上海碧云天生物技术有限公司,主要成分为明胶和甘油。甘油购自天津市大茂化学试剂厂。洗洁精(普通家用型)购自上海和黄白猫有限公司。透明胶纸购自得力集团有限公司。
1.3 取螨方法采用透明胶纸粘贴法和挤刮涂片法获取蠕形螨。透明胶纸粘贴法:临睡前用热水洗脸或者洗热水澡,将市售普通透明胶剪成与玻片等长或略长的条带粘贴于额头、鼻、鼻翼、两颊及下巴等部位,至次晨取下,粘贴于载玻片上镜检。挤刮涂片法:采用痤疮针刮取或者用拇指挤压鼻翼两侧使皮脂溢出,将刮取物或挤出物置于载玻片上,滴加1滴甘油,加盖玻片镜检[1, 6]。
1.4 直接封片法制作标本透明胶纸粘贴法检出的阳性标本:用记号笔在显微镜下标出蠕形螨在透明胶上的位置,若镜下视野较干净且油脂少不影响结构观察,则可直接用剪刀或裁纸刀裁去多余的胶带,擦去标记(注意透明胶带上的标记一定要擦拭干净,否则封片剂会溶解标记影响观察),滴加数滴中性树胶或者无味型封片剂或者甘油明胶于透明胶带上,并使不产生气泡,然后轻轻地从一端加盖一张洁净的盖玻片,待其自然干燥。
挤刮涂片法检出的阳性标本:由于该方法收集到的标本数量较少,未能采用多种方法试验和比较,仅使用甘油明胶直接封片[7-8]。
1.5 清洗法制作标本对于透明胶未粘贴好导致气泡多或者油脂、汗毛多影响观察的标本,先用记号笔在显微镜下标出蠕形螨在透明胶上的位置;取下标本,在载玻片背面同等位置处做好标记;擦去透明胶上的标记,裁剪出该段胶带;将该段透明胶带置于2%洗洁精溶液中[9-11],轻轻缓慢摇晃,荡洗1 min后,取出置于75%乙醇溶液30 s;然后依次放入95%乙醇溶液30 s,无水乙醇30 s,直至透明胶带上的白雾变的透明为止;取出胶带置于干净载玻片上,以中性树胶或者无味型封片剂或者甘油明胶进行封片。
对于一张透明胶上蠕形螨数量较多(5只及以上)的标本,将取下的透明胶和载玻片置于2%洗洁精溶液中浸泡约30 min;取出透明胶带和载玻片,用干净的2%洗洁精溶液冲洗载玻片和透明胶带2~3次;合并清洗液,静置20 min自然沉淀或者离心半径17.3 cm、1 000 r/min离心1~2 min;弃去上清液,向沉淀物中加入75%乙醇溶液固定,静置10~15 min;弃上清液,沉淀物依次用75%~100%乙醇中梯度脱水;采用上述方法静置自然沉淀或离心1~2 min;弃上清液,取沉淀物用甘油明胶封片。
1.6 标本观察标本干燥后,将制作好的标本置于数码显微镜KoPa WiFi EDU软件系统下观察和拍摄。主要观察指标包括镜下背景是否影响观察,能否区分虫种,虫体主要结构鄂体、足体和末体3部分是否清晰。
2 结果 2.1 直接封片法对于透明胶纸粘贴法获得的58张镜下视野较干净的标本,分别采用中性树胶、无味型封片剂和甘油明胶直接封片。每种封片剂先各制作3张标本。结果显示镜下观察3种封片剂制作的标本无太大差异,背景清晰;螨体形态清晰,能清楚的看到鄂体、足体和末体3部分;鄂体呈梯形,足体腹面有4对粗短的足,末体体表有环形皮纹。部分标本鄂体还可见螯肢、须肢以及足跗节上的爪。见图 1。

|
| 注:A中性树胶直接封片;B无味型封片剂直接封片;C甘油明胶直接封片。 图 1 毛囊蠕形螨成虫直接封片法制作标本图片(×400) Figure 1 Direct mounting of adult Demodex folliculorum (×400) |
| |
其余49张标本均采用无味型封片剂直接封片制作,干燥后镜下观察虫体结构清晰。
直接封片法共制作得到毛囊蠕形螨成虫标本45张、皮脂蠕形螨成虫标本11张、皮脂蠕形螨幼虫标本2张。
2.2 清洗法对于透明胶纸粘贴法收集的37张背景较脏、影响观察的标本采用不同清洗法处理后,分别采用中性树胶或无味型封片剂或甘油明胶对标本封片。每种清洗方法每种封片剂先各制作3张标本。
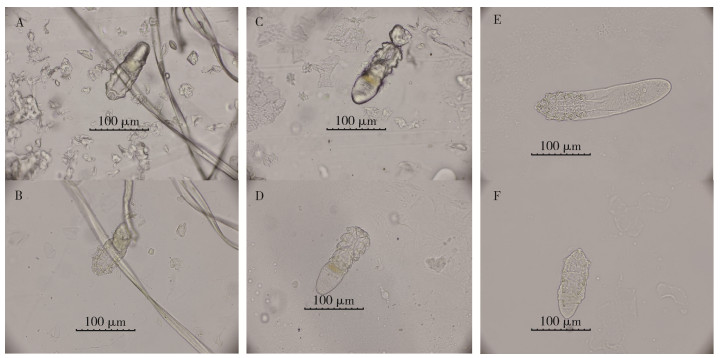
结果显示2%洗洁精短时间(1 min)清洗法可去除大部分的油脂和污渍,如图 2A-B、C-D所示,但对于粘附较多的汗毛去除效果有限(图 2A、B);2%洗洁精长时间浸泡(30 min)清洗法可将粘贴在透明胶上的大部分蠕形螨脱离,获得游离的蠕形螨标本,如图 2E、F所示。
|
| 注:A皮脂蠕形螨幼虫清洗前;B皮脂蠕形螨幼虫无味型封片剂封片(短时清洗法);C皮脂蠕形螨成虫清洗前;D皮脂蠕形螨成虫甘油明胶封片(短时清洗法);E毛囊蠕形螨成虫甘油明胶封片(长时清洗法);F皮脂蠕形螨成虫甘油明胶封片(长时清洗法)。 图 2 蠕形螨不同清洗法制作标本图片(×400) Figure 2 Different washing methods for preparing Demodex specimen (×400) |
| |
2%洗洁精短时间(1 min)清洗法制作得到标本17张,其中,毛囊蠕形螨成虫标本10张,皮脂蠕形螨成虫标本6张、皮脂蠕形螨幼虫标本1张。2%洗洁精长时间浸泡(30 min)清洗法制作得到标本13张,其中,毛囊蠕形螨成虫标本9张,皮脂蠕形螨成虫标本4张。由于操作失误,损失标本7张。
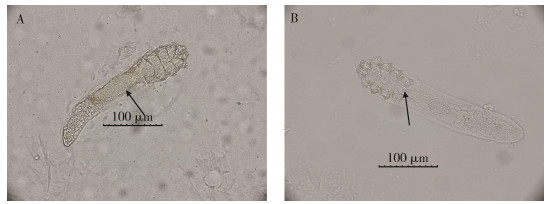
此外,本研究还应用无味型封片剂制作得到腹内含有一典型蘑菇状卵(如图 3A箭头所示)的毛囊蠕形螨雌虫标本。部分毛囊蠕形螨雌虫标本雌性生殖孔清晰可见,雌虫生殖孔位于腹面第4对足之间,如图 3B箭头所示。
|
| 注:A箭头所示蘑菇状卵(直接封片法,无味型封片剂封片);B箭头所示雌虫生殖孔(短时清洗法,无味型封片剂封片) 图 3 毛囊蠕形螨雌虫(×400) Figure 3 Female Demodex folliculorum (×400) |
| |
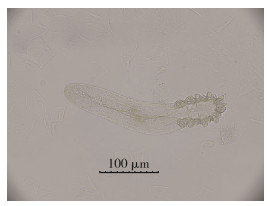
制成标本在同等条件(室温)下干燥,无味型封片剂用时最短,24 h内即可完全干燥,其次是甘油明胶,用时最长的是中性树胶。但在室温下放置约2周后,采用甘油明胶封片剂制作的标本,透明胶边缘出现肉眼可见的白雾层,对于在透明胶边缘附近的蠕形螨观察会有一定的影响,但将此标本放入恒温恒湿防潮柜(温度25 ℃,湿度15%)2 d后,白雾层逐渐消失。2020年6月采用无味型封片剂制作的蠕形螨标本,室温下存放至2021年5月仍可使用,结构清晰未变形(图 4)。中性树胶封片标本亦无此现象。
|
| 图 4 毛囊蠕形螨成虫(2020年6月制作标本,2021年5月观察,×400) Figure 4 Adult Demodex folliculorum (Fixed in June 2020 and observed in May 2021, ×400) |
| |
采用碘液进行染色,但标本在1~2 d后出现褪色,后期颜色变淡接近于未染色状态,虽然褪色但结构依然清晰、分明,可见足跗节上的爪。见图 5。

|
| 图 5 毛囊蠕形螨成虫(碘液染色褪色后,×400) Figure 5 Adult Demodex folliculorum (after decolorization of iodine stain, ×400) |
| |
中性树胶是一种经典的封片剂,但其含有二甲苯,二甲苯具有刺激性气味且在第3类致癌物质清单中。本研究对比中性树胶、无味型封片剂以及水性封片液甘油明胶的封片效果发现,透明胶纸粘贴法收集的人体蠕形螨分别使用3种封片剂直接封片制作的标本在镜下观察效果差别不大,所制标本均背景清晰、螨体形态清晰,能区分虫种,可清楚地看到鄂体、足体和末体3部分。
采用甘油明胶封片剂制作的标本,封片2周后透明胶边缘出现白雾层,但将此标本放入干燥箱(温度25℃,湿度15%)2 d后,白雾层消失。此现象可能是与海南省潮湿的天气以及甘油明胶是水性封片液、吸湿性强有一定的关系,标本在此条件下是否能够保存更长时间及在其他地区的保存时间有待观察。采用无味型封片剂和中性树胶制作的蠕形螨标本,室温下存放近1年未发生变化。综合考虑无味型封片剂以及甘油明胶中均不含有毒物质二甲苯,因此可选用无味型封片剂替代中性树胶制作蠕形螨标本。
对于油脂、汗毛过多影响观察的标本,本研究尝试仅采用75%~100%乙醇梯度浸泡的方式,但不能达到去除杂质和游离蠕形螨的效果,而延长了洗洁精浸泡时间后去除杂质和获得游离螨效果较好,可见洗洁精清洗是制作的关键步骤。采用普通家用型洗洁精即可去除大部分油脂,洗洁精既能很好地溶解油脂,来源又安全方便,且不影响蠕形螨的观察。但需注意的是,采用短时(1 min)振荡清洗法,只能去除大部分的油脂,透明胶仍具有一定的粘贴性,蠕形螨和汗毛等仍然粘贴在透明胶上;在75%~100%乙醇溶液中梯度脱水时应注意务必使透明胶完全脱水变得透明,否则在封片的过程中会出现云雾状混浊,影响观察,尤其是采用中性树胶封片时,若前期脱水未完全透明,滴加封片剂便立即产生混浊。
在制作过程中发现少数情况下撕下透明胶,蠕形螨并未附着在透明胶上而是残留粘贴在载玻片上,直接将玻片置于上述溶剂中摇晃荡洗,易造成蠕形螨脱落丢失,可使用滴管滴加少量上述试剂依次清洗和梯度洗脱后再封片。
对于一张透明胶上蠕形螨数量较多(5只及以上)的标本,采用洗洁精长时间(30 min)浸泡清洗法,可获得游离蠕形螨标本,但此方法并不能全部游离蠕形螨,在载玻片或透明胶上会有少量残留,残留的标本用前面的方法依次梯度洗脱后封片;游离的蠕形螨制作标本过程中容易丢失、损坏标本,在封片时游离的蠕形螨会跟随封片剂移动而造成标本折叠、损坏,其中无味型封片剂流动性最大,加盖盖玻片时的拖动也易造成标本损坏。可采用双盖片法减少标本的移动从而减少损失,但采用双盖片法时,使用无味型封片剂封片,大小盖片之间容易出现空隙或者有较大气泡,采用甘油明胶封片剂可避免该情况发生。
本研究尝试用碘液对标本进行染色,虽然标本1~2 d后褪色,但结构依然清晰可见,甚至更加分明(图 5中爪部分),是否与染色有关,有待进一步证实,后期可尝试多种染色方法制作染色蠕形螨标本。
综上所述,可采用无味型封片剂或者甘油明胶替代中性树胶作为蠕形螨标本制作的封片剂;无味型封片剂对于采用透明胶纸粘贴法收集的标本封片效果更佳;对于游离的蠕形螨标本采用甘油明胶封片效果更佳。甘油明胶封片剂制作的蠕形螨标本,需放入恒温恒湿防潮柜中保存。采用2%洗洁精浸泡30 min可较为彻底地清洗标本中存在的油脂且可达到从透明胶带中游离蠕形螨的效果。
利益冲突 无
| [1] |
卢致民, 李凤铭. 临床寄生虫学检验技术[M]. 武汉: 华中科技大学出版社, 2019: 213-214. Lu ZM, Li FM. Clinical parasitology and laboratory technology[M]. Wuhan: Huazhong University of Science & Technology Press, 2019: 213-214. |
| [2] |
蒲兴旺, 刘刚, 鲁开化. 人类蠕形螨虫与皮肤健康的临床研究进展[J]. 中国美容整形外科杂志, 2018, 29(8): 510-511. Pu XW, Liu G, Lu KH. Progress in clinical research on human Demodex and skin health[J]. Chin J Aesth Plast Surg, 2018, 29(8): 510-511. DOI:10.3969/j.issn.1673-7040.2018.08.019 |
| [3] |
诸欣平, 苏川. 人体寄生虫学[M]. 9版. 北京: 人民卫生出版社, 2018: 245. Zhu XP, Su C. Human parasitology[M]. 9th ed. Beijing: People's Medical Publishing House, 2018: 245. |
| [4] |
Hellerich U, Metzelder M. Incidence of scalp involvement by Demodex folliculorum Simon ectoparasites in a pathologic-anatomic and forensic medicine autopsy sample[J]. Arch Kriminol, 1994, 194(3/4): 111-118. |
| [5] |
Madeira NG, Sogayar MIL. Prevalencia de Demodex folliculorum e Demodex brevis em Uma amostra da população de Botucatu, São Paulo, Brasil[J]. Rev Soc Bras Med Trop, 1993, 26(4): 221-224. DOI:10.1590/S0037-86821993000400004 |
| [6] |
Li CP. Medical acarology[M]. Beijing: People's Military Medical Publishing House, 2006: 299-322.
|
| [7] |
郭家, 郭俊杰, 张浩, 等. 制备蠕形螨玻片标本的新方法: 透明胶纸永久封片法[J]. 齐齐哈尔医学院学报, 1999, 20(5): 507-508. Guo J, Guo JJ, Zhang H, et al. A new method for preparing Demodex glass slides: permanent mounting cellophane tape[J]. J Qiqihar Med Univ, 1999, 20(5): 507-508. |
| [8] |
王唯唯, 黄文达. 中性树胶直接封片制作蠕形螨标本[J]. 中国寄生虫学与寄生虫病杂志, 1998, 16(2): 76. Wang WW, Huang WD. Preparation of Demodex specimen by direct mounting with neutral gum[J]. Chin J Parasitol Parasit Dis, 1998, 16(2): 76. |
| [9] |
李永祥, 张辉, 刘振忠, 等. 蠕形螨标本制作方法探讨[J]. 中国寄生虫学与寄生虫病杂志, 2002, 20(4): 196. Li YX, Zhang H, Liu ZZ, et al. Preparation and staining of Demodex folliculorum specimen[J]. Chin J Parasitol Parasit Dis, 2002, 20(4): 196. DOI:10.3969/j.issn.1000-7423.2002.04.018 |
| [10] |
李永祥, 刘振忠, 郑志红. 蠕形螨标本的制作与染色[J]. 中国人兽共患病杂志, 2002, 18(2): 12. Li YX, Liu ZZ, Zheng ZH. Demodicidae sample making[J]. Chin J Zoonoses, 2002, 18(2): 12. DOI:10.3969/j.issn.1002-2694.2002.02.048 |
| [11] |
刘莹, 李速婷. 人体蠕形螨环境扫描电镜样本的制作[J]. 医学动物防制, 2007, 23(11): 818-819. Liu Y, Li ST. Preparation of environmental scanning electron microscope samples of human Demodex[J]. Med Ani Prev, 2007, 23(11): 818-819. DOI:10.3969/j.issn.1003-6245.2007.11.008 |
 2022, Vol. 33
2022, Vol. 33


