扩展功能
文章信息
- 徐颖, 刘海江, 庞英杰, 陈晓光, 张娟, 张瑾, 徐翮飞, 滕新栋
- XU Ying, LIU Hai-jiang, PANG Ying-jie, CHEN Xiao-guang, ZHANG Juan, ZHANG Jin, XU He-fei, TENG Xin-dong
- 青岛口岸入境货物中截获输入性东亚异蚤蝇
- Imported Megaselia spiracularis captured in the entry goods at Qingdao port of China
- 中国媒介生物学及控制杂志, 2022, 33(1): 133-136, 158
- Chin J Vector Biol & Control, 2022, 33(1): 133-136, 158
- 10.11853/j.issn.1003.8280.2022.01.024
-
文章历史
- 收稿日期: 2021-07-06
2 青岛机场海关, 山东 青岛 266000
2 Qingdao Airport Customs, Qingdao, Shandong 266000, China
东亚异蚤蝇(Megaselia spiracularis)隶属双翅目(Diptera)蚤蝇总科(Phoroidea)蚤蝇科(Phoroidae)裂蚤蝇亚科(Metopininae)异蚤蝇属,异蚤蝇属是双翅目蚤蝇科的第一大属[1],主要分布在我国局部地区、东南亚和澳大利亚[2],青岛地区未见分布。本次青岛机场海关在来自澳大利亚的1批货物中查获1批东亚异蚤蝇的成虫及蛹,是青岛地区首次捕获的入境蝇种。
传统的物种鉴定依靠形态学上的特征,但是以幼态形式存在的蝇类并不表现出物种水平的区分特征,只有等培养成熟以后才能被准确鉴定[3]。本次截获的东亚异蚤蝇,成虫的样本形态略有残缺,而对蛹的鉴别资料不多,给形态学的鉴定带来一定困难。DNA条形码技术被广泛应用于不同生物类群的鉴定中,如丽蝇、麻蝇、寄蝇等双翅目昆虫[4-5],通常情况下对残缺的样本包括蛹皮也能准确鉴定[6]。基于此,本次研究将形态学鉴定、DNA条形码技术相结合,对青岛机场海关截获的入境蝇类进行快速、准确的鉴定,确定其为东亚异蚤蝇,并经科技文献查新确认其为青岛口岸未见分布的外来入境物种。
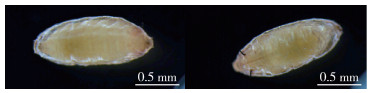
1 材料与方法 1.1 标本采集2020年青岛机场海关从入境的货物中截获1批未知蝇类的成虫及蛹,送往青岛国际旅行卫生保健中心实验室进行鉴定,对其拍照留档,蝇类成虫见图 1,蛹见图 2。

|
| 图 1 青岛口岸入境货物中截获的蝇成虫 Figure 1 The adult fly captured in the entry goods at Qingdao port |
| |
|
| 图 2 青岛口岸入境货物中截获的蝇蛹 Figure 2 The fly pupa captured in the entry goods at Qingdao port |
| |
根据蝇类检索表以及东亚异蚤蝇分类相关的参考文献在解剖镜下对捕获蝇类成虫进行形态学鉴定,并描述其形态特征。
1.3 DNA提取分别取蝇的1条后足和蛹,用于基因组DNA的提取,按试剂盒的说明书进行蝇和蛹样品的全基因组DNA提取,DNA提取试剂盒购自Qiagen公司,得到的DNA保存在-20 ℃冰箱备用。
1.4 DNA扩增所用引物序列为:LCO14905′-GGTCAACAAATCATAAAGATATTGG-3′,HCO21985′- TAAACTTCAGGGTGACCAAAAAATCA-3′[7]。引物由生工生物工程(上海)股份有限公司(上海生工)青岛有限公司合成,EX-Taq DNA聚合酶,dNTP等PCR所需试剂均购买自上海生工。PCR反应体系为[8]:10×PCR缓冲液5 μl,正向引物(20 umol/L)2 μl,反向引物(20 umol/L)2 μl;dNTP(10 mmol/L)2 μl;EX-Taq DNA聚合酶(5 U/μl)1 μl;模板DNA 3 μl(50 ng/μl),无菌水35 μl。DNA扩增条件:94 ℃预变性3 min;94 ℃变性30 s,52 ℃退火30 s,72 ℃延伸30 s,运行30个循环;72 ℃延伸10 min;4 ℃保存。
1.5 测序比对将PCR产物送至上海生工青岛有限公司测序,将所获得的双向序列进行拼接,去除引物片段后将所得序列上传至美国国立生物技术信息中心(NCBI)的GenBank和生命条形码系统(barcode of life data system,BOLD system)v4进行比对,根据比对结果选取物种序列,使用MEGA Ⅹ软件采用邻接法(neighbor-joining,NJ)建立系统发育树。
2 结果根据《SN/T 4278-2015国境口岸医学媒介昆虫DNA条形码鉴定操作规程》要求,序列相似度最高且≥99.00%者,可判定为同一种类[5]。结果表明,本次截获的成虫和蛹均为东亚异蚤蝇。
2.1 形态学鉴定根据《中国常见蝇类检索表》和《中国蝇类》,蚤蝇属鉴别特征为:成虫形态为体长1.00~2.00 mm,胸背部隆起呈驼背状,胸部背板为褐色,侧板为黄色,翅无横脉,足黄色。初步将截获成蝇鉴定为蚤蝇类,但送检样本成虫的形态被破坏,无法准确鉴定到种。
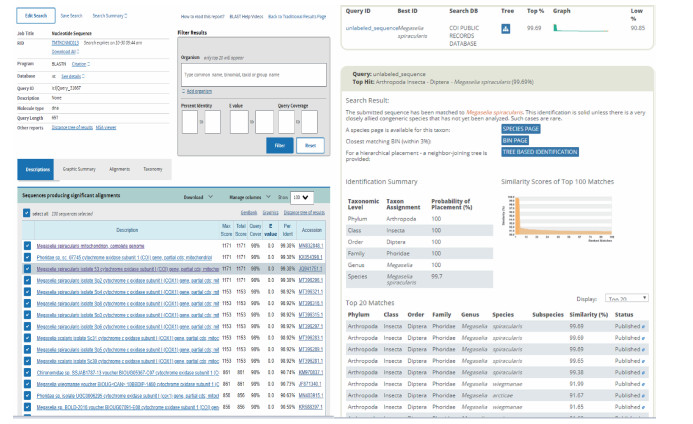
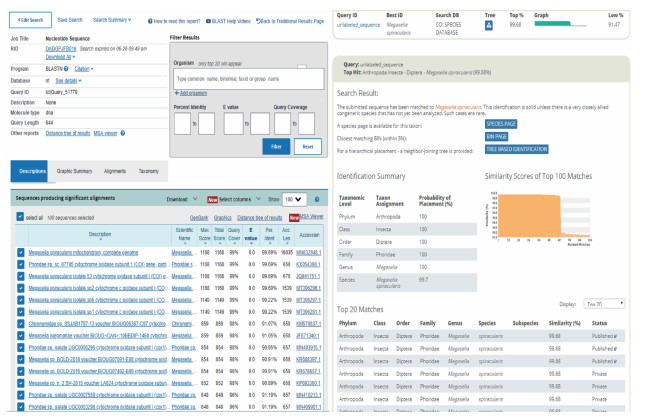
2.2 基因扩增和序列比对成虫得到有效长度为657 bp的序列,序列分别在GenBank和BOLD system v4中进行比对,成虫所得序列与GenBank中的东亚异蚤蝇(登录号:MN832848.1)细胞色素C氧化酶亚基Ⅰ(COⅠ)基因相似性为99.38%,与BOLD中的东亚异蚤蝇(序列号:JQ941752)序列相似性为99.69%,比对结果见图 3。蛹得到有效长度为644 bp的序列,将成虫与蛹的有效序列放在GenBank中进行比对,基因相似性为98.00%。蛹的所得序列分别在GenBank和BOLD system v4中进行比对,与GenBank中公布的东亚异蚤蝇(登录号:MN832848.1)COⅠ基因相似性为99.69%,与BOLD中公开的东亚异蚤蝇(序列号:JQ941752)基因序列相似性99.68%,比对结果见图 4。
|
| 图 3 青岛口岸截获蝇类成虫DNA条形码序列在GenBank和生命条形码系统中的比对结果 Figure 3 Comparison of the DNA barcoding sequence of the adult fly captured at Qingdao port with the sequence in GenBank and barcode of life data system |
| |
|
| 图 4 青岛口岸截获蛹DNA条形码序列在GenBank和生命条形码系统中的比对结果 Figure 4 Comparison of the DNA barcoding sequence of the pupae captured at Qingdao port with the sequence in GenBank and barcode of life data system |
| |
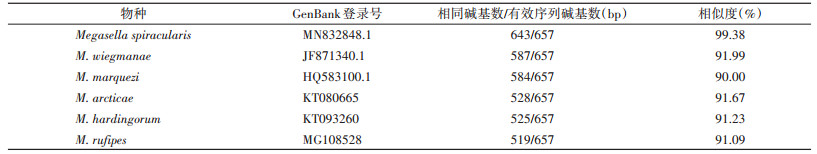
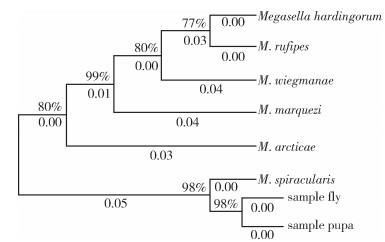
选取GenBank中与成虫的有效序列比较所得相似度较高的6个物种序列,分别是:M. spiracularis、M. wiegmanae、M. marquezi、M. arcticae、M. hardingorum和M. rufipes,上述物种的基因相关信息见表 1,用MEGA Ⅹ软件构建进化树,结果如图 5所示,NJ进化树上所标数字为置信度,因此可以根据DNA条形码判断本研究的蝇类为东亚异蚤蝇。
|
|
| 图 5 基于DNA条形码序列构建的青岛口岸截获蝇成虫和蛹与已知蚤蝇NJ系统发育树 Figure 5 The neighbor-joining phylogenetic tree of the fly and pupae captured at Qingdao port and the known Phoridae flies based on DNA barcoding sequence |
| |
为便于今后使用形态特征对东亚异蚤蝇进行形态鉴定,根据国内外参考文献及本研究样品观察特征,将东亚异蚤蝇的形态特征归纳如下。
雄性:额褐色,宽约0.28 mm,密布细毛,纵沟明显。触角上鬃2对,不等,下对短小。下额间鬃明显低于下额眶鬃。触角第3节红褐色,皮下感觉孔多,其直径大小不等;芒明显长于额宽,具微毛。下颚须黄色。胸部背板黄褐色或褐色,侧板黄色。足黄色,后足腿节末端色暗。翅略呈灰褐色,翅脉黑褐色,平衡棒黄色。体长1.50~2.00 mm[9]。
雌性:额黄色或褐色,触角比雄性略小;胸部背板褐色,侧板淡黄色。腹部腹面黄褐色至褐色,体长1.80~2.30 mm[7]。
卵:东亚异蚤蝇的卵,卵细长,底部平,呈船形,卵底部呈环状排列的片状构造,周围为有呼吸功能的气盾构造[9]。
幼虫:幼虫为白色,头部尖,无长尾[9]。
蛹:初始的蛹呈淡黄色,之后逐渐变暗,逐渐呈现为黄色或红褐色,前端背部具有1对羽化板,化蛹2~3 d后在每个板状结构上各生1个呼吸角[7]。
3 讨论蚤蝇属小型昆虫,体色单调,胸部背板隆起,加之头和腹部的着生位置偏下,所以侧面观身体呈驼背状,故有“驼背蝇”之称;蚤蝇生性活泼并且行动敏捷善于疾走,因此又被称为“疾走蝇”。蚤蝇的成虫、幼虫经常出没于人类居住区,大多数蚤蝇为腐食性、粪食性。它们在垃圾、粪便等污秽处活动,并常窜入居室内,污染人的食物、水源等,更严重的是因蚤蝇引起人类蝇蛆病的报道屡见不鲜[10-11]。东亚异蚤蝇与引起人类蝇蛆病的蛆症异蚤蝇(M. scalaris)习性相似,它们复杂的食谱和对环境的适应性决定了其广泛的分布,并且对这两物种卵的结构和染色体的观察表明它们亲缘关系非常相近[12],因此东亚异蚤蝇有可能成为危害人类健康的潜在害虫[13]。除此之外,东亚异蚤蝇是食用菌栽培中的重要害虫之一,常常造成蘑菇的严重减产[4]。
根据记载,东亚异蚤蝇的分布地区为我国的辽宁、北京、河南、浙江、江苏、江西、湖北、湖南、福建、海南、台湾省(直辖市)以及日本、马来西亚、斯里兰卡。青岛市本地没有东亚异蚤蝇的分布记录。本次截获是青岛机场海关从来自澳大利亚的贝壳类货物中查获,货物中夹带1批东亚异蚤蝇的成虫及蛹,且货物随航班直达青岛市,运输过程中无从其他途径入侵的机会,而且旅行时间比较短,不能满足成虫产卵至形成蛹的时长。东亚异蚤蝇在澳大利亚分布较广,东亚异蚤蝇具有腐食性,而贝类货物在购买、运输、处理、装箱等暴露在外的过程中容易吸引蝇类,由此推测本次截获的东亚异蚤蝇是外来入境物种。随着世界经济、贸易一体化进程的加速,出入境人员及货物逐年递增,海关人员在口岸截获的入境生物种类和数量逐年递增,此次截获提示我们应该高度重视入境生物由货物、人员携带等进入我国的风险。
利益冲突 无
| [1] |
杨金玲. 中国异蚤蝇属部分种类分子系统发育分析[D]. 沈阳: 沈阳大学, 2011. Yang JL. Molecular phylogenetic analysis of some species of Megaselia of China[D]. Shenyang: Shenyang University, 2011. (in Chinese) |
| [2] |
王秀红, 冯典兴, 邹天路. 温度对东亚异蚤蝇幼虫生长发育的影响[J]. 沈阳大学学报(自然科学版), 2019, 31(1): 18-21. Wang XH, Feng DX, Zou TL. Effects of temperature on growth and development of Megaselia spiracularis Schmitz[J]. J Shenyang Univ(Nat Sci), 2019, 31(1): 18-21. DOI:10.16103/j.cnki.21-1583/n.2019.01.004 |
| [3] |
陈庆, 白洁, 刘力, 等. 北京地区7种常见嗜尸性蝇类的COⅠ基因序列分析及DNA条形码的建立[J]. 昆虫学报, 2009, 52(2): 202-209. Chen Q, Bai J, Liu L, et al. Sequential analysis of mitochondrial COⅠ gene for seven common sarcosaphagous flies (Diptera) in Beijing and the establishment of their DNA barcodes[J]. Acta Entomol Sin, 2009, 52(2): 202-209. DOI:10.3321/j.issn:0454-6296.2009.02.012 |
| [4] |
Kim H, Shin SE, Ko KS, et al. The application of mitochondrial COⅠ gene-based molecular identification of forensically important scuttle flies (Diptera: Phoridae) in Korea[J]. Biomed Res Int, 2020, 2020: 6235848. DOI:10.1155/2020/6235848 |
| [5] |
Koroiva R, de Souza MS, de Oliveira Roque F, et al. DNA barcodes for forensically important fly species in Brazil[J]. J Med Entomol, 2018, 55(4): 1055-1061. DOI:10.1093/jme/tjy045 |
| [6] |
邱德义, 廖俊蕾, 魏晓雅, 等. 基于DNA条形码丽蝇科49种常见种的分类鉴定[J]. 中国媒介生物学及控制杂志, 2017, 28(4): 322-331. Qiu DY, Liao JL, Wei XY, et al. Identification of 49 common fly species in Calliphoridae based on DNA barcodes[J]. Chin J Vector Biol Control, 2017, 28(4): 322-331. DOI:10.11853/j.issn.1003.8280.2017.04.005 |
| [7] |
中华人民共和国国家质量监督检验检疫总局. SN/T 4278-2015国境口岸医学媒介昆虫DNA条形码鉴定操作规程[S]. 北京: 中国标准出版社, 2016. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. SN/T 4278-2015 Protocol for DNA barcoding identification techniques of medical insect at frontier ports[S]. Beijing: China Standard Press, 2016. (in Chinese) |
| [8] |
徐颖, 薛晓宁, 张娟, 等. 青岛未见分布蝇种: 天仙子泉蝇的鉴定[J]. 中国国境卫生检疫杂志, 2019, 42(4): 270-272. Xu Y, Xue XN, Zhang J, et al. Identification of Pegomya hyoscyami: A non-recorded fly at Qingdao[J]. Chin J Front Health Quarant, 2019, 42(4): 270-272. DOI:10.16408/j.1004-9770.2019.04.011 |
| [9] |
方红. 中国异蚤蝇区系分类研究(双翅目: 蚤蝇科)[D]. 沈阳: 沈阳农业大学, 2008. Fang H. Taxonomic research on Chinese Megaselia flies (Diptera: Phoridae)[D]. Shenyang: Shenyang Agricultural University, 2008. (in Chinese) |
| [10] |
Giangaspero A, Barlaam A, Pane S, et al. Accidental nasal myiasis caused by Megaselia rufipes (Diptera: Phoridae) in a child[J]. J Med Entomol, 2021, 58(1): 121-124. DOI:10.1093/jme/tjaa184 |
| [11] |
Solgi R, Djadid ND, Eslamifar A, et al. Morphological and molecular characteristic of Megaselia scalaris (Diptera: Phoridae) larvae as the cause of urinary myiasis[J]. J Med Entomol, 2017, 54(3): 781-784. DOI:10.1093/jme/tjw204 |
| [12] |
Wolf KW, Mitchell A, Liu GC. Centromere-like elements in Megaselia spiracularis (Diptera: Phoridae): A fine-structure and cytogenetic study[J]. Hereditas, 1996, 124(3): 203-210. DOI:10.1111/j.1601-5223.1996.t01-1-00203.x |
| [13] |
刘广纯, 陈琳, 何小慧, 等. 东亚异蚤蝇生活史研究[J]. 沈阳大学学报, 2001, 13(2): 1-2, 5. Liu GC, Chen L, He XH, et al. Life history of Megaselia spiracularis Schmitz(Diptera: Phoridae)[J]. J Shenyang Univ, 2001, 13(2): 1-2, 5. DOI:10.3969/j.issn.1008-9225.2001.02.002 |
 2022, Vol. 33
2022, Vol. 33


