扩展功能
文章信息
- 赵春春, 周欣欣, 李文玉, 伦辛畅, 刘小波, 吴海霞, 王君, 刘起勇, 孟凤霞
- ZHAO Chun-chun, ZHOU Xin-xin, LI Wen-yu, LUN Xin-chang, LIU Xiao-bo, WU Hai-xia, WANG Jun, LIU Qi-yong, MENG Feng-xia
- 2020年中国13省份登革热媒介白纹伊蚊抗药性监测及分析研究
- Insecticide resistance surveillance and characteristic analysis of dengue vector Aedes albopictus in 13 provinces of China in 2020
- 中国媒介生物学及控制杂志, 2022, 33(1): 30-37
- Chin J Vector Biol & Control, 2022, 33(1): 30-37
- 10.11853/j.issn.1003.8280.2022.01.006
-
文章历史
- 收稿日期: 2021-11-11
 虫威均未产生抗药性;有6.45%(4/62)的监测点的白纹伊蚊成蚊对马拉硫磷产生了抗药性,另52和59个监测点的白纹伊蚊成蚊对杀螟硫磷及毒死蜱均未产生抗药性。幼蚊监测结果显示,分别有93.48%(43/46)、28.30%(15/53)和25.45%(14/55)的监测点的白纹伊蚊幼蚊对吡丙醚、残杀威和双硫磷产生了中高抗药性。结论 我国登革热流行省份的白纹伊蚊成蚊对拟除虫菊酯类杀虫剂抗药性较为严重,对氨基甲酸酯类和有机磷类杀虫剂抗药性水平较低;幼蚊对吡丙醚抗药性较为严重。各地应根据当地白纹伊蚊抗药性实际情况,调整杀虫剂使用方案,提高媒介伊蚊控制效果。
虫威均未产生抗药性;有6.45%(4/62)的监测点的白纹伊蚊成蚊对马拉硫磷产生了抗药性,另52和59个监测点的白纹伊蚊成蚊对杀螟硫磷及毒死蜱均未产生抗药性。幼蚊监测结果显示,分别有93.48%(43/46)、28.30%(15/53)和25.45%(14/55)的监测点的白纹伊蚊幼蚊对吡丙醚、残杀威和双硫磷产生了中高抗药性。结论 我国登革热流行省份的白纹伊蚊成蚊对拟除虫菊酯类杀虫剂抗药性较为严重,对氨基甲酸酯类和有机磷类杀虫剂抗药性水平较低;幼蚊对吡丙醚抗药性较为严重。各地应根据当地白纹伊蚊抗药性实际情况,调整杀虫剂使用方案,提高媒介伊蚊控制效果。登革热是由蚊虫传播登革病毒引起的一种传染病。近十几年来,全球登革热发病率大幅增长,全球约有一半人口处于登革热发生的风险区[1]。2017年,在山东省济宁市发生了登革热流行[2],本地登革热流行区再次北扩。我国登革热发生范围逐渐扩大,防控形势日趋严峻。截至2019年,中国大陆已经有15个省(自治区、直辖市)出现过登革热的本地传播和流行,从南到北分别是海南、云南、广西、广东、福建、湖南、江西、四川、重庆、浙江、湖北、上海、安徽、河南和山东等省(自治区、直辖市)。由于尚无特效治疗药物和疫苗[3-4],因此,使用杀虫剂快速降低媒介伊蚊密度,依然是当前甚至更长一段时间内媒介伊蚊最有效的控制方法。但是,由于杀虫剂的大量或不规范使用,产生了严重的抗药性问题[5]。我国从2014年起在全国设立了媒介伊蚊抗药性监测点,对各省媒介伊蚊对不同种类杀虫剂的抗药性水平进行了全面监测,并对当地杀虫剂的使用进行指导。为进一步对我国登革热媒介伊蚊抗药性开展系统、全面、规范地监测,2019年10月,中国疾病预防控制中心(CDC)启动了“登革热媒介伊蚊专项调查”项目,针对2019年我国发生过登革热本地传播的12省(自治区、直辖市)开展登革热媒介伊蚊抗药性监测(项目方案编报完成后,四川省也发生了登革热本地流行,四川省CDC自愿加入了本项目的抗药性监测),使用统一规范的监测方法,获得可比可用的监测结果,旨在于登革热发生早期对当地杀虫剂使用进行科学指导,为登革热媒介伊蚊防控选择及使用卫生杀虫剂提供科学依据。
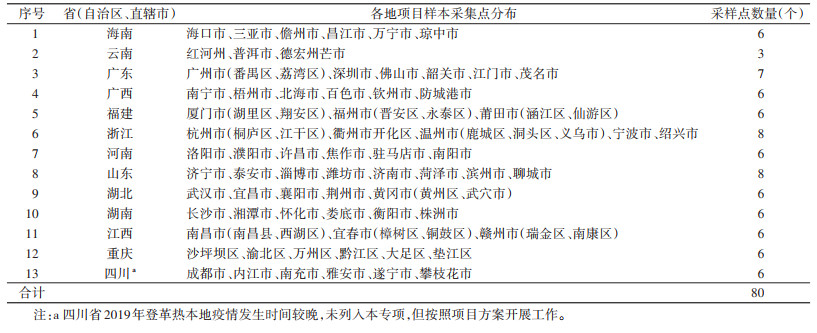
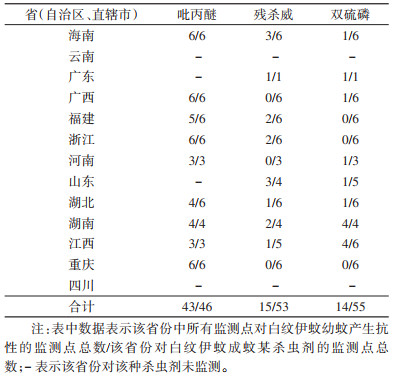
1 材料与方法 1.1 监测点的选择2020年,选取在2019年有过登革热本地流行的广东、海南、云南、广西、福建、浙江、江西、重庆、河南、湖北、湖南、山东、四川等13个省(自治区、直辖市)的全国病媒生物抗药性监测点开展。各省根据当地登革热发生及伊蚊分布情况,设置3个及以上的监测点。见表 1。
|
采用世界卫生组织(WHO)推荐的幼虫浸渍法和成蚊接触筒法,按照中国CDC《全国病媒生物监测实施方案》(2016)进行。我国白纹伊蚊幼蚊抗药性监测多采用半数致死量(LC50/IE50)[6]法,计算抗性倍数(RR),本研究中敏感品系的LC50(IE50)参考开文龙[7]和师灿南等[8]的测定结果,统一标定抗性倍数;白纹伊蚊成蚊抗药性监测多采用诊断剂量法[9]检测其诊断剂量下的死亡率,诊断剂量由中国CDC传染病预防控制所建立用于常规抗药性监测。
1.3 供试杀虫剂用于成蚊抗药性监测的诊断剂量杀虫剂药膜包括:拟除虫菊酯类(0.03%溴氰菊酯、0.4%氯菊酯、0.08%高效氯氰菊酯、0.07%高效氯氟氰菊酯),氨基甲酸酯类(0.05%残杀威、0.2% 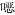
使用Excel 2016软件对监测收集到的数据进行录入、整理与分析,利用ArcGIS 10.3软件绘制抗药性水平地图。
1.5 抗性判定标准用不同颜色在地图上表示不同抗性水平。幼蚊:RR < 3,为敏感种群;3≤RR < 10,为低抗种群;10≤RR < 40为中抗种群;RR≥40,为高抗种群。成蚊:在诊断剂量下,死亡率≥98%为敏感种群;死亡率在80%~98%(不含)为可疑抗性种群;死亡率 < 80%为抗性种群。
2 结果 2.1 白纹伊蚊成蚊对9种常用杀虫剂抗药性监测结果本次伊蚊专项中成蚊抗药性监测主要针对9种常用杀虫剂进行监测。监测结果见表 2。
|
本次监测获得了4种常用的拟除虫菊酯类杀虫剂的抗药性监测结果,包括溴氰菊酯、氯菊酯、高效氯氰菊酯和高效氯氟氰菊酯。由表 2可见,有83.08%(54/65)的监测点的白纹伊蚊成蚊对溴氰菊酯产生了抗性;有77.97%(46/59)的监测点对氯菊酯产生了抗性;有87.30%(55/63)的监测点对高效氯氰菊酯产生了抗性;有79.31%(46/58)的监测点对高效氯氟氰菊酯产生了抗性。其中,广西壮族自治区(广西)、重庆市、福建和河南省几乎所有的监测点对这4种杀虫剂均产生了抗药性。从图 1可知,产生抗药性的监测点均匀分布在我国白纹伊蚊的分布区。整体来看,我国白纹伊蚊成蚊对拟除虫菊酯类杀虫剂产生了相当严重的抗药性。
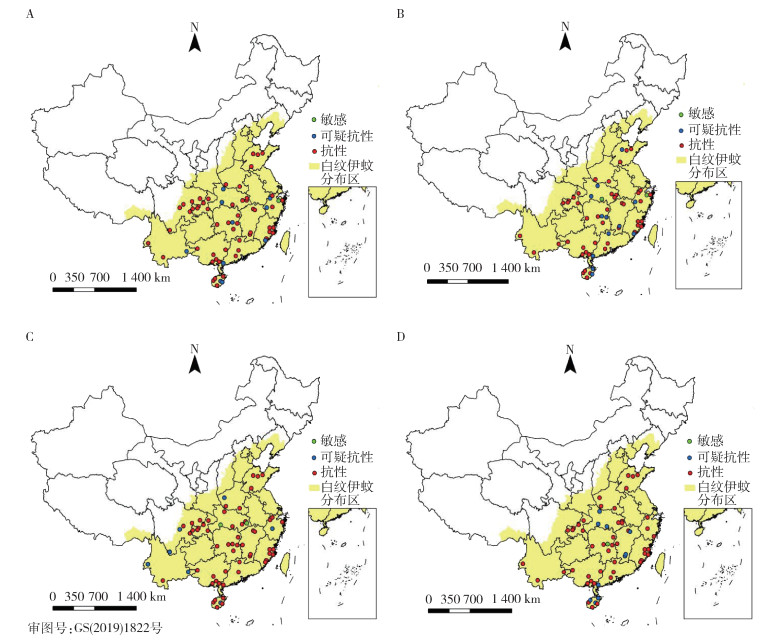
|
| 注:A白纹伊蚊成蚊对溴氰菊酯抗性分布;B白纹伊蚊成蚊对氯菊酯抗性分布;C白纹伊蚊成蚊对高效氯氰菊酯抗性分布;D白纹伊蚊成蚊对高效氯氟氰菊酯抗性分布。 图 1 2020年中国13省份登革热媒介伊蚊监测点白纹伊蚊成蚊对4种拟除虫菊酯类杀虫剂的抗性分布 Figure 1 Distribution of resistance of Aedes albopictus adults to 4 pyrethroid insecticides in surveillance sites of 13 provinces of China in 2020 |
| |
本次监测获得了2种常用的氨基甲酸酯类杀虫剂的抗药性监测结果,包括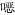
|
注:A白纹伊蚊成蚊对残杀威的抗性分布;B白纹伊蚊成蚊对 虫威的抗性分布。
图 2 2020年中国13省份登革热媒介伊蚊监测点白纹伊蚊成蚊对2种氨基甲酸酯类杀虫剂的抗性分布
Figure 2 Distribution of resistance of Aedes albopictus adults to 2 carbamate insecticides in surveillance sites of 13 provinces of China in 2020 虫威的抗性分布。
图 2 2020年中国13省份登革热媒介伊蚊监测点白纹伊蚊成蚊对2种氨基甲酸酯类杀虫剂的抗性分布
Figure 2 Distribution of resistance of Aedes albopictus adults to 2 carbamate insecticides in surveillance sites of 13 provinces of China in 2020
|
| |
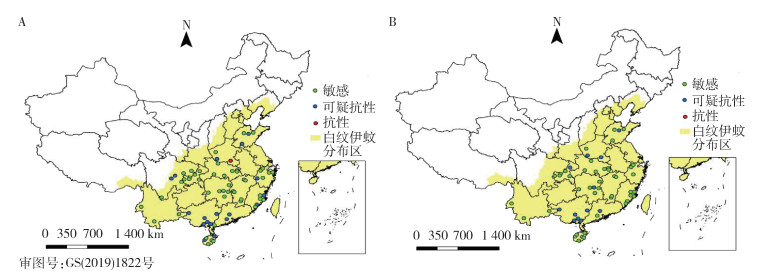
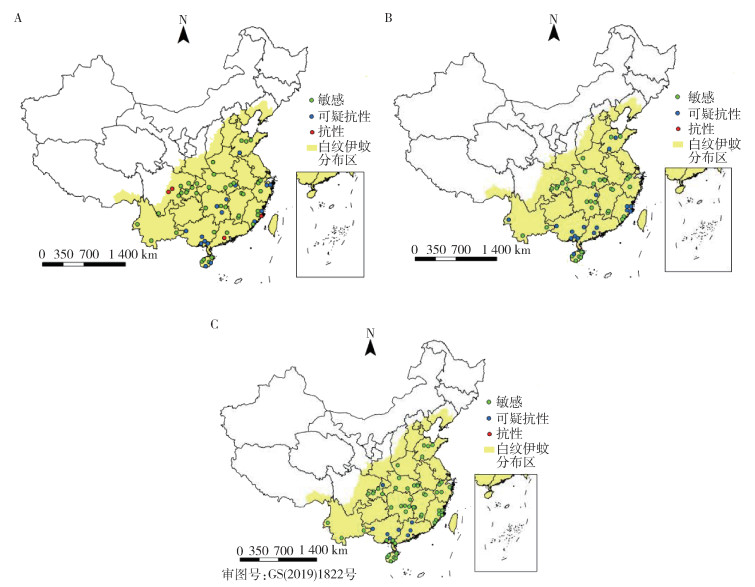
本次监测获得了白纹伊蚊成蚊对3种常用的有机磷类杀虫剂的抗药性监测结果,包括马拉硫磷、杀螟硫磷和毒死蜱。由表 2、图 3可知,有6.45%(4/62)的监测点的白纹伊蚊成蚊对马拉硫磷产生了抗性;52个监测点的白纹伊蚊成蚊对杀螟硫磷均未产生抗性;59个监测点的白纹伊蚊成蚊对毒死蜱均未产生抗性。
|
| 注:A白纹伊蚊成蚊对马拉硫磷的抗性分布;B白纹伊蚊成蚊对杀螟硫磷的抗性分布;C白纹伊蚊成蚊对毒死蜱的抗性分布。 图 3 2020年中国13省份登革热媒介伊蚊监测点白纹伊蚊成蚊对3种有机磷类杀虫剂的抗性分布 Figure 3 Distribution of resistance of Aedes albopictus adult to 3 organophosphorus insecticides at surveillance sites in 13 provinces of China in 2020 |
| |
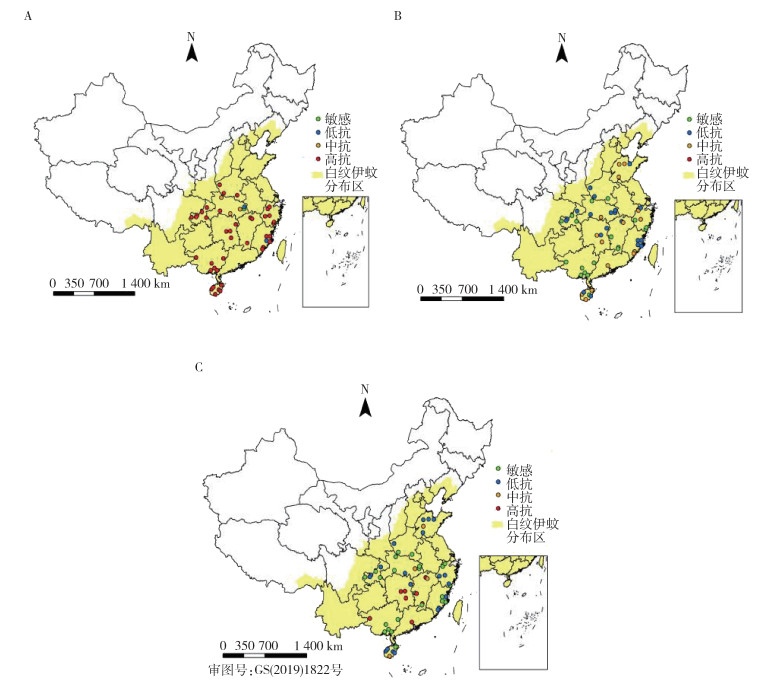
本次监测获得了白纹伊蚊幼蚊对3种常用杀虫剂的抗药性监测结果,包括吡丙醚、残杀威和双硫磷。由表 3可见,有93.48%(43/46)的监测点的白纹伊蚊幼蚊对吡丙醚产生了中高抗性;有28.30%(15/53)的监测点对残杀威产生了中高抗性;有25.45%(14/55)的监测点对双硫磷产生了中高抗性。从图 4可以看出,绝大多数监测点对吡丙醚产生了高抗水平,而对于残杀威,部分地区显示中抗水平,对双硫磷产生中高抗性的地区集中在湖南、湖北、江西等省份。
|
|
| 注:A白纹伊蚊幼蚊对吡丙醚的抗性分布;B白纹伊蚊幼蚊对残杀威的抗性分布;C白纹伊蚊幼蚊对双硫磷的抗性分布。 图 4 2020年中国13省登革热媒介伊蚊监测点白纹伊蚊幼蚊对3种杀虫剂的抗性分布 Figure 4 Distribution of resistance of Aedes albopictus larvae to 3 insecticides at surveillance sites in 13 provinces of China in 2020 |
| |
自我国启动病媒生物抗药性监测以来,各监测点根据当地情况,按照《全国病媒生物监测实施方案》,选择当地常用的杀虫剂进行监测。2020年首次统一规范使用抗性监测的杀虫剂,使得监测结果具有较强的可比性。
目前WHO和我国均无推荐可用的白纹伊蚊成蚊对各种杀虫剂的诊断剂量参考值。本研究中所使用的诊断剂量均为中国CDC传染病预防控制所媒介生物控制室敏感品系在2017-2019年参与项目《WHO多中心诊断剂量的研究》中的数据。通过统一发放药膜滤纸和杀虫剂原药,由各个监测点分别采集蚊虫进行生物测定,并将数据上报至中国CDC传染病预防控制所进行统一分析。该研究存在的问题为新的诊断剂量尚未得到验证,且拟除虫菊酯类杀虫剂的诊断剂量相较于之前的数据低了很多,因此与历史数据可比性差。但原有拟除虫菊酯类杀虫剂的诊断剂量一直较高,实际工作中不利于监测工作的进行和杀虫剂的指导使用。2020年伊蚊监测项目中,统一诊断剂量和杀虫剂,使得各个监测点间均衡可比,对于我国的白纹伊蚊分布区该蚊抗药性水平能够进行全面的了解,对于登革热风险区疫情防控杀虫剂的使用起到很好的指导作用。
拟除虫菊酯类杀虫剂由于其高效、低毒、广谱及环境友好等特性而被广泛使用在害虫防治中。其施用面积占我国杀虫剂总施用面积的1/3以上,常用于滞留喷洒和浸泡蚊帐、窗帘等[10]。但由于其大量及不规范地使用,抗药性等一系列问题也逐渐产生。2020年伊蚊监测项目中,下调了拟除虫菊酯类杀虫剂对于白纹伊蚊的诊断剂量。与2017-2018年监测结果相比[11],发生抗药性的监测点比例有了大幅提升,但这并不能说明抗药性的进展快,而是由于诊断剂量的下调导致的。但是下调之后的诊断剂量与WHO在2016年[12]提供的数据较为接近,且本次监测使用的诊断剂量是由全球多个实验室共同获得的,因此具有更好的参考性,本研究中白纹伊蚊对4种拟除虫菊酯类杀虫剂均有75%以上的监测点产生抗药性,这说明我国登革热流行区的白纹伊蚊对拟除虫菊酯类杀虫剂已经产生很严重的抗药性,应该尽快采取有效措施,调整用药方案。
有机磷类和氨基甲酸酯类杀虫剂具有合成简单、杀虫谱广、价格便宜等特点而被广泛应用。自20世纪中叶被开发以来,多用于农业和园林业,但不可避免地对蚊虫也产生了一定程度的抗药性[13-14]。本研究中对于白纹伊蚊共监测了2种氨基甲酸酯类杀虫剂和3种有机磷类杀虫剂,结果表明仅有很少部分的监测点白纹伊蚊对残杀威和马拉硫磷产生抗药性,而其余均表现为敏感或可疑抗性。说明这2类杀虫剂对于白纹伊蚊成蚊的控制具有较好的应用前景。
除了对白纹伊蚊成蚊的抗药性进行监测以外,本研究还汇总了3种杀虫剂对白纹伊蚊幼蚊的抗药性水平监测情况。其中作为昆虫生长调节剂的吡丙醚,90%以上的监测点对其产生了中高程度的抗药性。吡丙醚能够通过抑制昆虫几丁质的合成,导致昆虫在幼蚊阶段不能进行正常变态,从而死亡[15-16]。低浓度便可产生较好的防治效果,但由于见效缓慢,因此相较于拟除虫菊酯类等速效杀虫剂,使用并不是很广泛[17]。本次监测发现大部分地区对其已产生较为严重的抗药性,分析原因:①可能因为其他同类杀虫剂的大量使用使得白纹伊蚊对该类杀虫剂产生了交互抗性;②吡丙醚相对于其他幼蚊杀虫剂,作用缓慢,生物测定周期长,各监测点实验条件不一,可能导致测定结果有所偏差。相对而言,白纹伊蚊幼蚊对其他2种杀虫剂(残杀威和双硫磷)较为敏感,说明这2种杀虫剂还可以继续在当地用于白纹伊蚊幼蚊的防制。
志谢 本研究得到13个项目省(自治区、直辖市)的各级卫生健康委员会及疾病预防控制机构的大力支持,特此志谢利益冲突 无
| [1] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [2] |
Liu HM, Liu LH, Cheng P, et al. Bionomics and insecticide resistance of Aedes albopictus in Shandong, a high latitude and high-risk dengue transmission area in China[J]. Parasit Vectors, 2020, 13(1): 11. DOI:10.1186/s13071-020-3880-2 |
| [3] |
李志强, 钟俊鸿. 登革热媒介昆虫抗药性的研究进展[J]. 昆虫知识, 2008, 45(6): 857-862. Li ZQ, Zhong JH. Advance in the research of insecticide resistance in dengue fever vectors[J]. Chin Bull Entomol, 2008, 45(6): 857-862. DOI:10.3969/j.issn.0452-8255.2008.06.004 |
| [4] |
王伟善, 申硕. 登革热疫苗研发的主要障碍[J]. 中国生物制品学杂志, 2019, 32(1): 114-118. Wang WS, Shen S. Impediments to development of dengue fever vaccine[J]. Chin J Biol, 2019, 32(1): 114-118. DOI:10.13200/j.cnki.cjb.002454 |
| [5] |
邱星辉. 白纹伊蚊抗药性分子机制研究进展[J]. 寄生虫与医学昆虫学报, 2019, 26(3): 194-198. Qiu XH. Current knowledge about the molecular mechanisms underlying insecticide resistance in Aedes albopictus[J]. Acta Parasitol Med Entomol Sin, 2019, 26(3): 194-198. DOI:10.3969/j.issn.1005-0507.2019.03.009 |
| [6] |
张杰, 陆崇华, 姬淑红, 等. 上海市杨浦区白纹伊蚊幼虫对4种杀虫剂的抗性测定[J]. 中华卫生杀虫药械, 2019, 25(3): 289-290. Zhang J, Lu CH, Ji SH, et al. Resistance determination of Aedes albopictus larvae to four insecticides in Yangpu district of Shanghai city[J]. Chin J Hyg Insect Equip, 2019, 25(3): 289-290. DOI:10.19821/j.1671-2781.2019.03.026 |
| [7] |
开文龙. 白纹伊蚊杀虫剂敏感品系的纯化与应用[D]. 北京: 中国疾病预防控制中心, 2018. Kai WL. Application and purification of insecticide susceptible strain of Aedes albopictus[D]. Beijing: Chinese Center for Disease Control and Prevention, 2018. (in Chinese) |
| [8] |
师灿南, 开文龙, 刘起勇, 等. 景洪市登革热媒介伊蚊对吡丙醚的敏感性及其作用特点[J]. 中国媒介生物学及控制杂志, 2017, 28(2): 108-112. Shi CN, Kai WL, Liu QY, et al. Resistance and mortality pattern of dengue vectors exposed to pyriproxyfen in Jinghong city, Yunnan province[J]. Chin J Vector Biol Control, 2017, 28(2): 108-112. DOI:10.11853/j.issn.1003.8280.2017.02.003 |
| [9] |
徐建敏, 梁雪莹, 严子锵, 等. 白纹伊蚊对3种拟除虫菊酯类杀虫剂的抗药性调查[J]. 中华卫生杀虫药械, 2014, 20(5): 439-440, 443. Xu JM, Liang XY, Yan ZQ, et al. Resistance of Aedes albopictus to three pyrethroids insecticides[J]. Chin J Hyg Insect Equip, 2014, 20(5): 439-440, 443. DOI:10.19821/j.1671-2781.2014.05.014 |
| [10] |
余品红, 张华勋, 黄光全, 等. 嗜人按蚊分布区媒介按蚊对溴氰菊酯敏感性的监测[J]. 寄生虫与医学昆虫学报, 2003, 10(3): 152-156. Yu PH, Zhang HX, Huang GQ, et al. Surveillance of susceptibility of Anopheles vectors to deltamethrin in An. anthropophagous areas[J]. Acta Parasitol Med Entomol Sin, 2003, 10(3): 152-156. DOI:10.3969/j.issn.1005-0507.2003.03.005 |
| [11] |
赵春春, 朱彩英, 贾清臣, 等. 2017-2018年我国不同区域白纹伊蚊对常用杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2020, 31(2): 126-132. Zhao CC, Zhu CY, Jia QC, et al. Resistance of Aedes albopictus to commonly used insecticides in different areas of China, 2017-2018[J]. Chin J Vector Biol Control, 2020, 31(2): 126-132. DOI:10.11853/j.issn.1003.8280.2020.02.002 |
| [12] |
World Health Organization. Monitoring and managing insecticide resistance in Aedes mosquito populations interim guidance for entomologists[EB/OL]. (2016)[2021-11-11]. https://apps.who.int/iris/bitstream/handle/10665/204588/WHO_ZIKV_VC_16.1_eng.pdf.
|
| [13] |
刘斯璐, 崔峰, 燕帅国, 等. 中国媒介蚊虫对有机磷类和拟除虫菊酯类杀虫剂的抗性调查[J]. 中国媒介生物学及控制杂志, 2011, 22(2): 184-189. Liu SL, Cui F, Yan SG, et al. Investigation of organophosphate and pyrethroid resistance in vector mosquitoes in China[J]. Chin J Vector Biol Control, 2011, 22(2): 184-189. |
| [14] |
李春晓. 淡色库蚊对有机磷和氨基甲酸酯抗性相关基因的研究[D]. 北京: 中国人民解放军军事医学科学院, 2005. Li CX. Study on the genes responsible for organophosphate and carbamate resistance in Culex pipiens pallens[D]. Beijing: Academy of Military Medical Sciences, 2005. (in Chinese) |
| [15] |
Ishaaya I, Kontsedalov S, Horowitz AR. Biorational insecticides: mechanism and cross-resistance[J]. Arch Insect Biochem Physiol, 2005, 58(4): 192-199. DOI:10.1002/arch.20042 |
| [16] |
Shah RM, Abbas N, Shad SA, et al. Selection, resistance risk assessment, and reversion toward susceptibility of pyriproxyfen in Musca domestica L.[J]. Parasitol Res, 2015, 114(2): 487-494. DOI:10.1007/s00436-014-4206-0 |
| [17] |
徐仁权, 刘洪霞, 冷培恩, 等. 0.5%吡丙醚颗粒剂对白纹伊蚊控制效果的研究[J]. 中国媒介生物学及控制杂志, 2010, 21(4): 297-299. Xu RQ, Liu HX, Leng PE, et al. Effectiveness of 0.5% pyriproxyfen granules for Aedes albopictus control[J]. Chin J Vector Biol Control, 2010, 21(4): 297-299. |
 2022, Vol. 33
2022, Vol. 33


