扩展功能
文章信息
- 刘起勇
- LIU Qi-yong
- 2005-2020年我国媒介生物传染病报告病例:流行趋势、防控挑战及应对策略
- Reported cases of vector-borne diseases in China, 2005-2020: Epidemic trend, challenges in prevention and control, and related coping strategies
- 中国媒介生物学及控制杂志, 2022, 33(1): 1-7
- Chin J Vector Biol & Control, 2022, 33(1): 1-7
- 10.11853/j.issn.1003.8280.2022.01.001
-
文章历史
- 收稿日期: 2022-01-15
2 山东大学公共卫生学院媒介生物控制学系, 山东大学气候变化与健康研究中心, 山东 济南 250012
2 Department of Vector Control, Climate Changeand Health Center, School of Public Health, Shandong University, Ji'nan, Shandong 250012, China
媒介生物传染病(vector-borne diseases,VBDs)是由蚊、蚤、蜱、鼠等媒介生物传播的一类具有传染性的细菌、病毒或寄生虫病。根据世界卫生组织(WHO)“全球病媒控制对策2017-2030”,全球80%的人口处于1种或多种媒介生物传染病的风险中,17%的全球传染病负担是由媒介生物传染病造成的,每年有超过70万人死于媒介生物传染病[1]。我国蚊虫约21属400余种,蜱100余种,鼠、螨、钉螺等类群也有大量物种分布,这些都是传播疾病的重要媒介生物。气候变化、生态环境改变、跨境人口流动、全球化、城市化等自然和社会经济因素均可驱动媒介生物传染病的发生和传播[2]。作为传染病的重要组成部分,媒介生物传染病的总体风险和负担构成了严重的公共卫生挑战[3],引起了全球的广泛关注。近40年来,我国出现了莱姆病、人粒细胞无形体病(无形体病)、发热伴血小板减少综合征(SFTS)等新发媒介生物传染病,肾综合征出血热(HFRS)、登革热等疾病多次出现暴发流行,这些新发突发传染病可以影响我国的社会稳定、经济发展、民众健康甚至民族安危,需要引起高度重视[4]。我国媒介生物传染病多样性极高,包括10种法定报告传染病[甲类中的鼠疫,乙类中的HFRS、流行性乙型脑炎(乙脑)、登革热、钩端螺旋体病(钩体病)、血吸虫病、疟疾,丙类中的流行性和地方性斑疹伤寒、黑热病、丝虫病]、10种常见非法定报告传染病[恙虫病、发热伴血小板减少综合征(SFTS)、森林脑炎、新疆出血热(克里米亚-刚果出血热)、莱姆病、巴尔通体病、土拉菌病、埃立克体病、无形体病、基孔肯雅热],及其他大量被忽视、新发和未知媒介生物传染病,构成严重的公共卫生风险,造成了严重的疾病、经济和社会负担。为了掌握媒介生物传染病的流行特点和新趋势,本文汇总分析了2005-2020年中国大陆媒介生物传染病报告病例等数据,探索控制差距和挑战,为其精准预防控制决策和实践提供科学依据。
1 材料与方法 1.1 资料来源本文的病例数据来自中国疾病预防控制信息系统传染病监测系统,主要信息包括发病数、死亡数、性别和年龄,并通过中国疾病预防控制信息系统疾病预防控制综合管理系统收集研究期内我国人口数据。
1.2 方法使用Excel 2019软件建立数据库并对数据进行整理汇总,应用ArcGIS 10.2软件绘制疾病空间分布图。应用描述性流行病学研究方法分析我国2005-2020年媒介生物传染病报告病例数据。基于我国媒介生物传染病报告发病及死亡病例趋势,结合自然及社会风险因素分析,参考当前我国媒介生物传染病防控策略及国内外文献[1-3],对不同流行形势的媒介生物传染病防控策略及措施提出针对性建议。
2 结果 2.1 全国媒介生物传染病概述2005-2020年全国报告媒介生物传染病共14种(图 1),其中恙虫病自2006年开始上报、SFTS自2010年开始上报、寨卡病毒病自2016年开始上报。这16年间累计报告媒介生物传染病905 092例,其中疟疾、恙虫病和HFRS的病例数占66.94%,分别为224 057、197 088和184 743例,丝虫病、寨卡病毒病和鼠疫的病例数较少,分别为18、25和50例。2005-2020年共报告死亡病例5 076例,病死率为0.56%。其中乙脑、HFRS、SFTS以及疟疾的死亡病例数占93.26%。
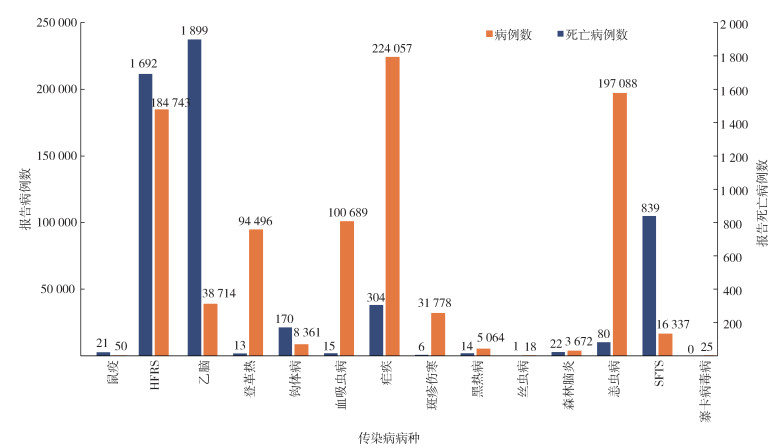
|
| 注:HFRS表示肾综合征出血热;SFTS表示发热伴血小板减少综合征;乙脑流行性乙型脑炎;钩体病钩端螺旋体病。 图 1 2005-2020年全国媒介生物传染病报告病例数及报告死亡病例数 Figure 1 Reported cases and deaths of vector-borne diseases in China from 2005 to 2020 |
| |
2005-2020年间,全国媒介生物传染病发病呈波动下降趋势。在2006和2014-2015年报告发病数出现2个明显高峰(图 2、3)。2006年出现疟疾暴发,病例数达60 382例(占当年全部媒介生物传染病病例数的64.59%)。2014年出现登革热暴发,病例数达46 863例(占53.76%)。2015年出现血吸虫病暴发,病例数达44 060例(占52.37%)。经Mann-Kendall趋势检验,乙脑、丝虫病、鼠疫、疟疾、黑热病、斑疹伤寒、HFRS、钩体病和寨卡病毒病的发病率均呈下降趋势,其中乙脑、疟疾、斑疹伤寒和钩体病的发病率下降趋势明显,差异有统计学意义(P < 0.01)。SFTS、登革热、恙虫病、血吸虫病和森林脑炎的发病率呈上升趋势,SFTS和恙虫病的上升趋势明显,差异亦有统计学意义(P < 0.01)。另外,媒介生物传染病的发生受季节影响明显。蚊传疾病6月进入高流行季节,发病高峰期为8-10月,10月达峰值后迅速下降。鼠传疾病发病呈现双峰现象,5、6月为春夏小高峰,11、12月出现秋冬大高峰。蜱传疾病5-8月为高流行期,在6、7月出现高峰。其他媒介生物传染病6-11月进入高流行期,10月达峰值后持续到11月,然后迅速下降。见图 4。
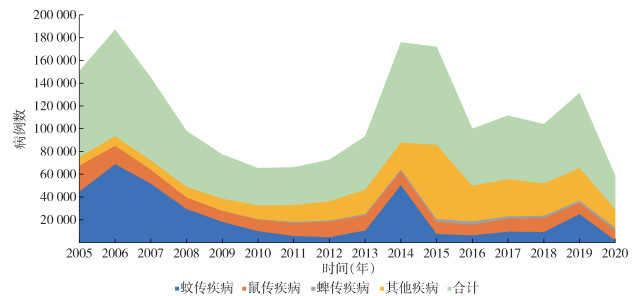
|
| 图 2 2005-2020年全国不同媒介生物传染病时间分布 Figure 2 Temporal distribution of different vector-borne diseases reported in China, 2005-2020 |
| |
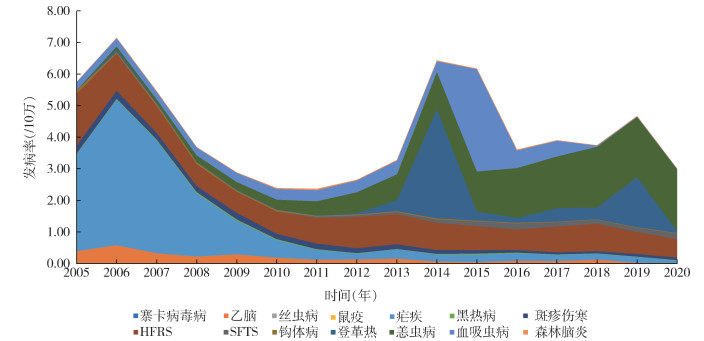
|
| 注:HFRS表示肾综合征出血热;SFTS表示发热伴血小板减少综合征;乙脑流行性乙型脑炎;钩体病钩端螺旋体病。 图 3 2005-2020年全国媒介生物传染病报告发病率 Figure 3 Morbidity of vector-borne diseases reported in China, 2005-2020 |
| |
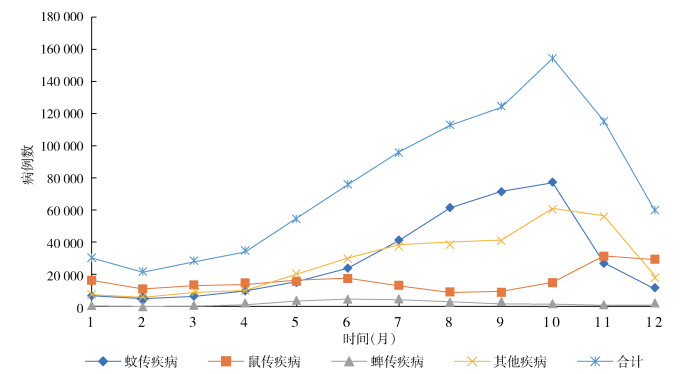
|
| 图 4 2005-2020年全国媒介生物传染病月报告病例数 Figure 4 Reported cases of vector-borne diseases in different months in China, 2005-2020 |
| |
2005-2020年间,全国媒介生物传染病年均病例报告区(县)约2 165个。其中2018年报告区(县)最多,为2 349个,2020年报告区(县)最少,为1 960个。经Mann-Kendall趋势检验,病例报告区(县)数呈上升趋势,但差异无统计学意义(P=0.367)。病例主要分布在黑河-腾冲线以东(图 5)。其中东北地区报告的主要疾病有森林脑炎、HFRS和SFTS等,以蜱传或鼠传疾病为主;华中及华东地区报告的主要疾病有疟疾、乙脑、血吸虫病、SFTS等,以蚊传、螺传或蜱传疾病为主;华南及西南地区报告的主要疾病有乙脑、恙虫病、登革热、钩体病和斑疹伤寒等,以蚊传或其他媒介生物传染病为主;云南和广东省媒介生物传染病种类最多。见图 6。
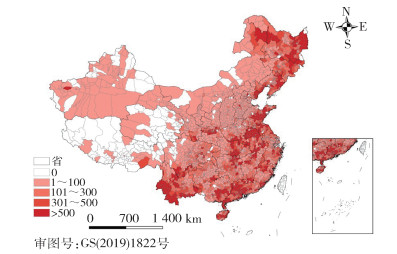
|
| 图 5 2005-2020年全国媒介生物传染病报告病例空间分布 Figure 5 Spatial distribution of reported cases of vector-borne diseases in China, 2005-2020 |
| |
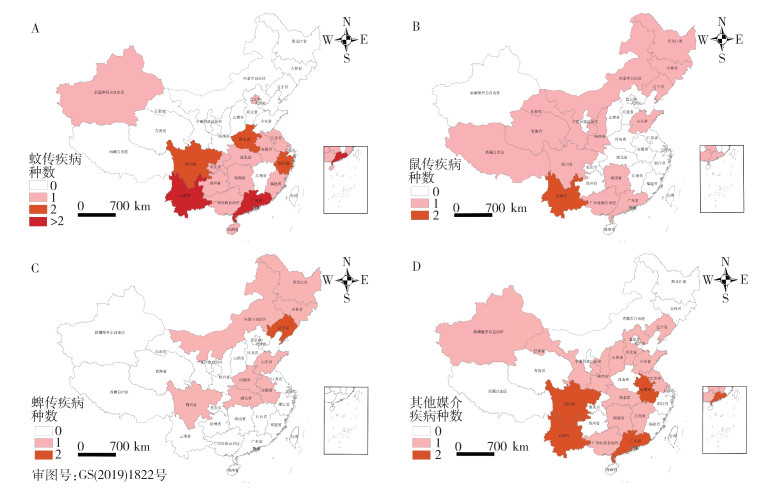
|
| 注:A蚊传疾病;B鼠传疾病;C蜱传疾病;D其他疾病。 图 6 2005-2020年全国不同媒介生物传染病空间分布 Figure 6 Spatial distribution of differernt vector-borne diseases in China, 2005-2020 |
| |
乙脑、森林脑炎以及血吸虫病报告病例中男性高于女性,发病高峰分别在20岁以下(80.64%)、20~59岁(85.08%)以及45~49岁(44.17%);黑热病发病男性(62.14%)高于女性(37.86%),病例数随年龄升高而减少;恙虫病及SFTS发病女性高于男性,且随年龄增高病例数增加;斑疹伤寒病例中女性(50.70%)略高于男性(49.30%),主要发病年龄在45岁以下(66.28%);鼠疫、HFRS、登革热、钩体病、疟疾以及寨卡病毒病报告病例中男性占比均高于女性,发病高峰在20~44岁。总体来看,媒介生物传染病的发病高峰年龄段在20~44岁(35.12%),且男性占比较高(61.44%)。见表 1。
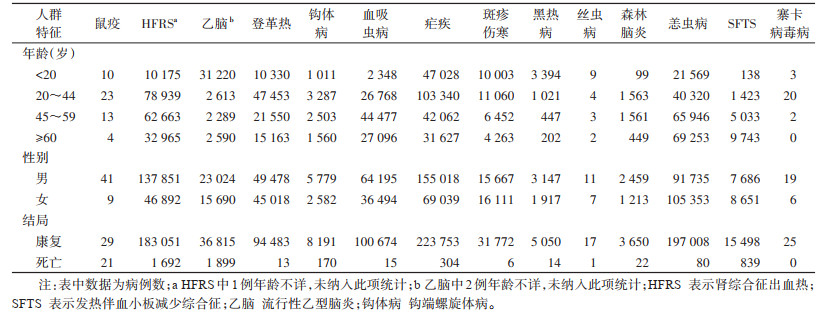
|
媒介生物传染病是我国传染病的重要组成部分[5]。针对全国媒介生物传染病全面、系统的分析研究少见报道。本文仅对我国传染病报告系统中14种媒介生物传染病做了分析,同期发生的黄热病、基孔肯亚热、裂谷热、非洲昏睡病等输入性、散发媒介生物传染病,莱姆病、巴尔通体病、斑点热、新疆出血热等本地散发传染病,因尚未纳入传染病报告系统、没有病例数据,未能做分析研究。另外,新型冠状病毒肺炎(新冠肺炎)防控对2020年媒介生物传染病发病应有抑制作用,对登革热及媒介生物传染病总体趋势的影响,尚待进一步研究。2005-2020年间,随着我国消除疟疾工作的推进,疟疾的发病率显著下降。2017-2020年,我国已经连续4年无本土原发疟疾病例报告。2015年,血吸虫病出现发病高峰,2016-2020年发病率呈明显的下降趋势,我国血吸虫病防治工作取得了显著成效,将流行程度降至历史最低水平[6]。恙虫病、登革热、HFRS是我国主要的媒介生物传染病,发病率较高。自2006年恙虫病开始上报以来,其发病率逐年上升,发病区域不断扩大[7],病例高发区主要集中在广东和云南省,并且存在由南向北扩张的趋势。近年来,登革热的暴发日趋频繁,利用不同典型浓度路径(RCP)情景进行预估,所有RCP情景下未来我国登革热的流行风险区均显著北扩,风险人口显著增加[8]。此外,乙脑、SFTS和HFRS造成了严重的死亡负担。近年来乙脑的流行特征发生了变化,成人发病率和病死率均高于儿童,中国西北地区已成为乙脑流行的新发地区[9]。SFTS自2010年上报以来,发病率呈上升趋势,流行区不断扩张,且病死率较高,政府、卫生部门和公众应给予更多关注。HFRS是一种较为严重的传染病,近年来发病率居较高水平,且发病多为青壮年农民,造成了严重的疾病负担。鼠疫、黑热病、钩体病等虽然呈局部散发状态,但也存在暴发风险,应加强监控。
媒介生物传染病在很大程度上受季节和地理因素影响,不同媒介生物传染病的流行具有不同的时空格局。例如,乙脑和钩体病在7-9月流行,8月达到高峰。登革热、斑疹伤寒和恙虫病病例多发生在7-11月,而HFRS在5和11月出现2个高峰。广东、云南省等地区存在多种媒介生物传染病,登革热、恙虫病、乙脑等构成了多重威胁。气候、生态环境、土地利用等自然因素变化也会影响媒介生物传染病宿主和病媒生物的种群数量和分布[10],造成新的流行风险。
3.2 防控挑战我国政府始终将健康放在社会发展的优先战略地位,高度重视媒介生物传染病的防控工作。经过长期不懈的努力,我国于2007年消除了淋巴丝虫病,2021年6月30日通过了WHO消除疟疾认证;血吸虫病发病率逐年下降并向2030年消除目标不断迈进;鼠疫、新疆出血热等媒介生物传染病长期控制在接近消除的水平。然而,近年来气候变化、全球化、城市化等多维因素对我国媒介生物传染病发病率贡献增加,尤其是恙虫病、登革热、SFTS等发病风险明显增加,但目前对该类传染病的控制力度尚难以抵消多种风险因素增加构成的传病风险增加。WHO“全球病媒控制对策2017-2030”提出,到2020年全球媒介生物传染病发病率下降至少25%、死亡率下降至少30%的控制目标(以2016年为基线)[1]。本研究发现,我国14种媒介生物传染病报告发病率下降了16.71%;受SFTS、钩体病等死亡率上升的影响,媒介生物传染病总体死亡率不降反增7.14%;我国的媒介生物传染病防控同WHO提出的2020年防控目标尚存较大差距。此外,未来在新冠肺炎疫情后,受国际交流增加及气候变化双重作用影响,我国将面临新发和再发及输入和本地媒介生物传染病“双重风险和负担”[3],防控工作将面临更严峻的“防反弹”挑战。
3.3 应对策略为有效应对上述媒介生物传染病流行及防控的挑战,我国媒介生物传染病防控应采取分类指导、分层可持续精准控制策略。首先,为巩固已消除媒介生物传染病成果,需防控疟疾等输入引起本地再传播流行[11],务必继续做好我国境内媒介按蚊可持续控制,积极加入全球消除疟疾行动,分享中国疟疾媒介按蚊分层、可持续控制策略和实践经验[12]。针对已经纳入《“健康中国2030”规划纲要》消除目标的血吸虫病,在其流行区坚持以控制传染源为主的钉螺综合治理的防控策略。针对恙虫病、SFTS、登革热等近年来发病上升快的媒介生物传染病,以及鼠疫等再度活跃的媒介生物传染病,需采取加强健康教育、媒介生物可持续控制等综合性防控措施,以遏制上升势头,降低暴发风险。针对乙脑、HFRS等媒介生物传染病,可通过扩大疫苗接种、强化媒介生物控制以达到有效防控的目的。对于近年来国外输入我国的媒介生物传染病,如黄热病、裂谷热、寨卡病毒病、锥虫病等,应切实加强出入境人员的健康管理;对于本地存在发病风险的基孔肯雅热、莱姆病、无形体病等,以及一些新发、再发虫媒病毒[13]及相关传染病[10, 14],应持续加强病例和媒介生物监测预警,采取综合性防控策略。
第70届世界卫生大会通过“全球病媒控制对策2017-2030”,号召通过适合当地情况的有效和可持续病媒控制来减少媒介生物传染病疾病负担和威胁,努力创建一个没有媒介生物传染病危害的世界。我国要遵循《中华人民共和国传染病防治法》《突发公共卫生事件应急条例》和《病媒生物预防控制管理规定》等相关法规,依法、科学、规范防控媒介生物传染病。要落实《“健康中国2030”规划纲要》,深入开展爱国卫生运动,实施环境治理为主的病媒生物综合治理,努力消除媒介生物传染病环境危险因素,加强媒介生物可持续精准控制,有效防范媒介生物传染病风险。目前正在制定的《国家适应气候变化战略2035》,也将气候敏感媒介生物传染病纳入防控规划,加强媒介生物监测预警和控制。我国政府已加强了对媒介生物监测和能力建设的经费投入,财政部和国家卫生健康委员会从2021年开始将病媒生物监测列入重大传染病防控项目。然而,未来我国媒介生物传染病将面临更为复杂且长久的风险因素,需不断增加人力、财力和物力投入,加强监测预警,做好发病前期的“三早”预防,确保媒介生物传染病可持续控制,减少及延缓发病及并发症,保障公共卫生安全和人民健康福祉。
综上所述,我国近年来媒介生物传染病报告发病总体呈波动下降趋势,但仍处于较高水平,且流行区还在扩张,恙虫病、SFTS、登革热等少数病种发病数上升、扩张较快。针对媒介生物传染病防控新挑战,应切实落实分类指导及媒介生物可持续精准控制等策略和措施,进一步降低媒介生物传染病发病率、死亡率,努力实现健康中国和全球病媒控制对策阶段性目标和总体目标,创建无媒介生物传染病危害的国家。
利益冲突 无
| [1] |
World Health Organization. Global vector control response 2017-2030: A strategic approach to tackle vector-borne diseases[R]. Geneva: WHO, 2017.
|
| [2] |
刘起勇. 气候变化对中国媒介生物传染病的影响及应对: 重大研究发现及未来研究建议[J]. 中国媒介生物学及控制杂志, 2021, 32(1): 1-11. Liu QY. Impact of climate change on vector-borne diseases and related response strategies in China: Major research findings and recommendations for future research[J]. Chin J Vect Biol Control, 2021, 32(1): 1-11. DOI:10.11853/j.issn.1003.8280.2021.01.001 |
| [3] |
刘起勇. 新时代媒介生物传染病形势及防控对策[J]. 中国媒介生物学及控制杂志, 2019, 30(1): 1-6, 11. Liu QY. Epidemic profile of vector-borne diseases and vector control strategies in the new era[J]. Chin J Vect Biol Control, 2019, 30(1): 1-6, 11. DOI:10.11853/j.issn.1003.8280.2019.01.001 |
| [4] |
徐建国. 未来传染病[J]. 首都公共卫生, 2016, 10(1): 5-6. Xu JG. Future infectious diseases[J]. Cap J Public Health, 2016, 10(1): 5-6. DOI:10.16760/j.cnki.sdggws.2016.01.002 |
| [5] |
Liu QY, Gao Y. Reported vector-borne diseases-China, 2018[J]. China CDC Weekly, 2020, 2(14): 219-224. DOI:10.46234/ccdcw2020.057 |
| [6] |
陈琳, 曹淳力, 刘阳, 等. 迈向消除阶段我国血吸虫病突发疫情应急响应[J/OL]. 中国血吸虫病防治杂志, 2022, 33: 1-5 [2022-01-12]. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CAPJLAST&filename=XXCB20220111000. Chen L, Cao CL, Liu Y, et al. Emergency responses to schistosomiasis outbreak during the stage moving towards elimination in China[J/OL]. Chin J Schisto Control, 2022, 33: 1-5 [2022-01-12]. https://kns.cnki.net/KCMS/detail/detail.aspx?dbcode=CJFQ&dbname=CAPJLAST&filename=XXCB20220111000. (in Chinese) |
| [7] |
Yue YJ, Ren DS, Liu XB, et al. Spatio-temporal patterns of scrub typhus in mainland China, 2006-2017[J]. PLoS Negl Trop Dis, 2019, 13(12): e0007916. DOI:10.1371/journal.pntd.0007916 |
| [8] |
刘起勇. 我国登革热流行新趋势、防控挑战及策略分析[J]. 中国媒介生物学及控制杂志, 2020, 31(1): 1-6. Liu QY. Dengue fever in China: new epidemical trend, challenges and strategies for prevention and control[J]. Chin J Vect Biol Control, 2020, 31(1): 1-6. DOI:10.11853/j.issn.1003.8280.2020.01.001 |
| [9] |
吴丹, 尹遵栋, 李军宏, 等. 中国2014-2018年流行性乙型脑炎流行病学特征[J]. 中国疫苗和免疫, 2020, 26(1): 1-4. Wu D, Yin ZD, Li JH, et al. Epidemiology of Japanese encephalitis in China, 2014-2018[J]. Chin J Vaccin Immun, 2020, 26(1): 1-4. |
| [10] |
Liu QY, Xu WB, Lu S, et al. Landscape of emerging and re-emerging infectious diseases in China: Impact of ecology, climate, and behavior[J]. Front Med, 2018, 12(1): 3-22. DOI:10.1007/s11684-017-0605-9 |
| [11] |
Cao J, Newby G, Cotter C, et al. Achieving malaria elimination in China[J]. Lancet Public Health, 2021, 6(12): E871-872. DOI:10.1016/S2468-2667(21)00201-2 |
| [12] |
刘起勇, 刘小波. 中国消除疟疾媒介按蚊控制策略和技术[J]. 中国媒介生物学及控制杂志, 2021, 32(5): 513-518. Liu QY, Liu XB. Anopheles vector control strategy and technology for eliminating the malaria in China[J]. Chin J Vect Biol Control, 2021, 32(5): 513-518. DOI:10.11853/j.issn.1003.8280.2021.05.002 |
| [13] |
Atoni E, Zhao L, Hu C, et al. A dataset of distribution and diversity of mosquito-associated viruses and their mosquito vectors in China[J]. Sci Data, 2020, 7(1): 342. DOI:10.1038/s41597-020-00687-9 |
| [14] |
梁国栋. 虫媒病毒: 重要的被忽略的热带传染病病原体[J]. 中国热带医学, 2018, 18(1): 1-5. Liang GD. Arbovirus: The very important pathogen of neglected tropical infectious disease in the world[J]. China Trop Med, 2018, 18(1): 1-5. DOI:10.13604/j.cnki.46-1064/r.2018.01 |
 2022, Vol. 33
2022, Vol. 33

