扩展功能
文章信息
- 王艳华, 孙英伟, 毛玲玲, 王子江, 张家勇, 张稷博, 彭遥, 夏连续
- WANG Yan-hua, SUN Ying-wei, MAO Ling-ling, WANG Zi-jiang, ZHANG Jia-yong, ZHANG Ji-bo, PENG Yao, XIA Lian-xu
- 我国部分地区蜱体弗朗西斯菌属和弗类共生体的检测研究
- Detection of Francisella strains and Francisella-like endosymbionts in ticks in some regions of China
- 中国媒介生物学及控制杂志, 2021, 32(6): 756-762
- Chin J Vector Biol & Control, 2021, 32(6): 756-762
- 10.11853/j.issn.1003.8280.2021.06.020
-
文章历史
- 收稿日期: 2021-07-05
2 辽宁省疾病预防控制中心, 辽宁 沈阳 110005
2 Liaoning Center for Disease Control and Prevention, Shenyang, Liaoning 110005, China
弗朗西斯菌属(Francisella)包括两个种:一个为土拉弗朗西斯菌(Francisella tularensis,简称土拉菌),另一个为Fr. philomiragia,这2个种16S rRNA序列的相似性大于98.30%。土拉菌属于胞内寄生的球杆菌,可以使人和多种动物如野兔、鼠类,羊、牛、猪畜类等发生土拉热,俗称“野兔热”,该传染病能够在人类和家畜中广泛地流行。土拉菌是人类医学史上已知的烈性病原体之一。由于它有很强的传染性,在空气中相对稳定,所以是一种潜在的生物恐怖战剂。美国疾病预防控制中心(CDC)把土拉菌和鼠疫耶尔森菌、炭疽杆菌一同归为A类生物恐怖战剂。
和弗朗西斯菌属具有较高同源性、同属于弗朗西斯菌科的另一成员是弗朗西斯菌属(类)内共生体(Francisella-like endosymbionts),简称弗类共生体。它在硬蜱属(Ixodes)、花蜱属(Amblyomma)、革蜱属(Dermacentor)和钝缘蜱属(Ornithodoros)中均有广泛分布[1],目前认为弗类共生体对人类无致病性。但是,由于它和弗朗西斯菌属的同源性较高,所以在实验室检测时能够正确区分两种微生物,对于正确评估弗朗西斯菌属对人类健康的影响非常重要。关于弗类共生体在长角血蜱(Haemaphysalis longicornis)中的分布情况,目前在我国还未见报道。鉴于此,本研究组在我国东北、西北和中南地区各选取采样点,对蜱进行了弗朗西斯菌属的16S rRNA和tul4检测及系统进化研究。
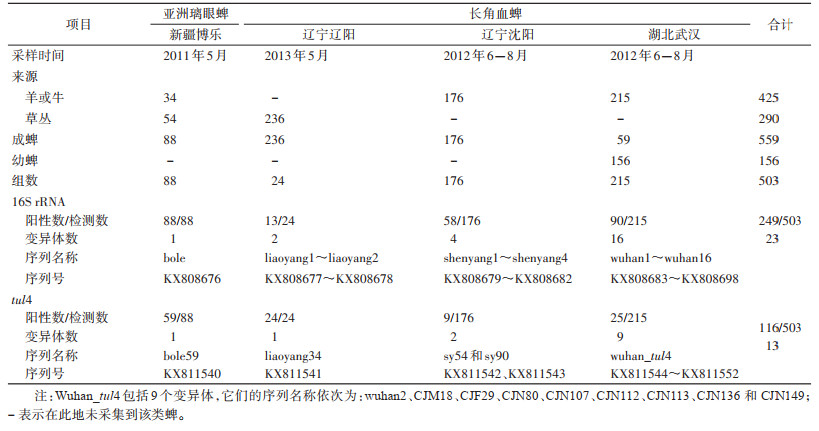
1 材料与方法 1.1 蜱类样本本研究组在我国东北、西北和中南地区,分别选取辽宁省、新疆维吾尔自治区(新疆)和湖北省作为采样点。各地采样时间见表 1。
|
将辽阳市236只长角血蜱,9~10只蜱分成1组,共24组。在核酸提取时,以1个组作为1个提取单位。其余3个城市均是每只蜱作为1个提取单位。将每个提取单位用磷酸盐缓冲液洗涤2次,再加入含有蛋白酶K的裂解液0.5 ml,用研磨棒研磨成匀浆。将所有匀浆在4 ℃下放置1 h后,2 500×g离心5 min,收集上清液用于提取DNA,按照QIAGEN组织提取试剂盒说明书操作步骤进行,核酸放置在-80 ℃冰箱保存。所有样本的分离物经鉴定,均未见土拉菌。
1.3 PCR扩增在已有文献[2-3]的基础上,对弗朗西斯菌属16S rRNA引物进行优化,正向引物:Ft16S-F:5′-TAC CAG TTG GAA ACG RCT GT-3′,反向引物:Ft16S-R:5′-TGC GGG ACT TAA CCC AAC AT-3′,扩增片段长度为949 bp。反应体系总体积为20 μl,包括2×EasyTaq Supermix 10 μl,正、反向引物各0.6 μl,模板8.8 μl。反应条件:95 ℃5 min;95 ℃ 1 min,59 ℃1 min,72 ℃1 min,共30个循环;72 ℃ 10 min。以土拉菌疫苗株(LVS)核酸作为阳性对照,无菌去离子水作为阴性对照。对于所有提取的核酸,均进行16S rRNA的巢式PCR。用德国Sensoquest LabCycler PCR扩增仪,PCR产物用1.5%的琼脂糖凝胶,100 V电泳30 min,观察是否有目的基因片段。另外,对于所有提取的核酸,采用引物FT393/FT642[4],又进行了编码相对分子质量17 000脂蛋白的tul4基因的巢式PCR,扩增的片段长度为250 bp。
1.4 测序及序列比对将有目的基因片段的产物,送北京天一辉远生物科技有限公司进行双向测序和拼接,得到完整的序列。本研究测序所得的核酸序列已提交给GenBank数据库,序列号为KX808676~KX808679、KX811540~KX811542和KX811545。将所有序列在http://www.ncbi.nlm.nih.gov/BLAST网站用BLAST进行比对,以期获得同源性最高的微生物种类。
1.5 系统进化分析首先,在GenBank网站通过BLASTn程序下载弗朗西斯菌属核酸序列,建立参考数据库。然后,本研究测序得到的所有16S rRNA、tul4序列和参考数据库,利用MEGA 6.0软件[5]的Clustal W进行序列比对,采用邻接法对进化史进行推导。每个节点的评估采用100次引导替换,引导值> 50的在节点处标出。
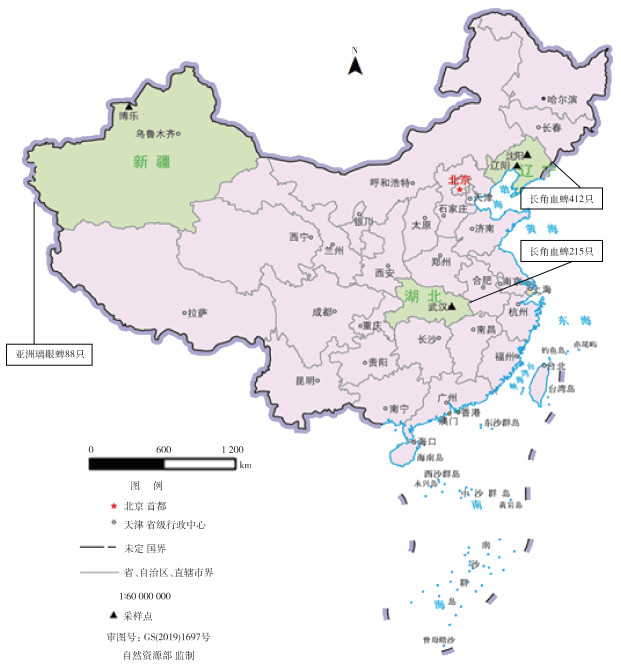
2 结果 2.1 蜱种鉴定从辽宁省沈阳和辽阳市,新疆博乐市和湖北省武汉市,采获蜱数量分别为176、236、88和215只,共计715只。经过形态学鉴定和线粒体18S、12S rDNA分子生物鉴定,鉴定出长角血蜱627只和亚洲璃眼蜱(Hyalomma asiaticum)88只。3个采样省及市的地理位置、采蜱的名称和数量见图 1。采获蜱中成蜱559只,占78.18%,幼蜱156只,占21.82%,其中来自羊或牛425只,来自草丛290只。见表 1。
|
| 图 1 3个采样点的地理位置、采蜱的名称和数量 Figure 1 Location of 3 sampling sites and name and number of collected ticks |
| |
两个蜱种进行了弗朗西斯菌16S rRNA基因的503次检测,包括479个单蜱和24个组蜱。其中,博乐市的88只亚洲璃眼蜱均显示阳性,携带率为100%(88/88)。而且具有一致的序列,命名为bole(GenBank accession no. KX808676)。辽阳市的24组长角血蜱中有13组为阳性,携带率为54.17%。具有2个变异体,分别命名为liaoyang1(序列号KX808677)和liaoyang2(序列号KX808678)。沈阳市的176只长角血蜱中58只为阳性,携带率为32.95%(58/176)。具有4个变异体,分别命名为shenyang1~shenyang4(序列号KX808679~KX808682)。武汉市的215只长角血蜱中90只为阳性,携带率为41.86%(90/215)。具有16个变异体,分别命名为wuhan1~wuhan16(序列号KX808683~KX808698)。见表 1。
2.3 弗朗西斯菌属tul4的检测两个蜱种进行了tul4基因的503次检测,包括479只单蜱和24个组蜱。其中博乐市的88只亚洲璃眼蜱中,59只显示阳性,且具有一致的序列,命名为bole59(序列号KX811540)。来自辽阳市的24组长角血蜱均为阳性,且具有一致的序列,命名为liaoyang34(序列号KX811541)。沈阳市176只长角血蜱中仅有9只为阳性,同时16S rRNA基因也为阳性。这9只阳性的长角血蜱具有2个变异体,分别命名为sy54和sy90(序列号KX811542和KX811543)。武汉市的215只长角血蜱中25只为阳性,同时16S rRNA基因也为阳性。这25只阳性的长角血蜱具有9个变异体,分别命名为wuhan2、CJM18、CJF29、CJN80、CJN107、CJN112、CJN113、CJN136和CJN149(序列号KX811544~KX811552)。见表 1。
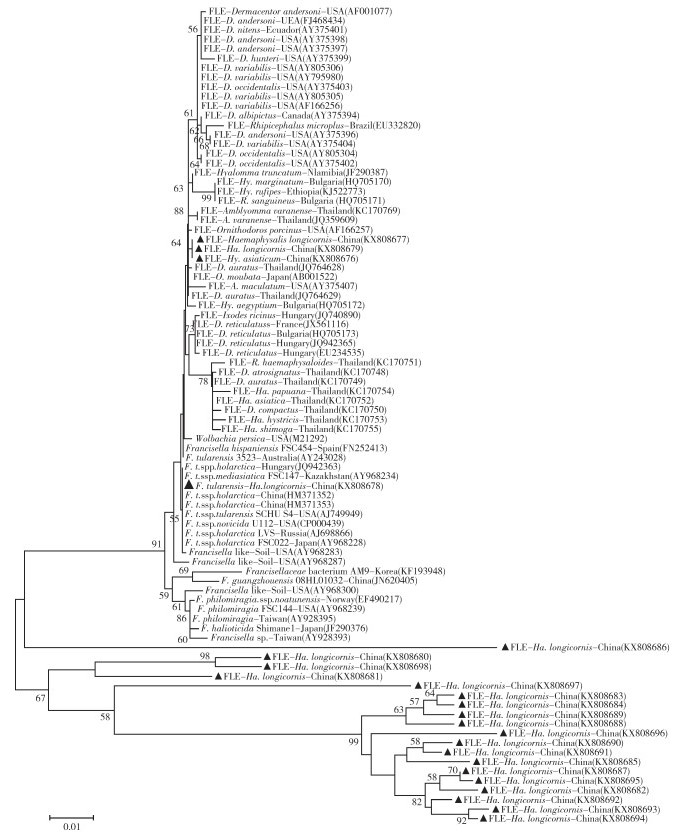
2.4 16S rRNA的系统进化分析为了研究土拉菌和弗类共生体在我国东北、西北和中南部地区的分布情况,以16S rRNA序列为基础,构建了中国和世界其他国家的弗朗西斯菌属及弗类共生体的进化树(图 2)。在图 2的中部可见,来自于辽阳长角血蜱的KX808678(即liaoyang2),和弗朗西斯菌属聚集在一起,前期我们的研究已证明liaoyang2是土拉菌B型[6],在辽阳长角血蜱中的携带率是2.12%(5/236)。本研究采集蜱的检测结果显示,大多数携带的是弗类共生体。来自中国的弗类共生体表现出高度的多样性,而且都是单独聚在同一个分支上,和其他国家均无交集。在图 2的上1/3处可见,KX808677、KX808679和KX808676聚在一个独立的分支上。在图 2的下部可见,从KX808686到KX808694,中国共有19个弗类共生体序列,与弗朗西斯菌属和其他弗类共生体完全分开。除了KX808686外,在节点值67的位置,其他18个弗类共生体形成一个单独的中国特有的谱系。
|
| 注:▲表示本研究采获蜱得到的16S rRNA序列。 图 2 弗朗西丝菌属、弗类共生体和蜱样本基于16S rRNA序列的系统进化分析 Figure 2 16S rRNA sequence-based phylogenic tree of Francisella strains, Francisella-like endosymbionts, and tick samples |
| |
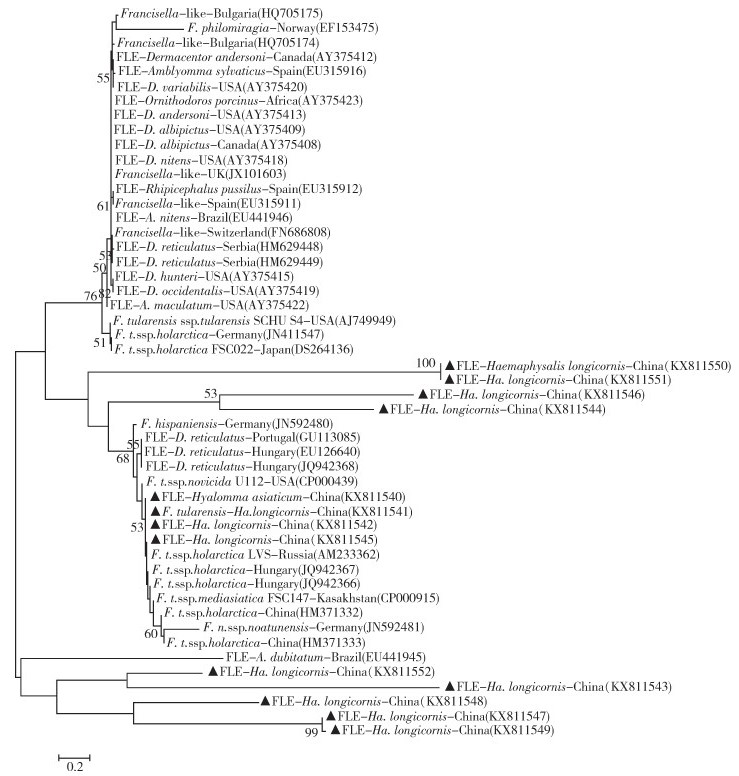
以tul4基因为基础,将本研究采集蜱得到的信息和公共数据库平台的弗朗西斯菌属、弗类共生体,共同构建了系统进化树(图 3)。图的中部和下部可见,来自中国蜱的tul4序列具有明显的谱系特征。武汉市长角血蜱的KX811550和KX811551具有完全一致的序列,聚在节点值100的分支上;来自武汉市长角血蜱的另外两个序列KX811546和KX811544,聚在节点值53的分支上。令人疑惑的是,来自辽阳市长角血蜱的土拉菌KX811541和3个弗类共生体聚在节点值53的分支上,包括博乐市亚洲璃眼蜱的KX811540、沈阳市长角血蜱的KX811542和武汉市长角血蜱的KX811545。图 3的下部可见,5个中国弗类共生体形成了单独的谱系,包括沈阳市长角血蜱的KX811543、武汉市长角血蜱的KX811547~KX811549和KX811552,和巴西双板花蜱(A. dubitatum)的EU441945有近缘关系。
|
| 注:▲表示本研究采集蜱得到的tul4序列。 图 3 弗朗西丝菌属、弗类共生体和蜱样本基于tul4序列的系统进化分析 Figure 3 Tul4 sequence-based phylogenic tree of Francisella strains, Francisella-like endosymbionts, and tick samples |
| |
本研究从我国东北、西北和中南地区,分别选取辽宁省、湖北省和新疆作为采样点,共采集627只长角血蜱和88只亚洲璃眼蜱。研究发现,辽宁省辽阳市5个组的长角血蜱含有土拉菌,由此可得最小带菌率为2.12%(5/236)。另外,从辽阳、沈阳和武汉市的长角血蜱,以及博乐市的亚洲璃眼蜱中,均检测到弗类共生体,携带率分别为3.39%(8/236)、32.95%(58/176)、41.86%(90/215)和100%(88/88)。
本研究中,在辽阳市弗朗西斯菌属阳性的长角血蜱中,有5个16S rRNA序列和土拉菌聚在一起。同样,它们的tul4基因序列也是阳性,这再一次证实了这5组长角血蜱携带土拉菌[6]。目前,国内有3篇检测长角血蜱和其他蜱种是否含有土拉菌的报道。1篇报道是在中国南方、中部和北方采集的蜱中,检测了包括土拉菌在内的8种病原体。结果在长角血蜱中检测出卡罗林疏螺旋体(Borrelia carolinensis)和比塞提疏螺旋体(B. bissettii),却未检测到土拉菌[7]。Zhang等[8]在中国自然环境中的森林革蜱(D. silvarum)和全沟硬蜱(I. persulcatus)中,检测出土拉菌,并得出平均流行率为1.98%。郑龙[9]采集了陕西省1 117只蜱标本,从达吉斯坦革蜱(D. daghestanieus)、日本血蜱(Ha. japonica)和嗜群血蜱(Ha. concinna)中检测出25只为土拉菌阳性,总阳性率为2.24%。一项采用batch learning self-organizing maps(BLSOM)分析的日本研究,在7个蜱种中检测无浆体(Anaplasma)、巴尔通体(Bartonella)、疏螺旋体、埃立克体(Ehrlichia)、弗朗西斯菌属和立克次体(Rickettsia)。结果在卵形硬蜱(I. ovatus)、全沟硬蜱、蓖麻硬蜱(I. ricinus)和A. testudinarium中,发现携带弗朗西斯菌属,而在长角血蜱、A. variegatum和台湾血蜱(Ha. formosensis)中均未检测到[10]。由此可知,本研究在中国辽宁省辽阳市首次从长角血蜱中检测到土拉菌。提示在这一区域工作的卫生部门和兽医工作者需要注意土拉热的发生。
弗类共生体在蜱中的分布和流行,以及对于土拉热传播的影响作用还是知之甚少,目前仅有几篇报道[11-13]。本研究发现在我国西北、中南部和东北地区的长角血蜱和亚洲璃眼蜱中,弗类共生体均有较高的感染率。16S rRNA聚类图显示,来自辽阳和沈阳市的弗类共生体,与来自博乐市的亚洲璃眼蜱具有完全一致的序列。这说明在两种蜱中可能存在相同的弗类共生体。有人提出宿主的种类和某种弗类共生体的进化有连锁关系,但是本研究的结果与该学说观点不符。另外,从地理位置上看,同一种弗类共生体分别来自两个相距较远的区域,即东北的辽宁省和西北的新疆。这提示,这种弗类共生体更适应于较冷环境中生活的蜱。除了1个来自武汉市长角血蜱的弗类共生体外,其他来自中国的18个弗类共生体,在节点值67的位置形成一个单独的中国特有谱系。国内有一些学者,也开展过长角血蜱携带病原体的研究[14-16],但是在筛检对象里均未包括土拉菌。另有研究,在我国钝刺血蜱(Ha. doenitzi)中检测出弗类共生体[17]。尹小平等[1]从中哈边境的243只游离亚洲璃眼蜱中,检测到35只含有弗类共生体,阳性率为14.40%。本研究也在游离亚洲璃眼蜱中检测到弗类共生体,阳性率高达100%。另外,本研究在我国长角血蜱中首次检测到弗类共生体。以上这些信息,将会为今后蜱传病原体的研究提供基础资料。
在以tul4基因为基础的进化树上,bole59、liaoyang34、CJM18、SY54和土拉菌聚在一起。由于来自辽阳市的24组长角血蜱具有一致的tul4序列,统一命名为liaoyang34。但是在16S rRNA序列检测时,这24组长角血蜱中仅有5组为阳性,其余19组和bole59、CJM18、SY54均为阴性,因而bole59、CJM18和SY54属于弗类共生体。另外,在tul4基因聚类图节点值51的分支上,SCHU S4、FSC022和德国土拉菌JN411547,与已知其他国家的弗类共生体聚在一起。因此,仅仅通过tul4基因序列来区分土拉菌和弗类共生体,容易导致判断错误。一项研究在检测保加利亚蜱时,12只16S rRNA检测为阳性的蜱中仅有6只蜱tul4检测为阳性[18-19]。另外,两种不同的tul4基因标准方法,在革蜱中检测是否含有弗类共生体已显示产生交叉反应[20-21]。应建立一种更精准识别弗类共生体的分子生物学方法。无论是基于16S rRNA还是tul4的系统进化分析,本研究得出的弗类共生体聚类模型都是相似的。也就是说,中国的大多数弗类共生体都被分在单独的组里,和其他国家已知弗类共生体有显著的差别,而且具有高度的遗传多样性,提示本次检测到的弗类共生体极可能是一些新发现的种类。
利益冲突 无
| [1] |
尹小平, 赵姗姗, 刘丹, 等. 从中哈边境亚洲璃眼蜱中检测到弗朗西斯氏菌样内共生体核酸[J]. 中国人兽共患病学报, 2017, 33(2): 170-172, 177. Yin XP, Zhao SS, Liu D, et al. First detection of Francisella-like endosymbionts in Hyalomma asiaticum asiaticum from China-Kazakhstan border[J]. Chin J Zoonoses, 2017, 33(2): 170-172, 177. DOI:10.3969/j.issn.1002-2694.2017.02.014 |
| [2] |
Forsman M, Henningson EW, Larsson E, et al. Francisella tularensis does not manifest virulence in viable but non-culturable state[J]. FEMS Microbiol Ecol, 2000, 31(3): 217-224. DOI:10.1111/j.1574-6941.2000.tb00686.x |
| [3] |
Dergousoff SJ, Chilton NB. Association of different genetic types of Francisella-like organisms with the rocky mountain wood tick (Dermacentor andersoni) and the American dog tick (Dermacentor variabilis) in localities near their northern distributional limits[J]. Appl Environ Microbiol, 2012, 78(4): 965-971. DOI:10.1128/AEM.05762-11 |
| [4] |
Long GW, Oprandy JJ, Narayanan RB, et al. Detection of Francisella tularensis in blood by polymerase chain reaction[J]. J Clin Microbiol, 1993, 31(1): 152-154. DOI:10.1128/jcm.31.1.152-154.1993 |
| [5] |
Tamura K, Stecher G, Peterson D, et al. MEGA 6:molecular evolutionary genetics analysis version 6.0[J]. Mol Biol Evol, 2013, 30(12): 2725-2729. DOI:10.1093/molbev/mst197 |
| [6] |
王艳华, 毛玲玲, 彭遥, 等. 在辽宁省长角血蜱中检测出土拉弗朗西斯菌[J]. 中国媒介生物学及控制杂志, 2016, 27(6): 529-532. Wang YH, Mao LL, Peng Y, et al. Francisella tularensis was detected in Haemaphysalis longicornis from Liaoning province[J]. Chin J Vector Biol Control, 2016, 27(6): 529-532. DOI:10.11853/j.issn.1003.8280.2016.06.001 |
| [7] |
Yu PF, Niu QL, Liu ZJ, et al. Molecular epidemiological surveillance to assess emergence and re-emergence of tick-borne infections in tick samples from China evaluated by nested PCRs[J]. Acta Trop, 2016, 158: 181-188. DOI:10.1016/j.actatropica.2016.02.027 |
| [8] |
Zhang F, Liu W, Wu XM, et al. Detection of Francisella tularensis in ticks and identification of their genotypes using multiple-locus variable-number tandem repeat analysis[J]. BMC Microbiol, 2008, 8: 152. DOI:10.1186/1471-2180-8-152 |
| [9] |
郑龙. 陕西省部分地区土拉弗朗西斯菌病自然疫源地调查研究[J]. 西北国防医学杂志, 2018, 39(7): 426-431. Zheng L. Investigation of natural epidemic focus of Francisella tularensis in Shaanxi province[J]. Med J Natl Defend Forces Northwest China, 2018, 39(7): 426-431. DOI:10.16021/j.cnki.1007-8622.2018.07.002 |
| [10] |
Nakao R, Abe T, Nijhof AM, et al. A novel approach, based on BLSOMs (batch learning self-organizing maps), to the microbiome analysis of ticks[J]. ISME J, 2013, 7(5): 1003-1015. DOI:10.1038/ismej.2012.171 |
| [11] |
Scoles GA. Phylogenetic analysis of the Francisella-like endosymbionts of Dermacentor ticks[J]. J Med Entomol, 2004, 41(3): 277-286. DOI:10.1603/0022-2585-41.3.277 |
| [12] |
Sun LV, Scoles GA, Fish D, et al. Francisella-like endosymbionts of ticks[J]. J Invertebr Pathol, 2000, 76(4): 301-303. DOI:10.1006/jipa.2000.4983 |
| [13] |
Kugeler KJ, Gurfield N, Creek JG, et al. Discrimination between Francisella tularensis and Francisella-like endosymbionts when screening ticks by PCR[J]. Appl Environ Microbiol, 2005, 71(11): 7594-7597. DOI:10.1128/AEM.71.11.7594-7597.2005 |
| [14] |
Li YQ, Yang JF, Chen Z, et al. Anaplasma infection of Bactrian camels (Camelus bactrianus) and ticks in Xinjiang, China[J]. Parasit Vectors, 2015, 8: 313. DOI:10.1186/s13071-015-0931-1 |
| [15] |
Xia H, Li P, Yang JL, et al. Epidemiological survey of Crimean-Congo hemorrhagic fever virus in Yunnan, China, 2008[J]. Int J Infect Dis, 2011, 15(7): e459-e463. DOI:10.1016/j.ijid.2011.03.013 |
| [16] |
Zhang LM, Wang Y, Cai DJ, et al. Detection of Anaplasma marginale in Hyalomma asiaticum ticks by PCR assay[J]. Parasitol Res, 2013, 112(7): 2697-2702. DOI:10.1007/s00436-013-3437-9 |
| [17] |
Liu JN, Yu ZJ, Liu LM, et al. Identification, distribution and population dynamics of Francisella-like endosymbiont in Haemaphysalis doenitzi (Acari: Ixodidae)[J]. Sci Rep, 2016, 6: 35178. DOI:10.1038/srep35178 |
| [18] |
Sjöstedt A, Sandström G, Tärnvik A, et al. Nucleotide sequence and T cell epitopes of a membrane protein of Francisella tularensis[J]. J Immunol, 1990, 145(1): 311-317. |
| [19] |
Ivanov IN, Mitkova N, Reye AL, et al. Detection of new Francisella-like tick endosymbionts in Hyalomma spp. and Rhipicephalus spp. (Acari: Ixodidae) from Bulgaria[J]. Appl Environ Microbiol, 2011, 77(15): 5562-5565. DOI:10.1128/AEM.02934-10 |
| [20] |
Niebylski ML, Peacock MG, Fischer ER, et al. Characterization of an endosymbiont infecting wood ticks, Dermacentor andersoni, as a member of the genus Francisella[J]. Appl Environ Microbiol, 1997, 63(10): 3933-3940. DOI:10.1128/aem.63.10.3933-3940.1997 |
| [21] |
Rijpkema SGT, Molkenboer MJ, Schouls LM, et al. Simultaneous detection and genotyping of three genomic groups of Borrelia burgdorferi sensu lato in Dutch Ixodes ricinus ticks by characterization of the amplified intergenic spacer region between 5S and 23S rRNA genes[J]. J Clin Microbiol, 1995, 33(12): 3091-3095. DOI:10.1128/jcm.33.12.3091-3095.1995 |
 2021, Vol. 32
2021, Vol. 32

