扩展功能
文章信息
- 周长印, 关晴晴, 戴雨琪, 刘洪霞, 钱坤
- ZHOU Chang-yin, GUAN Qing-qing, DAI Yu-qi, LIU Hong-xia, QIAN Kun
- 淡色库蚊保幼激素受体基因CpMet的表达特性和功能分析
- Expression characterization and functional analysis of juvenile hormone receptor gene CpMet in Culex pipiens pallens
- 中国媒介生物学及控制杂志, 2021, 32(6): 680-685
- Chin J Vector Biol & Control, 2021, 32(6): 680-685
- 10.11853/j.issn.1003.8280.2021.06.005
-
文章历史
- 收稿日期: 2021-05-25
2 上海市疾病预防控制中心, 上海 200336
2 Shanghai Municipal Center for Disease Control and Prevention, Shanghai 200336, China
蚊虫是重要的医学昆虫,不仅叮咬吸血,骚扰人们工作、学习和休息,而且还是流行性乙型脑炎、疟疾、丝虫病、登革热等多种传染病的传播媒介。蚊虫种类多,生命力顽强,具有快速的生殖周期,是研究生殖调控机制的优秀模式生物。近年来随着基因组学、生物信息学和分子生物学技术发展,人们对于蚊虫生殖调控的研究越来越深入。
保幼激素(juvenile hormone,JH)是调控昆虫生长发育、变态和生殖最重要的激素之一[1]。在双翅目昆虫中,JH不是刺激卵黄发生,而是调节发育阶段,为随后的卵黄发生和卵发育做好准备。JH调节蚊虫羽化后的营养资源分配,从而导致初级卵泡的成熟和生长[2-4]。JH还协调蚊虫羽化后脂肪体和中肠的发育,为消化吸收血液做准备[5]。
随着JH调控昆虫生殖机制研究的深入,大量实验数据表明JH的受体是螺旋-环-螺旋Per/Arnt/Sim(bHLH-PAS)结构的甲氧戊丁酸耐受蛋白(Met)[1]。Met作为JH的受体,在JH发挥功能效应中扮演着重要角色,研究发现在雌性埃及伊蚊(Aedes aegypti)中,JH的作用是由JH的受体基因Met介导的[6-7]。体外合成的AaMet以高亲和力与JH结合,关键预测残基的突变导致JH与其受体的结合大大减少[8]。RNAi介导的AaMet基因敲除阻止了蚊虫羽化后初级卵泡的JH依赖性生长,这一表型类似于JH剥夺的效果[7]。在埃及伊蚊羽化后的发育过程中,JH通过其受体Met调控许多基因的表达,引起激活或抑制,影响蚊虫的生殖和吸血行为[9]。
本文以城市优势蚊种淡色库蚊(Culex pipiens pallens)为研究对象,采用实时荧光定量PCR(RT-qPCR)检测CpMet基因在淡色库蚊不同生长发育阶段、不同组织以及激素处理后的表达特性,采用RNA干扰的方法研究CpMet基因在淡色库蚊生殖中的作用,研究结果对于进一步揭示昆虫JH信号通路调控昆虫生殖的分子机制,开发以Met为作用靶标的新型蚊虫防治药剂具有重要的科学意义。
1 材料与方法 1.1 供试虫源淡色库蚊敏感品系引自江苏省疾病预防控制中心,扬州大学园艺与植物保护学院养虫室连续多代饲养,饲养条件为温度(27±2)℃,相对湿度(75±5)%,光周期为12 h∶12 h,幼虫期饲喂全营养鼠粮,成虫期饲料为5%蔗糖水,使用小白鼠供蚊虫吸血繁殖。
1.2 主要试剂和仪器 1.2.1 主要试剂保幼激素类似物烯虫酯Methoprene购于Sigma-Aldrich公司,HiScript® Q RT SuperMix for qPCR(+gDNA wiper)(反转录试剂)和ChamQ Universal SYBR qPCR Master Mix购于Vazyme Biotech Co.,Ltd.,蜕皮激素20E购于生工生物工程(上海)股份有限公司,Ambion® TRIZol® reagent,三氯甲烷,75%乙醇溶液,异丙醇,RNase-free ddH2O。
1.2.2 主要仪器荧光定量PCR仪(伯乐,CFX96),高速冷冻离心机(eppendorf,5415R),显微镜,干式恒温零度金属浴(天根生化科技有限公司)。
1.3 实验方法 1.3.1 RT-qPCR检测CpMet基因的表达模式在正常饲养条件下收集1日龄卵、2日龄幼虫、5日龄幼虫、8日龄幼虫、11日龄幼虫、1日龄蛹、2日龄雌性成虫。对未吸血的3~5日龄雌性成蚊进行解剖,收集头部、胸部、脂肪体、马氏管、中肠、卵巢。收集的样品包含3个生物学重复。
采用Trizol法提取淡色库蚊不同发育阶段及不同组织的总RNA,利用HiScript® Q RT SuperMix for qPCR(+gDNA wiper)完成第一链cDNA模板的合成,PCR条件:50 ℃ 15 min,85 ℃2 min。产物-20 ℃保存。
根据已经获得的淡色库蚊Met基因(GeneBank登录号:MK616653)的cDNA序列设计、合成qPCR特异性引物CpMet-qF、CpMet-qR。将淡色库蚊肌动蛋白β-actin基因作为内参基因,合成特异性引物β-actin-F、β-actin-R[10]。见表 1。
使用诺唯赞荧光定量试剂盒进行RT-qPCR,10 µl反应体系如下:2×ChamQ Universal SYBR qPCR Master Mix 5 µl,正反向引物各0.4 µl,cDNA模板1 µl,无核酸酶水3.2 µl。将反应体系混合均匀、离心,使用CFX96TM荧光定量PCR仪(Bio-Rad,美国)进行RT-qPCR反应,具体反应步骤如下:95 ℃预变性30 s;95 ℃变性10 s,55 ℃退火15 s,72 ℃保温5 min,循环40次。扩增反应的特异性可以通过熔解曲线分析检测。
1.3.2 JH类似物烯虫酯和蜕皮激素20E处理将JH类似物烯虫酯溶解于丙酮中,配置成浓度为7 500 ng/μl溶液。选取龄期一致的蚊蛹和未吸血未交尾的2~3日龄雌性成蚊,每只蛹/雌蚊注射200 nl,对照组分别为注射等量丙酮的蛹/雌蚊,每个处理30只,3个生物学重复,随机收集注射后6、12和24 h样品提取总RNA,利用RT-qPCR检测烯虫酯处理后CpMet基因的表达量。
将蜕皮激素20E用乙醇溶解,配置成浓度为5 000 ng/μl溶液。选取龄期一致的蚊蛹注射200 nl,对照组注射等量乙醇,每组处理30只,并设置3个生物学重复,随机收集注射后6、12和24 h样品提取总RNA,利用RT-qPCR检测20E处理后CpMet基因的表达量。
1.3.3 双链RNA的合成使用Premier 5设计带有T7启动子序列的CpMet基因及对照增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)基因特异性dsRNA合成引物(表 2)。扩增出的片段用TranscriptAid T7 High Yield Transcription Kit试剂盒合成dsRNA,经纯化验证后分装保存于-80 ℃冰箱。
采用显微注射法,对未交尾的3~4日龄淡色库蚊雌性成虫进行dsRNA注射。将雌蚊低温麻醉后置于冰上,用镊子轻轻夹至已预冷的0 ℃金属浴上,将雌蚊侧卧,注射部位为胸部侧面中部的鳞片缝隙,注射时针头尽量与蚊虫侧面垂直。每个处理注射20~30只雌蚊,设3个生物学重复。注射后每隔24 h收一次样,连续3 d。采用RT-qPCR检测对CpMet干扰后基因的沉默效率。
1.3.5 淡色库蚊繁殖力测定将刚羽化的雌蚊雄蚊按1∶1.5的比例混合放入干净蚊笼中,喂养5%蔗糖溶液,3~4 d后吸出雌蚊,设置空白对照组、dsEGFP处理组和dsCpMet处理组,处理组进行注射dsRNA干扰,注射后每组试虫单独放入干净蚊笼中,用小白鼠作为血餐,24 h后把未吸血的雌蚊吸出,待笼中剩余雌蚊产卵后记录总产卵块量,在显微镜下统计不同处理组的每个卵块的卵粒数,并把每个卵块做好标记单独放在盛有脱氯水的培养皿中,于4 d后统计每个卵块孵化幼虫数,计算卵孵化率。
1.4 数据分析RT-qPCR的数据采用2-△△Ct法分析[11]目标基因的相对表达量,所有数据都用平均值±标准误表示,采用SPSS 13软件进行单因素方差分析(one-way ANOVA),用Tukey检验进行均值比较,用graphpad.prism.6软件作图。
2 结果 2.1 CpMet在淡色库蚊不同发育阶段的表达分析CpMet在淡色库蚊不同发育阶段的表达量测定结果表明,CpMet在各阶段均表达。卵期CpMet的表达量最高,并且与其他龄期相比差异有统计学意义(F=234.382,P < 0.001),蛹期、成虫期次之,差异亦有统计学意义(P=1.000),CpMet在幼虫各龄期表达量都较低。见图 1。
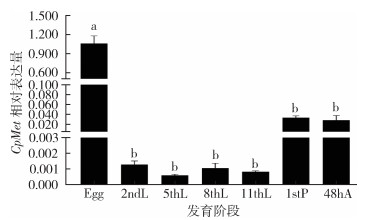
|
| 注:所有数据均为平均值±标准误;不同的字母表示差异有统计学意义;Egg表示1日龄卵;2ndL表示2日龄幼虫;5thL表示5日龄幼虫;8thL表示8日龄幼虫;11thL表示11日龄幼虫;1stP表示1日龄蛹;48hA表示2日龄雌性成虫。 图 1 淡色库蚊不同发育阶段CpMet的mRNA相对表达量 Figure 1 Relative CpMet mRNA expression in different developmental stages of Culex pipiens pallens |
| |
通过RT-qPCR检测了淡色库蚊未吸血的3~5日龄雌性成蚊不同组织部位CpMet的表达量情况,结果表明:CpMet在卵巢中表达量最高,脂肪体表达量次之,与除卵巢外的其他组织表达量差异有统计学意义(F=4 533.999,P < 0.001),表达量从高到低依次是卵巢、脂肪体、胸部、头部、马氏管、中肠。见图 2。
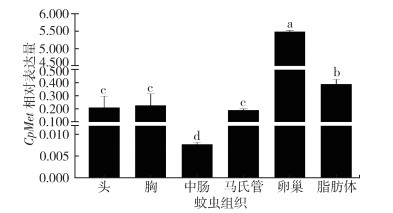
|
| 注:所有数据都是平均值±标准误;不同的字母表示不同组织两两比较差异有统计学意义。 图 2 CpMet在淡色库蚊不同组织的mRNA表达 Figure 2 CpMet expression in different tissues of Culex pipiens pallens |
| |
用JH类似物烯虫酯注射淡色库蚊蛹和未吸血未交尾的2~3日龄雌性成虫。结果显示,与对照(丙酮处理)相比,蚊蛹在烯虫酯处理6、12 h后CpMet表达量上调,分别为对照的1.91和1.35倍,而在处理24 h后表达量下调98.05%(图 3A)。成蚊用烯虫酯处理6、12和24 h后CpMet表达水平分别上调1.27、4.15和1.26倍。见图 3B。
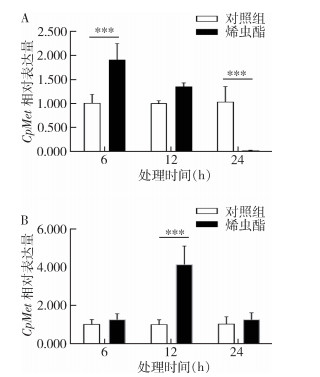
|
| 注:所有数据均为平均值±标准误;*** 与对照组比较,P < 0.005。 图 3 烯虫酯处理后蛹(A)和成虫(B)CpMet mRNA相对表达量 Figure 3 Relative CpMet mRNA expression in pupae (A) and adult mosquitoes (B) after methoprene treatment |
| |
用20E注射淡色库蚊蛹。结果显示,与对照(乙醇处理组)相比,蚊蛹在20E处理6、12 h后,CpMet表达量与对照差异无统计学意义(F=0.271,P=0.630;F=6.441,P=0.064),而在处理24 h后CpMet表达量是对照组的68.11倍(图 4),表达量显著增加,差异有统计学意义(F=101.227,P < 0.001)。
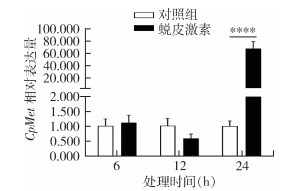
|
| 注:所有数据均为平均值±标准误;**** 与对照组比较,P < 0.001。 图 4 20E处理后蛹CpMet mRNA相对表达量 Figure 4 Relative CpMet mRNA expression in pupae after 20E treatment |
| |
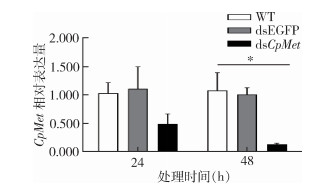
选择未吸血未交尾的3~4日龄雌性成蚊进行dsRNA干扰,每只雌蚊的注射量为200 nl,浓度为1.5 μg/μl。利用RT-qPCR检测基因表达水平,结果显示,与dsEGFP处理(对照)相比,dsCpMet处理组24 h后CpMet表达量下降了50.29%,48 h后转录水平被显著抑制了86.29%,与对照差异有统计学意义(F=9.157,P=0.039)。见图 5。
|
| 注:所有数据均为平均值±标准误;* 与dsEGFP比较,P < 0.05;WT表示空白对照;dsEGFP表示注射增强型荧光蛋白基因双链RNA组;dsCpMet表示注射CpMet双链RNA组。 图 5 RNAi后雌蚊CpMet mRNA表达 Figure 5 CpMet mRNA expression in female mosquitoes after RNA interference |
| |
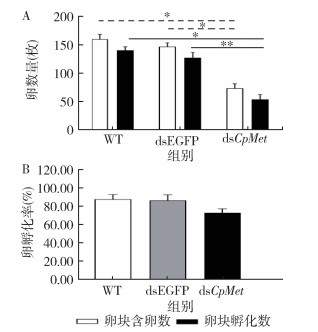
注射1 d后的雌蚊用小白鼠进行24 h供血,统计每个处理组的产卵率、卵块平均含卵数、卵块平均孵化数及孵化率。结果显示,注射dsCpMet组的卵块平均含卵数显著下降了49.89%,与对照组比较差异有统计学意义(F=156.120,P < 0.001)。孵化率方面,注射dsCpMet组孵化率降至73.36%(图 6),与对照组比较差异有统计学意义(F=195.376,P < 0.001)。
|
| 注:所有数据均为平均值±标准误;* 与dsEGFP比较,P < 0.05,** P < 0.01;WT表示空白对照;dsEGFP表示注射增强型荧光蛋白基因双链RNA组;dsCpMet表示注射CpMet双链RNA组。 图 6 不同处理雌蚊的产卵情况(A)及孵化率(B) Figure 6 Oviposition (A) and hatching rate (B) of female mosquitoes in different treatment groups |
| |
JH是一种结构独特的倍半萜类激素,是昆虫发育和繁殖的主要调节因子。在幼虫的发育阶段,JH的主要作用是推迟变态,直到幼虫达到适当的阶段和大小。当JH的抗变态作用结束后,晚期蛹再次合成JH,在昆虫的生殖过程中起着至关重要的作用。JH利用多种分子机制在昆虫生命周期的不同阶段发挥不同的作用。
作为JH信号通路上的重要基因,Met基因在昆虫的不同发育阶段和不同组织中都有表达,但其表达模式因昆虫而异。鳞翅目昆虫家蚕(Bombyx mori)的BmMet基因在胚胎发育期、幼虫发育期和蛹变态期均有表达,并且表达量基本一致,对幼虫解剖后发现BmMet基因在卵巢、精巢和脂肪体中的表达量较高[12]。半翅目昆虫褐飞虱(Nilaparvata lugens)的NlMet基因在卵期、不同龄期的若虫及成虫中均会有不同程度表达,其中卵期相对较高,对褐飞虱雌雄成虫解剖后发现,翅中NlMet基因的表达量最高[13]。双翅目昆虫桔小实蝇(Bactrocera dorsalis)的Met基因在整个发育阶段也会有不同程度的表达,其中幼虫期的表达量明显高于蛹期,对桔小实蝇的3龄幼虫进行解剖,检测发现马氏管和脂肪体表达量较高,其次为中肠和表皮[14]。本研究发现淡色库蚊在不同发育阶段中,卵期CpMet基因表达量最高,其次是蛹期和成虫期,幼虫期表达量最低。组织表达模式分析结果表明,相对于其他组织,CpMet基因在卵巢、脂肪体中表达量要略高。深入研究发现经JH类似物烯虫酯处理后不同时间的淡色库蚊,雌成虫CpMet基因的表达量均会有不同程度的增加,表明CpMet基因受JH的正调控,在成虫阶段参与JH信号的传导,作为JH的受体调节淡色库蚊的生殖。用蜕皮激素20E处理蚊蛹24 h后,CpMet基因的表达量急剧增加,表明CpMet基因表达受20E的诱导,在家蚕的研究中也有类似的发现,在蜕皮和化蛹期,20E滴度较高时,Met的表达达到峰值[15]。
Met作为JH的细胞内受体和传感器在昆虫的生长发育、生殖过程中发挥着重要的作用。目前,关于Met的功能研究主要围绕以下几个方面:调控幼虫的生长和变态发育[16]、翅的分化[17]、外生殖器的形成[18]以及对雌性成虫生殖[7, 19]的影响。Met基因对昆虫生殖的影响报道较多,干扰始红蝽(Pyrrhocoris apterus)的Met基因会抑制卵巢发育[18];干扰赤拟谷盗(Tribolium castaneum)的Met基因会抑制其卵黄蛋白的合成[20],影响其雌性成虫的产卵量并能在卵黄原蛋白中表达[21];干扰飞蝗(Locusta migratoria)的Met基因会影响卵母细胞的成熟和卵巢的发育[22];干扰太平洋折翅蠊(Diploptera punctata)的Met基因会阻止卵母细胞的生长和卵黄原蛋白的产生,进而影响到卵巢的发育[23];干扰埃及伊蚊Met基因会导致埃及伊蚊的产卵量显著降低[6];敲除沙漠蝗虫的Scg-Met基因导致雄性副腺的相对重量和相对蛋白质含量降低[24]。本文利用RNA干扰技术干扰淡色库蚊雌性成蚊的CpMet后,48 h干扰效率最高达到86.29%,雌蚊CpMet被干扰后可以正常交配并产卵,但是卵块不规则且部分无法正常孵化,产卵量和孵化率都有不同程度的下降。研究结果进一步证实了Met基因对蚊虫生殖的调控作用,干扰Met基因后产卵量显著下降,表明将Met作为蚊虫控制的潜在靶标是可行的,但如何运用到蚊虫防治实践中还需要大量的研究工作。
利益冲突 无
| [1] |
Roy S, Saha TT, Zou Z, et al. Regulatory pathways controlling female insect reproduction[J]. Annu Rev Entomol, 2018, 63: 489-511. DOI:10.1146/annurev-ento-020117-043258 |
| [2] |
Gwadz RW, Spielman A. Corpus allatum control of ovarian development in Aedes aegypti[J]. J Insect Physiol, 1973, 19(7): 1441-1448. DOI:10.1016/0022-1910(73)90174-1 |
| [3] |
Clifton ME, Noriega FG. Nutrient limitation results in juvenile hormone-mediated resorption of previtellogenic ovarian follicles in mosquitoes[J]. J Insect Physiol, 2011, 57(9): 1274-1281. DOI:10.1016/j.jinsphys.2011.06.002 |
| [4] |
Clifton ME, Noriega FG. The fate of follicles after a blood meal is dependent on previtellogenic nutrition and juvenile hormone in Aedes aegypti[J]. J Insect Physiol, 2012, 58(7): 1007-1019. DOI:10.1016/j.jinsphys.2012.05.005 |
| [5] |
Attardo GM, Hansen IA, Raikhel AS. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny[J]. Insect Biochem Mol Biol, 2005, 35(7): 661-675. DOI:10.1016/j.ibmb.2005.02.013 |
| [6] |
Li M, Mead EA, Zhu JS. Heterodimer of two bHLH-PAS proteins mediates juvenile hormone-induced gene expression[J]. Proc Natl Acad Sci USA, 2011, 108(2): 638-643. DOI:10.1073/pnas.1013914108 |
| [7] |
Zou Z, Saha TT, Roy S, et al. Juvenile hormone and its receptor, methoprene-tolerant, control the dynamics of mosquito gene expression[J]. Proc Natl Acad Sci USA, 2013, 110(24): E2173-E2181. DOI:10.1073/pnas.1305293110 |
| [8] |
Li M, Liu PC, Wiley JD, et al. A steroid receptor coactivator acts as the DNA-binding partner of the methoprene-tolerant protein in regulating juvenile hormone response genes[J]. Mol Cell Endocrinol, 2014, 394(1/2): 47-58. DOI:10.1016/j.mce.2014.06.021 |
| [9] |
Saha TT, Roy S, Pei GF, et al. Synergistic action of the transcription factors Krüppel homolog 1 and Hairy in juvenile hormone/Methoprene-tolerant-mediated gene-repression in the mosquito Aedes aegypti[J]. PLoS Genet, 2019, 15(10): e1008443. DOI:10.1371/journal.pgen.1008443 |
| [10] |
Hansen IA, Attardo GM, Park JH, et al. Target of rapamycin-mediated amino acid signaling in mosquito anautogeny[J]. Proc Natl Acad Sci USA, 2004, 101(29): 10626-10631. DOI:10.1073/pnas.0403460101 |
| [11] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
李志清. 家蚕BmMet基因的鉴定、克隆及功能分析[D]. 重庆: 西南大学, 2009. Li ZQ. Identification, cloning and functional analysis of BmMet, a Methoprene-tolerant gene in the Silkworm, Bombyx mori[D]. Chongqing: Southwest University, 2009. http://med.wanfangdata.com.cn/Paper/Detail?id=DegreePaper_Y1461230 |
| [13] |
姚云. 褐飞虱Met基因的克隆及其功能研究[D]. 杭州: 中国计量学院, 2015. Yao Y. Molecular cloning and functional study of Methoprene-tolerant (Met) from Nilaparvata lugens (Stål)[D]. Hangzhou: China Jiliang University, 2015. http://cdmd.cnki.com.cn/article/cdmd-10356-1015638646.htm |
| [14] |
李亚丽. 桔小实蝇保幼激素信号通路Met和Kr-h1基因功能初探[D]. 重庆: 西南大学, 2016. Li YL. Functional analysis of juvenile hormone signaling pathway genes Met and Kr-h1 in Bactrocera dorsalis (Hendel)(Diptera: Tephritidae)[D]. Chongqing: Southwest University, 2016. http://cdmd.cnki.com.cn/article/cdmd-10635-1016767485.htm |
| [15] |
Guo EE, He QY, Liu SM, et al. MET is required for the maximal action of 20-hydroxyecdysone during Bombyx metamorphosis[J]. PLoS One, 2012, 7(12): e53256. DOI:10.1371/journal.pone.0053256 |
| [16] |
Konopova B, Jindra M. Juvenile hormone resistance gene Methoprene-tolerant controls entry into metamorphosis in the beetle Tribolium castaneum[J]. Proc Natl Acad Sci USA, 2007, 104(25): 10488-10493. DOI:10.1073/pnas.0703719104 |
| [17] |
Lozano J, Belles X. Role of Methoprene-tolerant (Met) in adult morphogenesis and in adult ecdysis of Blattella germanica[J]. PLoS One, 2014, 9(7): e103614. DOI:10.1371/journal.pone.0103614 |
| [18] |
Smykal V, Bajgar A, Provaznik J, et al. Juvenile hormone signaling during reproduction and development of the linden bug, Pyrrhocoris apterus[J]. Insect Biochem Mol Biol, 2014, 45: 69-76. DOI:10.1016/j.ibmb.2013.12.003 |
| [19] |
Song JS, Wu ZX, Wang ZM, et al. Krüppel-homolog 1 mediates juvenile hormone action to promote vitellogenesis and oocyte maturation in the migratory locust[J]. Insect Biochem Mol Biol, 2014, 52: 94-101. DOI:10.1016/j.ibmb.2014.07.001 |
| [20] |
Parthasarathy R, Tan A, Sun Z, et al. Juvenile hormone regulation of male accessory gland activity in the red flour beetle, Tribolium castaneum[J]. Mech Dev, 2009, 126(7): 563-579. DOI:10.1016/j.mod.2009.03.005 |
| [21] |
Parthasarathy R, Tan AJ, Palli SR. bHLH-PAS family transcription factor methoprene-tolerant plays a key role in JH action in preventing the premature development of adult structures during larval-pupal metamorphosis[J]. Mech Dev, 2008, 125(7): 601-616. DOI:10.1016/j.mod.2008.03.004 |
| [22] |
Guo W, Wu ZX, Song JS, et al. Juvenile hormone-receptor complex acts on Mcm4 and Mcm7 to promote polyploidy and vitellogenesis in the migratory locust[J]. PLoS Genet, 2014, 10(10): e1004702. DOI:10.1371/journal.pgen.1004702 |
| [23] |
Marchal E, Hult EF, Huang J, et al. Methoprene-tolerant (Met) knockdown in the adult female cockroach, Diploptera punctata completely inhibits ovarian development[J]. PLoS One, 2014, 9(9): e106737. DOI:10.1371/journal.pone.0106737 |
| [24] |
Holtof M, Van Lommel J, Gijbels M, et al. Crucial role of juvenile hormone receptor components methoprene-tolerant and Taiman in sexual maturation of adult male desert locusts[J]. Biomolecules, 2021, 11(2): 244. DOI:10.3390/biom11020244 |
 2021, Vol. 32
2021, Vol. 32




