扩展功能
文章信息
- 周欣欣, 李芬, 段文波, 马欣然, 宋秀平, 吴少英, 孟凤霞
- ZHOU Xin-xin, LI Fen, DUAN Wen-bo, MA Xin-ran, SONG Xiu-ping, WU Shao-ying, MENG Feng-xia
- 白纹伊蚊电压门控钠离子通道基因克隆及其生物信息学分析
- Cloning and bioinformatics analysis of voltage-gated sodium channel gene of Aedes albopictus
- 中国媒介生物学及控制杂志, 2021, 32(6): 672-679
- Chin J Vector Biol & Control, 2021, 32(6): 672-679
- 10.11853/j.issn.1003.8280.2021.06.004
-
文章历史
- 收稿日期: 2021-07-05
2 热带作物安全生产关键技术的研发与应用团队, 海南大学, 海南 海口 570228
2 The Innovation Team of Research, Development, and Application of Key Technologies for Safe Production of the Tropical Crops, Hainan University, Haikou, Hainan 570228, China
白纹伊蚊(Aedes albopictus)又称为亚洲虎蚊、花斑蚊[1],是一种日间活动蚊虫。该物种是传播具有明显公共卫生重要性的一系列病原体的公认媒介,包括登革热、黄热病、基孔肯雅热和寨卡病毒病[2]。白纹伊蚊最早起源于东南亚的森林,由于其具有很高的生态和生理可塑性,能适应不同的环境和繁殖类型而在地理上处于不断扩张状态,现已在全球70多个国家广泛分布,并被认为是最具威胁的入侵物种之一[3]。全球化贸易、旅游和气候变化以及缺乏可靠的监测和有效的控制工具[4],这些都加剧了其在全球范围内的入侵,大大增加了虫媒疾病的暴发概率。
登革热是全世界广泛流行的疾病之一,每年报告的病例约为3.9亿例。在口岸不同现场样品中均检出登革病毒[5]。黄热病是一种病毒性出血热,如得不到适当的治疗,这可能是一种致命的疾病,尽管存在预防性疫苗,但全球每年报告病例至少有20万例,并且有3万例死于该疾病[6]。基孔肯雅热是一种因感染基孔肯雅病毒导致的蚊媒传播的病毒性疾病,白纹伊蚊是其传播媒介之一。该病临床症状与登革热相似,包括皮疹、突发性高热和关节疼痛,偶尔引起出血。虽然病死率很低,但在蚊媒密度高的地区也能形成大规模的暴发流行[7]。
为降低感染这些病毒的风险,有效控制传播媒介白纹伊蚊是防治的主要手段[8]。当处于疾病暴发期时,采取化学杀虫剂防治媒介仍是主要措施。由于化学杀虫剂的持续和广泛使用,使世界各地的许多昆虫产生选择压力,造成了抗药性的发生、发展。拟除虫菊酯类杀虫剂(pyrethroid insecticides)具有杀虫广谱、高效和环境中易于降解等特点,在世界范围内被广泛用于农业及害虫防治[9]。但正因为其长期过量的使用,我国多地白纹伊蚊野外种群已对其产生了较严重的抗药性[10]。
拟除虫菊酯类杀虫剂,如滴滴涕(DDT)及其类似物,属于一组具有相似作用模式的神经毒素。电压门控钠离子通道(voltage-gated sodium channel,VGSC)是其作用靶标位点。VGSC是一个完整的跨膜蛋白,由大约2 000个氨基酸残基组成,存在于神经元、肌细胞、内分泌细胞和卵巢细胞中,参与可兴奋细胞动作电位的起始和传播,改变神经冲动的传播动力学[11]。拟除虫菊酯类杀虫剂抗性机制之一是靶标的构象变化损害了杀虫剂分子的正确结合,导致靶标不敏感。研究发现,钠离子通道基因中一些核苷酸突变使相应编码的氨基酸发生改变,使钠离子通道基因结构发生变化,导致对拟除虫菊酯类杀虫剂的敏感性降低,这种类型的抗性通常被称为靶标抗性[11]。昆虫产生靶标抗性后,杀虫剂作用于昆虫的突出表现是不会产生击倒效应,因而又称为击倒抗性(knockdown resistance,kdr)[12]。迄今为止,大量昆虫的钠离子通道基因被克隆和测序分析,目的是为了从分子层面说明VGSC与kdr的关系[13]。但是,许多昆虫钠离子通道基因克隆获得的是部分cDNA片段,仅从家蝇(Musca domestica)、德国小蠊(Blattella germanica)等昆虫中克隆出钠离子通道基因全长[14-16]。本研究克隆获得白纹伊蚊钠离子通道编码基因全长cDNA序列,并分析了其生物信息学特征,有助于阐明抗性机制和新靶点的研究开发,特别是对拟除虫菊酯类杀虫剂产生的靶标抗性分子检测具有重要意义。
1 材料与方法 1.1 供试昆虫研究试虫选用本实验室饲养的白纹伊蚊敏感品系。白纹伊蚊幼蚊以猪肝粉以及馒头粉按1∶1的比例混合为饲料,每盆幼蚊密度控制在100~200条。成蚊使用10%的糖水喂养。养殖条件:温度(25±1)℃,相对湿度(75±5)%,光照周期(L∶D)=14 h∶10 h。
1.2 总RNA提取及第一链cDNA的合成取白纹伊蚊成蚊50只,加入裂解液后立即在组织细胞裂解仪中匀浆处理,按照RNA提取试剂盒(RNeasy Mini Kit)操作步骤提取白纹伊蚊匀浆中的总RNA。凝胶电泳测定总RNA产物完整性。使用NanoDrop微量核酸浓度测定仪测定总RNA产物的浓度和纯度。按照常规的反转录-聚合酶链式反应(RT-PCR)技术,将RNA产物按照第一链cDNA合成试剂盒(TransScript® Ⅱ All-in-One First-Strand cDNA Synthesis SuperMix for PCR)操作步骤合成cDNA。cDNA产物置于-20 ℃保存或用于后续实验。
1.3 目的片段扩增及纯化回收根据GenBank数据库中已公布的白纹伊蚊钠离子通道基因序列,利用Primer Premier 6.0软件设计2对白纹伊蚊钠离子通道全长扩增引物(表 1)。按照DNA聚合酶扩增试剂盒(Phanta Max Super-Fidelity DNA Polymerase)操作步骤进行PCR扩增,获得PCR产物。PCR反应体系为50 μl,每个反应包括cDNA模板1 μl,2 × Phanta® Max buffer 25 μl,dNTPs(10 mmol/L)1 μl,Phanta® Max Super-Fidelity DNA Polymerase 1 μl,正、反向引物(10uM)各2 μl,用ddH2O补足体积至50 μl。Aal-ⅠPCR反应条件:95 ℃ 3 min;95 ℃15 s,55 ℃ 15 s,72 ℃ 3 min,共35个循环;72 ℃延伸8 min,4 ℃保存。Aal-ⅡPCR反应条件:95 ℃ 3 min;95 ℃ 15 s,62 ℃ 15 s,72 ℃ 3 min,共35个循环;72 ℃延伸8 min,4 ℃保存。凝胶电泳检测PCR产物有无目的条带,按照胶纯化回收试剂盒(EasyPure® Quick Gel Extraction Kit)操作步骤将具有预期目的条带的产物纯化回收。

|
将纯化回收的产物与5 minTM TA/Blunt-Zero Vector载体连接构成重组DNA,然后将其转化到感受态细胞Trans1-T1中。经过卡那霉素培养基筛选,挑选白色单克隆经菌液PCR鉴定,把出现疑似条带的菌液,经37 ℃ 200 r/min过夜摇菌,按照质粒提取试剂盒(EasyPure®HiPure Plasmid MiniPrep Kit)操作步骤提取质粒,通过EcoRⅠ单酶切验证,将鉴定阳性质粒进行测序。
1.5 序列分析和系统进化树构建白纹伊蚊钠离子通道基因DNA序列首先利用美国国立生物技术信息中心(NCBI)序列分析在线网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析核苷酸和推导出的氨基酸序列,并进行序列比对。再使用DNAStar.Lasergene 7软件进行同源性分析;通过在线网站Protparam(http://www.expasy.org/tools/protparam.html)分析钠离子通道基因编码蛋白的理化性质。利用跨膜结构域预测软件(CCTOP)(http://cctop.enzim.ttk.mta.hu/?_=/jobs/submit)预测白纹伊蚊钠离子通道基因跨膜结构特征。使用MEGA X软件构建昆虫钠离子通道氨基酸数据集的系统进化树。
2 结果 2.1 白纹伊蚊钠离子通道基因克隆对白纹伊蚊电压门控钠离子通道基因的编码序列分两段进行PCR扩增,得到的PCR产物进行琼脂糖凝胶电泳,检测片段大小分别为3 309和3 100 bp的单一明亮特异性条带(图 1)。纯化回收的产物与5 minTM TA/Blunt-Zero Vector连接,连接产物转化到感受态细胞Trans1-T1中,在卡那霉素培养基中筛选菌落,对单菌落进行菌液PCR鉴定后提取质粒,质粒经过EcoRⅠ单酶切验证后进行测序。
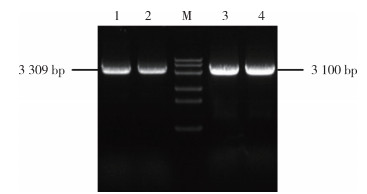
|
| 注:M表示Tranks8K DNA marker;1、2为Aal-Ⅰ电泳图;3、4为Aal-Ⅱ电泳图。 图 1 白纹伊蚊钠离子通道全长基因电泳结果 Figure 1 Electrophoretic map of full length gene of sodium channel of Aedes albopictus |
| |
阳性克隆送测序分析,将所得片段拼接后得到完整白纹伊蚊钠离子通道基因全长,命名为Aedes albopictus soudium channel(AalNaV)(图 2),其GenBank登录号为MW883396。该基因全长6 357 bp,共编码2 118个氨基酸,等电点为5.06,蛋白相对分子质量为237×103。白纹伊蚊钠离子通道AalNaV与埃及伊蚊(Ae. aegypti)的钠离子通道基因相似度为96.30%。
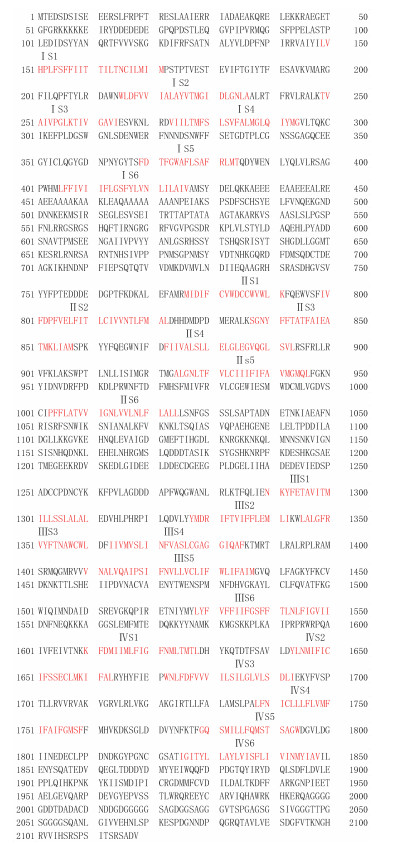
|
| 注:红色标记代表同源结构域。 图 2 白纹伊蚊钠离子通道AalNaV序列图 Figure 2 AalNaV sequence of sodium channel of Aedes albopictus |
| |
通过NCBI CD-search(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)对AalNaV分析发现其1039~1286位氨基酸残基对应着与Na+转运相关的真核生物钠离子通道保守性结构域pfam06512。利用CCTOP对AalNaV的跨膜结构进行预测(图 3),该基因由4个同源结构域(Ⅰ~Ⅳ)以及连接它们的长度不等的亲水肽链组成。每个同源结构域包括6个跨膜疏水性螺旋片段(S1~S6)和1个P环,每个片段由19~27个氨基酸组成。S5、S6和P环形成一个通道孔区,P环构成离子选择性过滤器。每个结构域的S1~S4螺旋结合在一起形成4个独立的电压敏感区,S4和S5片段之间的一个细胞内连接子将电压敏感区连接到通道孔区。S4片段是一个保守元件,对膜内外电压场的改变特别敏感,构成钠离子通道的电压传感器。S5~S6之间分别有D、E、K、A 4个氨基酸残基,是Na+选择性的关键残基,具有高度的保守性。在结构域Ⅲ S6片段和结构域Ⅳ S1片段之间有一疏水性氨基酸序列,是钠离子通道快速失活所必需残基(失活门)。白纹伊蚊钠离子通道该位点为甲硫氨酸一苯丙氨酸一甲硫氨酸(MFM),失活门在通道快速失活过程中起重要作用。见图 4。
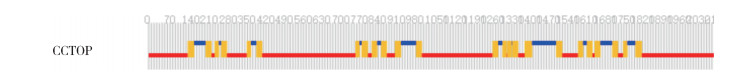
|
| 图 3 跨膜结构域预测软件对AalNaV跨膜结构的预测 Figure 3 Prediction of AalNaV transmembrane structure by CCTOP |
| |

|
| 注:S1~S4片段为电压敏感区;S5~S6片段和连接环为孔隙区。 图 4 白纹伊蚊电压门控钠离子通道拓扑图 Figure 4 Topological map of voltage-gated sodium channels in Aedes albopictus |
| |
采用遗传距离建树法的邻接法(Neighbor-joining method,NJ)构建系统进化树。对白纹伊蚊及与其同源性较高的12种昆虫的钠离子通道系统进化分析发现(图 5),白纹伊蚊钠离子通道与埃及伊蚊钠离子通道遗传距离最近,与褐家鼠(Rattus norvegicus)和人类钠离子通道遗传距离最远,双翅目昆虫的钠离子通道聚为一支。该系统进化树分支与昆虫分类学物种分类非常吻合,昆虫钠离子通道基因具有高度保守性,此特性可能作为物种分类的一种判断依据。
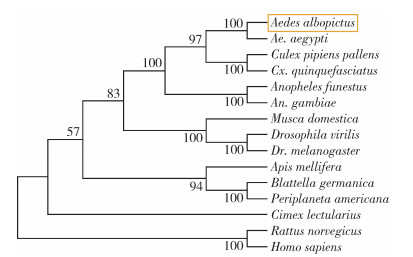
|
| 注:12种昆虫NCBI序列号为白纹伊蚊(Aedes albopictus,MW_883396)、埃及伊蚊(Ae. aegypti,ARM_35696.1)、淡色库蚊(Culex pipiens pallens,AGO_33659.1)、致倦库蚊(Cx. pipiens quinquefasciatus,AGO_33660.1)、不吉按蚊(Anopheles funestus,AUA_17904.1)、冈比亚按蚊(An. gambiae,CAM_12801.1)、家蝇(Musca domestica,NP_001273814.1)、黑腹果蝇(Drosophila melanogaster,NP_001188635.1)、意大利蜜蜂(Apis mellifera,NP_001159377.1)、德国小蠊(Blattella germanica,AAC_47483.1)、美洲大蠊(Periplaneta americana,ACX_44801.1)、臭虫(Cimex lectularius,NP_001303632.1)、褐家鼠(Rattus norvegicus,CAA_70364.1)和人类(Homo sapiens,BAA_78033.1)。 图 5 昆虫钠离子通道基因构建的系统进化树 Figure 5 Phylogenetic tree of insect sodium channel genes |
| |
对白纹伊蚊钠离子通道基因cDNA克隆的多重序列比对发现,AalNaV中存在3个选择性剪接,包括选择性外显子m、h和互斥外显子d,这3个选择性剪接位于结构域Ⅰ~Ⅲ之间,其氨基酸及核苷酸序列见图 6。

|
| 图 6 AalNaV中3个选择性剪接氨基酸及其核苷酸序列 Figure 6 Three alternative splicing amino acids and their nucleotide sequences in AalNaV |
| |
序列分析发现,白纹伊蚊钠离子通道中存在6个RNA编辑位点,其中2个造成氨基酸变化。一个氨基酸变化是A224B,核苷酸是由C变为A,位于结构域ⅠS1~S2之间;另一个氨基酸变化是K1133R,核苷酸是由A变为G,位于结构域ⅡS6~ⅢS1之间。
3 讨论昆虫中只存在1个基因编码钠离子通道[17],但是可以通过选择性剪接和RNA编辑2种方式产生蛋白功能的多样性。黑腹果蝇(Drosophila melanogaster)钠离子通道基因(para)被最早发现存在选择性剪接,包括9个选择性剪接位点(a、b、c/d、i、j、e、f、h和l/k),其中7个选择性外显子(a、b、i、j、e、f和h)位于细胞内连接肽上,2对互斥外显子(c/d、l/k)位于结构域Ⅱ和Ⅲ的跨膜区。研究发现,para的选择性剪接位点与其他大部分昆虫钠离子通道基本保持一致,钠离子通道基因的选择性剪接在昆虫中具有保守性[18]。对白纹伊蚊钠离子通道克隆序列分析发现了相应与黑腹果蝇para的选择性外显子h和互斥外显子d,并未发现互斥外显子c,并发现了Chang等[19]在埃及伊蚊钠通道中鉴定到的选择性外显子m,选择性外显子m长33 bp,位于连接结构域Ⅰ和Ⅱ之间的连接肽链上。RNA编辑是一种重要的转录后修饰,是通过基因转录本中单个核苷酸的变化,如A到I或C到U的转换,导致蛋白质结构和功能的改变[20]。A到I的RNA编辑主要发生在编码神经系统离子通道、神经递质受体或G蛋白偶联受体的基因转录本中。在果蝇钠通道转录本中发现了11个A到I的RNA编辑位点,其中有9个编辑位点发生了氨基酸变化[21]。对白纹伊蚊钠离子通道分析发现了6个RNA编辑位点,引起氨基酸变化的有2个A224B和K1133R,未引起氨基酸变化有4个编辑位点R88R、K436K、B441B和V748V。
对拟除虫菊酯不敏感的击倒抗性相关突变位点的鉴定是钠离子通道研究的热点[22]。大量研究表明,钠离子通道基因点突变是导致昆虫对拟除虫菊酯类杀虫剂产生击倒抗性的主要机制。击倒抗性是杀虫剂造成的昆虫协调能力丧失和瘫痪,通常伴随着痉挛和震颤[12]。这种机制最初是在家蝇中发现的,现已在全球范围内大量与农业和健康相关的节肢动物中发现了这种机制。至今,已在70多种昆虫中发现了70个钠离子通道基因突变与拟除虫菊酯类杀虫剂抗药性相关。已报道的昆虫抗性相关位点在4个结构域均有分布,但主要分布在结构域ⅡS5片段、结构域ⅡS6片段和结构域ⅡS4~ⅢS1细胞内片段接头处,结构域Ⅱ上的单氨基酸突变最常见。第1个与kdr相关的突变位于结构域ⅡS6片段,1014位点密码子突变(L1014F),亮氨酸突变为苯丙氨酸[23]。该位点突变出现频率非常高,在许多抗性昆虫以及蚊虫中频繁出现,但在白纹伊蚊中尚未观察到该位点突变。将白纹伊蚊与库蚊属和按蚊属等几种具有L1014F型突变的昆虫核苷酸序列进行比对分析发现[24-25],该位点突变均是由TTA编码的亮氨酸经过一个碱基转换或颠换变成TTT或TTC编码的苯丙氨酸,而白纹伊蚊该位点亮氨酸则是由CTA编码,若要突变为苯丙氨酸则需要一次颠换和一次转换,这从分子进化的角度看是不简约的,同时也说明击倒抗性相关基因的多态性和复杂性。
伊蚊对拟除虫菊酯类杀虫剂抗药性是一个全球性问题。埃及伊蚊击倒抗性已经得到了深入的研究和广泛的探讨,白纹伊蚊种群中也发现了越来越多的拟除虫菊酯抗性种群。白纹伊蚊的第1个kdr突变于2009年在新加坡的白纹伊蚊种群中发现。Kasai等[26]对VGSC基因5个位点(S989P、I1011M/V、V1016G/I、F1534C和D1763Y)进行了基因分型,并在结构域ⅢS6片段发现了1534位点密码子的突变(F1534C),苯丙氨酸突变为半胱氨酸。白纹伊蚊的第2个kdr突变是2011年在美国的一项调查中发现的[27],佛罗里达州的1份样本检测到1534位点密码子的一种新的kdr突变,为F1534L型突变,苯丙氨酸突变为亮氨酸。2011-2014年在日本、中国、新加坡、美国、法国和意大利共6个国家进行了白纹伊蚊kdr突变调查,发现了3个新的kdr突变,在来自意大利的白纹伊蚊种群发现了结构域ⅢS6片段1532位点密码子突变(I1532T),异亮氨酸突变为苏氨酸。在中国白纹伊蚊种群中发现了F1534S型突变,苯丙氨酸突变为丝氨酸。多项研究证实,1534位点的苯丙氨酸突变为半胱氨酸、丝氨酸或亮氨酸,这些突变型与拟除虫菊酯类杀虫剂抗性均相关[28-29]。Gao等[30]证明I15324T突变与溴氰菊酯抗药性呈负相关,与氯菊酯抗药性无关联。此外,位于结构域ⅡS6片段的1016位点密码子突变(V1016G),缬氨酸突变为甘氨酸,在埃及伊蚊中已广泛报道,且已证实与埃及伊蚊对拟除虫菊酯类杀虫剂抗药性密切相关。2019年Kasai等[31]也在白纹伊蚊种群中发现了该位点突变,并证明了白纹伊蚊V1016G型突变与氯菊酯抗药性相关,且比F1534S和F1534C型突变具有更强的突变效应。
在埃及伊蚊种群中不仅存在VGSC基因单位点突变,还存在同一基因组中同时发生的不同替换,这些多位点突变均明显降低了蚊虫对拟除虫菊酯类杀虫剂的敏感性。例如,S989P和V1016G联合突变明显增加了VGSC基因对拟除虫菊酯类杀虫剂的不敏感性,F1534C突变的额外存在进一步增强了对溴氰菊酯和氯氰菊酯的不敏感性。Zhou等[32]对北京市的白纹伊蚊种群VGSC基因进行研究发现部分V1016G+I1532T、I1532T+F1534S以及V1016G+ F1534S联合突变型个体,说明北京市白纹伊蚊对拟除虫菊酯类杀虫剂可能已产生高抗药性。在埃及伊蚊VGSC基因结构域Ⅱ~Ⅳ的S5和S6片段以及S5~S6片段连接处共发现了7个位点的突变,包括S989P、V1016G/I、F1534C、D1763Y、I1011V/M、L982W和G923V[5],与埃及伊蚊不同的是在白纹伊蚊种群中检测到的突变均与结构域Ⅱ、Ⅲ的S6片段有关,且只发现了3个位点的突变(V1016G、F1534C/L/S和I1532T)。这一证据表明,抗性可能与形成通道孔隙结构的氨基酸残基突变有关,它们可能会降低受体对化学杀虫剂的亲和力。此外,由于杀虫剂的确切结合位点尚不清楚,而且目前的研究主要集中于分析广泛的钠通道基因中的少数几个位点,因此不应排除其他突变在白纹伊蚊对化学杀虫剂的抗性中发挥作用的可能性。本研究克隆白纹伊蚊电压门控钠离子通道基因cDNA序列,并分析了其生物信息学特征,发现了3个选择性剪接和6个RNA编辑,为研究白纹伊蚊对拟除虫菊酯类杀虫剂产生靶标抗性的分子机制奠定了基础,有助于阐明抗性机制和新靶点的研究开发,特别是对拟除虫菊酯类杀虫剂产生的靶标抗性分子检测具有重要意义。
利益冲突 无
| [1] |
Paupy C, Delatte H, Bagny L, et al. Aedes albopictus, an arbovirus vector: from the darkness to the light[J]. Microbes Infect, 2009, 11(14/15): 1177-1185. DOI:10.1016/j.micinf.2009.05.005 |
| [2] |
Smith LB, Kasai S, Scott JG. Pyrethroid resistance in Aedes aegypti and Ae. albopictus: important mosquito vectors of human diseases[J]. Pestic Biochem Physiol, 2016, 133: 1-12. DOI:10.1016/j.pestbp.2016.03.005 |
| [3] |
Benelli G, Wilke ABB, Beier JC. Aedes albopictus (Asian Tiger Mosquito)[J]. Trends Parasitol, 2020, 36(11): 942-943. DOI:10.1016/j.pt.2020.01.001 |
| [4] |
Kamal M, Kenawy MA, Rady MH, et al. Mapping the global potential distributions of two arboviral vectors Aedes aegypti and Ae. albopictus under changing climate[J]. PLoS One, 2018, 13(12): e210122. DOI:10.1371/journal.pone.0210122 |
| [5] |
Auteri M, La Russa F, Blanda V, et al. Insecticide resistance associated with kdr mutations in Aedes albopictus: an update on worldwide evidences[J]. BioMed Res Int, 2018, 2018: 3098575. DOI:10.1155/2018/3098575 |
| [6] |
苏锦坤, 师永霞, 洪烨, 等. 黄热病现状分析及研究进展[J]. 中国国境卫生检疫杂志, 2011, 34(2): 139-144. Su JK, Shi YX, Hong Y, et al. Analysis and research on yellow fever[J]. Chin J Front Health Quarant, 2011, 34(2): 139-144. DOI:10.16408/j.1004-9770.2011.02.017 |
| [7] |
Pialoux G, Gaüzère BA, Jauréguiberry S, et al. Chikungunya, an epidemic arbovirosis[J]. Lancet Infect Dis, 2007, 7(5): 319-327. DOI:10.1016/S1473-3099(07)70107-X |
| [8] |
孟凤霞, 王义冠, 冯磊, 等. 我国登革热疫情防控与媒介伊蚊的综合治理[J]. 中国媒介生物学及控制杂志, 2015, 26(1): 4-10. Meng FX, Wang YG, Feng L, et al. Review on dengue prevention and control and integrated mosquito management in China[J]. Chin J Vector Biol Control, 2015, 26(1): 4-10. DOI:10.11853/j.issn.1003.4692.2015.01.002 |
| [9] |
李志强, 钟俊鸿. 登革热媒介昆虫抗药性的研究进展[J]. 昆虫知识, 2008, 45(6): 857-862. Li ZQ, Zhong JH. Research progress on drug resistance of dengue vector insects[J]. Chin Bull Entomol, 2008, 45(6): 857-862. DOI:10.3969/j.issn.0452-8255.2008.06.004 |
| [10] |
赵春春, 朱彩英, 贾清臣, 等. 2017-2018年我国不同区域白纹伊蚊对常用杀虫剂的抗药性[J]. 中国媒介生物学及控制杂志, 2020, 31(2): 126-132. Zhao CC, Zhu CY, Jia QC, et al. Resistance of Aedes albopictus to commonly used insecticides in different areas of China, 2017-2018[J]. Chin J Vector Biol Control, 2020, 31(2): 126-132. DOI:10.11853/j.issn.1003.8280.2020.02.002 |
| [11] |
刘钦梅. 蚊虫拟除虫菊酯类杀虫剂抗性基因的研究[D]. 海口: 海南大学, 2016. Liu QM. Studies on pyrethroid insecticides resisitance genes in mosquitoes[D]. Haikou: Hainan University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10589-1016075386.htm |
| [12] |
朱彩英. 中国白纹伊蚊击倒抗性基因突变及检测技术研究[D]. 北京: 中国疾病预防控制中心, 2020. Zhu CY. Study on knockdown resistance gene mutation and detection technology of Aedes albopictus in China[D]. Beijing: Chinese Center for Disease Control and Prevention, 2020. |
| [13] |
陈斌, 鲜鹏杰, 乔梁, 等. 昆虫钠离子通道基因突变及其与杀虫剂抗性关系的研究进展[J]. 昆虫学报, 2015, 58(10): 1116-1125. Chen B, Xian PJ, Qiao L, et al. Research progress in sodium channel gene mutations and their association with insecticide resistance of insects[J]. Acta Entomol Sin, 2015, 58(10): 1116-1125. DOI:10.16380/j.kcxb.2015.10.010 |
| [14] |
Davies TGE, Field LM, Usherwood PNR, et al. A comparative study of voltage-gated sodium channels in the Insecta: implications for pyrethroid resistance in Anopheline and other Neopteran species[J]. Insect Mol Biol, 2007, 16(3): 361-375. DOI:10.1111/j.1365-2583.2007.00733.x |
| [15] |
Dong K. A single amino acid change in the para sodium channel protein is associated with knockdown-resistance (kdr) to pyrethroid insecticides in German cockroach[J]. Insect Biochem Mol Biol, 1997, 27(2): 93-100. DOI:10.1016/S0965-1748(96)00082-3 |
| [16] |
Ingles PJ, Adams PM, Knipple DC, et al. Characterization of voltage-sensitive sodium channel gene coding sequences from insecticide-susceptible and knockdown-resistant house fly strains[J]. Insect Biochem Mol Biol, 1996, 26(4): 319-326. DOI:10.1016/0965-1748(95)00093-3 |
| [17] |
Loughney K, Kreber R, Ganetzky B. Molecular analysis of the para locus, a sodium channel gene in Drosophila[J]. Cell, 1989, 58(6): 1143-1154. DOI:10.1016/0092-8674(89)90512-6 |
| [18] |
Lee S, Ingles PJ, Knipple DC, et al. Developmental regulation of alternative exon usage in the house fly Vssc1 sodium channel gene[J]. Invert Neurosci, 2002, 4(3): 125-133. DOI:10.1007/s10158-001-0014-1 |
| [19] |
Chang C, Shen WK, Wang TT, et al. A novel amino acid substitution in a voltage-gated sodium channel is associated with knockdown resistance to permethrin in Aedes aegypti[J]. Insect Biochem Mol Biol, 2009, 39(4): 272-278. DOI:10.1016/j.ibmb.2009.01.001 |
| [20] |
Liu ZQ, Song WZ, Dong K. Persistent tetrodotoxin-sensitive sodium current resulting from U-to-C RNA editing of an insect sodium channel[J]. Proc Natl Acad Sci USA, 2004, 101(32): 11862-11867. DOI:10.1073/pnas.0307695101 |
| [21] |
Hanrahan CJ, Palladino MJ, Bonneau LJ, et al. RNA editing of a Drosophila sodium channel gene[J]. Ann N Y Acad Sci, 1999, 868(1): 51-66. DOI:10.1111/j.1749-6632.1999.tb11273.x |
| [22] |
Soderlund DM. Pyrethroids, knockdown resistance and sodium channels[J]. Pest Manag Sci, 2008, 64(6): 610-616. DOI:10.1002/ps.1574 |
| [23] |
段文波, 王颢, 李芬, 等. 麦长管蚜电压门控钠离子通道基因克隆及序列分析[J]. 中国生物防治学报, 2020, 36(2): 307-314. Duan WB, Wang H, Li F, et al. Cloning and sequences analysis of voltage-gated sodium channel gene in Sitobion avenae (Fabricius)[J]. Chin J Biol Control, 2020, 36(2): 307-314. DOI:10.16409/j.cnki.2095-039x.2020.02.018 |
| [24] |
Liu H, Lu YJ, Liu QY, et al. Comparison of pyrethroid resistance in adults and larvae of Culex pipiens pallens (Diptera: Culicidae) from four field populations in China[J]. J Econ Entomol, 2013, 106(1): 360-365. DOI:10.1603/EC11439 |
| [25] |
Chang XL, Zhong DB, Fang Q, et al. Multiple resistances and complex mechanisms of Anopheles sinensis mosquito: a major obstacle to mosquito-borne diseases control and elimination in China[J]. PLoS Negl Trop Dis, 2014, 8(5): e2889. DOI:10.1371/journal.pntd.0002889 |
| [26] |
Kasai S, Ng LC, Lam-Phua SG, et al. First detection of a putative knockdown resistance gene in major mosquito vector, Aedes albopictus[J]. Jpn J Infect Dis, 2011, 64(3): 217-221. |
| [27] |
Marcombe S, Farajollahi A, Healy SP, et al. Insecticide resistance status of United States populations of Aedes albopictus and mechanisms involved[J]. PLoS One, 2014, 9(7): e101992. DOI:10.1371/journal.pone.0101992 |
| [28] |
王晓花, 陈辉莹, 杨新艳, 等. 海口市白纹伊蚊对菊酯类杀虫剂的抗药性及击倒抗性基因突变分析[J]. 第二军医大学学报, 2015, 36(8): 832-838. Wang XH, Chen HY, Yang XY, et al. Resistance to pyrethroid insecticides and analysis of knockdown resistance (kdr) gene mutations in Aedes albopictus from Haikou city[J]. Acad J Second Milit Med Univ, 2015, 36(8): 832-838. DOI:10.3724/SP.J.1008.2015.00832 |
| [29] |
Xu JB, Bonizzoni M, Zhong DB, et al. Multi-country survey revealed prevalent and novel F1534S mutation in voltage-gated sodium channel (VGSC) gene in Aedes albopictus[J]. PLoS Negl Trop Dis, 2016, 10(5): e0004696. DOI:10.1371/journal.pntd.0004696 |
| [30] |
Gao JP, Chen HM, Shi H, et al. Correlation between adult pyrethroid resistance and knockdown resistance (kdr) mutations in Aedes albopictus (Diptera: Culicidae) field populations in China[J]. Infect Dis Poverty, 2018, 7(1): 86. DOI:10.1186/s40249-018-0471-y |
| [31] |
Kasai S, Caputo B, Tsunoda T, et al. First detection of a Vssc allele V1016G conferring a high level of insecticide resistance in Aedes albopictus collected from Europe (Italy) and Asia (Vietnam), 2016:a new emerging threat to controlling arboviral diseases[J]. Euro Surveill, 2019, 24(5): 1700847. DOI:10.2807/1560-7917.ES.2019.24.5.1700847 |
| [32] |
Zhou XJ, Yang C, Liu N, et al. Knockdown resistance (kdr) mutations within seventeen field populations of Aedes albopictus from Beijing China: first report of a novel V1016G mutation and evolutionary origins of kdr haplotypes[J]. Parasit Vectors, 2019, 12(1): 180. DOI:10.1186/s13071-019-3423-x |
 2021, Vol. 32
2021, Vol. 32


