扩展功能
文章信息
- 康东梅, 栗冬梅, 宋秀平, 张文竹, 刘起勇, 伦辛畅, 孟凤霞
- KANG Dong-mei, LI Dong-mei, SONG Xiu-ping, ZHANG Wen-zhu, LIU Qi-yong, LUN Xin-chang, MENG Feng-xia
- 汉赛巴尔通体感染SD大鼠实验研究
- An experiment of Bartonella henselae infection in Sprague-Dawley rats
- 中国媒介生物学及控制杂志, 2021, 32(6): 660-665
- Chin J Vector Biol & Control, 2021, 32(6): 660-665
- 10.11853/j.issn.1003.8280.2021.06.002
-
文章历史
- 收稿日期: 2021-06-28
2 中国疾病预防控制中心传染病预防控制所媒介生物控制室, 传染病预防控制国家重点实验室, 北京 102206
2 State Key Laboratory of Infectious Disease Prevention and Control, Department of Vector Biology and Control, National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
汉赛巴尔通体(Bartonella henselae)是一种致病性巴尔通体,可引起猫抓病(cat-scratch disease,CSD)、慢性淋巴结炎、心内膜炎、杆菌样血管肉瘤-杆菌样紫癜(BAP)、血管瘤、菌血症、脑炎、颈部淋巴结炎、肝功能改变、眼部疾病等[1],其中以CSD最普遍。相比之下,汉赛巴尔通体最常见于感染人类免疫缺陷病毒(HIV)的个体,通常以结节性病变的形式涉及皮肤的血管增生性疾病,也可能传播到其他的器官。
由于缺乏合适的动物模型,关于感染机制的研究较少。Sykes等[2]通过给猫静脉注射实验感染汉赛巴尔通体,发现在多个器官中有病理病变,包括肝脏和淋巴结中的肉芽肿。因此,猫可被用于研究感染汉赛巴尔通体的实验动物模型。然而,猫缺少标准化的实验动物,且操作不方便。国内外诸多实验室已建立汉赛巴尔通体感染小鼠的动物模型,如BALB/c小鼠[3]、C57小鼠[4]、免疫缺陷小鼠[5]和免疫低下小鼠慢性感染模型[6]等。与小鼠相比,大鼠对外环境适应性强,成年鼠很少患病,食性广泛,更广泛地用于医学动物模型的建立。本研究旨在开展汉赛巴尔通体感染SD大鼠的实验研究,为后续不同宿主型猫栉首蚤(Ctenocephalides felis)传播汉赛巴尔通体的研究奠定基础。
1 材料与方法 1.1 主要仪器和试剂371型二氧化碳培养箱(美国Thermo仪器设备有限公司),PCR仪(德国Sensoquest公司),Cel Doc XR4凝胶成像仪(美国BIO-RAD公司),Centrifuge 5804R台式低温离心机(德国EPPENDORF公司),HNDKT200-2型恒温金属浴(上海汗诺仪器有限公司),1001680高速组织研磨器〔天根生化科技(北京)有限公司〕,BX51荧光显微镜〔奥林巴斯(中国)有限公司〕;胰酶大豆琼脂培养基(美国BD公司),脑心浸液粉(美国BD公司),2×TransTaq-T PCR SuperMix(北京全式金生物技术有限公司),EasyPure Bacteria DNA Kit核酸提取试剂盒〔普洛麦格(北京)生物技术有限公司〕,脱纤维羊血(北京宝特医疗器械有限公司)。
1.2 实验菌株用中国疾病预防控制中心传染病预防控制所媒介生物控制室冻存的汉赛巴尔通体菌株,复苏后接种在10%羊血的胰酶大豆琼脂培养基上,置于37 ℃、5% CO2培养箱中培养5~7 d。用无菌接种环取第2代汉赛巴尔通体菌株,放入0.9%的灭菌生理盐水中,混匀,稀释至7 McF(2.1×109/ml),备用。
1.3 实验动物选择体质量250 g SPF级SD大鼠21只,均购自中国人民解放军军事医学科学院,编号xcxk-(军)2012-0004。鼠笼、垫料、鼠饲料和水均高压灭菌,在生物安全P2实验室将SD大鼠放入鼠笼,然后放入负压安全柜中,单鼠单笼饲养,每日观察。
1.4 实验动物随机分组共感染18只大鼠,雌雄各半,共分3组,按照雌雄分别编号1~9号,取随机数字,与鼠号一一对应,将每个随机数字除以3,余数是几则归为第几组,将雌雄对应的组数合并,保证每组均是雌雄各半。另设3只作为对照。
1.5 实验动物感染分别用1、2、5 ml的注射器吸取0.5、1.5、2.5 ml的备用菌液(7 McF),于皮下注射于大鼠体内,对照组用等量的0.9%灭菌生理盐水,感染后,置于负压安全柜中饲养。感染后第1、3、5、7、10、14天取尾静脉血,其中第3和第7天分别处死6只,每个感染组2只,雌雄各1只,第14天处死剩余9只,均取肝、脾、心、肾;全血4 ℃放置24 h取上清,冻存于-40 ℃冰箱,备用。
1.6 培养及PCR检测将采集的全血及肝、脾、心、肾进行培养。取全血与胰酶大豆肉汤进行1∶4稀释,组织取黄豆大小研磨成匀浆亦与胰酶大豆肉汤进行1∶4稀释,均接种至含10%羊血的胰酶大豆琼脂培养基上,置于35 ℃、5% CO2恒温箱中培养30 d。挑取可疑菌落提取DNA作为模板,PCR扩增选用的引物是枸橼酸合酶基因(gltA)对BhCS.781p-BhCS.1137n(正向引物:5'-GGG GAC CAG CTC ATG GTG G-3',反向引物:5'-AAT GCA AAA AGA ACA GTA AAC A-3')扩增,具备属水平特异性,进行测序分析。合成引物及测序均由北京天一辉远生物科技有限公司完成。
1.7 提取全血及组织DNA提取鼠全血及组织DNA,PCR扩增选用的引物同1.6,进行测序分析,引物合成和测序由北京天一辉远生物科技有限公司完成。
1.8 间接免疫荧光试验(IFA)抗体测定法用PBS-Tween对鼠血清进行稀释,用欧蒙医学诊断(中国)有限公司提供的抗汉赛巴尔通体抗体IgG检测试剂盒测定IgG水平,其中二抗由北京索莱宝科技有限公司提供的FITC(fluorescein isothiocyanate)标记的羊抗鼠抗体。荧光显微镜下观察抗原抗体的凝集程度。
1.9 统计学分析应用SPSS 19.0软件进行统计学分析,采用配伍组方差分析对不同剂量组和不同感染天数的阳性率进行分析;采用Fisher’s确切概率法对不同组织阳性率进行比较,检验水准为α=0.05。不同剂量组和不同感染天数的阳性率为:阳性率=阳性样本数(血液阳性样本数+组织阳性样本数)/检测样本总数×100%。
2 结果 2.1 SD大鼠感染后症状观察SD大鼠感染后,每天08:00和18:00各观察记录其活动、体质量、毛色1次,连续观察14 d,观察期间均未见明显异常变化。
2.2 获取样品分批处死大鼠,共获得全血90份(实验组72份,对照组18份)、血清21份(实验组18份,对照组3份)、组织82份(实验组70份,对照组12份)。见表 1。

|
共培养90份全血,82份组织,均未见可疑阳性菌落。见表 2。

|
提取90份全血和82份组织的DNA,其中感染第1、3、5天全血DNA出现阳性,经测序确定为汉赛巴尔通体,第3天的肝、脾、心、肾组织DNA为阳性,经测序为汉赛巴尔通体(表 2)。90份全血样品实验组72份中22份检出汉赛巴尔通体特异性基因片段,阳性率为30.56%(22/72);其中在第1天的高剂量组6份中有3份阳性;第3天的低剂量组6份均为阳性,中剂量组6份中5份阳性,高剂量组6份均为阳性;第5天的高剂量组4份中2份阳性。82份组织样品实验组70份中有16份检出汉赛巴尔通体特异性基因片段,阳性率为22.86%(16/70);其中肝18份中阳性5份,脾18份中阳性3份,心18份中阳性1份,肾16份中阳性7份。阳性组织样品均出现在注射菌液的第3~7天。见表 2。
经配伍组设计的方差分析,不同剂量组间阳性率差异无统计学意义(F=3.243,P=0.082);经Fisher’s确切概率法检验,不同组织样品阳性率差异无统计学意义(χ2=7.655,P=0.057);不同感染天数阳性率差异有统计学意义(F=11.770,P=0.001),不同感染天数两两比较,其中第3天的阳性率与第1、5、7、10和14天的差异均有统计学意义(均P < 0.05)。
2.5 电泳结果SD大鼠感染汉赛巴尔通体第3天,取肝、脾、肾提取DNA,PCR扩增后电泳结果见图 1。
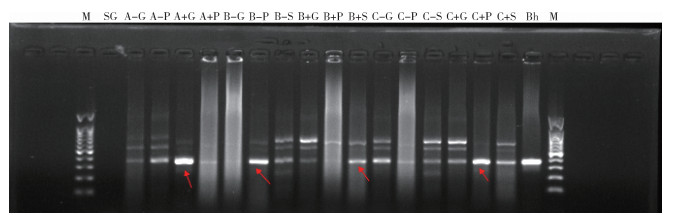
|
| 注:M表示Marker;SG代表随机大鼠肝脏;A、B、C分别代表 0.5、1.5和2.5 ml剂量组,-代表雄性,+ 代表雌性,G、P、S分别代表肝脏、脾脏和肾脏,为阳性对照,如A-G代表 0.5 ml组雄性大鼠肝脏,A+P代表 0.5 ml组雌性大鼠脾脏;Bh代表汉赛巴尔通体;箭头所指为汉赛巴尔通体DNA扩增产物。 图 1 汉赛巴尔通体感染SD大鼠第3天肝、脾、肾DNA扩增后电泳图谱 Figure 1 Electrophoresis diagrams of amplified DNA fragments from the liver, spleen, and kidney of Sprague-Dawley rats on the 3rd day since Bartonella henselae infection |
| |
大鼠感染的第3、7、14天分别取血清6、6和9份,共计21份血清,其中有3份为阴性对照。荧光显微镜下观察抗原抗体凝集,阴性组均未见凝集,实验组有6份出现凝集现象(其中1份阳性血清不同稀释倍数结果见图 2A~E),阳性率为33.33%,分别出现在第7和第14天(表 2)。第3天未见阳性凝集现象。抗原抗体反应出现的较菌血症晚。

|
| 图 2 间接免疫荧光试验测定汉赛巴尔通体感染SD大鼠血清阳性不同稀释倍数结果(×20) Figure 2 Positive serum results in different dilution factors by indirect immunofluorescence assay in Sprague-Dawley rats infected with Bartonella henselae |
| |
目前我国云南[7]、海南[8]、福建[9]、浙江[10]、广东[11]、内蒙古[12]、黑龙江[13]、北京[14]、山东[15]等省(自治区、直辖市)均有啮齿动物感染巴尔通体和汉赛巴尔通体致CSD的临床病例报道,说明巴尔通体已在我国部分地区普遍存在并广泛流行。汉赛巴尔通体所致疾病的传播涉及广泛的宿主动物和媒介。国外学者用BALB/c、C57BL/6及CD-1小鼠等进行汉赛巴尔通体和五日热巴尔通体的实验室感染,发现感染后第3天,从血液、肝、脾中分离到细菌[16]。杨小冉等[3]研究证实BALB/c小鼠可维持6 h的菌血症。本实验研究证实SD大鼠感染后第1天即从高剂量组的血液中检测到汉赛巴尔通体DNA序列,持续到第5天,仍从高剂量组中检测到其DNA序列,另外在感染的第3天,分别在血液、心、肝、脾、肾中检测到汉赛巴尔通体的DNA扩增产物,其中肾脏持续到第7天,但是遗憾的是并未从这些组织中分离培养到细菌。笔者认为可能是感染的剂量未达到产生菌血症的浓度,亦或者是其菌血症的产生是一过性的,这一点在杨小冉等[3]的研究中有所体现。鉴于此,笔者认为后续研究中应继续加大感染剂量,探索能够产生菌血症的可能浓度。
猫在实验室感染后,其菌血症可持续3个月之久,但在感染后的第2周,即可检测到较高滴度的特异性抗体[17]。SD大鼠在感染后的第7天检测到较高的特异性抗体滴度,直到实验结束仍可以在高剂量组检测到特异性抗体滴度。SD大鼠在心、肝、脾、肾脏检出汉赛巴尔通体特异性基因片段阳性率无差异,与栗冬梅等[18]的研究结论一致,提示巴尔通体感染啮齿动物对不同组织的侵袭无差异。
汉赛巴尔通体具有比较严格的宿主特异性,猫栉首蚤是其主要传播媒介。经实验室研究证实SD大鼠感染汉赛巴尔通体可以产生菌血症,且可维持一定的时间。可见,在特殊条件下,汉赛巴尔通体可能打破其宿主特异性限制。这种宿主特异性改变会否影响汉赛巴尔通体在自然界的宿主范围有待进一步调查。褐家鼠(Rattus norvegicus)和黄胸鼠(R. tanezumi)是猫栉首蚤的偶然宿主,其猫栉首蚤感染率仅为0.1%以下。但在实验室条件下,猫栉首蚤已发生宿主特异性分化,研究人员已获得了不同宿主型的大白鼠株和小白鼠株猫栉首蚤,并发现其吸血率和饱血率均较吸食猫血的猫栉首蚤高,且能产生稳定的后代[19]。在汉赛巴尔通体宿主发生变化后,这种发生宿主分化的猫栉首蚤是否会影响汉赛巴尔通体的传播形式也需更多研究。对这些问题的系统研究,将能促进CSD的流行病学发展,为有效预防控制CSD提供理论依据。
利益冲突 无
| [1] |
Oray M, Önal S, Akbay AK, et al. Diverse clinical signs of ocular involvement in cat scratch disease[J]. Turk J Ophthalmol, 2017, 47(1): 9-17. DOI:10.4274/tjo.28009 |
| [2] |
Sykes JE, Henn JB, Kasten RW, et al. Bartonella henselae infection in splenectomized domestic cats previously infected with hemotropic Mycoplasma species[J]. Vet Immunol Immunopathol, 2007, 116(1/2): 104-108. DOI:10.1016/j.vetimm.2006.12.004 |
| [3] |
杨小冉, 刘起勇, 崔步云, 等. BALB/c及昆明小鼠的汉赛巴尔通体实验室感染模型[J]. 中国媒介生物学及控制杂志, 2008, 19(1): 41-43. Yang XR, Liu QY, Cui BY, et al. Characterization of infective model in Bartonella henselae-specific immunity in BALB/c and KM mice[J]. Chin J Vector Biol Control, 2008, 19(1): 41-43. DOI:10.3969/j.issn.1003-4692.2008.01.015 |
| [4] |
Arvand M, Ignatius R, Regnath T, et al. Bartonella henselae-specific cell-mediated immune responses display a predominantly Th1 phenotype in experimentally infected C57BL/6 mice[J]. Infect Immun, 2001, 68(10): 6427-6433. DOI:10.1128/IAI.69.10.6427-6433.2001 |
| [5] |
Polar RC, Orellana G, Caso WS, et al. Encephalitis with convulsive status in an immunocompetent pediatric patient caused by Bartonella henselae[J]. Asian Pacific J Trop Med, 2016, 9(6): 610-613. DOI:10.1016/j.apjtm.2016.03.030 |
| [6] |
Chiaraviglio L, Duong S, Brown DA, et al. An immunocompromised murine model of chronic Bartonella infection[J]. Am J Pathol, 2010, 176(6): 2753-2763. DOI:10.2353/ajpath.2010.090862 |
| [7] |
白瑛, KosoyMY, MaupinGO, 等. 首次证实巴尔通体在我国云南鼠群中流行[J]. 中国人兽共患病杂志, 2002, 18(3): 5-9. Bai Y, Kosoy MY, Maupin GO, et al. Discovery of Bartonella species in rodents in Yunnan[J]. Chin J Zoonoses, 2002, 18(3): 5-9. DOI:10.3969/j.issn.1002-2694.2002.03.001 |
| [8] |
宋秀平, 刘起勇, 鲁亮, 等. 海南省小型兽类巴尔通体的分离培养和序列分析[J]. 中国媒介生物学及控制杂志, 2010, 21(2): 131-133. Song XP, Liu QY, Lu L, et al. Isolation and sequence analysis of Bartonella in small mammals in Hainan province[J]. Chin J Vector Biol Control, 2010, 21(2): 131-133. |
| [9] |
叶曦, 姚美琳, 李国伟. 福建省鼠形动物巴尔通体感染调查[J]. 中国人兽共患病学报, 2006, 22(8): 779-781. Ye X, Yao ML, Li GW. The investigation on the infection of Bartonella species in rodent hosts in Fujian[J]. Chin J Zoonoses, 2006, 22(8): 779-781. DOI:10.3969/j.issn.1002-2694.2006.08.024 |
| [10] |
陈秀英, 雷永良, 柳付明, 等. 浙江省丽水市鼠类巴尔通体的检测研究[J]. 中国卫生检验杂志, 2013, 23(1): 118-119. Chen XY, Lei YL, Liu FM, et al. Study on the detection of Bartonella of Lishui rodents in Zhejiang province[J]. Chin J Heal Inspect, 2013, 23(1): 118-119. |
| [11] |
赖瑞青, 徐晓红, 黄洁玲, 等. 33例猫抓病性淋巴结炎超声图像分析[J]. 广东医学院学报, 2010, 28(1): 45-47. Lai RQ, Xu XH, Huang JL, et al. Ultrasonographic analysis of 33 cases of cat scratch disease lymphadenitis[J]. J Guangdong Med Coll, 2010, 28(1): 45-47. DOI:10.3969/j.issn.1005-4057.2010.01.019 |
| [12] |
宋秀平, 栗冬梅, 贾丽军, 等. 内蒙古小型兽类巴尔通体感染情况调查[J]. 中国媒介生物学及控制杂志, 2015, 26(3): 233-237. Song XP, Li DM, Jia LJ, et al. Investigation of Bartonella infection in small mammals in Inner Mongolia, China[J]. Chin J Vector Biol Control, 2015, 26(3): 233-237. DOI:10.11853/j.issn.1003.4692.2015.03.004 |
| [13] |
左双燕. 我国黑龙江林区鼠型动物巴尔通体感染调查与分离鉴定[D]. 长沙: 中南大学, 2012. Zuo SY. Detection and isolation of Bartonella spp. in rodents in Helongjiang province of China[D]. Changsha: Central South University, 2012. https://d.wanfangdata.com.cn/thesis/Y2197314 |
| [14] |
王廷兆. 喜忧参半"宠物热"[J]. 环境, 2002, 5(10): 27-28. Wang TZ. Pet fever[J]. Environment, 2002, 5(10): 27-28. |
| [15] |
刘纳新. 猫抓病23例明确诊断与治疗分析[J]. 中国误诊学杂志, 2010, 10(9): 2204-2205. Liu NX. Diagnosis and treatment of cat scratch disease: an analysis of 23 cases[J]. Chin J Misd, 2010, 10(9): 2204-2205. |
| [16] |
Brouqui PP, Houpikian XY, Lepedi H, et al. Virulence-related factors of Bartonella: observation of Bartonella infection in vitro and in vivo[M]//Kazar J, Toman R. Rickettsiae and Rickettsial Diseases Veda. Bratislava: Slovakia, 1996: 622-627.
|
| [17] |
Greene CE, Mcdermott M, Jameson PH, et al. Bartonella henselae infection in cats: evaluation during primary infection, treatment, and rechallenge infection[J]. J Clin Microbiol, 1996, 34(7): 1682-1685. DOI:10.1128/jcm.34.7.1682-1685.1996 |
| [18] |
栗冬梅, 徐爱玲, 宋秀平, 等. 巴尔通体在自然感染的啮齿动物组织中的分布[J]. 中国媒介生物学及控制杂志, 2021, 32(2): 181-187. Li DM, Xu AL, Song XP, et al. Bartonella distribution in naturally infected rodent tissues[J]. Chin J Vector Biol Control, 2021, 32(2): 181-187. DOI:10.11853/j.issn.1003.8280.2021.02.012 |
| [19] |
康东梅, 师灿南, 开文龙, 等. 宿主动物对不同宿主型猫栉首蚤吸血率和饱血率的影响[J]. 中国媒介生物学及控制杂志, 2017, 28(3): 197-200. Kang DM, Shi CN, Kai WL, et al. Effect of hosts on blood-sucking and blood engorging in different host type cat fleas, Ctenocephalides felis[J]. Chin J Vector Biol Control, 2017, 28(3): 197-200. DOI:10.11853/j.issn.1003.8280.2017.03.001 |
 2021, Vol. 32
2021, Vol. 32


